Азотные триоды
 | |||
| |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена | |||
| Другие имена Йодид азота Трииоды аммиака Сенсорный порошок Трииодный нитрид Трийода мононитрид Триада [ нужна ссылка ] Трийодирование [ нужна ссылка ] Нитрид йода | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
ПабХим CID | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| НИ 3 | |||
| Молярная масса | 394.719 g/mol | ||
| Появление | темный твердый | ||
| Точка кипения | сублимируется при -20 ° C | ||
| нерастворимый | |||
| Растворимость | органические растворители, [2] например, диэтиловый эфир | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Чрезвычайно взрывной и нестабильный | ||
| NFPA 704 (огненный алмаз) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Трийодид азота — неорганическое соединение формулы N I 3 . Это чрезвычайно чувствительное контактное взрывчатое вещество : небольшие количества взрываются с громким и резким щелчком даже при легком прикосновении, выделяя пурпурное облако паров йода ; его можно даже взорвать под действием альфа-излучения . NI 3 имеет сложную структурную химию, которую трудно изучать из-за нестабильности производных.
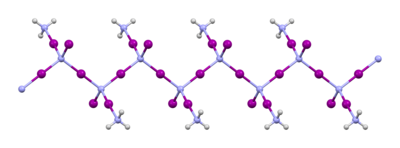
Структура НИ 3 и его производных
[ редактировать ]Трийодид азота был впервые охарактеризован с помощью рамановской спектроскопии в 1990 году, когда он был получен безаммиачным способом. Нитрид бора реагирует с монофторидом йода в трихлорфторметане при -30 ° C с образованием чистого NI 3 с низким выходом: [3]
- БН + 3 ЕСЛИ → НИ 3 + БФ 3
NI 3 имеет пирамидальную форму ( C 3v молекулярная симметрия ), как и другие тригалогениды азота и аммиак . [4]
Вещество, которое обычно называют «трийодид азота», получают реакцией йода с аммиаком . Когда эту реакцию проводят при низких температурах в безводном аммиаке, исходным продуктом является NI 3 · (NH 3 ) 5 , но при нагревании этот материал теряет часть аммиака с образованием аддукта NI 3 · NH 3 . Об этом аддукте впервые сообщил Бернар Куртуа в 1812 году, а его формула была окончательно определена в 1905 году Освальдом Зильберрадом . [5] Его твердотельная структура состоит из цепочек -NI 2 -I-NI 2 -I-NI 2 -I-. [6] Молекулы аммиака расположены между цепями. При хранении в холоде, в темноте и во влажном состоянии с аммиаком NI 3 · NH 3 стабилен.
Разложение и взрывоопасность
[ редактировать ]Нестабильность NI 3 и NI 3 · NH 3 можно объяснить большой стерической деформацией , вызванной тем, что три крупных атома йода удерживаются близко друг к другу вокруг относительно маленького атома азота. Это приводит к очень низкой энергии активации его разложения, реакция становится еще более благоприятной из-за большой стабильности N 2 . Трииодид азота не имеет практической коммерческой ценности из-за его чрезвычайной чувствительности к ударам, что делает невозможным его хранение, транспортировку и использование для контролируемых взрывов. В то время как чистый нитроглицерин обладает мощным действием и к тому же очень чувствителен к ударам (хотя и не так сильно, как трийодид азота, который можно воспламенить прикосновением пера), только благодаря флегматизаторам чувствительность нитроглицерина к ударам снизилась и стала безопаснее обращаться и транспортировать в виде динамита .
Разложение NI 3 протекает следующим образом с образованием газообразного азота и йода:
- 2 NI 3 (т) → N 2 (г) + 3 I 2 (г) (−290 кДж/моль)
Однако сухой материал представляет собой контактное взрывчатое вещество, разлагающееся примерно следующим образом: [4]
- 8 НИ 3 НХ 3 → 5 Н 2 + 6 НХ 4 И + 9 И 2
В соответствии с этим уравнением, эти взрывы оставляют пятна йода от оранжевого до фиолетового цвета, которые можно удалить раствором тиосульфата натрия . Альтернативный метод удаления пятен — просто дать йоду время сублимироваться.Небольшие количества трийодида азота иногда синтезируют в качестве демонстрации студентам-химикам старших классов или в качестве «химического волшебства». [7] Чтобы подчеркнуть чувствительность соединения, его обычно детонируют, прикоснувшись к нему пером, но даже малейший поток воздуха, свет лазера или другое движение могут вызвать детонацию . Трийодид азота также примечателен тем, что является единственным известным химическим взрывчатым веществом, которое детонирует при воздействии альфа-частиц и продуктов ядерного деления . [8]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с по аналогии см. названия NF 3 , Красная книга ИЮПАК 2005, стр. 314
- ^ 4. Аналитические методы . acornusers.org
- ^ Торнипорт-Эттинг, И.; Клапотке, Т. (1990). «Трийодид азота». Международное издание «Прикладная химия» . 29 (6): 677–679. дои : 10.1002/anie.199006771 .
- ^ Перейти обратно: а б Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего: Академическая пресса. ISBN 0-12-352651-5 .
- ^ Сильберрад, О. (1905). «Конституция трийодида азота» . Журнал Химического общества, Сделки . 87 : 55–66. дои : 10.1039/CT9058700055 .
- ^ Харт, Х.; Бернигхаузен, Х.; Джандер, Дж. (1968). «Кристаллическая структура трииодида азота-1-аммиака NJ 3 · NH 3 ». З. Анорг. Аллг. хим. 357 (4–6): 225–237. дои : 10.1002/zaac.19683570410 .
- ^ Форд, Луизиана; Грундмайер, EW (1993). Химическая магия . Дувр. п. 76 . ISBN 0-486-67628-5 .
- ^ Боуден, ФП (1958). «Инициирование взрыва нейтронами, α-частицами и продуктами деления». Труды Лондонского королевского общества А. 246 (1245): 216–219. Бибкод : 1958RSPSA.246..216B . дои : 10.1098/rspa.1958.0123 . S2CID 137728239 .