ДНК-полимераза II
| ДНК-полимераза II | |||
|---|---|---|---|
 Кристаллическая структура ДНК pol II (на основе записи PDB 3K5M) | |||
| Идентификаторы | |||
| Организм | |||
| Символ | polB | ||
| Входить | 944779 | ||
| ПДБ | 3К5М | ||
| RefSeq (защита) | НП_414602.1 | ||
| ЮниПрот | P21189 | ||
| Другие данные | |||
| Номер ЕС | 2.7.7.7 | ||
| хромосома | геном: 0,06 - 0,07 Мб | ||
| |||
ДНК-полимераза II (также известная как ДНК Pol II или Pol II ) представляет собой прокариотическую ДНК-зависимую ДНК-полимеразу, кодируемую геном PolB. [ 1 ]
массой 89,9 кДа ДНК-полимераза II представляет собой белок и является членом семейства ДНК-полимераз B. Первоначально он был выделен Томасом Корнбергом в 1970 году и охарактеризован в течение следующих нескольких лет. [ 2 ] [ 3 ] [ 4 ] Функциональность Pol II in vivo является предметом дискуссий, однако консенсус показывает, что Pol II в первую очередь участвует в качестве резервного фермента в репликации ДНК прокариот . Фермент обладает способностью синтезировать ДНК 5'→3' , а также корректирующей активностью 3'→5' экзонуклеазы . ДНК Pol II взаимодействует с множеством партнеров по связыванию, общих с ДНК Pol III, чтобы повысить ее точность и процессивность . [ 1 ]
Открытие
[ редактировать ]ДНК-полимераза I была первой ДНК-ориентированной ДНК-полимеразой, выделенной из E. coli . [ 5 ] Несколько исследований с участием этого изолированного фермента показали, что ДНК pol I, скорее всего, участвует в репарационной репликации и не является основной репликативной полимеразой. [ 6 ] Чтобы лучше понять in vivo роль ДНК pol I E. coli, , мутанты дефицитные по этому ферменту (называемые Pol A1 − ) были созданы в 1969 году Де Люсией и Кэрнсом. [ 7 ] Как охарактеризовано, этот новый мутантный штамм был более чувствителен к ультрафиолетовому свету , что подтверждает гипотезу о том, что ДНК pol I участвует в репарационной репликации. Мутант рос с той же скоростью, что и дикий тип , что указывает на наличие другого фермента, ответственного за репликацию ДНК . За этим последовало выделение и характеристика этой новой полимеразы, участвующей в полуконсервативной репликации ДНК, в ходе параллельных исследований, проведенных в нескольких лабораториях. [ 2 ] [ 3 ] [ 4 ] Новую полимеразу назвали ДНК-полимеразой II, и считалось, что она является основным репликативным ферментом E. coli . какое-то время [ 8 ] ДНК pol II была впервые кристаллизована Anderson et al. в 1994 году. [ 9 ]
В 2023 году сообщалось, что связанная со старением, ускоренная транскрипция, заставляет Pol II совершать больше ошибок, что приводит к образованию дефектных копий, которые могут вызвать многочисленные заболевания. [ 10 ]
Структура
[ редактировать ]ДНК Pol II представляет собой белок массой 89,9 кДа, состоящий из 783 аминокислот, кодируемый геном polB (dinA). Глобулярный белок ДНК Pol II действует как мономер, тогда как многие другие полимеразы образуют комплексы. Существует три основных отдела этого мономера, которые в просторечии называются ладонью, пальцами и большим пальцем. Эта «рука» сжимается вокруг нити ДНК. Ладонь комплекса содержит три каталитических остатка, которые для функционирования координируются с двумя ионами двухвалентных металлов. ДНК Pol II имеет большое количество копий в клетке, около 30-50, тогда как уровень ДНК Pol III в клетке в пять раз меньше.
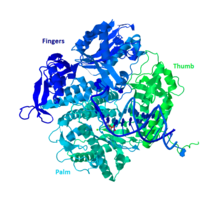
Сходство с другими полимеразами группы B
[ редактировать ]Большинство полимераз сгруппированы в семейства, основанные на схожей структуре и функциях. ДНК Pol II попадает в группу B вместе с человеческой ДНК Pol α, δ, ϵ и ζ. Все это гомологи RB69, 9°N-7 и Tgo. У других членов группы B есть по крайней мере еще одна субъединица, которая делает ДНК Pol II уникальной. [ 11 ]
Функция
[ редактировать ]Подтвержденный
[ редактировать ]Все полимеразы в той или иной степени участвуют в репликации ДНК , синтезируя цепочки нуклеиновых кислот. Репликация ДНК является жизненно важным аспектом пролиферации клетки. Без репликации своей ДНК клетка не может делиться и передавать свою генетическую информацию потомству. У прокариот, таких как E. coli , ДНК Pol III является основной полимеразой, участвующей в репликации ДНК. Хотя ДНК Pol II не является основным фактором репликации хромосом, у нее есть и другие функции.
ДНК Pol II действительно участвует в репликации ДНК. Хотя он, возможно, и не такой быстрый, как ДНК Pol III, он обладает некоторыми способностями, которые делают его эффективным ферментом. Этот фермент обладает ассоциированной 3'→5' экзонуклеазной активностью наряду с активностью примазы . ДНК Pol II представляет собой фермент высокой точности с частотой ошибок замены ≤ 2 × 10. −6 и частота ошибок сдвига кадра -1 ≤ 1 × 10. −6 . ДНК Pol II может корректировать и обрабатывать несоответствия, вызванные Pol III. Банах-Орловска и др. показали, что ДНК Pol II участвует в репликации, но зависит от цепи и преимущественно реплицирует отстающую цепь . Предлагаемый механизм предполагает, что когда ДНК Pol III останавливается или становится нефункциональной, тогда ДНК Pol II может быть специально рекрутирована в точку репликации и продолжить репликацию. [ 1 ]
Существует много разных способов повреждения ДНК, от повреждения ультрафиолетом до окисления, поэтому логично, что существуют разные типы полимераз для устранения этих повреждений. Одна важная роль ДНК Pol II заключается в том, что она является основной полимеразой для восстановления межцепочечных поперечных связей. Межнитевые поперечные связи вызываются такими химическими веществами, как азотистый иприт и псорален , которые вызывают цитотоксические повреждения. Исправить эти повреждения сложно, поскольку обе цепи ДНК были повреждены химическим агентом и, следовательно, генетическая информация на обеих цепях неверна. Точный механизм фиксации этих межнитевых поперечных связей все еще исследуется, но известно, что Pol II в этом активно участвует. [ 11 ]
Активность
[ редактировать ]ДНК Pol II не является наиболее изученной полимеразой, поэтому существует множество предполагаемых функций этого фермента, которые являются вероятными, но в конечном итоге не подтверждены: [ 1 ]
- восстановление ДНК, поврежденной УФ-облучением
- перезапуск репликации у E. coli, облученной УФ-излучением
- адаптивный мутагенез
- долгосрочное выживание
Механизм
[ редактировать ]
Во время репликации ДНК пары оснований в последовательности могут быть повреждены. Поврежденная последовательность ДНК может привести к остановке репликации. [ 12 ] Чтобы исправить ошибку в последовательности, ДНК Pol II катализирует восстановление пар нуклеотидных оснований. Исследования in vitro показали, что Pol II иногда взаимодействует с вспомогательными белками Pol III (β-зажим и комплекс загрузки зажима), предоставляя Pol II доступ к растущей растущей цепи. [ 1 ] [ 13 ] [ 14 ] [ 15 ] Что касается функции Pol II ДНК во время репликации ДНК, это имеет смысл, поскольку любые ошибки, которые производит Pol III, будут происходить в растущей цепи, а не в консервативной цепи. N-концевой домен ДНК Pol II отвечает за ассоциацию и диссоциацию цепи ДНК с каталитической субъединицей. Скорее всего, в N-концевом домене ДНК Pol II есть два сайта, которые распознают одноцепочечную ДНК. Один сайт(ы) отвечает за рекрутирование одноцепочечной ДНК в ДНК Pol II, а другой сайт(ы) отвечает за диссоциацию одноцепочечной ДНК от ДНК Pol II. [ 16 ]

При связывании субстрата ДНК Pol II связывает нуклеозидтрифосфаты, поддерживая структуру ДНК с водородными связями. Затем связывается правильный dNTP, и ферментный комплекс претерпевает конформационные изменения субдоменов и аминокислотных остатков. Эти конформационные изменения позволяют увеличить скорость синтеза репарации. [ 17 ] Активный центр содержит два Mg 2+ ионы, стабилизированные каталитическими аспарагиновыми кислотами D419 и D547. [ 18 ] Ионы магния связываются с ДНК вместе с dNTP в открытом состоянии и координируют конформационные изменения аминокислотных остатков активного центра для осуществления катализа (закрытое состояние). После высвобождения ионов магния фермент возвращается в открытое состояние. [ 19 ]
Распространение видов
[ редактировать ]Прокариотический
[ редактировать ]ДНК-полимераза II является членом семейства полимераз B и поддерживает полимеразу III в репликации ДНК, перемещающейся от 3'-конца к 5'-концу. [ 20 ] В случае, если Полимераза III останавливается во время ошибки репликации, Полимераза II может прервать и удалить несовпадающие основания. Полимераза II имеет гораздо более высокий коэффициент точности, чем Полимераза III, а это означает, что вероятность возникновения ошибочных спариваний гораздо ниже. Без этапа корректуры Полимеразы II Полимераза III увеличила бы количество неправильных спариваний и, таким образом, создала бы мутацию. [ 1 ]
Помимо защиты от мутаций, которые могут быть вызваны полимеразой III, полимераза II защищает от мутаций, вызванных полимеразой IV. Полимераза IV гораздо более склонна к ошибкам, чем Полимераза II, но также способна восстанавливать несовпадающие пары оснований, начиная с 3'-конца. Полимераза II защищает 3'-конец от Полимеразы IV и блокирует ее действие. Эта защита предотвратит образование мутаций, пока Полимераза II функционирует нормально. Если Полимераза II будет выведена из строя в результате мутации или отключена другими факторами, Полимераза IV займет ее место, чтобы исправить неправильно спаренные основания. [ 1 ]
Эукариотический
[ редактировать ]Хотя Полимераза II не будет функционировать естественным путем в сочетании с эукариотами семейства B, она имеет схожие структурные и функциональные мотивы. Члены семейства B включают полимеразы α, ε, ζ и δ. Все эти полимеразы корректируют вновь синтезированную ДНК в направлении 3’→5’. Эти полимеразы способны синтезировать ДНК как на ведущей, так и на отстающей цепи. Этот класс полимераз имеет тенденцию быть очень точным, что позволяет им исправлять любые ошибки спаривания, возникающие во время синтеза ДНК. [ 20 ]
Регулирование
[ редактировать ]ДНК-полимераза II естественным образом присутствует в клетке, ее количество обычно в пять раз превышает количество полимеразы III. Такое большее изобилие позволяет Полимеразе II подавлять Полимеразу III в случае неправильного спаривания. Это количество может быть увеличено после индукции SOS-ответа, который активирует ген polB, поэтому количество Полимеразы II увеличивается примерно в семь раз. Хотя Полимераза II может воздействовать на обе цепи, было показано, что она предпочитает отстающую цепь, а не ведущую. [ 1 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час Банах-Орловска М., Фиялковска И.Ю., Шаапер Р.М., Йончик П. (октябрь 2005 г.). «ДНК-полимераза II как фактор точности синтеза хромосомной ДНК в Escherichia coli» . Молекулярная микробиология . 58 (1): 61–70. дои : 10.1111/j.1365-2958.2005.04805.x . ПМИД 16164549 .
- ^ Перейти обратно: а б Корнберг Т., Гефтер М.Л. (сентябрь 1970 г.). «Синтез ДНК в бесклеточных экстрактах мутанта с дефектом ДНК-полимеразы». Связь с биохимическими и биофизическими исследованиями . 40 (6): 1348–55. дои : 10.1016/0006-291X(70)90014-8 . ПМИД 4933688 .
- ^ Перейти обратно: а б Моисей Р.Э., Ричардсон CC (декабрь 1970 г.). «Новая ДНК-полимеразная активность Escherichia coli. I. Очистка и свойства активности, присутствующей в E. coli polA1». Связь с биохимическими и биофизическими исследованиями . 41 (6): 1557–64. дои : 10.1016/0006-291X(70)90565-6 . ПМИД 4922636 .
- ^ Перейти обратно: а б Книпперс Р. (декабрь 1970 г.). «ДНК-полимераза II». Природа . 228 (5276): 1050–3. Бибкод : 1970Natur.228.1050K . дои : 10.1038/2281050a0 . ПМИД 4921664 . S2CID 4211529 .
- ^ Леман И.Р., Бессман М.Дж., Симмс Э.С., Корнберг А. (июль 1958 г.). «Ферментативный синтез дезоксирибонуклеиновой кислоты. I. Получение субстратов и частичная очистка фермента из кишечной палочки» . Журнал биологической химии . 233 (1): 163–70. дои : 10.1016/S0021-9258(19)68048-8 . ПМИД 13563462 .
- ^ Смит Д.В., Шаллер Х.Э., Бонхеффер Ф.Дж. (май 1970 г.). «Синтез ДНК in vitro». Природа . 226 (5247): 711–3. Бибкод : 1970Natur.226..711S . дои : 10.1038/226711a0 . ПМИД 4910150 . S2CID 1505496 .
- ^ Де Люсия П., Кэрнс Дж. (декабрь 1969 г.). «Выделение штамма E. coli с мутацией, затрагивающей ДНК-полимеразу». Природа . 224 (5225): 1164–6. Бибкод : 1969Natur.224.1164D . дои : 10.1038/2241164a0 . ПМИД 4902142 . S2CID 4182917 .
- ^ Корнберг Т., Гефтер М.Л. (апрель 1971 г.). «Очистка и синтез ДНК в бесклеточных экстрактах: свойства ДНК-полимеразы II» . Труды Национальной академии наук Соединенных Штатов Америки . 68 (4): 761–4. Бибкод : 1971ПНАС...68..761К . дои : 10.1073/pnas.68.4.761 . ПМК 389037 . ПМИД 4927672 .
- ^ Андерсон В.Ф., Принс Д.Б., Ю Х., МакЭнти К., Гудман М.Ф. (апрель 1994 г.). «Кристаллизация ДНК-полимеразы II из Escherichia coli». Журнал молекулярной биологии . 238 (1): 120–2. дои : 10.1006/jmbi.1994.1765 . ПМИД 8145251 .
- ^ Дебес, Седрик; Пападакис, Антониос; Грёнке, Себастьян; Каралай, Озлем; Тейн, Люк С.; Мизи, Афанасия; Накамура, Сюхей; Хан, Оливер; Вайгельт, Карина; Йосипович, Наташа; Зиркель, Энн; Брусиус, Изабель; Софиадис, Константинос; Лампрузи, Манта; Лу, Ю-Сюань; Хуан, Вэньмин; Эсмаили, Реза; Кубацкий, Торстен; Шпет, Мартин Р.; Шермер, Бернхард; Бенцинг, Томас; Мюллер, Роман-Ульрих; Антеби, Адам; Партридж, Линда; Папантонис, Аргирис; Бейер, Андреас (12 апреля 2023 г.). «Связанные со старением изменения в элонгации транскрипции влияют на продолжительность жизни» . Природа . 616 (7958): 814–821. дои : 10.1038/s41586-023-05922-y . ПМЦ 10132977 . ПМИД 37046086 .
- ^ Перейти обратно: а б Бебенек К., Кункель Т.А. (2004). «Функции ДНК-полимераз». Достижения в области химии белков . 69 : 137–65. doi : 10.1016/S0065-3233(04)69005-X . ISBN 9780120342693 . ПМИД 15588842 .
- ^ Бешерель О.Дж., Фукс Р.П. (июль 2001 г.). «Механизм мутагенеза сдвига рамки считывания, опосредованного ДНК-полимеразой II» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (15): 8566–71. Бибкод : 2001PNAS...98.8566B . дои : 10.1073/pnas.141113398 . ПМК 37476 . ПМИД 11447256 .
- ^ Викнер С., Гурвиц Дж. (октябрь 1974 г.). «Преобразование вирусной ДНК phiX174 в двухцепочечную форму очищенными белками Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 71 (10): 4120–4. Бибкод : 1974PNAS...71.4120W . дои : 10.1073/pnas.71.10.4120 . ПМК 434340 . ПМИД 4610569 .
- ^ Хьюз А.Дж., Брайан С.К., Чен Х., Мозес Р.Э., МакГенри К.С. (март 1991 г.). «ДНК-полимераза II Escherichia coli стимулируется вспомогательными субъединицами голофермента ДНК-полимеразы III» . Журнал биологической химии . 266 (7): 4568–73. дои : 10.1016/S0021-9258(20)64360-5 . ПМИД 1999435 .
- ^ Боннер К.А., Стукенберг П.Т., Раджагопалан М., Эритжа Р., О'Доннелл М., МакЭнти К. и др. (июнь 1992 г.). «Процессивный синтез ДНК ДНК-полимеразой II, опосредованный вспомогательными белками ДНК-полимеразы III» . Журнал биологической химии . 267 (16): 11431–8. дои : 10.1016/S0021-9258(19)49928-6 . ПМИД 1534562 .
- ^ Маки С., Хасимото К., Охара Т., Сугино А. (август 1998 г.). «ДНК-полимераза II (эпсилон) Saccharomyces cerevisiae диссоциирует от матрицы ДНК путем считывания одноцепочечной ДНК» . Журнал биологической химии . 273 (33): 21332–41. дои : 10.1074/jbc.273.33.21332 . ПМИД 9694894 .
- ^ Берд В.А., Уилсон С.Х. (май 2014 г.). «Структура и механизм ДНК-полимеразы β» . Биохимия . 53 (17): 2768–80. дои : 10.1021/bi500139h . ПМК 4018062 . ПМИД 24717170 .
- ^ Ван Ф, Ян В (декабрь 2009 г.). «Структурное понимание синтеза транслейкоза с помощью ДНК Pol II» . Клетка . 139 (7): 1279–89. дои : 10.1016/j.cell.2009.11.043 . ПМЦ 3480344 . ПМИД 20064374 .
- ^ Ян Л., Арора К., Бирд В.А., Уилсон Ш., Шлик Т. (июль 2004 г.). «Критическая роль ионов магния в закрытии и сборке активного сайта бета-полимеразы ДНК». Журнал Американского химического общества . 126 (27): 8441–53. дои : 10.1021/ja049412o . ПМИД 15238001 .
- ^ Перейти обратно: а б Мандал А (26 февраля 2019 г.). «Прокариотические ДНК-полимеразы» . Новости Медицинские .