Окрашивание

Окрашивание - это метод, используемый для повышения контрастности в образцах, как правило, на микроскопическом уровне. Пятна и красители часто используются в гистологии (микроскопическое исследование биологических тканей ), в цитологии (микроскопическое исследование клеток ) и в медицинских областях гистопатологии , гематологии и цитопатологии , которые фокусируются на исследовании и диагнозе заболеваний . на микроскопическом уровне Полем Пятна могут использоваться для определения биологических тканей (подчеркивая, например, мышечные волокна или соединительную ткань ), клеточных популяций (классификации различных клеток крови ) или органеллов в отдельных клетках.
В биохимии он включает в себя добавление специфического класса ( ДНК , белки , липиды , углеводы ) в субстрат для квалификации или количественной оценки присутствия определенного соединения. Окрашивание и флуоресцентное теги могут служить аналогичным целям. Биологическое окрашивание также используется для маркировки клеток в проточной цитометрии , а также для флагирования белков или нуклеиновых кислот в гелевом электрофорезе . Световые микроскопы используются для просмотра окрашенных образцов при высоком увеличении, обычно с использованием освещения яркого поля или эпи-флуоресценции.
Окрашивание не ограничивается только биологическими материалами, поскольку оно также может использоваться для изучения структуры других материалов; Например, пластинчатые структуры полукристаллических полимеров или доменных структур блок-сополимеров .
In vivo против in vitro
[ редактировать ]in vivo Окрашивание (также называемым окрашиванием жизненно важным или внутривидовым окрашиванием) является процессом окрашивания живых тканей. Вызывая определенные клетки или структуры, чтобы принять контрастные цвета, их форма ( морфология ) или положение в клетке или ткани можно легко увидеть и изучить. Обычная цель - раскрыть цитологические детали, которые в противном случае не могли бы быть очевидными; Однако окрашивание также может выявить, где в клетках или тканях происходят определенные химические вещества или специфические химические реакции.
Окрашивание in vitro включает в себя раскраски или структуры, которые были удалены из их биологического контекста. Определенные пятна часто объединяются, чтобы раскрыть больше деталей и особенностей, чем единственное пятно. В сочетании с конкретными протоколами для фиксации и подготовки образцов ученые и врачи могут использовать эти стандартные методы в качестве последовательных, повторяемых диагностических инструментов. Противостояние - это окрашивание, которое делает клетки или структуры более заметными, когда они не полностью видны с основным пятен.
- Кристаллические фиолетовые пятна как грамположительные, так и грамотрицательные организмы. Лечение алкоголем удаляет кристаллический фиолетовый цвет только из грамма -негативных организмов. Сафранин как Contrestain используется для окрашивания грамма -негативных организмов, которые были обесцвечены алкоголем.
В то время как ex vivo, многие клетки продолжают жить и метаболизироваться, пока они не станут «фиксированными». Некоторые методы окрашивания основаны на этом свойстве. Эти пятна, исключенные живыми клетками, но поглощенные и без того мертвыми клетками, называются жизненно важными пятнами (например, трипановый синий или йодид пропидия для эукариотических клеток). Те, кто вводит и окрашивает живые клетки, называются супдвитлазными пятнами (например, новый метиленовый синий и блестящий крезиловый синий для окрашивания ретикулоцитами ). Тем не менее, эти пятна в конечном итоге токсичны для организма, некоторые больше, чем другие. Частично из -за их токсического взаимодействия внутри живой клетки, когда суправитал -пятна попадают в живую клетку, они могут создавать характерную схему окрашивания, отличающегося от окрашивания и без того фиксированной клетки (например, «ретикулоцит», «внешний вид против диффузной« полихромаса »). Для достижения желаемых эффектов пятна используются в очень разбавленных решениях в диапазоне от 1 : 5 000 до 1 : 500 000 (Howey, 2000). Обратите внимание, что многие пятна могут использоваться как в живых, так и в фиксированных клетках.
Подготовка
[ редактировать ]Подготовительные этапы, связанные с запланированным типом анализа. Некоторые или все из следующих процедур могут потребоваться.
Влажные крепления используются для просмотра живых организмов и могут быть сделаны с использованием воды и определенных пятен. Жидкость добавляется к слайду перед добавлением организма, и покровное стекло помещается над образцом в воде и окрашивает, чтобы помочь сдержать его в поле зрения . [ 1 ]
Фиксация , которая сама по себе может состоять из нескольких этапов, направлена на то, чтобы сохранить форму клеток или ткани как можно больше. Иногда тепловая фиксация используется, чтобы убить, придерживаться и изменения образца, поэтому он принимает пятна. Большинство химических фиксированных фиксированных (химических веществ, вызывающих фиксацию), генерируют химические связи между белками и другими веществами в образце, увеличивая их жесткость. Общие фиксаторы включают формальдегид , этанол , метанол и/или пикриновая кислота . Кусочки ткани могут быть встроены в парафиновый воск, чтобы увеличить их механическую прочность и стабильность и облегчить их разрезание на тонкие срезы. [ 2 ]
Морданты - это химические агенты, которые способны делать красители для окрашивания материалов, которые в противном случае невыразимы
Морданты классифицируются на две категории:
а) Основной мордант: реагировать с кислотными красителями, например, квасцы, сульфат железа, хлорид цетилпиридиния и т. Д.
б) Кислотный мордант: реагировать с основными красителями, например, пикриновая кислота, таниновая кислота и т. Д.
[ 2 ] Прямое окрашивание: выполнено без Морданта.
Косвенное окрашивание: окрашивание с помощью Морданта.
| Sr нет. | Название техники косвенного окрашивания | Название Морданта применяется |
|---|---|---|
| 1.) | Грамм окрашивает | Грамм йод |
| 2.) | Окрашивание клеточной стенкой
а.) Метод Рингера б.) Метод Дайра |
10% таниновая кислота
0,34% CPC |
| 3.) | Окрашивание жгутиков
а.) Метод Лейфсона б.) Метод Лоффлера |
Танниновая кислота в пятно Лейфсона
Loeffler's Mordant (20%таниновая кислота) |
| 4.) | Спирохет окрашивание
а.) Метод Фонтаны б.) Метод Беккера |
Мордант Фонтана (5%таниновая кислота)
Мордант Фонтана (5%таниновая кислота) |
Проницаемость включает в себя лечение клеток (обычно) мягким поверхностно -активным веществом . Эта обработка растворяет клеточные мембраны и позволяет большим молекулам красителя во внутреннюю часть клетки.
Монтаж обычно включает прикрепление образцов к стеклянному микроскопу для наблюдения и анализа. В некоторых случаях клетки могут выращиваться непосредственно на слайде. Для образцов свободных клеток (как в случае с мазовом крови или мазором PAP ) образец может быть непосредственно нанесен на слайд. Для более крупных кусочков ткани тонкие срезы (срезы) изготовлены с использованием микротома ; Эти срезы могут быть установлены и осмотрены.
Стандартизация
[ редактировать ]Большинство красителей, обычно используемых в микроскопии, доступны в виде BSC-сертифицированных пятен . Это означает, что образцы партии производителя были протестированы независимым организмом, Биологической комиссией по пятнам ( BSC ) и обнаружено, что они соответствуют или превышают определенные стандарты чистоты, содержание красителя и производительность в методах окрашивания, обеспечивающих более точные эксперименты и более надежные результаты Эти стандарты опубликованы в журнале Комиссии Biotechnic & Histochemistry . [ 3 ] Многие красители не соответствуют составу от одного поставщика к другому. Использование сертифицированных BSC пятен устраняет источник неожиданных результатов. [ 4 ]
Некоторые поставщики продают пятна «сертифицированы» сами по себе, а не биологической комиссией. Такие продукты могут или не могут быть подходящими для диагностики и других применений. [ 5 ]
Отрицательное окрашивание
[ редактировать ]
Простой метод окрашивания для бактерий, который обычно является успешным, даже если методы положительного окрашивания не стержат, - это использование отрицательного пятна . Это может быть достигнуто путем размазывания образца на слайд, а затем применив нигрозин (черный синтетический краситель) или чернила Индии (водная суспензия частиц углерода). После сушки микроорганизмы могут рассматриваться в яркой полевой микроскопии, поскольку более легкие включения, хорошо контролируемые в отношении темной окружающей среды, окружающей их. [ 6 ] Отрицательное окрашивание способно окрасить фон вместо организмов, потому что клеточная стенка микроорганизмов обычно имеет отрицательный заряд, который отталкивает отрицательно заряженное пятно. Красители, используемые при отрицательных окрашивании, являются кислыми. [ 1 ] Примечание: негативное окрашивание - это мягкая техника, которая может не разрушать микроорганизмы и, следовательно, не подходит для изучения патогенов.
Положительное окрашивание
[ редактировать ]В отличие от отрицательного окрашивания, положительное окрашивание использует основные красители для окрашивания образца на ярком фоне. В то время как хромофор используется как для отрицательного, так и для положительного окрашивания, тип хромофора, используемого в этой технике, является положительно заряженным ионом, а не отрицательным. Негативно заряженная клеточная стенка многих микроорганизмов привлекает положительно заряженный хромофор, который заставляет образец поглощать пятно, придавая ему цвет используемого пятна. Положительное окрашивание используется чаще, чем отрицательное окрашивание в микробиологии. Различные типы положительного окрашивания перечислены ниже. [ 1 ]
Простой и дифференциал
[ редактировать ]Простое окрашивание - это метод, который использует только один тип пятна на слайде за раз. Поскольку используется только одно пятно, образцы (для положительных пятен) или фон (для отрицательных пятен) будут одним цветом. Следовательно, простые пятна обычно используются для просмотра только одного организма на слайд. Дифференциальное окрашивание использует несколько пятен на слайд. Основываясь на используемых пятнах, организмы с различными свойствами будут выглядеть разными цветами, позволяющими категоризировать несколько образцов. Дифференциальное окрашивание также может использоваться для окрашивания различных органелл в одном организме, которые можно увидеть при окрашивании Эндоспора . [ 1 ]
Типы
[ редактировать ]| Старший Хорошо. | Техника окрашивания | Подготовка | Приложение | Результат |
|---|---|---|---|---|
| 1. | Простой (монохромный) | Мазок окрашивает с одним красителем.
Например, метилен, сафранин ° = ↗ → и т. Д. |
Используется для выделения микробов и иллюстрации клеточных
Формы и аранжировки |
Организмы окрашены в цвет прикладного пятна |
| 2. | Отрицательный (рельеф) | Мазок, смешанный с нигрозином и распространять
в тонкую пленку |
Изучите морфологию клеток | Организм окрашен, фон черный |
| 3 | Грамм | Первичное пятно: кристаллическая фиолетовая, применяемая к пленке, затем обработано йодом (Mordant), спиртом (деколуризатор) и столовой окрашены сафранином | Характеризует бактерии в одной из двух групп, грампофиксированные или грамотрицательные | Грампофилька выглядит фиолетовым цветом
Грамм негативно выглядит розовым в цвете |
| 4 | Кислотный быстрый (техника Ziehl-Neelsen) | Пленка, окрашенная горячим ZNCF, деколуризированным (кислотным алкоголем) и противоречивым окрашиванием метиленовым синим | Отдельные нецелоризованные кислотные бактерии, которые не обесцвечены от раскрашенных некистных быстрых бактерий | Кислотные быстрые бактерии: красные
Не кислотный пост: синий |
| 5 | Эндоспору (метод Дорнора) | Первичное окрашивание малахит зеленое тепло, прикрепленное к проникновению споров; вегетативные клетки противостоят сафранину | Обнаруживает наличие эндоспоров в шести родах бактерий | Эндоспоры: зеленый
Вегетативные клетки: красные |
| 6 | Капсула
A: Метод HISS (позитивная техника) Б: Техника Маневала (негатив) |
Мазок, окрашенный пятнам шипа после лечения сульфатом меди
Бактериальная суспензия, смазанная вместе с Congo Red, и пятно маневаля применяется |
Капсулы можно наблюдать в виде прозрачных зон, окружающих клеток капсулированных бактерий, и используются для демонстрации присутствия капсул. | Капсула: светло -фиолетовый/бледный лиловый цвет
Бактерии: фиолетовая капсула, бактериальная клетка, выделяется на темном фоне |
| 7 | Клеточная стенка (метод Dyar) | Мазок, обработанный CPC, который диссоциирует с образованием положительно заряженного цетил -пиридиния и отрицательно заряженных ионов хлорида. Положительно заряженные ионы адсорбируются на отрицательно заряженной клеточной стенке | Пятна клеточная стенка бактерии | Клеточная стенка: красная цитоплазма: синяя |
| 8 | Жгности (метод Лейфсона) | Мордант действует, чтобы сгущать жгутику перед окрашиванием и увеличивает микроскопически видимость при окрашивании пятном Лейфсона | Демонстрирует присутствие жгутиков | Жгности: красные вегетативные клетки: синий |
| 9 | Ядерный материал (техника Feulgen) | Мазок обрабатывается для гидролиза, чтобы высвобождать пурины из ДНК, пурины, чтобы вызвать сдвиг образует фураноз в альдегид. Группы альдегида доступны для реагирования с реагентом Шиффа, чтобы сформировать добавленные соединения. | Продемонстрировать присутствие ДНК в клетке. Но для обнаружения ДНК РНК должна быть избирательно разрушена с помощью кислотного гидролиза, не влияя на ДНК | Ядерный материал- розоватый фиолетовый,
Цитоплазма- бесцветный |
| 10 | Метахроматические гранулы (метод Альберта) | Мазок сначала обрабатывается хлороформом для удаления жиров. Мазок, нанесенный пятном Alberts, который содержит катионные красители, такие как толуидиновый синий и малахитовый зеленый. Толуидиновый синий предпочтительно окрашивает гранулы, в то время как малахитовая зеленая пятна цитоплазма. | Гранулы показывают типичную природу монохроматизма, это используется для демонстрации гранул | Гранулы: голубоватый черный, цитоплазма: зеленая |
| 11 | Внутриклеточные липиды (метод Бурдона) | Липиды окрашены жирными растворимыми красителями, такими как Sudan Black. При применении суданских черных B-красителей перемещаются в липиды и сохраняются там, в то время как цитоплазма окрашена сафранином. | Чтобы обнаружить присутствие липидов в клеточной стенке, клеточной мембране или жировой глобуле (PHB в цитоплазме) | Гранулы липидов: глубокий синий,
Цитоплазма: светло -розовый |
| 12 | Полисахарид (метод Хотч Кусс) | Полисахарид окисляется периодатом с образованием полиалдегида, который реагирует с реагентами Шиффа на красный цвет, в то время как цитоплазма окрашивается малахитом зеленым | Обнаружает накопление полисахаридных гранул в клетках | Полисахарид: красный
Цитоплазма: зеленая |
Методы
[ редактировать ]Грамм
[ редактировать ]Окрашивание грамма используется для определения статуса грамма для классификации бактерий в широком смысле на основе состава их клеточной стенки . Окрашивание грамма использует кристаллическую фиолетовую для окрашивания клеточных стенков, йод (как монтант), а фуксин или сафранин противостоят (отметьте все бактерии). Статус грамма помогает разделить образцы бактерий на две группы, как правило, репрезентативные для их основной филогения. Эта характеристика в сочетании с другими методами делает его полезным инструментом в лабораториях клинических микробиологии, где это может быть важно при раннем отборе соответствующих антибиотиков . [ 8 ]
На большинстве окрашенных грамм препаратов грамотрицательные организмы кажутся красными или розовыми из-за их контрабанта. Из-за присутствия более высокого содержания липидов после лечения алкоголя пористость клеточной стенки увеличивается, следовательно, комплекс CVI (кристаллический фиолетовый-йод) может пройти через себя. Таким образом, первичное пятно не сохраняется. Кроме того, в отличие от большинства грамположительных бактерий, грамотрицательные бактерии имеют только несколько слоев пептидогликана и вторичной клеточной мембраны, сделанной в основном из липополисахарида.
Эндоспора
[ редактировать ]Окрашивание эндоспоры используется для определения наличия или отсутствия эндоспоров , которые затрудняют убить бактерии. Бактериальные споры оказались трудно окрасить, поскольку они не проницаемы для водных красительных реагентов. Окрашивание эндоспоры особенно полезно для идентификации эндоспоры, образующих бактериальные патогены, такие как Clostridium difficile . Перед разработкой более эффективных методов это пятно было выполнено с использованием метода Wirtz с тепловой фиксацией и Counterstain. Благодаря использованию малахитового зеленого и разбавленного соотношения карбола фуксин, фиксация бактерий в осмической кислоте была отличным способом обеспечения отсутствия смешивания красителей. Тем не менее, недавно пересмотренные методы окрашивания значительно снизили время, необходимое для создания этих пятен. Этот пересмотр включал замену карбола фуксина водным сафранином в сочетании с недавно разбавленной 5% -ной формулой малахитового зеленого. Этот новый и улучшенный состав пятен проводился так же, как и раньше, с использованием тепловой фиксации, полоскания и промокания сухого для последующего обследования. После изучения все бактерии, образующие эндоспору, будут окрашены зелеными, сопровождаемыми всеми другими клетками, появляющимися красными. [ 9 ]
Зил-Нельсен
[ редактировать ]Окрашивание Зил -Нилсена -это кислото-хитровое пятно, используемое для окрашивания видов микобактерии туберкулеза , которое не окрашивает стандартными лабораторными процедурами окрашивания, такими как окрашивание грамма.
Это пятно выполняется благодаря использованию как красного цвета , который окрашивает бактерии и столовое пятно, такое как метиленовый синий .
Гематоксилин и эозин (H & E)
[ редактировать ]
Окрашивание гематоксилином и эозином часто используется в гистологии для изучения тонких тканевых срезов. [ 10 ] Гематоксилин пятна клеточных ядер синий, в то время как эозин окрашивает цитоплазму, соединительную ткань и другие внеклеточные вещества розовые или красные. [ 10 ] Эозин сильно поглощается эритроцитами , окрашивая их ярко -красным. При умело сделанном подготовке H & E эритроциты практически оранжевые, а коллаген и цитоплазму (особенно мышцы) приобретают разные оттенки розового.
Папаниколау
[ редактировать ]Окрашивание Papanicolaou , или окрашивание PAP, было разработано для замены цитологии аспирации тонкой иглы (FNAC) в надежде на сокращение времени окрашивания и стоимости без ущерба для качества. Это пятно является часто используемым методом для изучения образцов клеток из различных типов тканей в различных органах. Окрашивание PAP пережило несколько модификаций, чтобы стать «подходящей альтернативой» для FNAC. Этот переход проистекает из оценки влажных фиксированных мазков со стороны ученых, сохраняющих структуры ядер, противоположные непрозрачному появлению воздухозащитных римско -мазки. Это привело к созданию гибридного пятно влажного фиксированного и высушенного воздуха, известного как сверхбыстрый пятно папаниколау. Эта модификация включает в себя использование носового физиологического раствора для регидрата клеток для повышения прозрачности клеток и в паре с использованием алкогольного формалина для усиления цвета ядер. Окрашивание Papanicolaou в настоящее время используется вместо цитологического окрашивания во всех типах органов из -за его увеличения морфологического качества, снижения времени окрашивания и снижения затрат. Он часто используется для окрашивания Образцы мазода PAP . [ 11 ] Он использует комбинацию гематоксилина , оранжевого G , Eosin Y , светло -зеленого SF , и иногда Bismarck Brown Y. [ 10 ] [ 11 ] [ 12 ]
НЕТ
[ редактировать ]
[ 13 ] Периодическая кислота-сиффиф является специальным гистологическим пятном, используемым для маркировки углеводов ( гликоген , гликопротеин , протеогликаны ). PAS обычно используется в тканях печени, где производятся отложения гликогена, которые предпринимаются в усилиях по различению различных типов заболеваний хранения гликогена. PAS важна, потому что он может обнаруживать гранулы гликогена, обнаруженные в опухолях яичников и поджелудочной железы эндокринной системы, а также в мочевом пузыре и почках почечной системы. Базальные мембраны также могут появляться в пятнах PAS и могут быть важны при диагностике почечных заболеваний. Из -за большого объема углеводов в клеточной стенке гиф и дрожжевых форм грибов, пятна периодической кислоты -отшиффы могут помочь найти эти виды в образцах ткани человеческого тела.
Массон
[ редактировать ]Трихром Массона (как следует из названия) трехцветный протокол окрашивания. Рецепт развивался из оригинальной техники Массона для различных конкретных применений, но все они хорошо подходят для отличия клеток от окружающей соединительной ткани . Большинство рецептов производят красные кератиновые и мышечные волокна, синие или зеленые окрашивание коллагена и костей , светло -красное или розовое окрашивание цитоплазмы и ядра чернокожих клеток .
Романовский
[ редактировать ]Пятна романовского считаются эффектом окрашивания полихромными и основаны на комбинации эозина плюс (химически сниженного эозина ) и деметилированного метиленового синего (содержащего его продукты окисления Azure A и Azure B ). Это пятно развивает различные цвета для всех клеточных структур («эффект Rommanowsky-Giemsa) и, таким образом, использовался в полиморфе окрашивания нейтрофилов и ядер клеток. Обычные варианты включают пятно Райта , пятно Дженнера , Стейн Мэй-Грунвальд, пятно Лейшмана и Гимса Стейн .
Все они используются для изучения крови или костного мозга образцов . Они предпочтительнее H & E для проверки клеток крови, потому что различные типы лейкоцитов (лейкоциты) можно легко отличить. Все они также подходят для изучения крови для обнаружения переносимых кровь паразитов, таких как малярия . [ 14 ]
Серебро
[ редактировать ]
Окрашивание серебра - это использование серебра для окрашивания гистологических срезов . Этот вид окрашивания важен для демонстрации белков (например, коллаген типа III ) и ДНК . Он используется, чтобы показать оба вещества внутри и внешних ячеек . Окрашивание серебра также используется в электрофорезе по градиенту температуры .
Клетки Арджентафина уменьшают раствор серебра в металлическое серебро после формалина фиксации . Этот метод был обнаружен итальянским Камилло Гольджи с использованием реакции между нитратом серебра и дихроматом калия , таким образом, осаждая хромат серебра в некоторых клетках (см. Метод Гольджи ). Рирофильные клетки уменьшают раствор серебра в металлическое серебро после воздействия пятно, которое содержит редуктатор . Примером этого может быть гидрохинон или формалин.
Судан
[ редактировать ]Окрашивание Судана использует суданские красители для окрашивания суданофильных веществ, часто включающих липиды . Судан III , Судан IV , нефтяной красный O , тетроксид осмия и Sudan Black B часто используются. Окрашивание Судана часто используется для определения уровня фекального жира при диагностике стеатореи .
Вирц-Конклин
[ редактировать ]Пятна Wirtz-Conklin-это специальная техника, предназначенная для окрашивания истинных эндоспоров с использованием малахитового зеленого красителя в качестве основного пятна и сафранина в качестве противника. После того, как они окрашивают, они не обесцвечивают. Добавление тепла в процессе окрашивания является огромным фактором. [ 15 ] Тепло помогает открыть мембрану спор, чтобы краситель мог войти. Основная цель этого пятна - показать прорастание бактериальных споров. Если происходит процесс прорастания, то спор станет зеленым цветом из -за малахитового зеленого, а окружающая ячейка будет красной от сафранина. Это пятно также может помочь определить ориентацию споры в бактериальной клетке; Будь то терминал (на кончике), субтерминальный (внутри ячейки) или центральный (полностью в середине клетки).
Коллагеновый гибридизующий пептид
[ редактировать ]Окрашивание гибридизирующим пептидом коллагена (CHP) позволяет легко, прямой способ окрашивать денатурированные коллагены любого типа (тип I, II, IV и т. Д.) Независимо от того, были ли они повреждены или разлагаются с помощью ферментативных, механических, химических или термических средств. Они работают, переживая в тройную спираль коллагена с доступными отдельными нити в ткани. CHP можно визуализировать с помощью простого флуоресцентного микроскопа .
Общие биологические пятна
[ редактировать ]Различные пятна реагируют или концентрируются в разных частях клетки или ткани, и эти свойства используются для преимущества для выявления определенных частей или областей. Некоторые из наиболее распространенных биологических пятен перечислены ниже. Если иное не отмечено, все эти красители могут использоваться с фиксированными клетками и тканями; Отмечены жизненно важные красители (подходящие для использования с живыми организмами).
Акридиновый апельсин
[ редактировать ]Акридиновый оранжевый (AO) представляет собой селективный флуоресцентный катионный краситель нуклеиновой кислоты, полезный для определения клеточного цикла. Он проницателен и взаимодействует с ДНК и РНК с помощью интеркаляции или электростатических достопримечательностей. Когда он связан с ДНК, он очень похож на флуоресцеин. Как и флуоресцеин, он также полезен в качестве неспецифического окрашивания для подсветки. Окрашенные окрашенные клетки на поверхности твердого образца ткани (флуоресцентное окрашивание подсветлено [ 16 ] ).
Бисмарк Браун
[ редактировать ][ 17 ] Bismarck Brown (также Bismarck Brown Y или Manchester Brown) придает желтый цвет слизистым муцинам и интенсивный коричневый цвет к тучным клеткам. Одним из дефолтов этого пятна является то, что оно разбросает любую другую структуру, окружающую его и делает низкое качество контраста. Это должно быть в сочетании с другими пятнами, чтобы быть полезным. Некоторые дополняющие пятна, используемые наряду с BiSmark Brown, - это гематоксилин и толуидиновый синий, которые обеспечивают лучшую контрастность в образце гистологии.
Кармин
[ редактировать ]
Carmine - это интенсивный красный краситель, используемый для окрашивания гликогена , в то время как квасцы Carmine - ядерное пятно. Пятна кармина требуют использования морданта, обычно алюминия .
Coomassie Blue
[ редактировать ]Coomassie Brilliant Blue неспецифично окрашивает белки синего синего цвета. Он часто используется в гелевом электрофорезе.
Cresyl Violet
[ редактировать ]Крезиловая фиолетовая окрашивает кислые компоненты нейрональной цитоплазмы фиолетового цвета, в частности Nissl тел . Часто используется в исследовании мозга.
Кристаллическая фиолетовая
[ редактировать ]Кристаллическая фиолетовая , в сочетании с подходящим мордантом, окрашивает клеточные стенки фиолетовые. Кристаллическая фиалка - это пятно, используемое в окрашивании грамм.
DAPI
[ редактировать ]DAPI представляет собой флуоресцентное ядерное пятно, возбужденное ультрафиолетовым светом и демонстрирует синюю синюю флуоресценцию при связывании с ДНК . DAPI связывается с A = T, богатыми повторами хромосом. DAPI также не видна с помощью обычной передачи микроскопии. Это может использоваться в живых или фиксированных клетках. Окрашенные DAPI клетки особенно подходят для подсчета клеток. [ 18 ]
Эозин
[ редактировать ]Эозин чаще всего используется в качестве противостояния гематоксилину, придавая розовый или красный цвет цитоплазматическому материалу, клеточным мембранам и некоторым внеклеточным структурам. Это также придает сильный красный цвет красным кровяным клеткам . Эозин также может быть использован в качестве противостояния в некоторых вариантах окрашивания грамма и во многих других протоколах. На самом деле есть два очень тесно связанных соединения, обычно называемых эозином. Чаще всего используется эозин (также известный как эозин y ws или eosin желтоватый); У него очень слегка желтоватый актер. Другим эозинским соединением является эозин B (голубоватый или имперский красный эозин); У этого есть очень слабый голубоватый актерский состав. Два красителя взаимозаменяемы, и использование одного или другого является скорее вопросом предпочтений и традиций.
Этидий бромид
[ редактировать ]Этидий бромид интеркалирует и окрашивает ДНК, обеспечивая флуоресцентное красное оранжевое пятно. Хотя он не будет окрашивать здоровые клетки, его можно использовать для идентификации клеток, которые находятся на конечных стадиях апоптоза - такие клетки имеют гораздо более проницаемые мембраны . Следовательно, бромид этидия часто используется в качестве маркера для апоптоза в популяциях клеток и для размещения полос ДНК в гелевом электрофорезе . Пятна также может использоваться в сочетании с акридиновым оранжевым (AO) при жизнеспособном подсчете клеток. Это EB/AO комбинированное окрашивание приводит к зеленым живым клеткам, в то время как апоптотические клетки сохраняют отличительную флуоресценцию красного оранжевого.
Фуксин кислота
[ редактировать ]Кислотный фуксин может использоваться для окрашивания коллагена, гладких мышц или митохондрий . Кислотный фуксин используется в качестве ядерного и цитоплазматического окрашивания в методе трихрома Мэллори. Кислотный фуксин окрашивает цитоплазму в некоторых вариантах трихрома Массона. В Picro-Fuchsine Van Gieson Acid Fuchsin придает свой красный цвет коллагеновым волокнам. Кислотный фуксин также является традиционным пятном для митохондрий (метод Альтмана).
Гематоксилин
[ редактировать ]Гематоксилин (гематоксилин в Северной Америке) является ядерным пятном. [ 10 ] Используется с ядрами с гематоксилином ядер с гематоксилином сине-фиолетовой или коричневой. [ 10 ] Чаще всего он используется с эозином в окрашивании H & E (гематоксилином и эозином), одной из наиболее распространенных процедур в гистологии . [ 10 ]
Hoechst пятна
[ редактировать ]HoeChst -это бис которое связывается с незначительной канавкой ДНК -бензимидазол -производное соединение , . Часто используемые в флуоресцентной микроскопии для окрашивания ДНК, пятна Hoechst выглядят желтыми, когда растворяются в водных растворах и испускают синий свет при возбуждении ультрафиолета. Есть два основных типа Hoechst : Hoechst 33258 и Hoechst 33342 . Два соединения функционально схожи, но с небольшой разницей в структуре. Hoechst 33258 содержит терминальную гидроксильную группу и, следовательно, более растворим в водном растворе, однако эти характеристики снижают его способность проникать в плазматическую мембрану . Hoechst 33342 содержит замену этила на терминальную гидроксильную группу (т. Е. Группа этилэфиров), что делает его более гидрофобным для более легкого прохода плазматической мембраны
Йод
[ редактировать ]Йод используется в химии в качестве индикатора для крахмала . Когда крахмал смешан с йодом в растворе, развивается интенсивно темно -синий цвет, представляющий комплекс крахмала/йода. Крахмал - это вещество, общее для большинства растительных клеток, и поэтому слабый йод раствор будет окрасить крахмал, присутствующий в клетках. Йод является одним из компонентов в технике окрашивания, известного как окрашивание грамма , используется в микробиологии . Используемый в качестве монданта в окрашивании Грам, йод усиливает вход красителя через поры, присутствующие в клеточной стенке/мембране.
Решение Лугола или йод Лугола (IKI) представляет собой коричневый раствор, который становится черным в присутствии крахмалов и может использоваться в качестве клеточного пятна, что делает ядра клеток более заметными.
Используемый с общим уксусом (уксусной кислотой), раствор Лугола используется для идентификации предварительных и раковых изменений в тканях шейки матки и влагалища во время последующих исследований «PAP PAP» при приготовлении к биопсии. Уксусная кислота заставляет аномальные клетки бланшировать белыми, в то время как нормальные ткани окрашивают коричневое дерево из йода. [ 19 ]
Малахит зеленый
[ редактировать ]Малахитовый зеленый (также известный как бриллиантовый зеленый B или Victoria Green B) может использоваться в качестве сине-зеленого контратака с сафранином в технике окрашивания Гименеса для бактерий. Его также можно использовать для непосредственного окрашивания спор .
Метил -зеленый
[ редактировать ]Метил-зеленый обычно используется с ярким полем, а также флуоресцентными микроскопами [ 20 ] окрасить хроматин клеток, чтобы их легче просмотреть.
Метиленовый синий
[ редактировать ]Метиленовый синий используется для окрашивания клеток животных, таких как клетки щека человека, чтобы сделать их ядра более наблюдаемыми. Также используется для окрашивания пленок крови в цитологии.
Нейтральный красный
[ редактировать ]Нейтральный красный (или толулиленовый красный) пятна Nissl SUPACE RED. Обычно он используется в качестве контрабанта в сочетании с другими красителями.
Нильский синий
[ редактировать ]Нильский синий (или голубой ниль -синие а) пятна от ядра синие. Это может использоваться с живыми клетками.
Нил красный
[ редактировать ]Нил красный (также известный как голубой оксазон Нила) образуется путем кипящего голубого ниля с серной кислотой . Это создает смесь Nile Red и Nile Blue. Нил красный - это липофильное пятно; Он будет накапливаться в липидных шариках внутри клеток, окрашивая их красным. Нил красный может использоваться с живыми клетками. Он сильно флуоресцирует при разделении на липиды, но практически не совсем в водном растворе.
Тетроксид осмия (формальное название: тетраоксид осмия)
[ редактировать ]Тетраоксид осмия используется при оптической микроскопии для окрашивания липидов . Он растворяется в жирах и снижается органическими материалами до элементарного осмия, легко видимого черного вещества.
Пропидий йодид
[ редактировать ]Йодид Propidium - это флуоресцентный интеркалирующий агент, который можно использовать для окрашивания клеток. Йодид пропидия используется в качестве окрашивания ДНК в проточной цитометрии для оценки жизнеспособности клеток или содержания ДНК в анализе клеточного цикла или в микроскопии для визуализации ядра и других органеллов, содержащих ДНК. Йодид Propidium не может пересекать мембрану живых клеток, что делает ее полезной для дифференциации некротических, апоптотических и здоровых клеток. PI также связывается с РНК, что требует обработки нуклеазами для различения РНК и окрашивания ДНК
Родамин
[ редактировать ]Родамин является белковым флуоресцентным окрашиванием, обычно используемым в флуоресцентной микроскопии.
Шафрон
[ редактировать ]Сафранин (или сафрин О) представляет собой красный катионный краситель. Он связывается с ядрами (ДНК) и другими полианионами ткани , включая гликозаминогликаны в хряще и тучных клетках, и компоненты лигнина и пластид в тканях растений. [ 21 ] Сафранин не следует путать с шафраном, дорогостоящим натуральным красителем, который используется в некоторых методах, чтобы придать коллаген желтый цвет, контрастировать с синими и красными цветами, передаваемыми другими красителями ядрам и цитоплазму в тканях животных (включая человека).
Неверное написание «сафранин» используется общее использование. Конец -ine подходит для сафрин, потому что этот краситель является амином. [ 4 ] [ 22 ] [ 23 ]
Окрабование тканей
[ редактировать ]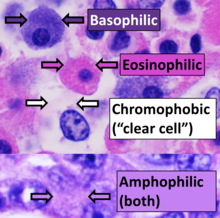
Ткани, которые занимают пятна, называются хроматическими . Хромосомы были названы так из -за их способности поглощать фиолетовое пятно.
Позитивная сродство к конкретному пятно может быть обозначено суффиксом -Philic . Например, ткани, окрашивающие пятно, могут быть названы азурофильным . Это также может быть использовано для более обобщенных окрашивающих свойств, таких как ацидофильные для тканей, которые окрашивают кислыми пятнами (в частности, эозин ), базофильные при окрашивании в основных красителях и амфофильной [ 24 ] При окрашивании кислотными или основными красителями. Напротив, хромофобные ткани не готовятся к цветному красителю.
Электронная микроскопия
[ редактировать ]Как и в световой микроскопии, пятна могут использоваться для повышения контрастности в просвечивающей электронной микроскопии . Обычно используются электронно-плотные соединения тяжелых металлов.
Фосфотунгстическая кислота
[ редактировать ][ 25 ] Фосфотунгстовая кислота является распространенным негативным окрашиванием для вирусов , нервов , полисахаридов и других биологических тканевых материалов. В основном он используется в форме рН .5-2%, что делает его нейтральным и в паре с водой для изготовления водного раствора. Фосфотунгстическая кислота заполнена электронным плотным веществом, которое окрашивает фон, окружающий экземпляр темного, и саму образец свет. Этот процесс не является обычным положительным методом для окрашивания, когда образец темный, а фон остается легким.
Осмий тетроксид
[ редактировать ]Тетроксид осмия используется в оптической микроскопии для окрашивания липидов . Он растворяется в жирах и снижается органическими материалами до элементарного осмия, легко видимого черного вещества. Поскольку это тяжелый металл, который поглощает электроны, это, пожалуй, самое распространенное пятно, используемое для морфологии в биологической электронной микроскопии. Он также используется для окрашивания различных полимеров для изучения их морфологии TEM. Осо
4 очень нестабильный и чрезвычайно токсичен. Это сильный окислительный агент, поскольку осмий имеет количество окисления +8. Он агрессивно окисляет многие материалы, оставляя позади осадок нелетую осмия в более низком уровне окисления.
Рутениум тетроксид
[ редактировать ]Тетроксид рутения одинаково изменен и даже более агрессивный, чем тетраоксид осмия, и способен окрашивать даже материалы, которые противостоят пятнам осмия, например, полиэтилен.
Другие химические вещества, используемые в окрашивании электронной микроскопией, включают: ammonium molybdate , cadmium iodide , carbohydrazide , ferric chloride , hexamine , indium trichloride , lanthanum(III) nitrate , lead acetate , lead citrate , lead(II) nitrate , periodic acid , phosphomolybdic acid , potassium ferricyanide , potassium ferrocyanide , ruthenium red , silver нитрат , серебряный белок , хлорауавр натрия , нитрат таллий , тиосемирбазид , уранилацетат , уранил нитрат и ванадилсульфат .
Смотрите также
[ редактировать ]- Комиссия по биологическим пятнам : контроль качества третьих сторонний контроль и сертификация пятен
- Цитология : изучение клеток
- Гистология : изучение тканей
- Иммуногистохимия : использование антисыворотки для маркировки специфических антигенов
- Рутениум (II) Трис (батофенантролин дисульфонат) , белковый краситель.
- Жизненно важное пятно : пятна, которые не убивают клетки
- Страница : разделение молекул белка
- Клизма бария - тип пятно in vivo, который создает контраст в рентгеновской части светового спектра
- Диафонизация
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый Паркер Н. (2012). Микробиология . OpenStax.
- ^ Jump up to: а беременный Pomerville JC (2017). Основы микробиологии . Тол. I. Джонс и Бартлетт Learning. с. 248, 249. ISBN 978-1-284-10095-2 .
- ^ Penney DP, Powers JM, Frank M, Willis C, Churukian C (2002). «Анализ и тестирование биологических пятен-процедуры биологической комиссии по пятнам». Биотехнический и гистохимия . 77 (5–6): 237–75. doi : 10.1080/714028210 . PMID 12564600 .
- ^ Jump up to: а беременный Horobin R, Kiernan J, Eds. (2002). Биологические пятна Конн: руководство по красителям, пятнам и флуорохромах для использования в биологии и медицине . Тейлор и Фрэнсис. ISBN 978-1-85996-099-8 .
- ^ «Список продавцов - Комиссия по биологическим пятнам» . Biologicalstaincommission.org . Получено 25 марта 2018 года .
- ^ Кларк Г. (1981). Процедуры окрашивания (4 -е изд.). Балтимор: Уильямс и Уилкинс. П. 412. ISBN 978-0-683-01707-6 .
- ^ Элементарная микробиология Vol - i .
- ^ Стоун, Ребекка Б.; Стил, Джон Ч. (2009-07-01). «Влияние сообщений о пятнах грамма является результатом культур крови на выбор антимикробных агентов» . Американский журнал клинической патологии . 132 (1): 5–6. doi : 10.1309/ajcp9ruv0yglbvha . ISSN 0002-9173 . PMID 19864226 .
- ^ Schaeffer AB, Fulton MD (февраль 1933 г.). «Упрощенный метод окрашивания эндоспоров». Наука . 77 (1990): 194. Bibcode : 1933sci .... 77..194S . doi : 10.1126/science.77.1990.194 . PMID 17741261 .
- ^ Jump up to: а беременный в дюймовый и фон Bancroft J, Stevens A, Eds. (1982). Теория и практика гистологических методов (2 -е изд.). Longman Group Limited.
- ^ Jump up to: а беременный Gill GW (2013). "Papanicolaou окрашивает". CytopreParation . Основы в цитопатологии. Тол. 12. С. 143–189. doi : 10.1007/978-1-4614-4933-1_10 . ISBN 978-1-4614-4932-4 Полем ISSN 1574-9053 .
- ^ Thakur M, Guttikonda VR (2017). «Модифицированная техника окрашивания папаниколау: сравнительное исследование» . Журнал цитологии . 34 (3): 149–153. doi : 10.4103/joc.joc_23_16 . PMC 5492752 . PMID 28701828 .
- ^ «Периодическая кислота (PAS): диагностические применения - labce.com, лабораторное непрерывное образование» . labce.com . Получено 2020-04-16 .
- ^ Bezrukov AV (2017-01-02). «Рамановский окрашивание, римско -эффект и мысли по вопросу научного приоритета». Биотехнический и гистохимия . 92 (1): 29–35. doi : 10.1080/10520295.2016.1250285 . PMID 28098484 . S2CID 37401579 .
- ^ Кори Л (март 1986 г.). «Лабораторная диагностика инфекций вируса простого герпеса. Принципы, направляющие развитие быстрых диагностических тестов». Диагностическая микробиология и инфекционные заболевания . 4 (3 Suppl): 111S - 119S. doi : 10.1016/s0732-8893 (86) 80049-9 . PMID 3009082 .
- ^ Уэллс Дж. (1988). «Техника окрашивания поверхностных клеток осажденных волосяных фолликулов и других твердых тканей». Технология пятна . 63 (3).
- ^ Томов Н., Димитров Н. (2017). «Модифицированное окрашивание коричневым висмарком для демонстрации тучных клеток мягких тканей» (PDF) . Trakia Journal of Sciences . 15 (3): 195–197. doi : 10.15547/tjs.2017.03.001 .
- ^ Левенфус I (2011). Эффективный метод подсчета окрашенных DAPI клеток с использованием FIJI . Мюнхен: Умехая. ISBN 978-3-640-86284-9 .
- ^ Sellors JW, Sankaranarayanan R (Eds.). «Глава 4: Введение в кольпоскопию: показания для кольпоскопии, инструментов, принципов и документации результатов». Колпоскопия и лечение интраэпителиальной неоплазии шейки матки: руководство для начинающих . Всемирная организация здравоохранения. Архивировано из оригинала 31 января 2019 года.
- ^ Прието Д., Апарисио Г., Моранде П.Е., Золесси Ф.Р. (сентябрь 2014). «Быстрая, низкая стоимость и высокоэффективная метод флуоресцентной ДНК с использованием метилового зеленого». Гистохимия и клеточная биология . 142 (3): 335–45. doi : 10.1007/s00418-014-1215-0 . HDL : 11336/35891 . PMID 24671497 . S2CID 11094194 .
- ^ Berlyn GP, Miksche JP (1976). Ботанический микротехник и цитохимия . Издательство штата Айова.
- ^ Бейкер -младший (1958). Принципы биологической микротехники . С. 329 фр. Лондон: Метуэн.
- ^ Kiernan JA (2001). «Классификация и название красителей, пятен и флуорохромов». Биотехнический и гистохимия . 76 (5–6): 261–78. doi : 10.1080/bih.76.5-6.261.278 . PMID 11871748 . S2CID 32479873 .
- ^ thefreedictionary.com> Амфофильный цитирование: Сондерс всеобъемлющий ветеринарный словарь , 3 изд. 2007 Elsevier, Inc.
- ^ «Отрицательное окрашивание | Центральная микроскопическая исследовательская установка» . cmrf.research.uiowa.edu . Получено 2020-04-16 .
Дальнейшее чтение
[ редактировать ]- Bancroft JD, Gamble M, Eds. (2002). Теория и практика гистологических методов (5 -е изд.). Лондон: Черчилль-Ливингстоун. ISBN 978-0-443-06435-7 .
- Kiernan JA (2015). Гистологические и гистохимические методы. Теория и практика . Банбери, Великобритания: Scion. ISBN 978-1-907904-32-5 .
- Presnell JK, Schreibman MP (1997). Техника тканей животных Хумасона (5 -е изд.). Балтимор: издательство Джона Хопкинса. ISBN 9780801854019 .
- Рузин С.Е. (1999). Заводка микротехника и микроскопия . Нью -Йорк: издательство Оксфордского университета. ISBN 978-0-19-508956-1 .
Внешние ссылки
[ редактировать ]- Комиссия по биологической пятнам -это независимая некоммерческая компания, которая тестирует красители с начала 1920-х годов и выдает сертификаты одобрения партий красителей, которые соответствуют всемирно признанным стандартам.
- Справочник по картинкам для красителей и методов окрашивания.
- Жизненно важное окрашивание для простейших и связанных с ними методов временного монтажа ~ Howey, 2000
- Говоря о фиксации: часть 1 и часть 2 - М. Халит Умар
- Микрофотографии гистологических пятен
- Часто задаваемые вопросы при окрашивании упражнений на домашней странице Sridhar Rao PN