Фосфоглюкомутаза
| Фосфоглюкомутаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 5.4.2.2 | ||
| Номер CAS. | 9001-81-4 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Фосфоглюкомутаза ( EC 5.4.2.2 ) представляет собой фермент , который переносит фосфатную группу α-D- глюкозы мономера из положения 1 в положение 6 в прямом направлении или из положения 6 в положение 1 в обратном направлении.
Точнее, он облегчает взаимное превращение глюкозо-1-фосфата и глюкозо-6-фосфата .
Функция
[ редактировать ]Роль в гликогенолизе
[ редактировать ]После того, как гликогенфосфорилаза катализирует фосфоролитическое отщепление глюкозильного остатка от гликогенового полимера , освобожденная глюкоза имеет фосфатную группу на своем 1-м атоме углерода. глюкозо-1-фосфата Эта молекула сама по себе не является полезным промежуточным продуктом метаболизма, но фосфоглюкомутаза катализирует превращение этого глюкозо-1-фосфата в глюкозо-6-фосфат (механизм этой реакции см. ниже).
Метаболическая судьба глюкозо-6-фосфата зависит от потребностей клетки в момент его образования. Если в клетке мало энергии, то глюкозо-6-фосфат будет двигаться по гликолитическому пути , в конечном итоге образуя две молекулы аденозинтрифосфата . Если клетка нуждается в промежуточных продуктах биосинтеза, глюкозо-6-фосфат вступит в пентозофосфатный путь , где он подвергнется серии реакций с образованием рибозы и/или НАДФН , в зависимости от клеточных условий.
Если в печени происходит гликогенолиз, глюкозо-6-фосфат может превращаться в глюкозу с помощью фермента глюкозо-6-фосфатазы ; Глюкоза, вырабатываемая в печени, затем попадает в кровоток для использования в других органах. В мышечных клетках, напротив, нет фермента глюкозо-6-фосфатазы, поэтому они не могут делиться своими запасами гликогена с остальным телом.
Роль в гликогенезе
[ редактировать ]Фосфоглюкомутаза также действует противоположным образом, когда уровень глюкозы в крови высок. При этом фосфоглюкомутаза катализирует превращение глюкозо-6-фосфата (который легко образуется из глюкозы под действием гексокиназы ) в глюкозо-1-фосфат.
Этот глюкозо-1-фосфат может затем реагировать с UTP с образованием UDP-глюкозы в реакции, катализируемой UDP-глюкозо-пирофосфорилазой . При активации инсулином гликогенсинтаза . начнет откреплять глюкозу из комплекса УДФ-глюкоза на полимер гликогена
Механизм реакции
[ редактировать ]Фосфоглюкомутаза влияет на сдвиг фосфорильной группы путем замены фосфорильной группы на субстрат . [ 1 ] Эксперименты по изотопному мечению подтвердили, что эта реакция протекает через глюкозо-1,6-бисфосфата промежуточный продукт . [ 2 ]
Первым этапом прямой реакции является перенос фосфорильной группы от фермента к глюкозо-1-фосфату с образованием глюкозо-1,6-бисфосфата и образованием дефосфорилированной формы фермента. [ 2 ] Затем фермент подвергается быстрой диффузионной переориентации, чтобы правильно расположить 1-фосфат промежуточного бисфосфата относительно дефосфорилированного фермента. [ 3 ] Зависимость скорости субстрата и тесты индуцированного транспорта показали, что дефосфорилированный фермент затем облегчает перенос фосфорильной группы от промежуточного соединения глюкозо-1,6-бисфосфата к ферменту, регенерируя фосфорилированную фосфоглюкомутазу и образуя глюкозо-6-фосфат (в прямом направлении). ). [ 4 ] [ 5 ] Более поздние структурные исследования подтвердили, что единственный участок фермента, который фосфорилируется и дефосфорилируется, представляет собой кислород в активном центре остатка серина (см. Диаграмму ниже). [ 6 ] [ 7 ] двухвалентного металла Ион , обычно магния или кадмия , необходим для ферментативной активности и, как было показано, образует комплекс непосредственно с фосфорильной группой, этерифицированной с серином активного центра. [ 8 ]
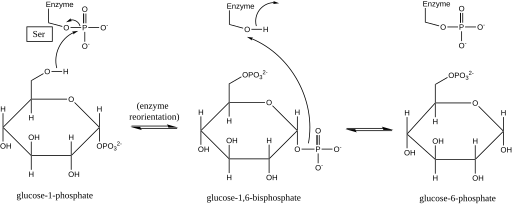
Это образование промежуточного соединения глюкозо-1,6-бисфосфата аналогично взаимному превращению 2-фосфоглицерата и 3-фосфоглицерата , катализируемому фосфоглицератмутазой , при котором 2,3-бисфосфоглицерат образуется в качестве промежуточного продукта. [ 9 ]
Структура
[ редактировать ]
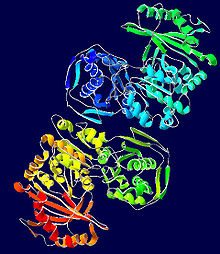
Хотя фосфоглюкомутаза мышц кролика послужила прототипом для большей части выяснения структуры этого фермента, новые кристаллические структуры, полученные из бактерий, демонстрируют многие из тех же определяющих характеристик. [ 10 ] Каждый мономер фосфоглюкомутазы можно разделить на четыре домена последовательности, I-IV, в зависимости от стандартной пространственной конфигурации фермента (см. изображение справа). [ 11 ]
каждого мономера Каждый мономер состоит из четырех различных структурных единиц α/β, каждая из которых содержит одну из четырех цепей в β-листе и состоит только из остатков в данном домене последовательности (см. изображение справа). [ 11 ] Захоронение активного центра (включая Ser-116, критический остаток фермента, который фосфорилируется и дефосфорилируется) в гидрофобной внутренней части фермента служит для исключения воды из контрпродуктивного гидролиза критических фосфоэфирных связей, в то же время позволяя субстрату получить доступ к активному центру. сайт. [ 12 ]
Актуальность заболевания
[ редактировать ]Мышцы человека содержат два изофермента фосфоглюкомутазы с почти идентичными каталитическими свойствами: PGM I и PGM II. [ 13 ] У некоторых людей та или иная из этих форм отсутствует врожденно. [ 14 ] Дефицит PGM1 известен как PGM1-CDG или синдром CDG типа 1t (CDG1T), ранее известный как болезнь накопления гликогена типа 14 (GSD XIV). [ 15 ] [ 16 ] Заболевание представляет собой одновременно гликогеноз и врожденное нарушение гликозилирования. [ 17 ] [ 18 ] Это также метаболическая миопатия и врожденное нарушение углеводного обмена . [ 19 ]
Дефицит МПГ — чрезвычайно редкое состояние, не имеющее набора четко охарактеризованных физиологических симптомов. Это состояние можно обнаружить с помощью in vitro исследования анаэробного гликолиза , которое выявляет блокировку пути производства молочной кислоты после глюкозо-1-фосфата, но до глюкозо-6-фосфата. [ 20 ] Выделяют две формы PGM1-CDG: 1.) исключительно миогенную и 2.) мультисистемную (включая мышцы). [ 16 ]
Обычный путь образования гликогена из глюкозы в крови блокируется, так как без фосфоглюкомутазы глюкозо-6-фосфат не может превращаться в глюкозо-1-фосфат. Однако альтернативный путь галактозы может образовывать гликоген путем превращения галактозы → галактозо-1-фосфат → глюкозо-1-фосфат. Это позволяет образовываться гликогену, но без фосфоглюкомутазы глюкозо-1-фосфат не может превращаться в глюкозо-6-фосфат для гликолиза. Это вызывает аномальное накопление гликогена в мышечных клетках, наблюдаемое при биопсии мышц. [ 16 ] [ 21 ]
Хотя фенотип и тяжесть заболевания сильно различаются, общие симптомы включают: непереносимость физической нагрузки , гипераммониемию , вызванную физической нагрузкой , аномальное накопление гликогена в мышечной биопсии, повышенный уровень КФК в сыворотке, аномальный трансферрин в сыворотке (потеря полных N-гликанов), низкий рост, расщелина неба, расщепленный язычок и гепатопатия. [ 16 ] [ 21 ]
Феномен « второго дыхания » можно наблюдать у некоторых, но не у всех, при измерении частоты пульса на беговой дорожке. [ 16 ] [ 22 ] В состоянии покоя мышечные клетки полагаются на глюкозу в крови и свободные жирные кислоты; при нагрузке мышечный гликоген необходим наряду с глюкозой в крови и свободными жирными кислотами. [ 23 ] [ 24 ] Зависимость от мышечного гликогена возрастает при выполнении аэробных упражнений более высокой интенсивности и всех анаэробных упражнений. [ 23 ] [ 24 ]
Не имея возможности создавать АТФ из накопленного мышечного гликогена, во время тренировки резерв АТФ остается низким (АДФ>АТФ). В таких обстоятельствах частота сердечных сокращений и дыхания увеличивается неадекватно, учитывая интенсивность упражнений, в попытке максимизировать доставку кислорода и топлива, переносимого кровью, к мышечным клеткам. организма, Свободные жирные кислоты являются самой медленной из биоэнергетических систем производящей АТФ путем окислительного фосфорилирования , примерно за 10 минут. [ 23 ] Облегчение симптомов непереносимости физической нагрузки, включая снижение частоты сердечных сокращений как минимум на 10 ударов в минуту при движении на той же скорости на беговой дорожке, примерно через 10 минут аэробных упражнений, называется « вторым дыханием », когда повышенное количество АТФ вырабатывается из свободных жиров. кислоты.
Другим последствием низкого уровня АТФ (АДФ>АТФ) во время тренировки из-за невозможности вырабатывать АТФ из мышечного гликогена является повышенное использование миокиназной ( аденилаткиназной) реакции и пуринового нуклеотидного цикла . Миокиназная реакция производит АМФ (2 АДФ → АТФ + АМФ), а затем пуриновый нуклеотидный цикл использует АМФ и производит больше АМФ вместе с фумаратом (затем фумарат преобразуется и производит АТФ посредством окислительного фосфорилирования). Аммиак (NH 3 ) является побочным продуктом пуринового нуклеотидного цикла, когда АМФ превращается в ИМФ. Во время неишемического теста на предплечье у лиц с PGM1-CDG наблюдается вызванное физической нагрузкой повышенное содержание аммиака в сыворотке (гипераммониемия) и нормальное повышение уровня лактата в сыворотке. [ 16 ] [ 18 ] [ 19 ]
Исследования других заболеваний, сопровождающихся гликолитическим блоком, показали во время ишемических и неишемических нагрузочных тестов на предплечье, что не только повышается аммиак, но после тренировки также повышается уровень инозина в сыворотке, гипоксантина и мочевой кислоты. [ 25 ] [ 26 ] Эти исследования подтвердили, что, когда упражнения прекращаются или из других видов топлива (например, свободных жирных кислот) вырабатывается достаточное количество АТФ, резервуар АТФ нормализуется, а накопление АМФ и других нуклеотидов преобразуется в нуклеозиды и оставляет мышечную клетку для преобразования в мочевая кислота , известная как миогенная гиперурикемия . АМФ → ИМФ → Инозин → Гипоксантин → Ксантин → Мочевая кислота. К сожалению, исследования PGM1-CDG проверяли только на содержание аммиака и лактата в сыворотке, поэтому в настоящее время окончательно неизвестно, страдают ли люди с PGM1-CDG также миогенной гиперурикемией. [ 16 ] [ 18 ] [ 19 ]
Гены
[ редактировать ]См. также
[ редактировать ]- Бета-фосфоглюкомутаза
- Врожденное нарушение гликозилирования
- Непереносимость физических упражнений § Низкий резервуар АТФ в мышцах
- Болезнь накопления гликогена
- Врожденные нарушения углеводного обмена
- Метаболические миопатии
- двигаться
- Пуриновый нуклеотидный цикл (АДФ>АТФ, АМФ↑)
- Второе дыхание (феномен упражнения)
Ссылки
[ редактировать ]- ^ Джаганнатан V, Лак Дж. М. (июнь 1949 г.). «Фосфоглюкомутаза; механизм действия» . Журнал биологической химии . 179 (2): 569–575. дои : 10.1016/S0021-9258(19)51252-2 . ПМИД 18149991 .
- ^ Перейти обратно: а б Наджар В.А., Пуллман М.Е. (май 1954 г.). «Происхождение группового переноса с участием фермента (фосфоглюкомутазы) и субстрата». Наука . 119 (3097): 631–634. Бибкод : 1954Sci...119..631N . дои : 10.1126/science.119.3097.631 . ПМИД 13156640 .
- ^ Рэй-младший WJ, Пек EJ (1972). «Фосфомутазы». В Бойере П.Д. (ред.). Ферменты . Том. 6 (3-е изд.). Нью-Йорк: Академическая пресса. стр. 407–477. дои : 10.1016/S1874-6047(08)60047-5 . ISBN 978-0-12-122706-7 .
- ^ Рэй У.Дж., Рочелли Г.А. (апрель 1964 г.). «Кинетическое исследование пути фосфоглюкомутазы» . Журнал биологической химии . 239 (4): 1228–1236. дои : 10.1016/S0021-9258(18)91416-X . ПМИД 14165931 .
- ^ Бриттон Х.Г., Кларк Дж.Б. (ноябрь 1968 г.). «Механизм фосфоглюкомутазной реакции. Исследования фосфоглюкомутазы мышц кролика флюсовыми методами» . Биохимический журнал . 110 (2): 161–180. дои : 10.1042/bj1100161 . ПМК 1187194 . ПМИД 5726186 .
- ^ Рэй У.Дж., Милдван А.С., Грутцнер Дж.Б. (декабрь 1977 г.). «Исследование фосфорного ядерного магнитного резонанса фосфоглюкомутазы и ее комплексов с ионами металлов». Архив биохимии и биофизики . 184 (2): 453–463. дои : 10.1016/0003-9861(77)90455-6 . ПМИД 23074 .
- ^ Рэй У.Дж., Хермодсон М.А., Пуватингал Дж.М., Махони У.К. (август 1983 г.). «Полная аминокислотная последовательность фосфоглюкомутазы мышц кролика» . Журнал биологической химии . 258 (15): 9166–9174. дои : 10.1016/S0021-9258(17)44646-1 . ПМИД 6223925 .
- ^ Рю Дж.И., Рэй В.Дж., Маркли Дж.Л. (январь 1984 г.). «Связанные с ферментом промежуточные продукты превращения глюкозо-1-фосфата в глюкозо-6-фосфат под действием фосфоглюкомутазы. Исследования ЯМР фосфора». Биохимия . 23 (2): 252–260. дои : 10.1021/bi00297a013 . ПМИД 6230103 .
- ^ Сазерленд EW, Кон М (октябрь 1949 г.). «Механизм фосфоглюкомутазной реакции» . Журнал биологической химии . 180 (3): 1285–1295. дои : 10.1016/S0021-9258(19)51242-X . ПМИД 18148026 .
- ^ Мехра-Чаудхари Р., Мик Дж., Таннер Дж.Дж., Хенцл М.Т., Бимер Л.Дж. (апрель 2011 г.). «Кристаллическая структура бактериальной фосфоглюкомутазы, фермента, участвующего в вирулентности множества патогенов человека» . Белки . 79 (4): 1215–1229. дои : 10.1002/прот.22957 . ПМК 3066478 . ПМИД 21246636 .
- ^ Перейти обратно: а б Дай Дж.Б., Лю Ю., Рэй В.Дж., Конно М. (март 1992 г.). «Кристаллическая структура мышечной фосфоглюкомутазы, уточненная с разрешением 2,7 ангстрем» . Журнал биологической химии . 267 (9): 6322–6337. дои : 10.1016/S0021-9258(18)42699-3 . ПМИД 1532581 .
- ^ Рэй В.Дж., Пуватингал Дж.М., Лю Ю.В. (июль 1991 г.). «Образование комплексов субстрата и аналога переходного состояния в кристаллах фосфоглюкомутазы после удаления кристаллизационной соли». Биохимия . 30 (28): 6875–6885. дои : 10.1021/bi00242a011 . ПМИД 1829964 .
- ^ Джоши Дж. Г., Хэндлер П. (июнь 1969 г.). «Фосфоглюкомутаза. VI. Очистка и свойства фосфоглюкомутазы из мышц человека» . Журнал биологической химии . 244 (12): 3343–3351. дои : 10.1016/S0021-9258(18)93132-7 . ПМИД 4978319 .
- ^ Браун Д.Х. (1986). «Обмен гликогена и гликолиз в мышцах». Миология: фундаментальная и клиническая . Нью-Йорк: МакГроу-Хилл. стр. 673–95. ISBN 978-0-07-079570-9 .
- ^ «Орфанет: болезнь накопления гликогена из-за дефицита фосфоглюкомутазы» . www.orpha.net . Проверено 13 мая 2021 г.
- ^ Перейти обратно: а б с д и ж г Альтассан Р., Раденкович С., Эдмондсон А.С., Барон Р., Бразил С., Чехова А. и др. (январь 2021 г.). «Международные консенсусные рекомендации по дефициту фосфоглюкомутазы 1 (PGM1-CDG): диагностика, последующее наблюдение и лечение» . Журнал наследственных метаболических заболеваний . 44 (1): 148–163. дои : 10.1002/jimd.12286 . ПМЦ 7855268 . ПМИД 32681750 .
- ^ Тегтмейер Л.С., Раст С., ван Шерпензел М., Нг Б.Г., Лосфельд М.Е., Тимал С. и др. (февраль 2014 г.). «Множественные фенотипы дефицита фосфоглюкомутазы 1» . Медицинский журнал Новой Англии . 370 (6): 533–542. дои : 10.1056/NEJMoa1206605 . ПМЦ 4373661 . ПМИД 24499211 .
- ^ Перейти обратно: а б с Стойкович Т., Виссинг Дж., Пети Ф., Пиро М., Орнгрин М.С., Андерсен Г. и др. (июль 2009 г.). «Мышечный гликогеноз из-за дефицита фосфоглюкомутазы 1» . Медицинский журнал Новой Англии . 361 (4): 425–427. дои : 10.1056/NEJMc0901158 . ПМИД 19625727 .
- ^ Перейти обратно: а б с Хогрел Дж. Я., Янссен Дж. Б., Леду И., Оливье Г., Бехин А., Стойкович Т. и др. (октябрь 2017 г.). «Диагностическая ценность гипераммониемии, вызванной неишемическим нагрузочным тестом на предплечье» (PDF) . Журнал клинической патологии . 70 (10): 896–898. doi : 10.1136/jclinpath-2017-204324 . ПМИД 28400468 . S2CID 36935686 .
- ^ Суги Х., Кобаяши Дж., Суги Ю., Ичимура М., Миямото Р., Ито Т. и др. (апрель 1988 г.). «Детская болезнь накопления гликогена в мышцах: дефицит фосфоглюкомутазы со снижением уровня карнитина в мышцах и сыворотке». Неврология . 38 (4): 602–605. дои : 10.1212/WNL.38.4.602 . ПМИД 2965317 . S2CID 11491932 .
- ^ Перейти обратно: а б «Врожденное нарушение гликозилирования типа It; CDG1T» . Интернет-менделевское наследование у человека . 11 июля 2012 г.
- ^ Прейслер Н., Коэн Дж., Виссинг Ч.Р., Мэдсен К.Л., Хейнике К., Шарп Л.Дж. и др. (ноябрь 2017 г.). «Нарушение распада и синтеза гликогена при дефиците фосфоглюкомутазы 1». Молекулярная генетика и обмен веществ . 122 (3): 117–121. дои : 10.1016/j.ymgme.2017.08.007 . ПМИД 28882528 .
- ^ Перейти обратно: а б с «Физиология Берна и Леви, 6-е изд. 38. Гормональная регуляция энергетического обмена» .
- ^ Перейти обратно: а б ван Лун Л.Дж., Гринхафф П.Л., Константин-Теодосиу Д., Сарис В.Х., Вагенмейкерс А.Дж. (октябрь 2001 г.). «Влияние увеличения интенсивности упражнений на использование мышечного топлива у людей» . Журнал физиологии . 536 (Часть 1): 295–304. дои : 10.1111/j.1469-7793.2001.00295.x . ПМК 2278845 . ПМИД 11579177 .
- ^ Минео И., Коно Н., Хара Н., Симидзу Т., Ямада Ю., Кавачи М. и др. (июль 1987 г.). «Миогенная гиперурикемия. Общая патофизиологическая особенность гликогеноза типов III, V и VII». Медицинский журнал Новой Англии . 317 (2): 75–80. дои : 10.1056/NEJM198707093170203 . ПМИД 3473284 .
- ^ Минео I, Таруи С (1995). «Миогенная гиперурикемия: чему мы можем научиться из метаболических миопатий?». Мышцы и нервы. Добавка . 3 : S75–S81. дои : 10.1002/mus.880181416 . ПМИД 7603532 . S2CID 41588282 .
Внешние ссылки
[ редактировать ]- Фосфоглюкомутаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)