ДНК-полимераза I
| ДНК-полимераза I | |||
|---|---|---|---|
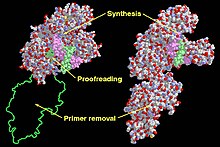 Функциональные домены во фрагменте Кленова (слева) и ДНК-полимеразе I (справа). | |||
| Идентификаторы | |||
| Организм | |||
| Символ | автор А | ||
| Входить | 948356 | ||
| ПДБ | 1DPI | ||
| RefSeq (защита) | НП_418300.1 | ||
| ЮниПрот | P00582 | ||
| Другие данные | |||
| Номер ЕС | 2.7.7.7 | ||
| хромосома | геном: 4,04 - 4,05 Мб | ||
| |||
ДНК-полимераза I (или Pol I ) — фермент , участвующий в процессе репликации ДНК прокариот . Открыт Артуром Корнбергом в 1956 году. [ 1 ] это была первая известная ДНК-полимераза любого типа (и первая известная полимераза ). Первоначально он был охарактеризован в E. coli и повсеместно встречается у прокариот . У E. coli и многих других бактерий ген , кодирующий Pol I, известен как polA . Фермент Pol I E. coli состоит из 928 аминокислот и является примером процессивного фермента — он может последовательно катализировать несколько стадий полимеризации, не высвобождая одноцепочечную матрицу. [ 2 ] Физиологическая функция Pol I заключается в основном в поддержке восстановления поврежденной ДНК, но он также способствует соединению фрагментов Оказаки путем удаления праймеров РНК и замены рибонуклеотидов ДНК.
Открытие
[ редактировать ]В 1956 году Артур Корнберг и его коллеги открыли Pol I, используя экстракты Escherichia coli ( E. coli ) для разработки анализа синтеза ДНК. Ученые добавили 14 С-меченный тимидин, чтобы можно было получить радиоактивный полимер ДНК, а не РНК. Чтобы инициировать очистку ДНК-полимеразы, исследователи добавили сульфат стрептомицина к экстракту кишечной палочки . При этом экстракт разделялся на супернатант, не содержащий нуклеиновых кислот (S-фракция) и осадок, содержащий нуклеиновую кислоту (P-фракция). Р-фракция также содержала Pol I и термостабильные факторы, необходимые для реакций синтеза ДНК. Эти факторы были идентифицированы как нуклеозидтрифосфаты , строительные блоки нуклеиновых кислот. S-фракция содержала несколько дезоксинуклеозидкиназ . [ 3 ] В 1959 году Нобелевская премия по физиологии и медицине была присуждена Артуру Корнбергу и Северо Очоа «за открытие механизмов, участвующих в биологическом синтезе рибонуклеиновой кислоты и дезоксирибонуклеиновой кислоты ». [ 4 ]

Структура и функции
[ редактировать ]Общая структура
[ редактировать ]Pol I в основном участвует в восстановлении поврежденной ДНК. Структурно Pol I является членом суперсемейства альфа/бета-белков, которое включает белки, в которых α-спирали и β-цепи встречаются в нерегулярных последовательностях. ДНК Pol I E. coli состоит из множества доменов с тремя различными ферментативными активностями. Три домена, часто называемые доменами большого пальца, пальца и ладони, работают вместе, чтобы поддерживать активность ДНК-полимеразы. [ 5 ] Четвертый домен рядом с доменом ладони содержит активный сайт экзонуклеазы , который удаляет неправильно включенные нуклеотиды в направлении от 3’ к 5’ в процессе, известном как корректура. Пятый домен содержит еще один активный сайт экзонуклеазы , который удаляет ДНК или РНК в направлении от 5’ к 3’ и необходим для удаления праймера РНК во время репликации ДНК или ДНК во время процессов репарации ДНК.
Бактерии E. coli продуцируют 5 различных ДНК-полимераз: ДНК Pol I, ДНК Pol II, ДНК Pol III, ДНК Pol IV и ДНК Pol V. [ 6 ]
Структурное и функциональное сходство с другими полимеразами.
[ редактировать ]При репликации ДНК ведущая цепь ДНК непрерывно удлиняется в направлении движения репликационной вилки, тогда как отстающая цепь ДНК прерывисто движется в противоположном направлении, как фрагменты Оказаки . [ 7 ] ДНК-полимеразы также не могут инициировать цепи ДНК, поэтому они должны инициироваться короткими сегментами РНК или ДНК, известными как праймеры. [ 5 ] Для того чтобы произошла полимеризация ДНК, должны быть выполнены два условия. Прежде всего, все ДНК-полимеразы должны иметь как матричную цепь, так и праймерную цепь. В отличие от РНК, ДНК-полимеразы не могут синтезировать ДНК из матричной цепи. Синтез должен быть инициирован коротким сегментом РНК, известным как РНК-праймер , синтезируемым примазой в направлении от 5’ к 3’. Затем синтез ДНК происходит путем добавления dNTP к 3'-гидроксильной группе на конце ранее существовавшей цепи ДНК или праймера РНК. Во-вторых, ДНК-полимеразы могут добавлять новые нуклеотиды к уже существующей цепи только посредством водородных связей. [ 6 ] Поскольку все ДНК-полимеразы имеют схожую структуру, все они имеют полимеразный механизм, катализируемый ионами двух металлов. Один из ионов металла активирует 3'-гидроксильную группу праймера, которая затем атакует первичный 5'-фосфат dNTP. Второй ион металла стабилизирует отрицательный заряд уходящего кислорода и впоследствии хелатирует две уходящие фосфатные группы. [ 8 ]
Рентгенокристаллические структуры полимеразных доменов ДНК-полимераз описаны по аналогии с правыми руками человека. Все ДНК-полимеразы содержат три домена. Первый домен, известный как «домен пальцев», взаимодействует с dNTP и базой парного шаблона. «Домен пальцев» также взаимодействует с шаблоном, чтобы правильно расположить его на активном сайте. [ 9 ] Второй домен, известный как «пальмовый домен», катализирует реакцию переноса фосфорильной группы. Наконец, третий домен, известный как «домен большого пальца», взаимодействует с двухцепочечной ДНК. [ 10 ] Домен экзонуклеазы содержит собственный каталитический сайт и удаляет неправильно спаренные основания. Среди семи различных семейств ДНК-полимераз «пальмовый домен» консервативен в пяти из этих семейств. «Домен пальца» и «домен большого пальца» не совпадают в каждом семействе из-за различий в элементах вторичной структуры из разных последовательностей. [ 9 ]
Функция
[ редактировать ]Pol I обладает четырьмя ферментативными активностями:
- 5 '→3' (прямая) ДНК-зависимая активность ДНК-полимеразы, требующая 3'- праймерного сайта и матричной цепи.
- 3'→5' (обратная), Активность экзонуклеазы которая обеспечивает корректуру.
- 5'→3' (прямая) активность экзонуклеазы, опосредующая трансляцию разрыва во время репарации ДНК .
- 5'→3' (прямая) РНК-зависимая активность ДНК-полимеразы. Pol I действует на матрицах РНК со значительно меньшей эффективностью (0,1–0,4%), чем на матрицах ДНК, и эта активность, вероятно, имеет лишь ограниченное биологическое значение. [ 11 ]
Чтобы определить, использовался ли Pol I в первую очередь для репликации ДНК или для восстановления повреждений ДНК, был проведен эксперимент с дефицитным мутантным штаммом Pol I E. coli . Мутантный штамм, в котором отсутствовал Pol I, был выделен и обработан мутагеном. У мутантного штамма образовались бактериальные колонии, которые продолжали нормально расти и в которых также отсутствовал Pol I. Это подтвердило, что Pol I не требуется для репликации ДНК. Однако мутантный штамм также продемонстрировал характеристики, которые включали чрезвычайную чувствительность к определенным факторам, повреждающим ДНК, таким как ультрафиолетовый свет . Таким образом, это подтвердило, что Pol I, скорее всего, будет участвовать в восстановлении повреждений ДНК, а не в репликации ДНК. [ 6 ]
Механизм
[ редактировать ]В процессе репликации РНКаза H удаляет праймер РНК (созданный примазой ) из отстающей цепи , а затем полимераза I заполняет необходимые нуклеотиды между фрагментами Оказаки (см. Репликация ДНК ) в направлении 5'→3', корректируя ошибки. как получится. Это фермент, зависимый от матрицы: он добавляет только нуклеотиды, основания которых правильно спариваются с существующей цепью ДНК, действующей как матрица. Крайне важно, чтобы эти нуклеотиды имели правильную ориентацию и геометрию для пары оснований с цепью матрицы ДНК, чтобы ДНК-лигаза могла соединять различные фрагменты вместе в непрерывную цепь ДНК . Исследования полимеразы I подтвердили, что разные dNTP могут связываться с одним и тем же активным сайтом полимеразы I. Полимераза I способна активно различать разные dNTP только после того, как она претерпит конформационные изменения . Как только это изменение произошло, Pol I проверяет правильную геометрию и правильное выравнивание пары оснований, образованной между связанным dNTP и совпадающим основанием на цепи шаблона. Правильная геометрия пар оснований A=T и G≡C — единственные, которые могут вписаться в активный сайт . Однако важно знать, что один из каждых 10 4 до 10 5 нуклеотиды добавлены неправильно. Тем не менее, Pol I может исправить эту ошибку в репликации ДНК, используя свой избирательный метод активной дискриминации. [ 5 ]
Несмотря на раннее описание, быстро стало очевидно, что полимераза I не является ферментом, ответственным за большую часть синтеза ДНК: репликация ДНК в E. coli происходит со скоростью примерно 1000 нуклеотидов в секунду, тогда как скорость синтеза пар оснований полимеразой I в среднем составляет всего лишь 10 нуклеотидов в секунду. и 20 нуклеотидов/секунду. Более того, его клеточное содержание, составляющее примерно 400 молекул на клетку, не коррелирует с тем фактом, что обычно имеется только две репликационные вилки у E. coli . недостаточно процессивно Кроме того, копирование всего генома , поскольку он отпадает после включения всего 25–50 нуклеотидов . Его роль в репликации была доказана, когда в 1969 году Джон Кэрнс выделил жизнеспособный мутант полимеразы I , лишенный полимеразной активности. [ 12 ] Лаборантка Кэрнса Паула Де Люсия создала тысячи бесклеточных экстрактов из E. coli колоний и проверила их на ДНК-полимеразную активность. 3478-й клон содержал мутанта polA , которого Кэрнс назвал в честь Паулы [Де Люсия]. [ 13 ] Лишь после открытия ДНК-полимеразы III была наконец идентифицирована основная репликативная ДНК-полимераза.
Исследовательские приложения
[ редактировать ]
ДНК-полимераза I, полученная из E. coli , широко используется в исследованиях в области молекулярной биологии . Однако активность экзонуклеазы 5'→3' делает его непригодным для многих применений. Эту нежелательную ферментативную активность можно просто удалить из голофермента, чтобы оставить полезную молекулу, называемую фрагментом Кленова , широко используемую в молекулярной биологии . Фактически, фрагмент Кленова использовался во время первых протоколов амплификации полимеразной цепной реакции (ПЦР) до тех пор, пока в 1976 году не был открыт Thermus aquaticus , источник термоустойчивой Taq -полимеразы I. [ 15 ] Воздействие ДНК-полимеразы I на протеазу субтилизин расщепляет молекулу на меньший фрагмент, который сохраняет только ДНК-полимеразную и корректирующую активность.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Леман И.Р., Бессман М.Дж., Симмс Э.С., Корнберг А. (июль 1958 г.). «Ферментативный синтез дезоксирибонуклеиновой кислоты. I. Получение субстратов и частичная очистка фермента из кишечной палочки » . Журнал биологической химии . 233 (1): 163–70. дои : 10.1016/S0021-9258(19)68048-8 . ПМИД 13563462 .
- ^ Воет Д., Воет Дж.Г., Пратт К.В. (1999). Основы биохимии . Нью-Йорк: Уайли. [ нужна страница ]
- ^ Lehman IR (сентябрь 2003 г.). «Открытие ДНК-полимеразы» . Журнал биологической химии . 278 (37): 34733–8. дои : 10.1074/jbc.X300002200 . ПМИД 12791679 .
- ^ «Нобелевская премия по физиологии и медицине 1959 года» . www.nobelprize.org . Проверено 8 ноября 2016 г.
- ^ Jump up to: а б с Кокс М.М., Дудна Дж. (2015). Молекулярная биология (2-е изд.). Нью-Йорк: WH Freeman. [ нужна страница ]
- ^ Jump up to: а б с Купер, Джеффри М. Джеффри (1 января 2000 г.). «Репликация ДНК» .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Хюбшер У, Спадари С, Виллани Г, Мага Г (2010). ДНК-полимеразы . дои : 10.1142/7667 . ISBN 978-981-4299-16-9 . [ нужна страница ]
- ^ «ДНК-полимераза I: ферментативные реакции» .
- ^ Jump up to: а б «МБИО.4.14.5» . bioscience.jbpub.com . Проверено 14 мая 2017 г.
- ^ Леб Л.А., Моннат Р.Дж. (август 2008 г.). «ДНК-полимеразы и болезни человека». Обзоры природы Генетика . 9 (8): 594–604. дои : 10.1038/nrg2345 . ПМИД 18626473 . S2CID 3344014 .
- ^ Риккетти М., Бук Х. (февраль 1993 г.). « ДНК-полимераза I E. coli как обратная транскриптаза» . Журнал ЭМБО . 12 (2): 387–96. дои : 10.1002/j.1460-2075.1993.tb05670.x . ПМК 413221 . ПМИД 7679988 .
- ^ Де Люсия П., Кэрнс Дж. (декабрь 1969 г.). «Выделение штамма E. coli с мутацией, затрагивающей ДНК-полимеразу». Природа . 224 (5225): 1164–6. Бибкод : 1969Natur.224.1164D . дои : 10.1038/2241164a0 . ПМИД 4902142 . S2CID 4182917 .
- ^ Фридберг ЕС (февраль 2006 г.). «Фермент Эврика: открытие ДНК-полимеразы». Nature Reviews Молекулярно-клеточная биология . 7 (2): 143–7. дои : 10.1038/nrm1787 . ПМИД 16493419 . S2CID 39605644 .
- ^ ЭМБЛ-ЭБИ. «Европейский институт биоинформатики EMBL» . www.ebi.ac.uk. Проверено 8 ноября 2016 г.
- ^ ван Пелт-Веркуил Э., ван Белкум А., Хейс Дж. П. (2008). «Taq и другие термостабильные ДНК-полимеразы». Принципы и технические аспекты ПЦР-амплификации . стр. 103–18. дои : 10.1007/978-1-4020-6241-4_7 . ISBN 978-1-4020-6240-7 .