Стандартная энтальпия образования
В химии и термодинамике стандартная энтальпия образования или стандартная теплота образования — соединения изменение энтальпии при образовании 1 моля вещества из составляющих его элементов в исходном состоянии при всех веществах в стандартном состоянии . Стандартное давления значение p ⦵ = 10 5 Па (= 100 кПа = 1 бар ) рекомендовано ИЮПАК значение 1,00 атм (101,325 кПа). , хотя до 1982 года использовалось [1] Стандартной температуры не существует. Его символ — Δ f H. ⦵ . Надстрочный индекс Plimsoll на этом символе указывает на то, что процесс протекал в стандартных условиях при указанной температуре (обычно 25 °C или 298,15 К).
Стандартные состояния определены для различных типов веществ. Для газа это гипотетическое состояние, которое он принял бы, если бы подчинялся уравнению идеального газа при давлении 1 бар. Для газообразного или твердого растворенного вещества, присутствующего в разбавленном идеальном растворе , стандартным состоянием является гипотетическое состояние концентрации растворенного вещества ровно один моль на литр (1 М ) при давлении 1 бар, экстраполированное из бесконечного разбавления. Для чистого вещества или растворителя в конденсированном состоянии (жидком или твердом) стандартным состоянием является чистая жидкость или твердое вещество под давлением 1 бар.
Для элементов, имеющих несколько аллотропов , эталонным состоянием обычно выбирается форма, в которой элемент наиболее стабилен при давлении 1 бар. Единственным исключением является фосфор , для которого наиболее стабильной формой при давлении 1 бар является черный фосфор , но белый фосфор выбран в качестве стандартного эталонного состояния при нулевой энтальпии образования. [2]
Например, стандартная энтальпия образования углекислого газа — это энтальпия следующей реакции в указанных выше условиях:
Все элементы записываются в свои стандартные состояния, и образуется один моль продукта. Это справедливо для всех энтальпий образования.
Стандартная энтальпия образования измеряется в единицах энергии на количество вещества, обычно выражается в килоджоулях на моль (кДж моль). −1 ), но также в килокалориях на моль , джоулях на моль или килокалориях на грамм (любая комбинация этих единиц, соответствующая рекомендациям по количеству энергии на массу или количество).
Все элементы в исходных состояниях ( газообразный кислород , твердый углерод в форме графита и т. д.) имеют стандартную энтальпию образования, равную нулю, поскольку при их образовании не происходит никаких изменений.
Реакция образования представляет собой процесс при постоянном давлении и постоянной температуре. Поскольку давление стандартной реакции образования фиксировано на уровне 1 бар, стандартная энтальпия образования или теплота реакции является функцией температуры. Для целей таблицы все стандартные энтальпии образования указаны при одной температуре: 298 К, обозначенной символом Δ f H. ⦵
298 К.
Закон Гесса
[ редактировать ]Для многих веществ реакцию образования можно рассматривать как сумму ряда более простых реакций, реальных или вымышленных. Затем энтальпию реакции можно проанализировать, применив закон Гесса , который гласит, что сумма изменений энтальпии для ряда отдельных стадий реакции равна изменению энтальпии всей реакции. Это верно, поскольку энтальпия — это функция состояния , значение которой для всего процесса зависит только от начального и конечного состояний, а не от каких-либо промежуточных состояний. Примеры приведены в следующих разделах.
Ионные соединения: цикл Борна – Габера.
[ редактировать ]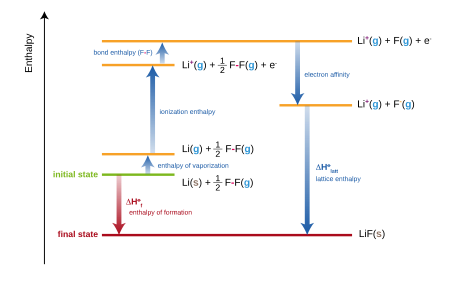
Для ионных соединений стандартная энтальпия образования эквивалентна сумме нескольких членов, входящих в цикл Борна–Габера . Например, образование фторида лития ,
можно рассматривать как сумму нескольких ступеней, каждая из которых имеет свою энтальпию (или энергию, примерно):
- H sub — стандартная энтальпия атомизации (или сублимации ) твердого лития.
- IE Li , первая энергия ионизации газообразного лития.
- B(F–F) — стандартная энтальпия атомизации (или энергия связи) газообразного фтора.
- EA F , сродство к электрону атома фтора.
- U L – энергия решетки фторида лития.
Сумма этих энтальпий дает стандартную энтальпию образования ( Δ f H ) фторида лития:
На практике энтальпию образования фторида лития можно определить экспериментально, но энергию решетки невозможно измерить напрямую. Поэтому уравнение переформулировано для оценки энергии решетки: [3]
Органические соединения
[ редактировать ]Реакции образования большинства органических соединений являются гипотетическими. Например, углерод и водород не вступают в прямую реакцию с образованием метана ( CH 4 ), так что стандартную энтальпию образования невозможно измерить напрямую. Однако стандартную энтальпию сгорания легко измерить с помощью бомбовой калориметрии . Затем стандартную энтальпию образования определяют с помощью закона Гесса . Горение метана:
эквивалентна сумме гипотетического разложения на элементы с последующим сгоранием элементов с образованием углекислого газа ( CO 2 ) и вода ( Н 2 О ):
Применяя закон Гесса,
Решая стандарт энтальпии образования,
Значение определяется как -74,8 кДж/моль. Знак минус показывает, что реакция, если бы она протекала, была бы экзотермической ; то есть метан энтальпически более стабилен, чем газообразный водород и углерод.
можно Прогнозировать теплоты образования простых ненапряженных органических соединений с помощью метода групповой аддитивности теплоты образования .
Использование в расчетах для других реакций.
[ редактировать ]Стандартное изменение энтальпии любой реакции можно рассчитать по стандартным энтальпиям образования реагентов и продуктов с использованием закона Гесса. Данную реакцию рассматривают как разложение всех реагирующих веществ на элементы в их стандартных состояниях с последующим образованием всех продуктов. Тогда тепло реакции минус сумма стандартных энтальпий образования реагентов (каждый из которых умножается на соответствующий стехиометрический коэффициент ν ) плюс сумма стандартных энтальпий образования продуктов (каждый из которых также умножается на соответствующий стехиометрический коэффициент). коэффициент), как показано в уравнении ниже: [4]
Если стандартная энтальпия продуктов меньше стандартной энтальпии реагентов, стандартная энтальпия реакции отрицательна. Это означает, что реакция является экзотермической. Обратное также верно; стандартная энтальпия реакции положительна для эндотермической реакции. В этом расчете неявно предполагается идеальное решение между реагентами и продуктами, при котором энтальпия смешения равна нулю.
Например, при сжигании метана :
Однако является элементом в своем стандартном состоянии, так что , а теплота реакции упрощается до
это уравнение из предыдущего раздела для энтальпии сгорания .
Ключевые понятия для расчета энтальпии
[ редактировать ]- При обратном ходе реакции величина ΔH остается прежней, но меняется знак.
- Когда сбалансированное уравнение реакции умножается на целое число, соответствующее значение Δ H также необходимо умножить на это целое число.
- Изменение энтальпии реакции можно рассчитать по энтальпиям образования реагентов и продуктов.
- Элементы в стандартном состоянии не вносят вклада в расчеты энтальпии реакции, поскольку энтальпия элемента в стандартном состоянии равна нулю. Аллотропы элемента, отличного от стандартного состояния, обычно имеют ненулевую стандартную энтальпию образования.
Примеры: стандартные энтальпии образования при 25 °C.
[ редактировать ]Термохимические свойства отдельных веществ при 298,15 К и 1 атм.
Неорганические вещества
[ редактировать ]| Разновидность | Фаза | Химическая формула | Δ ф Ч ⦵ /(кДж/моль) |
|---|---|---|---|
| Алюминий | Твердый | Ал | 0 |
| Хлорид алюминия | Твердый | AlCl 3 | −705.63 |
| Оксид алюминия | Твердый | Al2OAl2O3 | −1675.5 |
| Гидроксид алюминия | Твердый | Ал(ОН) 3 | −1277 |
| Сульфат алюминия | Твердый | Ал 2 (SO 4 ) 3 | −3440 |
| Хлорид бария | Твердый | БаСl 2 | −858.6 |
| Карбонат бария | Твердый | BaCOBaCO3 | −1216 |
| Гидроксид бария | Твердый | Ба(ОН) 2 | −944.7 |
| Оксид бария | Твердый | Сумка | −548.1 |
| Сульфат бария | Твердый | БаСО 4 | −1473.3 |
| Бериллий | Твердый | Быть | 0 |
| гидроксид бериллия | Твердый | Be(OH) 2 | −903 |
| Оксид бериллия | Твердый | БеО | −609.4 |
| Трихлорид бора | Твердый | БСl 3 | −402.96 |
| Бром | Жидкость | BrБр2 | 0 |
| Бромид-ион | Водный | Бр − | −121 |
| Бром | Газ | Бр | 111.884 |
| Бром | Газ | BrБр2 | 30.91 |
| трифторид брома | Газ | BrFБрФ3 | −255.60 |
| Бромистый водород | Газ | ХБр | −36.29 |
| Кадмий | Твердый | компакт-диск | 0 |
| Оксид кадмия | Твердый | КАЖДЫЙ | −258 |
| гидроксид кадмия | Твердый | Cd(OH) 2 | −561 |
| Сульфид кадмия | Твердый | CDS | −162 |
| Сульфат кадмия | Твердый | CdSO 4 | −935 |
| Цезий | Твердый | Cs | 0 |
| Цезий | Газ | Cs | 76.50 |
| Цезий | Жидкость | Cs | 2.09 |
| Ион цезия(I) | Газ | Cs + | 457.964 |
| Хлорид цезия | Твердый | CsCl | −443.04 |
| Кальций | Твердый | Что | 0 |
| Кальций | Газ | Что | 178.2 |
| Ион кальция(II) | Газ | Что 2+ | 1925.90 |
| Ион кальция(II) | Водный | Что 2+ | −542.7 |
| Карбид кальция | Твердый | СаС 2 | −59.8 |
| Карбонат кальция ( Кальцит ) | Твердый | СаСО 3 | −1206.9 |
| Хлорид кальция | Твердый | СаСl 2 | −795.8 |
| Хлорид кальция | Водный | СаСl 2 | −877.3 |
| Фосфат кальция | Твердый | Са 3 (РО 4 ) 2 | −4132 |
| фторид кальция | Твердый | КаФ 2 | −1219.6 |
| Гидрид кальция | Твердый | КаН 2 | −186.2 |
| Гидроксид кальция | Твердый | Са(ОН) 2 | −986.09 |
| Гидроксид кальция | Водный | Са(ОН) 2 | −1002.82 |
| Оксид кальция | Твердый | Высокий | −635.09 |
| Сульфат кальция | Твердый | СаSO 4 | −1434.52 |
| Сульфид кальция | Твердый | КаС | −482.4 |
| Волластонит | Твердый | CaSiO 3 | −1630 |
| Углерод ( Графит ) | Твердый | С | 0 |
| Углерод ( Алмаз ) | Твердый | С | 1.9 |
| Углерод | Газ | С | 716.67 |
| Углекислый газ | Газ | СО 2 | −393.509 |
| Сероуглерод | Жидкость | КС 2 | 89.41 |
| Сероуглерод | Газ | КС 2 | 116.7 |
| Окись углерода | Газ | СО | −110.525 |
| Карбонилхлорид ( Фосген ) | Газ | КОСl 2 | −218.8 |
| Диоксид углерода (неионизированный) | Водный | СО 2 (водн.) | −419.26 |
| Бикарбонат- ион | Водный | HCOHCO3 – | −689.93 |
| Карбонат -ион | Водный | COСО3 2– | −675.23 |
| Одноатомный хлор | Газ | кл. | 121.7 |
| Хлорид- ион | Водный | кл. − | −167.2 |
| хлор | Газ | кл 2 | 0 |
| Хром | Твердый | Кр | 0 |
| Медь | Твердый | С | 0 |
| Бромид меди(II) | Твердый | CuBr2 | −138.490 |
| Хлорид меди(II) | Твердый | CuCl2 | −217.986 |
| Оксид меди(II) | Твердый | CuO | −155.2 |
| Сульфат меди(II) | Водный | CuSO 4 | −769.98 |
| Фтор | Газ | FФ2 | 0 |
| Одноатомный водород | Газ | ЧАС | 218 |
| Водород | Газ | Ч 2 | 0 |
| Вода | Газ | Н 2 О | −241.818 |
| Вода | Жидкость | Н 2 О | −285.8 |
| Ион водорода | Водный | ЧАС + | 0 |
| Гидроксид-ион | Водный | ОЙ − | −230 |
| Перекись водорода | Жидкость | Н 2 О 2 | −187.8 |
| Фосфорная кислота | Жидкость | Н 3 ПО 4 | −1288 |
| Цианистый водород | Газ | HCN | 130.5 |
| Бромистый водород | Жидкость | ХБр | −36.3 |
| Хлороводород | Газ | HCl | −92.30 |
| Хлороводород | Водный | HCl | −167.2 |
| фтороводород | Газ | ВЧ | −273.3 |
| Йодоводород | Газ | ПРИВЕТ | 26.5 |
| Йод | Твердый | я 2 | 0 |
| Йод | Газ | я 2 | 62.438 |
| Йод | Водный | я 2 | 23 |
| Йодид- ион | Водный | я − | −55 |
| Железо | Твердый | Фе | 0 |
| Карбид железа ( Цементит ) | Твердый | Фе 3 С | 5.4 |
| Карбонат железа(II) ( Сидерит ) | Твердый | ФеСО 3 | −750.6 |
| Хлорид железа(III) | Твердый | FeCl 3 | −399.4 |
| Оксид железа(II) ( вюстит ) | Твердый | FeO | −272 |
| Оксид железа(II,III) ( Магнетит ) | Твердый | Fe 3 О 4 | −1118.4 |
| Оксид железа(III) ( гематит ) | Твердый | Fe2OFe2O3 | −824.2 |
| Сульфат железа(II) | Твердый | FeSO 4 | −929 |
| Сульфат железа(III) | Твердый | Fe 2 (SO 4 ) 3 | −2583 |
| Сульфид железа(II) | Твердый | ФеС | −102 |
| Пирит | Твердый | ФеС 2 | −178 |
| Вести | Твердый | Pb | 0 |
| Диоксид свинца | Твердый | PbO 2 | −277 |
| Сульфид свинца | Твердый | ПбС | −100 |
| Сульфат свинца | Твердый | PbSO 4 | −920 |
| Нитрат свинца(II) | Твердый | Pb(NO 3 ) 2 | −452 |
| Сульфат свинца(II) | Твердый | PbSO 4 | −920 |
| фторид лития | Твердый | ЛиФ | −616.93 |
| Магний | Твердый | мг | 0 |
| Ион магния | Водный | мг 2+ | −466.85 |
| Карбонат магния | Твердый | MgCO 3 | −1095.797 |
| Хлорид магния | Твердый | MgCl 2 | −641.8 |
| Гидроксид магния | Твердый | Мг(ОН) 2 | −924.54 |
| Гидроксид магния | Водный | Мг(ОН) 2 | −926.8 |
| Оксид магния | Твердый | MgO | −601.6 |
| Сульфат магния | Твердый | MgSO 4 | −1278.2 |
| Марганец | Твердый | Мин. | 0 |
| Оксид марганца(II) | Твердый | MnO | −384.9 |
| Оксид марганца(IV) | Твердый | МnО 2 | −519.7 |
| Оксид марганца(III) | Твердый | Mn2OMn2O3 | −971 |
| Оксид марганца(II,III) | Твердый | Mn3OMn3O4 | −1387 |
| Перманганат | Водный | MnO − 4 | −543 |
| Оксид ртути(II) (красный) | Твердый | HgO | −90.83 |
| Сульфид ртути (красный, киноварь ) | Твердый | HgS | −58.2 |
| Азот | Газ | № 2 | 0 |
| Аммиак (гидроксид аммония) | Водный | NH 3 (NH 4 ОН) | −80.8 |
| Аммиак | Газ | NHNH3 | −46.1 |
| Нитрат аммония | Твердый | НХ 4 НО 3 | −365.6 |
| Хлорид аммония | Твердый | NH 4 Cl | −314.55 |
| Диоксид азота | Газ | НЕТ 2 | 33.2 |
| Гидразин | Газ | Н 2 Ч 4 | 95.4 |
| Гидразин | Жидкость | Н 2 Ч 4 | 50.6 |
| Закись азота | Газ | Н 2 О | 82.05 |
| Оксид азота | Газ | НЕТ | 90.29 |
| Четырехокись азота | Газ | N 2 O 4 | 9.16 |
| Пятиокись азота | Твердый | N2ON2O5 | −43.1 |
| Пятиокись азота | Газ | N2ON2O5 | 11.3 |
| Азотная кислота | Водный | HNOHNO3 | −207 |
| Одноатомный кислород | Газ | ТО | 249 |
| Кислород | Газ | Около 2 | 0 |
| Озон | Газ | OО3 | 143 |
| Белый фосфор | Твердый | PP4 | 0 |
| Красный фосфор | Твердый | П | −17.4 [5] |
| Черный фосфор | Твердый | П | −39.3 [5] |
| трихлорид фосфора | Жидкость | ПКл 3 | −319.7 |
| трихлорид фосфора | Газ | ПКл 3 | −278 |
| Пентахлорид фосфора | Твердый | ПКл 5 | −440 |
| Пентахлорид фосфора | Газ | ПКл 5 | −321 |
| Пятиокись фосфора | Твердый | П 2 О 5 | −1505.5 [6] |
| Бромид калия | Твердый | КБр | −392.2 |
| Карбонат калия | Твердый | K2COK2CO3 | −1150 |
| Хлорат калия | Твердый | КСlO3 | −391.4 |
| Калий хлорид | Твердый | КСl | −436.68 |
| Калия фторид | Твердый | КФ | −562.6 |
| Оксид калия | Твердый | К 2 О | −363 |
| Калийная селитра | Твердый | КНО 3 | −494.5 |
| Перхлорат калия | Твердый | КСlO 4 | −430.12 |
| Кремний | Газ | И | 368.2 |
| Карбид кремния | Твердый | Карбид кремния | −74.4, [7] −71.5 [8] |
| Тетрахлорид кремния | Жидкость | SiCl 4 | −640.1 |
| Кремнезем ( Кварц ) | Твердый | SiO 2 | −910.86 |
| Бромид серебра | Твердый | АгБр | −99.5 |
| Хлорид серебра | Твердый | AgCl | −127.01 |
| Йодид серебра | Твердый | AgI | −62.4 |
| Оксид серебра | Твердый | Аг 2 О | −31.1 |
| Сульфид серебра | Твердый | Аг 2 С | −31.8 |
| Натрий | Твердый | Уже | 0 |
| Натрий | Газ | Уже | 107.5 |
| Бикарбонат натрия | Твердый | NaHCONaHCO3 | −950.8 |
| Карбонат натрия | Твердый | Na2CONa2CO3 | −1130.77 |
| Хлорид натрия | Водный | NaCl | −407.27 |
| Хлорид натрия | Твердый | NaCl | −411.12 |
| Хлорид натрия | Жидкость | NaCl | −385.92 |
| Хлорид натрия | Газ | NaCl | −181.42 |
| Хлорат натрия | Твердый | NaClO 3 | −365.4 |
| фторид натрия | Твердый | НаФ | −569.0 |
| Гидроксид натрия | Водный | NaOH | −469.15 |
| Гидроксид натрия | Твердый | NaOH | −425.93 |
| Гипохлорит натрия | Твердый | NaOCl | −347.1 |
| Нитрат натрия | Водный | НаНО 3 | −446.2 |
| Нитрат натрия | Твердый | НаНО 3 | −424.8 |
| Оксид натрия | Твердый | NaNa2O O | −414.2 |
| Сера (моноклинная) | Твердый | С 8 | 0.3 |
| Сера (ромбическая) | Твердый | С 8 | 0 |
| Сероводород | Газ | Ч 2 С | −20.63 |
| Диоксид серы | Газ | SOSO2 | −296.84 |
| Триоксид серы | Газ | SOSO3 | −395.7 |
| Серная кислота | Жидкость | Н 2 ТАК 4 | −814 |
| Титан | Газ | Из | 468 |
| Тетрахлорид титана | Газ | ТиСl 4 | −763.2 |
| Тетрахлорид титана | Жидкость | ТиСl 4 | −804.2 |
| Диоксид титана | Твердый | ТиО 2 | −944.7 |
| Цинк | Газ | Зн | 130.7 |
| Хлорид цинка | Твердый | ZnCl 2 | −415.1 |
| Оксид цинка | Твердый | ZnO | −348.0 |
| Сульфат цинка | Твердый | ZnSO 4 | −980.14 |
Алифатические углеводороды
[ редактировать ]| Формула | Имя | Δ ф Ч ⦵ /(ккал/моль) | Δ ф Ч ⦵ /(кДж/моль) |
|---|---|---|---|
| Прямая цепь | |||
| СН 4 | Метан | −17.9 | −74.9 |
| С 2 Ч 6 | Этан | −20.0 | −83.7 |
| С 2 Ч 4 | Этилен | 12.5 | 52.5 |
| С 2 Ч 2 | Ацетилен | 54.2 | 226.8 |
| C3HC3H8 | Пропан | −25.0 | −104.6 |
| С 4 Ч 10 | н - Бутан | −30.0 | −125.5 |
| С 5 Ч 12 | н - Пентан | −35.1 | −146.9 |
| С 6 Ч 14 | н - гексан | −40.0 | −167.4 |
| С 7 Ч 16 | н - Гептан | −44.9 | −187.9 |
| С 8 Ч 18 | н - Октан | −49.8 | −208.4 |
| C9HC9H20 | н - Нонан | −54.8 | −229.3 |
| С 10 Ч 22 | н - Декан | −59.6 | −249.4 |
| C 4 Разветвленные изомеры алканов | |||
| С 4 Ч 10 | Изобутан (метилпропан) | −32.1 | −134.3 |
| C 5 алкановые разветвленные изомеры | |||
| С 5 Ч 12 | Неопентан (диметилпропан) | −40.1 | −167.8 |
| С 5 Ч 12 | Изопентан (метилбутан) | −36.9 | −154.4 |
| C 6 алкановые разветвленные изомеры | |||
| С 6 Ч 14 | 2,2-Диметилбутан | −44.5 | −186.2 |
| С 6 Ч 14 | 2,3-Диметилбутан | −42.5 | −177.8 |
| С 6 Ч 14 | 2-Метилпентан (изогексан) | −41.8 | −174.9 |
| С 6 Ч 14 | 3-Метилпентан | −41.1 | −172.0 |
| C 7 алкановые разветвленные изомеры | |||
| С 7 Ч 16 | 2,2-диметилпентан | −49.2 | −205.9 |
| С 7 Ч 16 | 2,2,3-Триметилбутан | −49.0 | −205.0 |
| С 7 Ч 16 | 3,3-диметилпентан | −48.1 | −201.3 |
| С 7 Ч 16 | 2,3-диметилпентан | −47.3 | −197.9 |
| С 7 Ч 16 | 2,4-диметилпентан | −48.2 | −201.7 |
| С 7 Ч 16 | 2-метилгексан | −46.5 | −194.6 |
| С 7 Ч 16 | 3-метилгексан | −45.7 | −191.2 |
| С 7 Ч 16 | 3-этилпентан | −45.3 | −189.5 |
| C 8 Разветвленные изомеры алканов | |||
| С 8 Ч 18 | 2,3-Диметилгексан | −55.1 | −230.5 |
| С 8 Ч 18 | 2,2,3,3-Тетраметилбутан | −53.9 | −225.5 |
| С 8 Ч 18 | 2,2-Диметилгексан | −53.7 | −224.7 |
| С 8 Ч 18 | 2,2,4-Триметилпентан (изооктан) | −53.5 | −223.8 |
| С 8 Ч 18 | 2,5-Диметилгексан | −53.2 | −222.6 |
| С 8 Ч 18 | 2,2,3-триметилпентан | −52.6 | −220.1 |
| С 8 Ч 18 | 3,3-Диметилгексан | −52.6 | −220.1 |
| С 8 Ч 18 | 2,4-Диметилгексан | −52.4 | −219.2 |
| С 8 Ч 18 | 2,3,4-триметилпентан | −51.9 | −217.1 |
| С 8 Ч 18 | 2,3,3-Триметилпентан | −51.7 | −216.3 |
| С 8 Ч 18 | 2-метилгептан | −51.5 | −215.5 |
| С 8 Ч 18 | 3-Этил-3-метилпентан | −51.4 | −215.1 |
| С 8 Ч 18 | 3,4-Диметилгексан | −50.9 | −213.0 |
| С 8 Ч 18 | 3-Этил-2-Метилпентан | −50.4 | −210.9 |
| С 8 Ч 18 | 3-метилгептан | −60.3 | −252.5 |
| С 8 Ч 18 | 4-Метилгептан | ? | ? |
| С 8 Ч 18 | 3-Этилгексан | ? | ? |
| C 9 разветвленные изомеры алканов (выбраны) | |||
| C9HC9H20 | 2,2,4,4-Тетраметилпентан | −57.8 | −241.8 |
| C9HC9H20 | 2,2,3,3-Тетраметилпентан | −56.7 | −237.2 |
| C9HC9H20 | 2,2,3,4-Тетраметилпентан | −56.6 | −236.8 |
| C9HC9H20 | 2,3,3,4-Тетраметилпентан | −56.4 | −236.0 |
| C9HC9H20 | 3,3-Диэтилпентан | −55.7 | −233.0 |
Другие органические соединения
[ редактировать ]| Разновидность | Фаза | Химическая формула | Δ ф Ч ⦵ /(кДж/моль) |
|---|---|---|---|
| Ацетон | Жидкость | C3H6C3H6O | −248.4 |
| Бензол | Жидкость | C6HC6H6 | 48.95 |
| Бензойная кислота | Твердый | C7H6OC7H6O2 | −385.2 |
| Четыреххлористый углерод | Жидкость | ССl 4 | −135.4 |
| Четыреххлористый углерод | Газ | ССl 4 | −95.98 |
| Этанол | Жидкость | С 2 Н 5 ОН | −277.0 |
| Этанол | Газ | С 2 Н 5 ОН | −235.3 |
| Глюкоза | Твердый | С 6 Н 12 О 6 | −1271 |
| Изопропанол | Газ | C3H7C3H7OH | −318.1 |
| Метанол (метиловый спирт) | Жидкость | СН 3 ОН | −238.4 |
| Метанол (метиловый спирт) | Газ | СН 3 ОН | −201.0 |
| Метиллинолеат ( Биодизель ) | Газ | С 19 Н 34 О 2 | −356.3 |
| Сахароза | Твердый | С 12 Н 22 О 11 | −2226.1 |
| Трихлорметан ( Хлороформ ) | Жидкость | CHClCHCl3 | −134.47 |
| Трихлорметан ( Хлороформ ) | Газ | CHClCHCl3 | −103.18 |
| Винилхлорид | Твердый | С 2 Н 3 Cl | −94.12 |
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) « стандартное давление ». дои : 10.1351/goldbook.S05921
- ^ Окстоби, Дэвид В.; Пэт Гиллис, Х; Кэмпион, Алан (2011). Основы современной химии . Cengage Обучение. п. 547. ИСБН 978-0-8400-4931-5 .
- ^ Мур, Станицкий и Юрс. Химия: молекулярная наука . 3-е издание. 2008. ISBN 0-495-10521-X . страницы 320–321.
- ^ «Энтальпии реакции» . www.science.uwaterloo.ca . Архивировано из оригинала 25 октября 2017 года . Проверено 2 мая 2018 г.
- ^ Jump up to: а б Хаускрофт, CE; Шарп, AG (2004). Неорганическая химия (2-е изд.). Прентис Холл. п. 392. ИСБН 978-0-13-039913-7 .
- ^ Грин, Д.В., изд. (2007). Справочник инженеров-химиков Перри (8-е изд.). Макгроу-Хилл. стр. 2–191. ISBN 9780071422949 .
- ^ Клейкамп, Х. (1998). «Энергия Гиббса образования SiC: вклад в термодинамическую стабильность модификаций». Доклады Бунзеновского общества физической химии . 102 (9): 1231–1234. дои : 10.1002/bbpc.19981020928 .
- ^ «Карбид кремния Альфа (SiC)» . Март 1967 года . Проверено 5 февраля 2019 г.
- Зумдал, Стивен (2009). Химические принципы (6-е изд.). Бостон. Нью-Йорк: Хоутон Миффлин. стр. 384–387. ISBN 978-0-547-19626-8 .








![{\displaystyle \Delta _{\text{comb}}H^{\ominus }({\text{CH}}_{4})=[\Delta _{\text{f}}H^{\ominus } ({\text{CO}}_{2})+2\Delta _{\text{f}}H^{\ominus }({\text{H}}_{2}{\text{O}} )]-\Delta _{\text{f}}H^{\ominus }({\text{CH}}_{4}).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/868ef759a6238c57f082b526d2599d6a04ae8c6a)
![{\displaystyle \Delta _ {\text{f}}H^{\ominus }({\text{CH}}_{4}) = [\Delta _ {\text{f}}H^{\ominus } ({\text{CO}}_{2})+2\Delta _{\text{f}}H^{\ominus }({\text{H}}_{2}{\text{O}} )]-\Delta _{\text{comb}}H^{\ominus }({\text{CH}}_{4}).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eaa4ff8ecbdfc22efc596605a9e9c5b9fc178c70)



![{\displaystyle \Delta _{\text{r}}H^{\ominus }=[\Delta _{\text{f}}H^{\ominus }({\text{CO}}_{2}) +2\Delta _{\text{f}}H^{\ominus }({\text{H}}_{2}{}{\text{O}})]-[\Delta _{\text{ f}}H^{\ominus }({\text{CH}}_{4})+2\Delta _{\text{f}}H^{\ominus }({\text{O}}_{ 2})].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f12483f224dc97b374f8b1908de1c158d83541e)


![{\displaystyle \Delta _{\text{r}}H^{\ominus }=[\Delta _{\text{f}}H^{\ominus }({\text{CO}}_{2}) +2\Delta _{\text{f}}H^{\ominus }({\text{H}}_{2}{}{\text{O}})]-\Delta _{\text{f }}H^{\ominus }({\text{CH}}_{4}),}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c42524f88a1a7f73776f08e9a85b8d7d1469574)
