Биологическая фиксация углерода

Биологическая фиксация углерода , или ассимиляция углерода , — это процесс , посредством которого живые организмы превращают неорганический углерод (особенно углекислый газ ) в органические соединения . Эти органические соединения затем используются для хранения энергии и в качестве структур для других биомолекул . Углерод в основном фиксируется посредством фотосинтеза , но некоторые организмы используют хемосинтез в отсутствие солнечного света . Хемосинтез — это фиксация углерода, вызванная химической энергией, а не солнечным светом.
Процесс биологической фиксации углерода играет решающую роль в глобальном углеродном цикле, поскольку он служит основным механизмом удаления CO 2 (диоксида углерода) из атмосферы и включения его в живую биомассу. Первичное производство органических соединений позволяет углероду проникать в биосферу . [1] Углерод считается необходимым для жизни как базовый элемент для построения органических соединений. [2] Элемент углерода образует основы биогеохимических циклов (или круговоротов питательных веществ ) и управляет сообществами живых организмов. [2] Понимание биологической фиксации углерода необходимо для понимания динамики экосистем , регулирования климата и устойчивости жизни на Земле. [3]
Организмы, которые растут за счет фиксации углерода, такие как большинство растений и водорослей , называются автотрофами . К ним относятся фотоавтотрофы (использующие солнечный свет) и литоавтотрофы (использующие неорганическое окисление ). Гетеротрофы , такие как животные и грибы , не способны к фиксации углерода, но способны расти, потребляя углерод, зафиксированный автотрофами или другими гетеротрофами.
В настоящее время известны шесть естественных или автотрофных путей фиксации углерода. Это: i) цикл Кальвина-Бенсона-Башама (цикл Кальвина), ii) обратный цикл Кребса (rTCA), iii) восстановительный ацетил-КоА (путь Вуда-Люнгдала), iv) 3-гидроксипропионат [3-HP] велосипед , v) цикл 3-гидропропионат/4-гидроксибутират (3-HP/4-HB) и vi) цикл дикарбоксилат/4-гидроксибутират (DC/4-HB). [1] «Неподвижный углерод», «восстановленный углерод» и «органический углерод» могут использоваться взаимозаменяемо для обозначения различных органических соединений. [4]
Чистая и валовая CO 2 фиксация
[ редактировать ]
Первичной формой фиксированного неорганического углерода является диоксид углерода (CO 2 ). По оценкам, ежегодно в результате фотосинтеза преобразуется около 250 миллиардов тонн углекислого газа. Большая часть фиксации происходит в наземной среде, особенно в тропиках. Общее количество фиксированного углекислого газа намного больше, поскольку около 40% потребляется на дыхание после фотосинтеза. [5] [6] Исторически считается, что примерно 2×10 11 миллиардов тонн углерода было зафиксировано с момента зарождения жизни. [7]
Обзор путей
[ редактировать ]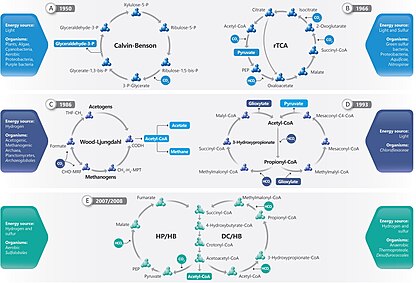
шесть автотрофных путей фиксации углерода: Известны [8] цикл Кальвина, обратный цикл Кребса, восстановительный ацетил-КоА, велосипед 3-HP, цикл 3-HP/4-HB и циклы DC/4-HB.
К организмам, цикл Кальвина в которых обнаружен , относятся растения, водоросли, цианобактерии , аэробные протеобактерии и пурпурные бактерии. [1] Цикл Кальвина фиксирует углерод в хлоропластах растений и водорослей, а также в цианобактериях . Он также фиксирует углерод в ходе аноксигенного фотосинтеза у одного типа Pseudomonadota, называемого пурпурными бактериями , и у некоторых нефототрофных Pseudomonadota. [9]
Из других автотрофных путей два известны только у бактерий ( восстановительный цикл лимонной кислоты и цикл 3-гидроксипропионата ), два только у архей (два варианта цикла 3-гидроксипропионата) и один и у бактерий, и у архей ( восстановительный путь ацетил-КоА ). Бактерии, окисляющие серу и водород, часто используют цикл Кальвина или восстановительный цикл лимонной кислоты. [10]
Список путей
[ редактировать ]
Цикл Кальвина
[ редактировать ]На цикл Кальвина приходится 90% биологической фиксации углерода. Потребляя аденозинтрифосфат (АТФ) и никотинамидадениндинуклеотидфосфат (НАДФН), цикл Кальвина у растений обуславливает преобладание фиксации углерода на суше. У водорослей и цианобактерий он обеспечивает преобладание фиксации углерода в океанах. Цикл Кальвина преобразует углекислый газ в сахар в виде триозофосфата (TP), который представляет собой глицеральдегид-3-фосфат (GAP) вместе с дигидроксиацетонфосфатом (DHAP): [11]
- 3 СО 2 + 12 е − + 12 ч. + + П я → ТП + 4 Н 2 О
Альтернативная точка зрения учитывает НАДФН (источник электронной − ) и АТФ:
- 3 СО 2 + 6 НАДФН + 6 Н + + 9 АТФ + 5 H 2 O → TP + 6 НАДФ + + 9 АДФ + 8 П и
Формула неорганического фосфата (P i ) — HOPO 3. 2− +2Ч + . Формулы триозы и ТП: C 2 H 3 O 2 -CH 2 OH и C 2 H 3 O 2 -CH 2 OPO 3. 2− +2Ч +

Обратный цикл Кребса
[ редактировать ]Обратный цикл Кребса , также известный как обратный цикл ТЦА (rTCA) или восстановительный цикл лимонной кислоты , является альтернативой стандартному циклу Кальвина-Бенсона для фиксации углерода. Он был обнаружен у строгих анаэробных или микроаэробных бактерий (например, Aquiificales ) и анаэробных архей . Он был открыт Эвансом, Бьюкененом и Арноном в 1966 году при работе с фотосинтезирующей зеленой серной бактерией Chlorobium limicola . [12] , это один из наиболее часто используемых путей распространения Campylobacterota в источниках гидротермальных В частности . [13] Эта функция обеспечивает первичное производство океана в афотической среде или «темное первичное производство». [14] Без этого в афотических средах не было бы первичной продукции, что привело бы к созданию среды обитания без жизни.
Цикл включает биосинтез ацетил -КоА из двух молекул CO 2 . [15] Ключевые этапы обратного цикла Кребса:
- Оксалоацетат в малат с помощью НАДН + Н. +
- Преобразование фумарата в сукцинат , катализируемое оксидоредуктазой, фумаратредуктазой.
- Сукцинат до сукцинил-КоА , АТФ-зависимый этап
- Сукцинил-КоА в альфа-кетоглутарат с использованием одной молекулы CO 2
- Альфа-кетоглутарат в изоцитрат с использованием НАДФН + Н. + и еще молекула CO 2
- Цитрат превращается в оксалоацетат и ацетил-КоА . Это АТФ-зависимый этап, ключевым ферментом является АТФ-цитратлиаза.
Этот путь является циклическим из-за регенерации оксалоацетата. [16]
Бактерии Gammaproteobacteria и Riftia pachyptila переключаются с цикла Кальвина-Бенсона на цикл rTCA в ответ на концентрацию H 2 S . [17]

Восстановительный путь ацетил-КоА
[ редактировать ]Путь восстановительного ацетил-КоА (СоА), также известный как путь Вуда-Люнгдала, использует CO 2 в качестве акцептора электронов и источника углерода, а H 2 в качестве донора электронов для образования уксусной кислоты. [18] Этот метаболизм широко распространен в типе Bacillota , особенно в Clostridia . [19]
Этот путь также используется метаногенами , которыми в основном являются Euryarchaeota , и некоторыми анаэробными хемолитоавтотрофами, такими как сульфатредуцирующие бактерии и археи. Вероятно, это также осуществляют Brocadiales, отряд Planctomycetota , которые окисляют аммиак в анаэробных условиях. [15] [19] [20] Гидрогенотрофный метаногенез , который встречается только у некоторых архей и составляет 80% глобального метаногенеза, также основан на восстановительном пути ацетил-КоА.
/ Дегидрогеназа монооксида углерода синтаза ацетил-КоА представляет собой чувствительный к кислороду фермент, который позволяет восстанавливать CO 2 до CO и синтезировать ацетил-КоА в нескольких реакциях. [21]
Одна ветвь этого пути, метильная ветвь, схожа, но негомологична у бактерий и архей. В этой ветви происходит восстановление CO 2 до метильного остатка, связанного с кофактором. Промежуточными продуктами являются формиат для бактерий и формилметанфуран для архей, а также переносчики, тетрагидрофолат и тетрагидроптерины соответственно у бактерий и архей, различны, например, ферменты, образующие метильную группу, связанную с кофактором. [15]
В противном случае карбонильная ветвь гомологична между двумя доменами и состоит из восстановления другой молекулы CO 2 до карбонильного остатка, связанного с ферментом, катализируемого CO-дегидрогеназой/ацетил-КоА-синтазой. Этот ключевой фермент также является катализатором образования ацетил-КоА из продуктов предыдущих реакций, метильных и карбонильных остатков. [21]
Этот путь фиксации углерода требует всего одной молекулы АТФ для производства одной молекулы пирувата, что делает этот процесс одним из основных вариантов выбора для хемолитоавтотрофов, ограниченных в энергии и живущих в анаэробных условиях. [15]
3-гидроксипропионат [3-HP] велосипед
[ редактировать ]3 -Гидроксипропионатный цикл , также известный как цикл 3-ГП/малил-КоА, открытый только в 1989 году, утилизируется зелеными несерными фототрофами семейства Chloroflexaceae , включая максимальный представитель этого семейства Chloroflexus auranticus , которым был открыт этот путь. и продемонстрировал. [22] 3-гидроксипропионатный велосипед состоит из двух циклов, и название этого пути происходит от 3-гидроксипоропионата, который соответствует его промежуточной характеристике.

Первый цикл представляет собой путь синтеза глиоксилата . Во время этого цикла два эквивалента бикарбоната фиксируются под действием двух ферментов: ацетил-КоА-карбоксилаза катализирует карбоксилирование ацетил-КоА в малонил-КоА, а пропионил-КоА-карбоксилаза катализирует карбоксилирование пропионил-КоА в метиламалонил-КоА. . С этого момента ряд реакций приводит к образованию глиоксилата, который, таким образом, становится частью второго цикла. [23] [24]

Во втором цикле глиоксилат составляет примерно один эквивалент пропионил-КоА, образуя метиламалонил-КоА. Он, в свою очередь, затем в результате ряда реакций превращается в цитрамалил-КоА. Цитрамалил-КоА расщепляется на пируват и ацетил-КоА благодаря ферменту ММС-лиазе. В этот момент пируват высвобождается, а ацетил-КоА повторно используется и снова карбоксилируется по малонил-КоА, таким образом восстанавливая цикл. [25]
Всего в 3-гидроксипропионатном велосипеде участвуют 19 реакций и используются 13 многофункциональных ферментов. Многофункциональность этих ферментов является важной особенностью этого пути, который, таким образом, позволяет фиксировать три молекулы бикарбоната. [25]
Это очень дорогой путь: 7 молекул АТФ используются для синтеза нового пирувата и 3 АТФ для синтеза фосфаттриозы. [24]
Важной характеристикой этого цикла является то, что он допускает совместную ассимиляцию многочисленных соединений, что делает его пригодным для миксотрофных организмов. [24]
Циклы, связанные с 3-гидроксипропионатным циклом
[ редактировать ]Было обнаружено, что вариант 3-гидроксипропионатного цикла действует у аэробной крайне термоацидофильной археи Metallosphaera sedula . Этот путь называется циклом 3-гидроксипропионат/4-гидроксибутират (3-HP/4-HB). [26]
Еще одним вариантом 3-гидроксипропионатного цикла является цикл дикарбоксилат/4-гидроксибутират (DC/4-HB). Он был обнаружен у анаэробных архей.Он был предложен в 2008 году для гипертермофильного археона Ignicoccus Hospitalis . [27]
еноил-КоА-карбоксилазы/редуктазы
[ редактировать ]Фиксация CO 2 катализируется еноил-КоА-карбоксилазами/редуктазами. [28]
Неавтотрофные пути
[ редактировать ]Хотя ни один гетеротроф не использует углекислый газ в биосинтезе, некоторое количество углекислого газа включается в их метаболизм. [29] В частности, пируваткарбоксилаза потребляет углекислый газ (в виде ионов бикарбоната) в ходе глюконеогенеза , а углекислый газ потребляется в различных анаплеротических реакциях .
6-фосфоглюконатдегидрогеназа катализирует восстановительное карбоксилирование рибулозо-5-фосфата до 6-фосфоглюконата в E. coli при повышенных концентрациях CO 2 . [30]
Дискриминация изотопов углерода
[ редактировать ]Некоторые карбоксилазы , особенно RuBisCO , предпочтительно связывают более легкий стабильный изотоп углерода углерод-12, чем более тяжелый углерод-13 . Это известно как дискриминация изотопов углерода и приводит к тому, что соотношение углерода-12 и углерода-13 в растении выше, чем в свободном воздухе. Измерение этого соотношения важно для оценки эффективности использования воды растениями. [31] [32] [33] а также при оценке возможных или вероятных источников углерода в исследованиях глобального углеродного цикла.
Биологическая фиксация углерода в почвах
[ редактировать ]Помимо фотосинтетических и хемосинтетических процессов, биологическая фиксация углерода в почве происходит за счет деятельности микроорганизмов, таких как бактерии и грибы. Эти почвенные микробы играют решающую роль в глобальном углеродном цикле, улавливая углерод из разложившегося органического вещества и возвращая его обратно в почву, тем самым способствуя плодородию почвы и продуктивности экосистем. [34]
В почвенной среде органические вещества, полученные из мертвых растительных и животных материалов, подвергаются разложению — процессу, осуществляемому разнообразным сообществом микроорганизмов. В процессе разложения сложные органические соединения расщепляются на более простые молекулы под действием ферментов, вырабатываемых бактериями, грибами и другими почвенными организмами. При разложении органического вещества углерод выделяется в различных формах, включая диоксид углерода (CO2) и растворенный органический углерод (DOC).
Однако не весь углерод, выделяющийся при разложении, сразу выбрасывается в атмосферу; значительная часть сохраняется в почве в результате процессов, известных как секвестрация углерода почвой. Почвенные микробы, особенно бактерии и грибы, играют ключевую роль в этом процессе, включая в свою биомассу разложившийся органический углерод или способствуя образованию стабильных органических соединений, таких как гумус и органическое вещество почвы. [35]
Одним из ключевых механизмов, с помощью которого почвенные микробы связывают углерод, является процесс производства микробной биомассы. Бактерии и грибы усваивают углерод из разложившегося органического вещества в свои клеточные структуры по мере роста и размножения. Эта микробная биомасса служит резервуаром для накопленного углерода в почве, эффективно изолируя углерод из атмосферы.
Кроме того, почвенные микробы способствуют образованию стабильного органического вещества почвы посредством синтеза внеклеточных полимеров , ферментов и других биохимических соединений . Эти вещества помогают связывать частицы почвы вместе, образуя агрегаты, которые защищают органический углерод от микробного разложения и физической эрозии . Со временем эти агрегаты накапливаются в почве, что приводит к образованию почвенного органического вещества, которое может сохраняться от столетий до тысячелетий.
Связывание углерода в почве не только помогает смягчить накопление атмосферного CO2 и смягчить последствия изменения климата , но также повышает плодородие почвы, удержание воды и круговорот питательных веществ , тем самым поддерживая рост растений и продуктивность экосистем. Следовательно, понимание роли почвенных микробов в биологической фиксации углерода имеет важное значение для управления здоровьем почвы , смягчения последствий изменения климата и продвижения методов устойчивого управления земельными ресурсами.
Биологическая фиксация углерода — это фундаментальный процесс, который поддерживает жизнь на Земле, регулируя уровень CO2 в атмосфере, поддерживая рост растений и других фотосинтезирующих организмов и поддерживая экологический баланс.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Сантос Корреа С., Шульц Дж., Лауэрсен К.Дж., Соареш Росадо А. (1 мая 2023 г.). «Природная фиксация углерода и достижения в области синтетической инженерии для изменения конструкции и создания новых путей фиксации» . Журнал перспективных исследований . 47 : 75–92. дои : 10.1016/j.jare.2022.07.011 . hdl : 10754/680126 . ISSN 2090-1232 . ПМЦ 10173188 . ПМИД 35918056 .
- ^ Перейти обратно: а б Сантос Корреа С., Шульц Дж., Лауэрсен К.Дж., Соареш Росадо А. (1 мая 2023 г.). «Природная фиксация углерода и достижения в области синтетической инженерии для изменения конструкции и создания новых путей фиксации» . Журнал перспективных исследований . 47 : 75–92. дои : 10.1016/j.jare.2022.07.011 . hdl : 10754/680126 . ISSN 2090-1232 . ПМЦ 10173188 . ПМИД 35918056 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2013). Страйер Биохимия . дои : 10.1007/978-3-8274-2989-6 . ISBN 978-3-8274-2988-9 .
- ^ Гейдер Р.Дж. и др. (2001). «Первичная продуктивность планеты Земля: биологические детерминанты и физические ограничения в наземной и водной среде обитания» . Биология глобальных изменений . 7 (8): 849–882. Бибкод : 2001GCBio...7..849G . дои : 10.1046/j.1365-2486.2001.00448.x . S2CID 41335311 .
- ^ Гейдер Р.Дж. и др. (2001). «Первичная продуктивность планеты Земля: биологические детерминанты и физические ограничения в наземной и водной среде обитания» . Биология глобальных изменений . 7 (8): 849–882. Бибкод : 2001GCBio...7..849G . дои : 10.1046/j.1365-2486.2001.00448.x . S2CID 41335311 .
- ^ Рагхавендра, А.С. (01 января 2003 г.), Томас, Брайан (редактор), «ФОТОСИНТЕЗ И РАЗДЕЛЕНИЕ | Растения C3», Энциклопедия прикладных наук о растениях , Оксфорд: Elsevier, стр. 673–680, ISBN 978-0-12-227050-5 , получено 21 марта 2021 г.
- ^ Крокфорд П.В., Бар Он Ю.М., Уорд Л.М., Майло Р., Халеви И. (ноябрь 2023 г.). «Геологическая история первичной продуктивности» . Современная биология . 33 (21): 4741–4750.e5. Бибкод : 2023CBio...33E4741C . дои : 10.1016/j.cub.2023.09.040 . ISSN 0960-9822 . ПМИД 37827153 . S2CID 263839383 .
- ^ Сантос Корреа С., Шульц Дж., Лауэрсен К.Дж., Соареш Росадо А. (1 мая 2023 г.). «Природная фиксация углерода и достижения в области синтетической инженерии для изменения конструкции и создания новых путей фиксации» . Журнал перспективных исследований . 47 : 75–92. дои : 10.1016/j.jare.2022.07.011 . hdl : 10754/680126 . ISSN 2090-1232 . ПМЦ 10173188 . ПМИД 35918056 .
- ^ Свон Б.К., Мартинес-Гарсия М., Престон С.М., Ширба А., Войк Т., Лами Д. и др. (сентябрь 2011 г.). «Возможность хемолитоавтотрофии среди вездесущих линий бактерий в темном океане». Наука . 333 (6047): 1296–300. Бибкод : 2011Sci...333.1296S . дои : 10.1126/science.1203690 . ПМИД 21885783 . S2CID 206533092 .
- ^ Энциклопедия микробиологии . Академическая пресса. 2009. стр. 83–84. ISBN 978-0-12-373944-5 .
- ^ Рейнс, Калифорния (1 января 2003 г.). «Возвращение к циклу Кальвина» . Исследования фотосинтеза . 75 (1): 1–10. дои : 10.1023/А:1022421515027 . ISSN 1573-5079 . ПМИД 16245089 .
- ^ Фукс Г. (13 октября 2011 г.). «Альтернативные пути фиксации углекислого газа: понимание ранней эволюции жизни?». Ежегодный обзор микробиологии . 65 (1): 631–58. doi : 10.1146/annurev-micro-090110-102801 . ПМИД 21740227 .
- ^ Гржимски Дж.Дж., Мюррей А.Э., Кэмпбелл Б.Дж., Капларевич М., Гао Г.Р., Ли С. и др. (ноябрь 2008 г.). «Метагеномный анализ экстремального микробного симбиоза выявляет эвритермическую адаптацию и метаболическую гибкость» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (45): 17516–21. Бибкод : 2008PNAS..10517516G . дои : 10.1073/pnas.0802782105 . ПМЦ 2579889 . ПМИД 18987310 .
- ^ Балтар Ф, Херндль Г.Дж. (11 июня 2019 г.). «Имеет ли отношение темная фиксация углерода к оценкам первичной продукции океана?» (PDF) . Биогеонауки . дои : 10.5194/bg-2019-223 .
- ^ Перейти обратно: а б с д Хюглер М., Зиверт С.М. (15 января 2011 г.). «За пределами цикла Кальвина: автотрофная фиксация углерода в океане». Ежегодный обзор морской науки . 3 (1): 261–89. Бибкод : 2011ARMS....3..261H . doi : 10.1146/annurev-marine-120709-142712 . ПМИД 21329206 . S2CID 44800487 .
- ^ Бьюкенен Б.Б., Арнон Д.И. (апрель 1990 г.). «Обратный цикл КРЕБСА в фотосинтезе: наконец-то консенсус». Исследования фотосинтеза . 24 (1): 47–53. Бибкод : 1990PhoRe..24...47B . дои : 10.1007/bf00032643 . ПМИД 24419764 . S2CID 2753977 .
- ^ Маркерт С., Арндт С., Фелбек Х., Бехер Д., Зиверт С.М., Хюглер М. и др. (январь 2007 г.). «Физиологическая протеомика некультивируемого эндосимбионта Riftia pachyptila». Наука . 315 (5809): 247–50. Бибкод : 2007Sci...315..247M . дои : 10.1126/science.1132913 . HDL : 1912/1514 . ОСЛК 655249163 . ПМИД 17218528 . S2CID 45745396 .
- ^ Люнгдал Л.Г. (2009). «Жизнь с ацетогенами, термофилами и целлюлолитическими анаэробами» . Ежегодный обзор микробиологии . 63 (1): 1–25. дои : 10.1146/annurev.micro.091208.073617 . ПМИД 19575555 .
- ^ Перейти обратно: а б Дрейк Х.Л., Гесснер А.С., Дэниел С.Л. (март 2008 г.). «Старые ацетогены, новый свет». Анналы Нью-Йоркской академии наук . 1125 (1): 100–28. Бибкод : 2008NYASA1125..100D . дои : 10.1196/анналы.1419.016 . ПМИД 18378590 . S2CID 24050060 .
- ^ Строус М., Пеллетье Э., Манжено С., Раттей Т., Ленер А., Тейлор М.В. и др. (апрель 2006 г.). «Расшифровка эволюции и метаболизма анаммокс-бактерии на основе генома сообщества». Природа . 440 (7085): 790–4. Бибкод : 2006Natur.440..790S . дои : 10.1038/nature04647 . hdl : 2066/35981 . ПМИД 16598256 . S2CID 4402553 .
- ^ Перейти обратно: а б Пезака Э., Вуд Х.Г. (октябрь 1984 г.). «Роль дегидрогеназы монооксида углерода в автотрофном пути, используемом ацетогенными бактериями» . Труды Национальной академии наук Соединенных Штатов Америки . 81 (20): 6261–5. Бибкод : 1984PNAS...81.6261P . дои : 10.1073/pnas.81.20.6261 . ПМК 391903 . ПМИД 6436811 .
- ^ Штраус Г., Фукс Г. (август 1993 г.). «Ферменты нового пути автотрофной фиксации CO2 у фототрофной бактерии Chloroflexus aurantiacus, 3-гидроксипропионатного цикла» . Европейский журнал биохимии . 215 (3): 633–43. дои : 10.1111/j.1432-1033.1993.tb18074.x . ПМИД 8354269 .
- ^ Гертер С., Буш А., Фукс Г. (ноябрь 2002 г.). «L-малил-коэнзим А-лиаза/бета-метилмалил-кофермент А-лиаза из Chloroflexus aurantiacus, бифункциональный фермент, участвующий в автотрофной фиксации CO 2 » . Журнал бактериологии . 184 (21): 5999–6006. дои : 10.1128/jb.184.21.5999-6006.2002 . ПМК 135395 . ПМИД 12374834 .
- ^ Перейти обратно: а б с Берг И.А. (март 2011 г.). «Экологические аспекты распространения различных автотрофных путей фиксации СО 2 » . Прикладная и экологическая микробиология . 77 (6): 1925–36. Бибкод : 2011ApEnM..77.1925B . дои : 10.1128/aem.02473-10 . ПМК 3067309 . ПМИД 21216907 .
- ^ Перейти обратно: а б Зажицки Дж., Брехт В., Мюллер М., Фукс Г. (декабрь 2009 г.). «Идентификация недостающих этапов автотрофного цикла фиксации 3-гидроксипропионата CO2 у Chloroflexus aurantiacus» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (50): 21317–22. дои : 10.1073/pnas.0908356106 . ПМЦ 2795484 . ПМИД 19955419 .
- ^ Берг И.А., Кокелькорн Д., Бакель В., Фукс Г. (декабрь 2007 г.). «Путь автотрофной ассимиляции углекислого газа 3-гидроксипропионата / 4-гидроксибутирата у архей». Наука . 318 (5857): 1782–6. Бибкод : 2007Sci...318.1782B . дои : 10.1126/science.1149976 . ПМИД 18079405 . S2CID 13218676 .
- ^ Хубер Х., Галленбергер М., Ян У., Эйлерт Э., Берг И.А., Кокелькорн Д. и др. (июнь 2008 г.). «Цикл автотрофной ассимиляции углерода дикарбоксилат/4-гидроксибутират у гипертермофильных Archaeum Ignicoccus Hospitalis» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (22): 7851–6. Бибкод : 2008PNAS..105.7851H . дои : 10.1073/pnas.0801043105 . ПМК 2409403 . ПМИД 18511565 .
- ^ Швандер Т., Шада фон Боржисковски Л., Бургенер С., Кортина Н.С., Эрб Т.Дж. (2016). «Синтетический путь фиксации углекислого газа in vitro» . Наука . 354 (6314): 900–904. Бибкод : 2016Sci...354..900S . дои : 10.1126/science.aah5237 . ПМЦ 5892708 . ПМИД 27856910 .
- ^ Николь Кресдж, Роберт Д. Симони, Роберт Л. Хилл (2005). «Открытие Харландом Г. Вудом гетеротрофной фиксации углекислого газа» . Журнал биологической химии . 280 (18): е15.
- ^ Сатановский А., Дронселла Б., Нур Е., Фёгели Б., Хе Х., Вихманн П. и др. (ноябрь 2020 г.). «Пробуждение скрытого цикла фиксации углерода в Escherichia coli» . Природные коммуникации . 11 (1): 5812. Бибкод : 2020NatCo..11.5812S . дои : 10.1038/s41467-020-19564-5 . ПМЦ 7669889 . ПМИД 33199707 .
- ^ Адиредхо А.Л., Наво О., Муньос С., Лангладе Н.Б., Ламаз Т., Гриу П. (3 июля 2014 г.). «Генетический контроль эффективности использования воды и распознавание изотопов углерода в листьях подсолнечника (Helianthus annuus L.), подверженного двум сценариям засухи» . ПЛОС ОДИН . 9 (7): e101218. Бибкод : 2014PLoSO...9j1218A . дои : 10.1371/journal.pone.0101218 . ПМК 4081578 . ПМИД 24992022 .
- ^ Фаркуар Г.Д., Элерингер-младший, Хубик К.Т. (июнь 1989 г.). «Дискриминация изотопов углерода и фотосинтез». Ежегодный обзор физиологии растений и молекулярной биологии растений . 40 (1): 503–537. дои : 10.1146/annurev.pp.40.060189.002443 . S2CID 12988287 .
- ^ Сейбт У., Раджаби А., Гриффитс Х., Берри Дж.А. (март 2008 г.). «Изотопы углерода и эффективность использования воды: смысл и чувствительность». Экология . 155 (3): 441–54. Бибкод : 2008Oecol.155..441S . дои : 10.1007/s00442-007-0932-7 . ПМИД 18224341 . S2CID 451126 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2013). Страйер Биохимия . дои : 10.1007/978-3-8274-2989-6 . ISBN 978-3-8274-2988-9 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2013). Страйер Биохимия . дои : 10.1007/978-3-8274-2989-6 . ISBN 978-3-8274-2988-9 .
Дальнейшее чтение
[ редактировать ]- Килинг П.Дж. (октябрь 2004 г.). «Разнообразие и история эволюции пластид и их хозяев» . Американский журнал ботаники . 91 (10): 1481–93. дои : 10.3732/ajb.91.10.1481 . ПМИД 21652304 . S2CID 17522125 .
- Килинг Пи Джей (2009). «Хромальвеолаты и эволюция пластид путем вторичного эндосимбиоза» (PDF) . Журнал эукариотической микробиологии . 56 (1): 1–8. дои : 10.1111/j.1550-7408.2008.00371.x . ПМИД 19335769 . S2CID 34259721 . Архивировано из оригинала (PDF) 9 июля 2009 года.
- Килинг П.Дж. (март 2010 г.). «Эндсимбиотическое происхождение, диверсификация и судьба пластид» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 365 (1541): 729–48. дои : 10.1098/rstb.2009.0103 . ПМК 2817223 . ПМИД 20124341 .
- Тимме Р.Э., Бахваров Т.Р., Делвич К.Ф. (2012). «Широкая филогеномная выборка и сестринская линия наземных растений» . ПЛОС ОДИН . 7 (1): e29696. Бибкод : 2012PLoSO...729696T . дои : 10.1371/journal.pone.0029696 . ПМЦ 3258253 . ПМИД 22253761 .
- Шпигель FW (февраль 2012 г.). «Эволюция. Созерцание первых растений». Наука . 335 (6070): 809–10. Бибкод : 2012Sci...335..809S . дои : 10.1126/science.1218515 . ПМИД 22344435 . S2CID 36584136 .
- Прайс Д.С., Чан С.Х., Юн Х.С., Ян Э.К., Цю Х., Вебер А.П. и др. (февраль 2012 г.). «Геном Cyanophora paradoxa объясняет происхождение фотосинтеза у водорослей и растений» (PDF) . Наука . 335 (6070): 843–7. Бибкод : 2012Sci...335..843P . дои : 10.1126/science.1213561 . ПМИД 22344442 . S2CID 17190180 . Архивировано из оригинала (PDF) 14 мая 2013 года.






