Высокоэффективная жидкостная хроматография

Высокоэффективная жидкостная хроматография ( ВЭЖХ ), ранее называвшаяся жидкостной хроматографией высокого давления , представляет собой метод аналитической химии, используемый для разделения, идентификации и количественного определения конкретных компонентов в смесях. Смеси могут происходить из пищевых продуктов , химикатов , фармацевтических препаратов , [1] биологические , экологические и сельскохозяйственные и т. д., которые растворены в жидких растворах. [ нужна ссылка ]
Он основан на насосах высокого давления, которые доставляют смеси различных растворителей, называемые подвижной фазой , которая течет через систему, собирая по пути смесь проб и доставляя ее в цилиндр, называемый колонкой, наполненный твердыми частицами, изготовленными из Адсорбирующий материал , называемый неподвижной фазой . [2]
Каждый компонент образца по-разному взаимодействует с адсорбирующим материалом, вызывая разные скорости миграции каждого компонента. [3] Эти различные скорости приводят к разделению, поскольку частицы перетекают из колонки в специальный детектор, например УФ-детекторы . Выходным сигналом детектора является график, называемый хроматограммой. Хроматограммы представляют собой графическое представление интенсивности сигнала в зависимости от времени или объема, показывающее пики, которые представляют компоненты образца. Каждый образец появляется в соответствующее время, называемое временем удерживания, и имеет площадь, пропорциональную его количеству. [2]
ВЭЖХ широко используется в производстве ( например , в процессе производства фармацевтических и биологических продуктов), [4] [5] юридические ( например , обнаружение в моче препаратов, повышающих работоспособность), [6] исследовательские ( например , отделение компонентов сложного биологического образца или аналогичных синтетических химических веществ друг от друга) и медицинские ( например , определение уровня витамина D в сыворотке крови) целей. [7]
Хроматографию можно описать как процесс массообмена, включающий адсорбцию и/или распределение . Как уже упоминалось, в ВЭЖХ используются насосы для пропускания жидкости под давлением и смеси пробы через колонку, заполненную адсорбентом, что приводит к разделению компонентов пробы. Активный компонент колонки — адсорбент — обычно представляет собой гранулированный материал из твердых частиц ( например , кремнезема , полимеров и т. д.) размером 1,5–50 мкм, на котором могут быть связаны различные реагенты. [8] [9] Компоненты пробной смеси отделены друг от друга за счет разной степени взаимодействия с частицами адсорбента. Жидкость под давлением обычно представляет собой смесь растворителей ( например , воды, буферов , ацетонитрила и/или метанола ) и называется «подвижной фазой». Его состав и температура играют важную роль в процессе разделения, влияя на взаимодействие компонентов пробы и адсорбента. Эти взаимодействия имеют физическую природу, например гидрофобные (дисперсионные), диполь-дипольные и ионные, чаще всего их комбинации. [ нужна ссылка ]
Операция
[ редактировать ]Жидкостный хроматограф сложен. [10] и имеет сложную и деликатную технологию. Для правильной работы системы должна быть минимальная основа для понимания того, как устройство выполняет обработку данных, чтобы избежать неверных данных и искаженных результатов. [11] [12] [13]
ВЭЖХ отличается от традиционной жидкостной хроматографии («низкого давления») , поскольку рабочее давление значительно выше (около 50–1400 бар), тогда как обычная жидкостная хроматография обычно полагается на силу гравитации для прохождения подвижной фазы через насадочную колонку. Из-за небольшого количества пробы, отделяемой при аналитической ВЭЖХ, типичные размеры колонки составляют 2,1–4,6 мм в диаметре и 30–250 мм в длину. Также колонки для ВЭЖХ изготавливаются с более мелкими частицами адсорбента (средний размер частиц 1,5–50 мкм). Это дает ВЭЖХ превосходную разрешающую способность (способность различать соединения) при разделении смесей, что делает ее популярным хроматографическим методом. [ нужна ссылка ]
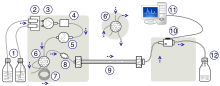
Схема прибора для ВЭЖХ обычно включает резервуары для растворителей, один или несколько насосов, дегазатор растворителя , пробоотборник, колонку и детектор. Растворители готовятся заранее в соответствии с потребностями разделения, они проходят через дегазатор для удаления растворенных газов, смешиваются и становятся подвижной фазой, затем проходят через пробоотборник, который подает смесь проб в поток подвижной фазы, который затем несет его в колонну. Насосы подают желаемый поток и состав подвижной фазы через неподвижную фазу внутри колонки, а затем непосредственно в проточную ячейку внутри детектора. Детектор генерирует сигнал, пропорциональный количеству компонента пробы, выходящего из колонки, что позволяет проводить количественный анализ компонентов пробы. Детектор также отмечает время появления, время удерживания, что служит для первичной идентификации компонента. Более совершенные детекторы также предоставляют дополнительную информацию, специфичную для характеристик аналита, например: UV-VIS спектр или масс-спектр , который может дать представление о его структурных особенностях. Эти детекторы широко используются, например, детектор УФ/Вид, детектор с фотодиодной матрицей (КПК)/ диодной матрицей и детектор масс-спектрометрии . [ нужна ссылка ]
Цифровой микропроцессор и пользовательское программное обеспечение управляют прибором ВЭЖХ и обеспечивают анализ данных. Некоторые модели механических насосов в приборе ВЭЖХ могут смешивать несколько растворителей в соотношениях, меняющихся во времени, создавая градиент состава в подвижной фазе. Большинство приборов ВЭЖХ также оснащены термостатом колонки, который позволяет регулировать температуру, при которой выполняется разделение. [ нужна ссылка ]
Смесь проб, которую необходимо разделить и проанализировать, вводят в дискретном небольшом объеме (обычно микролитрах) в поток подвижной фазы, просачивающийся через колонку. Компоненты пробы движутся через колонку, каждый с разной скоростью, которая зависит от конкретных физических взаимодействий с адсорбентом, неподвижной фазой. Скорость каждого компонента зависит от его химической природы, природы неподвижной фазы (внутри колонны) и состава подвижной фазы. Время, в течение которого конкретный аналит элюируется (выходит из колонки), называется временем его удерживания. Время удерживания, измеренное в определенных условиях, является отличительной характеристикой данного аналита. [ нужна ссылка ]
Доступно множество различных типов колонок, наполненных адсорбентами разного размера частиц, пористости и химического состава поверхности. Использование насадочных материалов с частицами меньшего размера требует использования более высокого рабочего давления («противодавления») и обычно улучшает хроматографическое разрешение (степень разделения пиков между последовательными аналитами, выходящими из колонки). Частицы сорбента могут иметь ионную, гидрофобную или полярную природу. [ нужна ссылка ]
Наиболее распространенным методом жидкостной хроматографии является обращенно-фазовая , при которой используемые подвижные фазы включают любую смешиваемую комбинацию воды или буферов с различными органическими растворителями (наиболее распространенными являются ацетонитрил и метанол). В некоторых методах ВЭЖХ используются безводные подвижные фазы (см. Нормально-фазовую хроматографию ниже). Водный компонент подвижной фазы может содержать кислоты (такие как муравьиная, фосфорная или трифторуксусная кислота ) или соли, способствующие разделению компонентов пробы. Состав подвижной фазы можно поддерживать постоянным («режим изократического элюирования») или изменять («режим градиентного элюирования») в ходе хроматографического анализа. Изократическое элюирование обычно эффективно при разделении простых смесей. Градиентное элюирование необходимо для сложных смесей с различным взаимодействием с неподвижной и подвижной фазами. По этой причине при градиентном элюировании состав подвижной фазы обычно варьируется от низкой до высокой силы элюирования. Сила элюирования подвижной фазы отражается на времени удерживания аналита, поскольку высокая сила элюирования ускоряет элюирование (что приводит к сокращению времени удерживания). Например, типичный профиль градиента в обращенно-фазовой хроматографии может начинаться с 5% ацетонитрила (в воде или водном буфере) и линейно прогрессировать до 95% ацетонитрила в течение 5–25 минут. Периоды постоянного состава подвижной фазы (плато) также могут быть частью градиентного профиля. Например, состав подвижной фазы можно поддерживать постоянным при 5% ацетонитриле в течение 1–3 минут с последующим линейным изменением до 95% ацетонитрила. [ нужна ссылка ]
Выбранный состав подвижной фазы зависит от интенсивности взаимодействий между различными компонентами пробы («аналитами») и неподвижной фазой ( например , гидрофобных взаимодействий в обращенно-фазовой ВЭЖХ). В зависимости от их сродства к неподвижной и подвижной фазам аналиты распределяются между ними во время процесса разделения, происходящего в колонке. Этот процесс разделения аналогичен тому, который происходит при жидкостно-жидкостной экстракции , но является непрерывным, а не ступенчатым. [ нужна ссылка ]
В примере с использованием градиента вода/ацетонитрил более гидрофобные компоненты будут элюироваться (уходить с колонки) позже, а затем, как только подвижная фаза станет богаче ацетонитрилом ( т. е . подвижная фаза станет более элюирующим раствором), скорость их элюирования изменится. вверх. [ нужна ссылка ]
Выбор компонентов подвижной фазы, добавок (таких как соли или кислоты) и условий градиента зависит от природы колонки и компонентов пробы. Часто с образцом проводится серия пробных испытаний, чтобы найти метод ВЭЖХ, обеспечивающий адекватное разделение. [ нужна ссылка ]
История и развитие
[ редактировать ]До ВЭЖХ ученые использовали методы настольной колоночной жидкостной хроматографии. Жидкостные хроматографические системы были в значительной степени неэффективны из-за того, что скорость потока растворителей зависела от силы тяжести. Разлука занимала многие часы, а иногда и дни. Газовая хроматография (ГХ) в то время была более мощной, чем жидкостная хроматография (ЖХ), однако было очевидно, что разделение газовых фаз и анализ очень полярных высокомолекулярных биополимеров невозможны. [14] ГХ оказался неэффективен для многих приложений в области медико-биологических наук и здравоохранения для биомолекул, поскольку они в основном нелетучи и термически нестабильны при высоких температурах ГХ. [15] В результате была выдвинута гипотеза об альтернативных методах, которые вскоре привели к развитию ВЭЖХ. [ нужна ссылка ]
предсказал Следуя плодотворной работе Мартина и Синга в 1941 году, Кэлвин Гиддингс : [16] Йозеф Хубер и другие в 1960-х годах предположили, что ЖК может работать в высокоэффективном режиме за счет уменьшения диаметра частиц упаковки существенно ниже типичного уровня ЖК (и ГХ) в 150 мкм и использования давления для увеличения скорости подвижной фазы. [14] Эти предсказания подвергались обширным экспериментам и уточнениям на протяжении 60-70-х годов и до наших дней. [17] Ранние исследования начали улучшать ЖК-частицы, например, исторический Zipax, поверхностно-пористые частицы. [18]
1970-е годы принесли множество изменений в области оборудования и приборов. Исследователи начали использовать насосы и инжекторы для создания элементарной конструкции системы ВЭЖХ. [19] Насосы-усилители газа были идеальными, поскольку они работали при постоянном давлении и не требовали герметичных уплотнений или обратных клапанов для обеспечения стабильного потока и хорошего количественного анализа. [15] В Dupont IPD (подразделение промышленных полимеров) были реализованы важные этапы в области аппаратного обеспечения, такие как использование градиентного устройства с малым объемом выдержки, а также замена септального инжектора на петлевой инжекторный клапан. [15]
Хотя разработка приборов была важна, история ВЭЖХ в первую очередь связана с историей и развитием технологии частиц . [15] [20] После введения частиц пористого слоя наблюдается устойчивая тенденция к уменьшению размера частиц для повышения эффективности. [15] Однако при уменьшении размера частиц возникли новые проблемы. Практические недостатки связаны с чрезмерным перепадом давления, необходимым для проталкивания подвижной жидкости через колонну, а также с трудностью приготовления однородной упаковки из очень мелких материалов. [21] Каждый раз, когда размер частиц значительно уменьшается, обычно требуется новый этап разработки прибора, чтобы выдержать такое давление. [17] [15]
Типы
[ редактировать ]Распределительная хроматография
[ редактировать ]
Распределительная хроматография была одним из первых видов хроматографии, разработанных химиками, и в наши дни практически не используется. [22] Принцип коэффициента распределения применялся в бумажной хроматографии , тонкослойной хроматографии , газовой фазе и разделении жидкость-жидкость . по химии 1952 года Нобелевская премия была присуждена Арчеру Джону Портеру Мартину и Ричарду Лоуренсу Миллингтону Синджу за разработку метода разделения аминокислот . [23] В распределительной хроматографии используется удерживаемый растворитель на поверхности или внутри зерен или волокон «инертной» твердой поддерживающей матрицы, как и в бумажной хроматографии; или использует некоторое кулоновское и/или донорное взаимодействие водорода с неподвижной фазой. Молекулы аналита распределяются между жидкой неподвижной фазой и элюентом. Как и в хроматографии гидрофильного взаимодействия (HILIC; подметод ВЭЖХ), этот метод разделяет аналиты на основе различий в их полярности. В HILIC чаще всего используется связанная полярная неподвижная фаза и подвижная фаза, состоящая в основном из ацетонитрила с водой в качестве сильного компонента. Разделительная ВЭЖХ исторически использовалась на несвязанных носителях из диоксида кремния или оксида алюминия. Каждый из них эффективно работает для разделения аналитов по относительным полярным разностям. Преимущество связанных фаз HILIC заключается в разделении кислых , основных и нейтральных растворенных веществ за один хроматографический цикл. [24]
Полярные аналиты диффундируют в неподвижный слой воды, связанный с полярной стационарной фазой, и, таким образом, удерживаются. Чем сильнее взаимодействие между полярным аналитом и полярной неподвижной фазой (относительно подвижной фазы), тем дольше время элюирования. Сила взаимодействия зависит от функциональных групп, входящих в молекулярную структуру аналита, с более поляризованными группами ( например , гидроксил-) и группами, способными образовывать водородные связи, вызывающими большее удерживание. Кулоновские (электростатические) взаимодействия также могут увеличить удерживание. Использование более полярных растворителей в подвижной фазе уменьшит время удерживания аналитов, тогда как более гидрофобные растворители имеют тенденцию увеличивать время удерживания. [ нужна ссылка ]
Нормально-фазовая хроматография
[ редактировать ]Нормально-фазовая хроматография была одним из первых видов ВЭЖХ, разработанных химиками, но за последние десятилетия ее использование сократилось. Этот метод, также известный как нормально-фазовая ВЭЖХ (NP-ВЭЖХ), разделяет аналиты на основе их сродства к полярной неподвижной поверхности, такой как кремнезем; следовательно, он основан на способности аналита вступать в полярные взаимодействия (такие как взаимодействия водородной связи или диполь-дипольного типа) с поверхностью сорбента. В NP-ВЭЖХ используется неполярная неводная подвижная фаза ( например , хлороформ ) и она эффективно работает для разделения аналитов, легко растворимых в неполярных растворителях. Аналит связывается с полярной стационарной фазой и удерживается ею. Сила адсорбции увеличивается с увеличением полярности аналита. Сила взаимодействия зависит не только от функциональных групп, присутствующих в структуре молекулы аналита, но и от стерических факторов . Влияние стерических затруднений на силу взаимодействия позволяет этому методу разделять (разделять) структурные изомеры . [ нужна ссылка ]
Использование более полярных растворителей в подвижной фазе уменьшит время удерживания аналитов, тогда как более гидрофобные растворители имеют тенденцию вызывать более медленное элюирование (увеличение времени удерживания). Очень полярные растворители, такие как следы воды в подвижной фазе, имеют тенденцию адсорбироваться на твердой поверхности неподвижной фазы, образуя неподвижный связанный (водный) слой, который, как считается, играет активную роль в удерживании. Такое поведение несколько характерно для нормально-фазовой хроматографии, поскольку оно регулируется почти исключительно адсорбционным механизмом ( т.е. аналиты взаимодействуют с твердой поверхностью, а не с сольватированным слоем лиганда, прикрепленного к поверхности сорбента; см. также обращенно-фазовую ВЭЖХ ниже). ). Адсорбционная хроматография до сих пор в некоторой степени используется для разделения структурных изомеров как в формате колоночной, так и в тонкослойной хроматографии на активированных (высушенных) носителях из диоксида кремния или оксида алюминия. [ нужна ссылка ]
Распределительная и NP-ВЭЖХ вышли из моды в 1970-х годах с развитием обращенно-фазовой ВЭЖХ из-за плохой воспроизводимости времен удерживания из-за присутствия слоя воды или протонного органического растворителя на поверхности из диоксида кремния или оксида алюминия хроматографических сред . . Этот слой изменяется при любых изменениях состава подвижной фазы ( например , уровня влажности), вызывая дрейф времени удерживания. [ нужна ссылка ]
В последнее время распределительная хроматография снова стала популярной благодаря разработке хилик- связанных фаз, которые демонстрируют улучшенную воспроизводимость, а также благодаря лучшему пониманию диапазона полезности этого метода.
Вытеснительная хроматография
[ редактировать ]Использование вытеснительной хроматографии довольно ограничено и в основном используется для препаративной хроматографии. Основной принцип основан на молекуле с высоким сродством к хроматографической матрице (вытеснитель), которая используется для эффективной конкуренции за места связывания и, таким образом, вытесняет все молекулы с меньшим сродством. [25] Существуют явные различия между вытеснительной и элюционной хроматографией. В режиме элюирования вещества обычно выходят из колонки в виде узких гауссовских пиков. Для достижения максимальной очистки желательно широкое разделение пиков, предпочтительно до базовой линии. Скорость, с которой любой компонент смеси перемещается по колонке в режиме элюирования, зависит от многих факторов. Но для того, чтобы два вещества двигались с разной скоростью и, таким образом, растворялись, должны существовать существенные различия во взаимодействии между биомолекулами и хроматографической матрицей. Рабочие параметры корректируются так, чтобы максимизировать эффект этой разницы. Во многих случаях разделение пиков по базовой линии может быть достигнуто только при градиентном элюировании и низкой загрузке колонки. Таким образом, двумя недостатками элюционной хроматографии, особенно в препаративном масштабе, являются сложность эксплуатации из-за градиентной перекачки растворителя и низкая пропускная способность из-за низкой загрузки колонки. Вытесняющая хроматография имеет преимущества перед элюционной хроматографией в том, что компоненты разделяются на последовательные зоны чистых веществ, а не на «пики». Поскольку в этом процессе используется нелинейность изотерм, на данной колонке можно разделить большее количество сырья, при этом очищенные компоненты извлекаются при значительно более высокой концентрации. [ нужна ссылка ]
Обращенно-фазовая жидкостная хроматография (RP-LC)
[ редактировать ]
Обращенно-фазовая ВЭЖХ (ОФ-ВЭЖХ) [26] является наиболее распространенным методом хроматографии. Он имеет неполярную неподвижную фазу и водную умеренно полярную подвижную фазу. В обращенно-фазовых методах вещества удерживаются в системе, тем более гидрофобными они являются. Для удержания органических веществ неподвижные фазы, упакованные внутри колонн, состоят в основном из пористых гранул силикагеля различной формы, преимущественно сферической, разного диаметра (1,5, 2, 3, 5, 7, 10 мкм), с различным диаметром пор (60, 100, 150, 300, А), на поверхности которых химически связаны различные углеводородные лиганды, такие как С3, С4, С8, С18. Существуют также полимерные гидрофобные частицы, служащие неподвижной фазой, когда необходимы растворы с экстремальными значениями pH, или гибридный кремнезем, полимеризующийся с органическими веществами. Чем дольше углеводородный лиганд находится в неподвижной фазе, тем дольше могут сохраняться компоненты пробы. В большинстве современных методов разделения биомедицинских материалов используются колонки типа C-18, иногда называемые торговыми названиями, такими как ODS (октадецилсилан) или RP-18 (обратная фаза 18).
Наиболее распространенные стационарные фазы RP основаны на кремнеземном носителе, поверхность которого модифицирована путем связывания RMe 2 SiCl, где R представляет собой алкильную группу с прямой цепью, такую как C 18 H 37 или C 8 H 17 .
В таких стационарных фазах время удерживания липофильных молекул больше, тогда как полярные молекулы элюируются легче (появляются на ранних стадиях анализа). Хроматограф может увеличить время удерживания, добавляя больше воды в подвижную фазу, тем самым делая взаимодействие гидрофобного аналита с гидрофобной неподвижной фазой относительно более сильным. Аналогичным образом исследователь может уменьшить время удерживания, добавив к подвижной фазе больше органического растворителя. ОФ-ВЭЖХ настолько широко используется биологами и специалистами в области медико-биологических наук, что ее часто ошибочно называют просто «ВЭЖХ» без дальнейших уточнений. Фармацевтическая промышленность также регулярно использует ОФ-ВЭЖХ для квалификации лекарств перед их выпуском. [ нужна ссылка ]
ОФ-ВЭЖХ работает на принципе гидрофобных взаимодействий, который обусловлен высокой симметрией диполярной структуры воды и играет важнейшую роль во всех процессах в науках о жизни. ОФ-ВЭЖХ позволяет измерить эти взаимодействующие силы. Связывание аналита с неподвижной фазой пропорционально площади поверхности контакта вокруг неполярного сегмента молекулы аналита при ассоциации с лигандом на неподвижной фазе. В этом сольвофобном эффекте преобладает сила воды, способствующая «уменьшению полостей» вокруг аналита и C 18 -цепи по сравнению с комплексом обоих. Энергия, выделяющаяся при этом процессе, пропорциональна поверхностному натяжению элюента (вода: 7,3 × 10 −6 Дж /см 2 , метанол: 2,2 × 10 −6 Дж/см 2 ) и к гидрофобной поверхности аналита и лиганда соответственно. Удерживание можно уменьшить, добавив в подвижную фазу менее полярный растворитель (метанол, ацетонитрил ) для уменьшения поверхностного натяжения воды. Градиентное элюирование использует этот эффект, автоматически уменьшая полярность и поверхностное натяжение водной подвижной фазы в ходе анализа.
Структурные свойства молекулы аналита могут играть важную роль в ее характеристиках удерживания. Теоретически аналит с большей площадью гидрофобной поверхности (C–H, C–C и, как правило, неполярными атомными связями, такими как SS и другие) может удерживаться дольше, поскольку он не взаимодействует со структурой воды. С другой стороны, аналиты с более высокой площадью полярной поверхности (в результате присутствия полярных групп, таких как -OH, -NH 2 , COO − или -NH 3 + в своей структуре) меньше сохраняются, так как лучше интегрируются в воду. На взаимодействие с неподвижной фазой также могут влиять стерические эффекты или эффекты исключения, при которых компонент очень большой молекулы может иметь лишь ограниченный доступ к порам неподвижной фазы, где происходят взаимодействия с поверхностными лигандами (алкильными цепями). Такое поверхностное препятствие обычно приводит к меньшему удерживанию.
Время удерживания увеличивается с увеличением гидрофобной (неполярной) площади поверхности молекул. Например, соединения с разветвленной цепью могут элюироваться быстрее, чем соответствующие им линейные изомеры, поскольку их общая площадь поверхности меньше. Точно так же органические соединения с одинарными связями C–C часто элюируются позже, чем соединения с C=C или даже тройной связью, поскольку двойная или тройная связь делает молекулу более компактной, чем одинарная связь C–C.
подвижной фазы Другим важным фактором является pH , поскольку он может изменить гидрофобный характер ионизируемого аналита. По этой причине в большинстве методов используется буферный агент , такой как фосфат натрия для контроля pH . Буферы служат нескольким целям: контроль pH, который влияет на состояние ионизации ионизируемых аналитов, влияет на заряд ионизируемой поверхности кремнезема неподвижной фазы между линантами связанной фазы, а в некоторых случаях даже действуют как агенты ионного спаривания для нейтрализации аналита. заряжать. Формиат аммония обычно добавляют в масс-спектрометрию для улучшения обнаружения определенных аналитов за счет образования аддуктов аналит-аммоний . Летучую органическую кислоту, такую как уксусная кислота или чаще всего муравьиная кислота , часто добавляют к подвижной фазе, если для анализа стоков колонки используется масс-спектрометрия.
Трифторуксусная кислота (ТФУ) в качестве добавки к подвижной фазе широко используется для сложных смесей биомедицинских образцов, в основном пептидов и белков, с использованием преимущественно УФ-детекторов. Их редко используют в методах масс-спектрометрии из-за остатков, которые они могут оставлять в детекторе и системе подачи растворителя, которые мешают анализу и обнаружению. Однако TFA может быть очень эффективным для улучшения удерживания аналитов, таких как карбоновые кислоты , в приложениях, использующих другие детекторы, такие как UV-VIS, поскольку это довольно сильная органическая кислота. Эффекты кислот и буферов различаются в зависимости от применения, но обычно улучшают хроматографическое разрешение при работе с ионизируемыми компонентами.
Колонки с обращенной фазой довольно трудно повредить по сравнению с обычными колонками с силикагелем благодаря экранирующему эффекту связанных гидрофобных лигандов; однако большинство колонок с обращенной фазой состоят из частиц диоксида кремния, модифицированных алкилом, и склонны к гидролизу диоксида кремния при экстремальных условиях pH в подвижной фазе. Большинство типов колонок с ОФ не следует использовать с водными основаниями , поскольку они гидролизуют лежащие под ними частицы кремнезема и растворяют их. Существуют выбранные марки частиц гибридного или усиленного диоксида кремния для колонок с ОФ, которые можно использовать в условиях экстремального pH. Использование экстремально кислых условий также не рекомендуется, так как они также могут гидролизовать и разъедать внутренние стенки металлических частей оборудования для ВЭЖХ.
Как правило, в большинстве случаев колонки ОФ-ВЭЖХ следует промывать чистым растворителем после использования для удаления остаточных кислот или буферов и хранить в растворителе соответствующего состава. Некоторые биомедицинские применения требуют неметаллической среды для оптимального разделения. Для таких чувствительных случаев существует тест на содержание металлов в колонке, заключающийся в вводе образца, представляющего собой смесь 2,2'- и 4,4'- бипиридина . Поскольку 2,2'-бипи может хелатировать металл, форма пика 2,2'-бипи будет искажена (хвостовая), когда металла ионы присутствуют на поверхности кремнезема . [ нужна ссылка ] ..
Эксклюзионная хроматография
[ редактировать ]Эксклюзионная хроматография ( SEC ) [27] разделяет молекулы полимера и биомолекулы частицы на основе различий в их молекулярном размере (фактически по радиусу Стокса ). Процесс разделения основан на способности молекул пробы проникать через поры гелевых сфер, упакованных внутри колонки, и зависит от относительного размера молекул аналита и соответствующего размера пор абсорбента. Этот процесс также основан на отсутствии каких-либо взаимодействий с поверхностью насадочного материала.
Обычно называют два типа SEC:
- Гель-проникающая хроматография (ГПХ) — разделение синтетических полимеров (водорастворимых или органорастворимых). ГПХ — мощный метод определения характеристик полимеров с использованием преимущественно органических растворителей.
- Гель-фильтрационная хроматография (ГФХ) — разделение водорастворимых биополимеров. GFC использует в основном водные растворители (обычно для водорастворимых биополимеров, таких как белки и т. д.).
Принцип разделения в ЭХ основан на полном или частичном проникновении высокомолекулярных веществ пробы в пористые частицы неподвижной фазы при их транспортировке через колонку. Элюент подвижной фазы выбран таким образом, чтобы полностью исключить взаимодействие с поверхностью неподвижной фазы. В этих условиях, чем меньше размер молекулы, тем больше она способна проникнуть внутрь порового пространства и движение по колонке занимает больше времени. С другой стороны, чем больше размер молекулы, тем выше вероятность, что молекула не полностью проникнет в поры неподвижной фазы, а даже будет путешествовать вокруг них и, таким образом, будет элюирована раньше. Молекулы разделяются в порядке убывания молекулярной массы: самые крупные молекулы элюируются из колонки первыми, а молекулы меньшего размера элюируются позже. Молекулы, размер которых превышает размер пор, вообще не проникают в поры и элюируются вместе, образуя первый пик на хроматограмме, и это называется общим объемом исключения, который определяет предел исключения для конкретной колонки. Малые молекулы полностью проникнут через поры частиц неподвижной фазы и будут элюироваться последними, отмечая конец хроматограммы, и могут выступать в качестве маркера полного проникновения.
В биомедицинских науках ее обычно рассматривают как хроматографию низкого разрешения, и поэтому ее часто используют для заключительного, «полирующего» этапа очистки. Это также полезно для определения третичной структуры и четвертичной структуры очищенных белков. SEC используется в основном для анализа больших молекул, таких как белки или полимеры. SEC работает также препаративным путем, улавливая более мелкие молекулы в порах частиц. Более крупные молекулы просто проходят мимо пор, поскольку они слишком велики, чтобы войти в поры. Таким образом, более крупные молекулы проходят через колонку быстрее, чем более мелкие молекулы: то есть, чем меньше молекула, тем дольше время удерживания.
Этот метод широко используется для определения молекулярной массы полисахаридов. SEC — это официальный метод (предложенный Европейской фармакопеей) для сравнения молекулярной массы различных коммерчески доступных низкомолекулярных гепаринов . [28]
Ионообменная хроматография
[ редактировать ]Ионообменная хроматография ( ИЭК ) или ионная хроматография ( ИК ) [29] представляет собой аналитический метод разделения и определения ионных растворенных веществ в водных пробах из окружающей среды и промышленных источников, таких как металлургическая промышленность, промышленные сточные воды, в биологических системах, фармацевтических образцах, продуктах питания и т. д. Удерживание основано на притяжении между ионами растворенных веществ и заряженные участки, связанные со стационарной фазой. Ионы растворенного вещества, заряженные так же, как ионы на колонке, отталкиваются и элюируются без удержания, в то время как ионы растворенного вещества, заряженные противоположно заряженным участкам колонки, удерживаются на ней. Ионы растворенного вещества, задерживающиеся на колонке, можно элюировать из нее путем изменения состава подвижной фазы, например увеличения концентрации ее солей и pH или повышения температуры колонки и т. д.
Типы ионообменников включают полистироловые смолы , целлюлозные и декстрановые ионообменники (гели), а также стекло с контролируемой пористостью или пористый силикагель . Полистирольные смолы допускают образование поперечных связей, что повышает стабильность цепи. Более высокая поперечная связь уменьшает отклонение, что увеличивает время установления равновесия и в конечном итоге улучшает селективность. Ионообменники целлюлозы и декстрана обладают более крупными размерами пор и низкой плотностью заряда, что делает их пригодными для разделения белков.
В целом ионообменники способствуют связыванию ионов с более высоким зарядом и меньшим радиусом.
Увеличение концентрации противоионов (по отношению к функциональным группам в смолах) уменьшает время удерживания, так как создает сильную конкуренцию ионам растворенного вещества. Снижение pH уменьшает время удерживания при катионном обмене, а увеличение pH уменьшает время удерживания при анионном обмене. Например, при понижении pH растворителя в катионообменной колонке появляется больше ионов водорода, которые могут конкурировать за позиции в анионной неподвижной фазе, тем самым элюируя слабосвязанные катионы.
Этот вид хроматографии широко используется в следующих приложениях: очистка воды, концентрирование микроэлементов, лигандообменная хроматография, ионообменная хроматография белков, высокорН- анионообменная хроматография углеводов и олигосахаридов и другие.
Биоаффинная хроматография
[ редактировать ]Высокоэффективная аффинная хроматография (HPAC) [30] Принцип работы заключается в пропускании раствора образца через колонку, заполненную неподвижной фазой, содержащей иммобилизованный биологически активный лиганд. Лиганд фактически представляет собой субстрат, обладающий специфическим сродством связывания с целевой молекулой в растворе образца. Молекула-мишень связывается с лигандом, в то время как другие молекулы раствора пробы проходят через колонку, практически не задерживаясь. Затем целевую молекулу элюируют из колонки с использованием подходящего элюирующего буфера.
Этот хроматографический процесс основан на способности связанных активных веществ образовывать стабильные, специфические и обратимые комплексы благодаря их биологическому распознаванию определенных конкретных компонентов образца. В образовании этих комплексов участвуют общие молекулярные силы, такие как взаимодействие Ван-дер-Ваальса , электростатическое взаимодействие, диполь-дипольное взаимодействие, гидрофобное взаимодействие и водородная связь. Эффективная биоспецифическая связь образуется в результате одновременного и согласованного действия нескольких из этих сил в дополнительных сайтах связывания.
Водная нормально-фазовая хроматография
[ редактировать ]Водную нормально-фазовую хроматографию ( ANP ) также называют жидкостной хроматографией гидрофильного взаимодействия ( HILIC ). [31] Это хроматографический метод, который охватывает область подвижной фазы между обращенно-фазовой хроматографией (RP) и органической нормально-фазовой хроматографией (ONP). HILIC используется для достижения уникальной селективности в отношении гидрофильных соединений. [32] показывающий нормальный порядок элюирования фаз с использованием «растворителей с обращенной фазой», т.е. относительно полярных, в основном неводных растворителей в подвижной фазе. [31] Многие биологические молекулы, особенно те, которые содержатся в биологических жидкостях, представляют собой небольшие полярные соединения, которые плохо удерживаются при помощи обращенно-фазовой ВЭЖХ. Это сделало ЖХ гидрофильного взаимодействия (HILIC) привлекательной альтернативой и полезным подходом для анализа полярных молекул. Кроме того, поскольку HILIC обычно используется с традиционными водными смесями с полярными органическими растворителями, такими как ACN и метанол, его можно легко сочетать с МС. [32]
Изократическое и градиентное элюирование
[ редактировать ]
Разделение, при котором состав подвижной фазы остается постоянным на протяжении всей процедуры, называется изократическим (что означает постоянный состав ). Это слово было придумано Чабой Хорватом , одним из пионеров ВЭЖХ. [33] [34]
Состав подвижной фазы не обязательно должен оставаться постоянным. Разделение, при котором состав подвижной фазы изменяется в процессе разделения, описывается как градиентное элюирование . [35] [36] Например, градиент может начинаться при 10% метанола в воде и заканчиваться при 90% метанола в воде через 20 минут. Два компонента подвижной фазы обычно обозначаются «А» и «В»; A — «слабый» растворитель, который позволяет растворенному веществу элюироваться лишь медленно, тогда как B — «сильный» растворитель, который быстро элюирует растворенные вещества из колонки. В обращенно-фазовой хроматографии растворителем А часто является вода или водный буфер, а В — органический растворитель, смешивающийся с водой, такой как ацетонитрил , метанол, ТГФ или изопропанол .
При изократическом элюировании ширина пика увеличивается со временем удерживания линейно в соответствии с уравнением для N, количества теоретических тарелок. Это может быть серьезным недостатком при анализе пробы, содержащей аналиты с широким диапазоном коэффициентов удерживания. При использовании более слабой подвижной фазы время анализа увеличивается, что приводит к тому, что медленно элюируемые пики становятся широкими, что приводит к снижению чувствительности. Более сильная подвижная фаза улучшит время анализа и уширит более поздние пики, но приведет к уменьшению разделения пиков, особенно для быстро элюируемых аналитов, у которых может быть недостаточно времени для полного разделения. Эта проблема решается путем изменения состава подвижной фазы градиентного элюирования.

Начиная с более слабой подвижной фазы и усиливая ее во время анализа, градиентное элюирование уменьшает удерживание элюируемых позже компонентов, так что они элюируются быстрее, давая более узкие (и более высокие) пики для большинства компонентов, а также позволяя адекватно разделить ранее элюирующиеся компоненты. Это также улучшает форму хвостатых пиков, поскольку возрастающая концентрация органического элюента сдвигает хвостовую часть пика вперед. Это также увеличивает высоту пика (пик выглядит «острее»), что важно при анализе следов. Программа градиента может включать внезапное «ступенчатое» увеличение процентного содержания органического компонента или различные наклоны в разное время – все в соответствии с желанием оптимального разделения за минимальное время.
При изократическом элюировании порядок удерживания не меняется при изменении размеров колонки (длины и внутреннего диаметра), то есть пики элюируются в одном и том же порядке. Однако при градиентном элюировании порядок элюирования может меняться по мере изменения размеров или скорости потока. если они не уменьшены или увеличены в соответствии с изменением [37]
Движущая сила обращенно-фазовой хроматографии зарождается в структуре воды высокого порядка. Роль органического компонента подвижной фазы заключается в уменьшении этого высокого порядка и, таким образом, уменьшении замедляющей силы водного компонента.
Параметры
[ редактировать ]Теоретический
[ редактировать ]Теория высокоэффективной жидкостной хроматографии-ВЭЖХ по своей сути аналогична общей теории хроматографии. [38] Эта теория использовалась в качестве основы для испытаний на пригодность системы , как можно увидеть в Фармакопее USP: [39] которые представляют собой набор количественных критериев, проверяющих пригодность системы ВЭЖХ для требуемого анализа на любом его этапе.
Это соотношение также представлено как нормализованный безразмерный коэффициент, известный как коэффициент удержания или параметр удержания, который является экспериментальным измерением коэффициента емкости, как также показано на рисунке критериев производительности. t R — время удерживания конкретного компонента, а t 0 — время, необходимое неудерживаемому веществу для элюирования через систему без какого-либо удерживания, поэтому оно называется временем пустоты.
Отношение коэффициентов удерживания k' каждых двух соседних пиков на хроматограмме используется для оценки степени разделения между ними и называется коэффициентом селективности α, как показано на графике критериев эффективности.
Число тарелок N как критерий эффективности системы было разработано для изократических условий, т.е. постоянного состава подвижной фазы на протяжении всего опыта. В градиентных условиях, когда подвижная фаза изменяется во времени в ходе хроматографического анализа, более целесообразно использовать параметр пиковой емкости P c в качестве меры эффективности системы. [40] Определение пиковой емкости в хроматографии — это количество пиков, которые можно разделить в пределах окна удерживания для определенного заранее определенного коэффициента разрешения, обычно ~ 1. Его также можно представить как время выполнения, измеряемое количеством средней ширины пиков. Уравнение показано на рисунке критериев эффективности. В этом уравнении tg — время градиента, а w(ave) — средняя ширина пиков у основания.

Параметры в значительной степени получены из двух наборов хроматографической теории: теории пластинок (как часть распределительной хроматографии ) и теории скоростей хроматографии / уравнения Ван Деемтера . Конечно, их можно применить на практике путем анализа хроматограмм ВЭЖХ, хотя теория скоростей считается более точной теорией.
Они аналогичны расчету коэффициента удерживания для разделения с помощью бумажной хроматографии , но описывают, насколько хорошо ВЭЖХ разделяет смесь на два или более компонентов, которые обнаруживаются в виде пиков (полос) на хроматограмме. Параметрами ВЭЖХ являются: коэффициент эффективности ( N ), коэффициент удерживания (каппа-штрих) и коэффициент разделения (альфа). Вместе эти факторы являются переменными в уравнении разрешения, которое описывает, насколько хорошо пики двух компонентов разделяются или перекрываются друг с другом. Эти параметры в основном используются только для описания обращенно-фазового разделения ВЭЖХ и нормального фазового разделения ВЭЖХ, поскольку эти разделения имеют тенденцию быть более тонкими, чем другие режимы ВЭЖХ ( например , ионный обмен и исключение размера).
Пустой объем — это объем пространства в колонне, занимаемый растворителем. Это пространство внутри колонны, находящееся за пределами внутреннего упаковочного материала колонны. Объем пустот измеряется на хроматограмме по первому обнаруженному пику компонента, которым обычно является растворитель, присутствующий в смеси проб; в идеале растворитель пробы течет через колонку, не взаимодействуя с колонкой, но все же его можно обнаружить в отличие от растворителя ВЭЖХ. Объем пустот используется в качестве поправочного коэффициента.
Коэффициент эффективности ( N ) практически измеряет, насколько резкими являются пики компонентов на хроматограмме, как отношение площади пика компонента («времени удерживания») к ширине пиков в их самом широком месте (на базовой линии). Высокие, острые и относительно узкие пики указывают на то, что метод разделения эффективно удаляет компонент из смеси; высокая эффективность. Эффективность во многом зависит от колонки ВЭЖХ и используемого метода ВЭЖХ. Коэффициент эффективности является синонимом количества пластин и «количества теоретических пластин».
Коэффициент удерживания ( каппа-прайм ) измеряет, как долго компонент смеси прилипает к колонке, измеряется площадью под кривой его пика на хроматограмме (поскольку хроматограммы ВЭЖХ являются функцией времени). Каждый пик хроматограммы будет иметь свой собственный коэффициент удерживания ( например , каппа 1 для коэффициента удерживания первого пика). Этот фактор можно скорректировать за счет пустого объема колонны.
Коэффициент разделения ( альфа ) представляет собой относительное сравнение того, насколько хорошо были разделены два соседних компонента смеси ( т. е . две соседние полосы на хроматограмме). Этот коэффициент определяется как соотношение коэффициентов удерживания пары соседних пиков хроматограммы и может быть также скорректирован с учетом пустотного объема колонки. Чем больше значение коэффициента разделения превышает 1,0, тем лучше разделение, вплоть до примерно 2,0, после которого метод ВЭЖХ, вероятно, не требуется для разделения.Уравнения разрешения связывают три фактора таким образом, что высокая эффективность и коэффициенты разделения улучшают разрешение пиков компонентов при разделении ВЭЖХ.
Внутренний диаметр
[ редактировать ]
Внутренний диаметр (ID) колонки ВЭЖХ является важным параметром. [41] При его уменьшении он может влиять на реакцию обнаружения из-за уменьшения боковой диффузии полосы растворенного вещества. Это также может повлиять на селективность разделения, когда скорость потока и объемы впрыска не уменьшаются или увеличиваются пропорционально меньшему или большему используемому диаметру как в изократическом, так и в градиентном режимах. [42] Он определяет количество аналита, которое можно загрузить в колонку. Колонки большего диаметра обычно используются в препаративных целях, например, при очистке лекарственного препарата для последующего использования. [43] Колонки с низким ID обладают улучшенной чувствительностью и меньшим потреблением растворителя в новейшей ультравысокоэффективной жидкостной хроматографии (УВЭЖХ). [44]
Колонки с большим внутренним диаметром (более 10 мм) используются для очистки полезного количества материала из-за их большой вместимости.
Колонки с аналитической шкалой (4,6 мм) были наиболее распространенным типом колонок, хотя колонки были более узкими. [44] стремительно набирают популярность. Они используются в традиционном количественном анализе образцов и часто используют детектор поглощения УФ-ВИД .
Колонки с узким отверстием (1–2 мм) используются для применений, когда требуется большая чувствительность либо с помощью специальных детекторов УФ-ВИД, флуоресцентного обнаружения, либо с другими методами обнаружения, такими как жидкостная хроматография-масс-спектрометрия.
Капиллярные колонки (менее 0,3 мм) используются почти исключительно с альтернативными средствами обнаружения, такими как масс-спектрометрия . Обычно они изготавливаются из капилляров из плавленого кварца , а не из трубок из нержавеющей стали, которые используются в более крупных колонках.
Размер частиц
[ редактировать ]В большинстве традиционных ВЭЖХ неподвижная фаза прикреплена к внешней стороне небольших сферических частиц кремнезема (очень маленьких шариков). Эти частицы бывают разных размеров, наиболее распространенными являются шарики размером 5 мкм. Частицы меньшего размера обычно обеспечивают большую площадь поверхности и лучшее разделение, но давление, необходимое для оптимальной линейной скорости, увеличивается пропорционально квадрату диаметра частиц. [45] [46] [47]
Согласно уравнениям [48] скорости колонки, эффективности и противодавления , уменьшение диаметра частиц вдвое и сохранение размера колонки тем же самым удвоит скорость и эффективность колонки; но в четыре раза увеличить противодавление. ВЭЖХ с мелкими частицами также может уменьшить расширение ширины. [49] Частицы большего размера используются в препаративной ВЭЖХ (диаметр колонки от 5 см до >30 см) и в других приложениях, не связанных с ВЭЖХ, таких как твердофазная экстракция .
Размер пор
[ редактировать ]Многие неподвижные фазы являются пористыми, что обеспечивает большую площадь поверхности. Маленькие поры обеспечивают большую площадь поверхности, тогда как поры большего размера имеют лучшую кинетику, особенно для более крупных аналитов. Например, белок, размер которого лишь немного меньше поры, может войти в пору, но с трудом выходит из нее.
Давление насоса
[ редактировать ]Насосы различаются по напорной способности, но их производительность измеряется их способностью обеспечивать постоянный и воспроизводимый объемный расход . Давление может достигать 60 МПа (6000 фунтов силы/дюйм). 2 ), или около 600 атмосфер. Современные системы ВЭЖХ были улучшены для работы при гораздо более высоких давлениях и, следовательно, могут использовать в колонках частицы гораздо меньшего размера (<2 мкм). Эти системы «сверхвысокоэффективной жидкостной хроматографии» или УВЭЖХ, которые также могут быть известны как системы хроматографии сверхвысокого давления, [50] может работать при давлении до 120 МПа (17 405 фунт-сила/дюйм). 2 ), или около 1200 атмосфер. [51] Термин «УПЛК» [52] является торговой маркой Waters Corporation , но иногда используется для обозначения более общего метода УВЭЖХ.
Детекторы
[ редактировать ]Детекторы ВЭЖХ делятся на две основные категории: универсальные и селективные. Универсальные детекторы обычно измеряют объемное свойство ( например , показатель преломления ) путем измерения разницы физических свойств между подвижной фазой и подвижной фазой растворенного вещества, в то время как селективные детекторы измеряют свойство растворенного вещества ( например , поглощение в УФ-видимом диапазоне ), просто реагируя на физическое или химическое свойство растворенного вещества. [53] В ВЭЖХ чаще всего используется детектор поглощения УФ-Вид ; широкий спектр других хроматографических детекторов однако можно использовать . Универсальным детектором, дополняющим обнаружение поглощения УФ-Вид, является детектор заряженного аэрозоля (CAD). К типу обычно используемых детекторов относятся детекторы показателя преломления, которые обеспечивают показания путем измерения изменений показателя преломления элюента по мере его движения через проточную кювету. В некоторых случаях можно использовать несколько детекторов, например, LCMS обычно сочетает УФ-Вид с масс-спектрометром.
При использовании с электрохимическим детектором (ЭХД) ВЭЖХ-ЭХД выборочно обнаруживает нейротрансмиттеры , такие как норадреналин , дофамин , серотонин , глутамат , ГАМК, ацетилхолин и другие, в исследовательских приложениях нейрохимического анализа. [54] ВЭЖХ-ECD обнаруживает нейротрансмиттеры в фемтомолярном диапазоне. Другие методы обнаружения нейромедиаторов включают жидкостную хроматографию-масс-спектрометрию, ELISA или радиоиммуноанализы.
Автосамплеры
[ редактировать ]Большое количество образцов можно автоматически вводить в систему ВЭЖХ с помощью автосамплеров ВЭЖХ. Кроме того, автосамплеры ВЭЖХ имеют одинаковый объем и технику впрыска для каждой инъекции, следовательно, они обеспечивают высокую степень точности объема впрыска.Можно обеспечить перемешивание пробы внутри камеры для отбора проб, тем самым обеспечивая гомогенность. [55]
Приложения
[ редактировать ]Производство
[ редактировать ]ВЭЖХ имеет множество применений как в лабораторных, так и в клинических науках. Это распространенный метод, используемый при разработке фармацевтических препаратов, поскольку это надежный способ получения и обеспечения чистоты продукта. [56] Хотя ВЭЖХ позволяет производить (чистые) продукты чрезвычайно высокого качества, она не всегда является основным методом, используемым при производстве нерасфасованных лекарственных материалов. [57] По данным Европейской фармакопеи, ВЭЖХ используется лишь в 15,5% синтезов. [58] Однако он играет роль в 44% синтезов в фармакопее США. [59] Возможно, это связано с различиями в денежных и временных ограничениях, поскольку ВЭЖХ в больших масштабах может быть дорогостоящим методом. К сожалению, повышение специфичности и точности, которое происходит при использовании ВЭЖХ, соответствует увеличению стоимости.
Юридический
[ редактировать ]Этот метод также используется для обнаружения запрещенных наркотиков в различных образцах. [60] Наиболее распространенным методом обнаружения наркотиков был иммуноанализ . [61] Этот метод гораздо удобнее. Однако за удобство приходится платить ценой специфичности и охвата широкого спектра лекарств, поэтому в качестве альтернативного метода использовалась ВЭЖХ. Поскольку ВЭЖХ является методом определения (и, возможно, повышения) чистоты, использование только ВЭЖХ для оценки концентрации лекарств было несколько недостаточным. Поэтому ВЭЖХ в этом контексте часто выполняется в сочетании с масс-спектрометрией . [62] Использование жидкостной хроматографии-масс-спектрометрии (ЖХ-МС) вместо газовой хроматографии-масс-спектрометрии (ГХ-МС) позволяет избежать необходимости деривитизации с помощью ацетилирующих или алкилирующих агентов, что может быть обременительным дополнительным этапом. [63] ЖХ-МС использовалась для обнаружения различных агентов, таких как допинговые вещества, метаболиты лекарств, конъюгаты глюкуронидов, амфетамины, опиоиды, кокаин, БЗД, кетамин, ЛСД, каннабис и пестициды. [64] [65] Выполнение ВЭЖХ в сочетании с масс-спектрометрией снижает абсолютную потребность в стандартизации экспериментальных циклов ВЭЖХ.
Исследовать
[ редактировать ]Подобные анализы можно проводить в исследовательских целях, определяя концентрации потенциальных клинических кандидатов, таких как противогрибковые и противоастматические препараты. [66] Этот метод, очевидно, также полезен при наблюдении нескольких видов в собранных образцах, но требует использования стандартных решений при поиске информации об идентичности видов. Его используют как метод подтверждения результатов реакций синтеза, поскольку в этом типе исследований важна чистота. Однако масс-спектрометрия по-прежнему остается более надежным способом идентификации видов.
Медицинские и медицинские науки
[ редактировать ]При медицинском использовании ВЭЖХ в качестве детектора обычно используется масс-спектрометр (МС), поэтому этот метод называется ЖХ-МС. [67] или ЖХ-МС/МС для тандемной МС, где два типа МС работают последовательно. [68] Когда прибор ВЭЖХ подключен к более чем одному детектору, его называют системой ЖХ с дефисом. [ нужна ссылка ] Фармацевтическое применение [69] являются основными пользователями ВЭЖХ, ЖХ-МС и ЖХ-МС/МС. [70] Это включает в себя разработку лекарств [71] и фармакология, которая является научным исследованием воздействия лекарств и химических веществ на живые организмы, [72] персонализированная медицина, [73] общественное здравоохранение [74] [75] и диагностика. [76] Хотя моча является наиболее распространенной средой для анализа концентрации лекарств, сыворотка крови является образцом, собираемым для большинства медицинских анализов с помощью ВЭЖХ. [77] Одной из наиболее важных ролей ЖХ-МС и ЖХ-МС/МС в клинической лаборатории является скрининг новорожденных (NBS) на предмет метаболических нарушений. [78] и последующая диагностика. [79] [80] Образцы младенцев имеют форму высохших пятен крови (DBS). [81] который легко подготовить и транспортировать, что обеспечивает безопасную и доступную диагностику как на местном, так и на глобальном уровне.
Другие методы обнаружения молекул, полезные для клинических исследований, были протестированы с помощью ВЭЖХ, а именно иммуноанализы. В одном из примеров сравнивались анализы конкурентного связывания белков (CPBA) и ВЭЖХ по чувствительности при обнаружении витамина D. Было обнаружено, что чувствительность и специфичность этого метода CPBA, полезного для диагностики дефицита витамина D у детей, достигали только 40% и 60%. % соответственно от емкости ВЭЖХ. [82] Несмотря на то, что это дорогой инструмент, точность ВЭЖХ практически не имеет себе равных.
См. также
[ редактировать ]- История хроматографии
- Капиллярная электрохроматография
- Колоночная хроматография
- Чаба Хорват
- Ионная хроматография
- Мицеллярная жидкостная хроматография
Ссылки
[ редактировать ]- ^ Казакевич Юрий; ЛоБрутто, Розарио, ред. (2007). ВЭЖХ для ученых-фармацевтов . Хобокен, Нью-Джерси: Wiley-Interscience. ISBN 978-0-471-68162-5 .
- ^ Jump up to: а б «Хроматография» . web.njit.edu . Проверено 5 августа 2024 г.
- ^ Чайтали Даттатрай Харде1, доктор Амол Навнатх Хедкар, Вайшнави Санджай Саке. «Обзор высокоэффективной жидкостной хроматографии» (PDF) .
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Левин, Суламит (январь 2004 г.). «Обращенно-фазовые стационарные фазы в фармацевтических науках» . Журнал жидкостной хроматографии и родственных технологий . 27 (7–9): 1353–1376. дои : 10.1081/JLC-120030606 . ISSN 1082-6076 . S2CID 97490509 .
- ^ Гербер, Ф.; Круммен, М.; Потгетер, Х.; Рот, А.; Сифрин, К.; Спендлин, К. (2004). «Практические аспекты быстрой высокоэффективной жидкостной хроматографии с обращенной фазой с использованием колонок с насадкой частиц 3 мкм и монолитных колонок при разработке и производстве фармацевтических препаратов в соответствии с современной надлежащей производственной практикой». Журнал хроматографии А. 1036 (2): 127–133. дои : 10.1016/j.chroma.2004.02.056 . ПМИД 15146913 .
- ^ Бейн, Ширли; Карлин, Мишель (2017). Судебно-медицинское применение высокоэффективной жидкостной хроматографии (1-е изд.). ЦРК Пресс. ISBN 9780429251962 .
- ^ Сегер, Кристоф; Зальцманн, Линда (01 августа 2020 г.). «Спустя еще десять лет: ЖХ-МС/МС стала рутиной в клинической диагностике» . Клиническая биохимия . Развитие и применение масс-спектрометрии в лабораторной медицине. 82 : 2–11. doi : 10.1016/j.clinbiochem.2020.03.004 . ISSN 0009-9120 . ПМИД 32188572 . S2CID 213186669 .
- ^ Унгер, К.К., изд. (1979-01-01), «Глава 5 Колонки с силикагелем - процедуры упаковки и рабочие характеристики» , Journal of Chromatography Library , vol. 16, Elsevier, стр. 169–186 , получено 5 августа 2024 г.
- ^ Сюй, Ян; Цао, Цин; Швец, Франтишек; Фреше, Жан MJ (15 апреля 2010 г.). «Пористая полимерная монолитная колонка со связанными с поверхностью наночастицами золота для захвата и разделения цистеинсодержащих пептидов» . Аналитическая химия . 82 (8): 3352–3358. дои : 10.1021/ac1002646 . ISSN 0003-2700 . ПМК 2875083 . ПМИД 20302345 .
- ^ Донг, Майкл (2018). «Десять здравого смысла в фармацевтическом анализе с помощью высокоэффективной жидкостной хроматографии» . LCGC Европа . LCGC Европа-01-08-2018. 31 (8): 432–436.
- ^ Снайдер, Ллойд Р.; Киркланд, Джозеф Дж.; Глайч, Джозеф Л. (2012). Практическая разработка метода ВЭЖХ (2-е изд.). Джон Уайли и сыновья.
- ^ Макмастер, Марвин С. (2007). ВЭЖХ: практическое руководство пользователя (2-е изд.). Хобокен, Нью-Джерси: Wiley-Interscience. ISBN 978-0-471-75401-5 .
- ^ Ханаи, Тошихико; Ханаи, Т. (1999). ВЭЖХ: практическое руководство . Монографии по хроматографии РСК. Королевское химическое общество. Кембридж: Королевское химическое общество. ISBN 978-0-85404-515-0 .
- ^ Jump up to: а б Каргер, Барри Л. (1997). «ВЭЖХ: ранние и недавние перспективы». Журнал химического образования . 74 (1): 45. Бибкод : 1997ЖЧЭд..74...45К . дои : 10.1021/ed074p45 .
- ^ Jump up to: а б с д и ж Генри, Ричард А. (1 февраля 2009 г.) «Первые дни ВЭЖХ в Dupont». Архивировано 1 августа 2020 г. в Wayback Machine . Хроматография онлайн. Аванстар Коммуникейшнз Инк.
- ^ Гиддингс, Кальвин (1965). Динамика хроматографии: принципы и теория . Марсель Деккер.
- ^ Jump up to: а б Левин, Суламит (2017). Гринберг, Нелу; Карр, Питер В. (ред.). Колонки с твердым сердечником или полностью пористые в сверхвысокоэффективной жидкостной хроматографии: какой путь выбрать для повышения эффективности разделения? . Достижения хроматографии. Том. 55 (1-е изд.). Бока-Ратон: CRC Press. стр. 185–203. ISBN 9781315158075 .
- ^ Илер, РК (1979) Химия кремнезема . Джон Уайли и сыновья. Нью-Йорк.
- ^ Каргер, БЛ; Берри, Л.В. (1971). «Быстрое жидкостно-хроматографическое разделение стероидов на колонках, сильно загруженных неподвижной фазой» . Клин. Хим . 17 (8): 757–64. дои : 10.1093/клинчем/17.8.757 . ПМИД 4254537 .
- ^ Нойе, Уве Д. (1997). Колонки ВЭЖХ: теория, технология и практика . Нью-Йорк, штат Нью-Йорк: Wiley VCH. ISBN 978-0-471-19037-0 .
- ^ Гиддингс, Дж. Кальвин (1965) Динамика хроматографии, Часть I. Принципы и теория . Марсель Деккер, Инк., Нью-Йорк. п. 281.
- ^ Эттре, К. (2001). «Вехи в хроматографии: рождение разделительной хроматографии» (PDF) . ЛКГК . 19 (5): 506–512. Архивировано из оригинала (PDF) 4 марта 2016 г. Проверено 26 февраля 2016 г.
- ^ Мартин, AJP; Synge, RLM (1941). «Разделение высших моноаминокислот методом противоточной жидкостно-жидкостной экстракции: аминокислотный состав шерсти» . Биохимический журнал . 35 (1–2): 91–121. дои : 10.1042/bj0350091 . ПМЦ 1265473 . ПМИД 16747393 .
- ^ Линдси, С.; Кили, Д. (1987). Высокоэффективная жидкостная хроматография . Уайли. ОСТИ 7013902 . из обзора Хунг, Л.Б.; Парчер, Дж. Ф.; Шорс, Джей Си; Уорд, Э.Х. (1988). «Теоретические и экспериментальные основы программирования покрытия поверхности в газотвердой хроматографии с адсорбируемым газом-носителем». Дж. Ам. хим. Соц . 110 (11): 1090–1096. дои : 10.1021/ac00162a003 .
- ^ Вытеснительная хроматография . Sacheminc.com. Проверено 7 июня 2011 г. Архивировано 15 сентября 2008 г. в Wayback Machine.
- ^ ЛоБрутто, Росарио; Казакевич, Юрий (22 января 2007 г.), Казакевич, Юрий; ЛоБрутто, Розарио (ред.), «Обращенно-фазовая ВЭЖХ» , ВЭЖХ для ученых-фармацевтов (1-е изд.), Wiley, стр. 139–239, doi : 10.1002/9780470087954.ch4 , ISBN 978-0-471-68162-5 , получено 10 октября 2023 г.
- ^ Казакевич Юрий; ЛоБрутто, Росарио (22 января 2007 г.), Казакевич Юрий; ЛоБрутто, Розарио (ред.), «Эксклюзионная хроматография» , ВЭЖХ для ученых-фармацевтов (1-е изд.), Wiley, стр. 263–279, doi : 10.1002/9780470087954.ch6 , ISBN 978-0-471-68162-5 , получено 10 октября 2023 г.
- ^ Маллой, Барбара; Хит, Алан; Шрайвер, Закари; Джеймисон, Фабиан; Аль Хаким, Али; Моррис, Тина С.; Саек, Анита Ю. (01 августа 2014 г.). «Сборник фармакопеи США по методам анализа гепарина: хроматографическое определение распределения молекулярной массы гепарина натрия» . Аналитическая и биоаналитическая химия . 406 (20): 4815–4823. дои : 10.1007/s00216-014-7940-3 . hdl : 1721.1/104914 . ISSN 1618-2650 . ПМИД 24958344 . S2CID 492085 .
- ^ Фриц, Джеймс С.; Гджерде, Дуглас Т. (25 апреля 2000 г.). Ионная хроматография (1-е изд.). Уайли. дои : 10.1002/9783527613243 . ISBN 978-3-527-29914-0 .
- ^ Чжан, Чэньхуа; Родригес, Эллиотт; Би, Конг; Чжэн, Сивэй; Суреш, Доддавенкатана; Су, Кьюнга; Ли, Чжао; Эльсебаи, Фавзи; Хейдж, Дэвид С. (2018). «Высокоэффективная аффинная хроматография и родственные методы разделения для анализа биологических и фармацевтических агентов» . Аналитик . 143 (2): 374–391. Бибкод : 2018Ана...143..374Z . дои : 10.1039/C7AN01469D . ISSN 1364-5528 . ПМК 5768458 . ПМИД 29200216 .
- ^ Jump up to: а б МакКолли, Дэвид В. (10 ноября 2017 г.). «Понимание и управление разделением в жидкостной хроматографии гидрофильного взаимодействия» . Журнал хроматографии А. 1523 : 49–71. дои : 10.1016/j.chroma.2017.06.026 . ISSN 1873-3778 . ПМИД 28668366 .
- ^ Jump up to: а б Бушевский, Богуслав; Нога, Сильвия (2012). «Жидкостная хроматография гидрофильного взаимодействия (HILIC) — мощный метод разделения» . Аналитическая и биоаналитическая химия . 402 (1): 231–247. дои : 10.1007/s00216-011-5308-5 . ISSN 1618-2650 . ПМЦ 3249561 . ПМИД 21879300 .
- ^ Шеллингер, Адам П.; Карр, Питер В. (2006). «Изократическая и градиентная элюционная хроматография: сравнение с точки зрения скорости, воспроизводимости удерживания и количественного анализа» . Журнал хроматографии А. 1109 (2): 253–266. дои : 10.1016/j.chroma.2006.01.047 . ПМИД 16460742 . S2CID 26072994 .
- ^ Эттре, Л.С.; Златкис А., ред. (1979), «Чаба Хорват» , Библиотека журнала хроматографии , 75 лет хроматографии как исторический диалог, том. 17, Elsevier, стр. 151–158, doi : 10.1016/s0301-4770(08)60645-4 , ISBN. 9780444417541 , получено 15 октября 2023 г.
- ^ Снайдер, Ллойд Р.; Долан, Джон В. (2006). Высокоэффективное градиентное элюирование: практическое применение модели линейной концентрации растворителя . Уайли Интерсайенс. ISBN 978-0470055519 .
- ^ Шеллингер, Адам П.; Карр, Питер В. (2006). «Изократическая и градиентная элюционная хроматография: сравнение с точки зрения скорости, воспроизводимости удерживания и количественного анализа» . Журнал хроматографии А. 19-й Международный симпозиум по микромасштабным биосепарациям. 1109 (2): 253–266. дои : 10.1016/j.chroma.2006.01.047 . ISSN 0021-9673 . ПМИД 16460742 . S2CID 26072994 .
- ^ Долан, Джон В. (2014). «Масштабирование метода ЖХ, Часть II: Градиентное разделение». LCGC Северная Америка . 32 (3): 188–193.
- ^ Мартин, AJP; Synge, RLM (1 декабря 1941 г.). «Новая форма хроматограммы с использованием двух жидких фаз» . Биохимический журнал . 35 (12): 1358–1368. дои : 10.1042/bj0351358 . ISSN 0306-3283 . ПМЦ 1265645 . ПМИД 16747422 .
- ^ https://www.usp.org/sites/default/files/usp/document/harmonization/gen-chapter/harmonization-november-2021-m99380.pdf [ только URL-адрес PDF ] , ХРОМАТОГРАФ, 4 этап Гармонизации (1 декабря 2022 г.)
- ^ Рен, Стивен AC (15 июня 2005 г.). «Пиковая емкость в градиентной ультраэффективной жидкостной хроматографии (UPLC)» . Журнал фармацевтического и биомедицинского анализа . 38 (2): 337–343. дои : 10.1016/j.jpba.2004.12.028 . ISSN 0731-7085 . ПМИД 15925228 .
- ^ Зеленянский, Дора; Фелингер, Аттила (01 октября 2020 г.). «Влияние оборудования колонки на эффективность жидкостной хроматографии (ЖХ)» . LCGC Европа . LCGC Европа-01.10.2020. 33 (10): 498–504.
- ^ Долан, Джон (2014). «Масштабирование метода ЖХ, Часть II: Градиентное разделение» . LCGC Северная Америка . LCGC Северная Америка-01.03.2014. 32 (3): 188–193.
- ^ Дженсен, Оле Эльванг; Кидаль, Штеффен (01 марта 2006 г.). «Использование объемного потока для масштабирования хроматографических процессов» . БиоФарм Интернешнл . BioPharm International-01.03.2006. 19 (3).
- ^ Jump up to: а б Уолтер, Томас Х.; Эндрюс, Ричард В. (2014). «Последние инновации в колонках и приборах для УВЭЖХ» . Тенденции в аналитической химии . 63 : 14–20. дои : 10.1016/j.trac.2014.07.016 . ISSN 0165-9936 .
- ^ Мэйджорс, Рональд Э.. (07.09.2010) Быстрая и сверхбыстрая ВЭЖХ на пористых частицах размером менее 2 мкм - куда нам идти дальше? – LC-GC Европа . Lcgceurope.com. Проверено 7 июня 2011 г.
- ^ Сян, Ю.; Лю Ю.; Ли МЛ (2006). «Жидкостная хроматография сверхвысокого давления с использованием повышенной температуры». Журнал хроматографии А. 1104 (1–2): 198–202. дои : 10.1016/j.chroma.2005.11.118 . ПМИД 16376355 .
- ^ Хорват, Чес.; Прейсс Б.А.; Липский С.Р. (1967). «Быстрая жидкостная хроматография. Исследование рабочих параметров и разделение нуклеотидов на пленочных ионообменниках». Аналитическая химия . 39 (12): 1422–1428. дои : 10.1021/ac60256a003 . ПМИД 6073805 .
- ^ Нгуен, Дао Т.-Т.; Гийярме, Дэви; Рудаз, Серж; Вети, Жан-Люк (2006). «Быстрый анализ в жидкостной хроматографии с использованием частиц малого размера и высокого давления» . Журнал науки о разделении . 29 (12): 1836–1848. дои : 10.1002/jssc.200600189 . ISSN 1615-9306 . ПМИД 16970187 .
- ^ Гритти, Фабрис; Гиошон, Жорж (2013). «Уравнение Ван Деемтера: предположения, ограничения и корректировка современной высокоэффективной жидкостной хроматографии» . Журнал хроматографии А. 1302 : 1–13. дои : 10.1016/j.chroma.2013.06.032 . ПМИД 23838304 .
- ^ Сян, Яньцяо; Лю, Яньшэн; Ли, Милтон Л. (2006). «Жидкостная хроматография сверхвысокого давления с использованием повышенной температуры». Журнал хроматографии А. 1104 (1–2): 198–202. дои : 10.1016/j.chroma.2005.11.118 . ПМИД 16376355 .
- ↑ Четвертичный насос 1290 Infinity. Архивировано 20 ноября 2015 г. в Wayback Machine . Аджилент
- ^ воды. «Торговые марки: Воды» . www.waters.com .
- ^ К., Робардс (1994). Принципы и практика современных хроматографических методов . Хаддад, PR, Джексон, PE Амстердам: Elsevier/Academic Press. ISBN 9780080571782 . OCLC 815471219 .
- ^ «Основы ВЭЖХ-ЭЗД (электрохимического обнаружения)» .
- ^ Маркович, Омер; Оттеле, Джим; Вельдман, Обе; Отто, Сийбрен (2020). «Автоматизированное устройство для непрерывного перемешивания при отборе проб в системах жидкостной хроматографии» . Химия связи . 3 (1): 180. дои : 10.1038/s42004-020-00427-5 . ПМЦ 9814086 . ПМИД 36703458 .
- ^ Гербер, Фредерик (май 2004 г.). «Практические аспекты быстрой высокоэффективной жидкостной хроматографии с обращенной фазой с использованием колонок с насадкой частиц 3 мкм и монолитных колонок при разработке и производстве фармацевтических препаратов в соответствии с современной надлежащей производственной практикой». Журнал хроматографии . 1036 (2): 127–33. дои : 10.1016/j.chroma.2004.02.056 . ПМИД 15146913 .
- ^ Сиддики, Масум Раза; Аль-Отман, Зейд А.; Рахман, Нафисур (2013). «Аналитические методы фармацевтического анализа: обзор» . Арабский химический журнал . 10 : С1409–С1421. дои : 10.1016/j.arabjc.2013.04.016 .
- ^ Европейская фармакопея , 2002. четвертое издание, Совет Европы, Страсбург.
- ^ Фармакопея США , 2004. 27-е изд. The USP Convention Inc., Роквилл, Мэриленд.
- ^ Мероне, Джузеппе М.; Тарталья, Анжела; Росси, Сандра; Сантавенере, Франческо; Бассотти, Элиза; Д'Овидио, Кристиан; Бонелли, Мартина; Розато, Энрика; де Грация, Уго; Локателли, Марчелло; Савини, Фабио (2021). «Быстрое количественное определение запрещенных веществ с помощью ЖХ-МС/МС в твердых и жидких неизвестных изъятых образцах» . Аналитическая химия . 93 (49): 16308–16313. дои : 10.1021/acs.analchem.1c03310 . ISSN 0003-2700 . ПМЦ 8674870 . ПМИД 34843645 .
- ^ Пеше, Амадео; Розенталь, Мюррей; Уэст, Роберт; Уэст, Кэмерон; Крюс, Бриджит; Микель, Чарльз; Алмазан, Перла; Латышев, Сергей (01.06.2010). «Оценка диагностической точности жидкостной хроматографии и тандемной масс-спектрометрии по сравнению с иммунологическим тестированием лекарств у пациентов с болью» . Врач боли . 13 (3): 273–281. ПМИД 20495592 .
- ^ Цай, И.-Лин; Вэн, Тэ-И.; Ценг, Юфэн Дж.; Тан, Хэппи Куй-Лок; Сунь, Сяо-Цзюй; Куо, Чинг-Хуа (01 декабря 2013 г.). «Скрининг и подтверждение 62 наркотических средств и метаболитов в моче с помощью сверхвысокоэффективной жидкостной хроматографии-квадрупольной времяпролетной масс-спектрометрии» . Журнал аналитической токсикологии . 37 (9): 642–651. дои : 10.1093/jat/bkt083 . ПМИД 24084874 .
- ^ Вайнманн, В.; Ренц, М.; Фогт, С.; Поллак, С. (1 января 2000 г.). «Автоматическая твердофазная экстракция и двухэтапная дериватизация для одновременного анализа основных запрещенных наркотиков в сыворотке с помощью ГХ/МС». Международный журнал юридической медицины . 113 (4): 229–235. дои : 10.1007/s004149900098 . ПМИД 10929239 . S2CID 20451772 .
- ^ Колмонен, Марджо; Лейнонен, Антти; Пеландер, Анна; Оянперя, Илкка (28 февраля 2007 г.). «Общий метод выявления допинговых веществ в моче человека путем твердофазной экстракции и жидкостной хроматографии/времяпролетной масс-спектрометрии». Аналитика Химика Акта . 585 (1): 94–102. Бибкод : 2007AcAC..585...94K . дои : 10.1016/j.aca.2006.12.028 . ПМИД 17386652 .
- ^ Пеландер, Анна; Оянперя, Илкка; Лосось, Лето; Расанен, Ильпо; Вуори, Эркки (1 ноября 2003 г.). «Токсикологический скрининг с идентификацией метаболитов по формулам методом жидкостной хроматографии / времяпролетной масс-спектрометрии». Аналитическая химия . 75 (21): 5710–5718. дои : 10.1021/ac030162o . ПМИД 14588010 .
- ^ Нобилис, Милан; Пур, Милан; Сенель, Петр; Павлик, Ян; Кунес, Иржи; Вопрсалова, Мария; Коларова, Ленка; Холчапек, Михал (15 июня 2007 г.). «Метаболическое профилирование потенциального противогрибкового препарата 3-(4-бромфенил)-5-ацетоксиметил-2,5-дигидрофуран-2-она в моче мышей с использованием высокоэффективной жидкостной хроматографии с УФ-фотодиодной матрицей и масс-спектрометрического обнаружения» . Журнал хроматографии Б. 853 (1–2): 10–19. дои : 10.1016/j.jchromb.2007.02.045 . ПМИД 17400036 .
- ^ Гу, Джатин; Патель, Кумар; Шах, Дирен (2016). «ПРИМЕНЕНИЕ ЖХ-МС» . ФармаТьютор .
- ^ Таллам, Анил Кумар; Алапати, Сахити; Нули, Мохана Вамси (2023). «Обзор разработки биоаналитических методов и валидации противораковых препаратов с использованием ЖХ/МС/МС и их применения в рутинном анализе» . Журнал интегральных наук : 4–19. дои : 10.37022/jis.v6i1.51 . ISSN 2581-5679 . S2CID 257295079 .
- ^ О'Дрисколл, Эйми (2021). «ВЭЖХ в фармацевтике» . Менеджер лаборатории .
- ^ Беккариа, Марко; Кабутер, Дейдра (2020). «Современные разработки в области ЖХ-МС для фармацевтического анализа» . Аналитик . 145 (4): 1129–1157. Бибкод : 2020Ана...145.1129B . дои : 10.1039/C9AN02145K . hdl : 11392/2479221 . ISSN 1364-5528 . ПМИД 31971527 . S2CID 210866236 .
- ^ Гу, Чунан (Кристина); Рассел, Дэвид; Йель, Питер (2016). «Применение LCMS при разработке низкомолекулярных лекарств» . Европейский фармацевтический обзор . 21 (4): 54–57.
- ^ Д'Овидио, Кристиан; Локателли, Марчелло; Перруччи, Мирьям; Чириоло, Луиджи; Фертон, Кеннет Г.; Газиоглу, Исил; Кабир, Абузар; Мероне, Джузеппе Мария; де Грация, Уго; Али, Имран; Катена, Антонио Мария; Трелья, Микеле; Марселла, Луиджи Т.; Савини, Фабио (2023). «Применение ЖХ-МС/МС в области фармакотоксикологии: современное состояние и новые применения» . Молекулы . 28 (5): 2127. doi : 10,3390/molecules28052127 . ISSN 1420-3049 . ПМЦ 10004468 . ПМИД 36903374 .
- ^ Чжоу, Цзюньтуо; Чжун, Лицзюнь (2022). «Применение метаболомики на основе жидкостной хроматографии-масс-спектрометрии в прогностической и персонализированной медицине» . Границы молекулярной биологии . 9 . дои : 10.3389/fmolb.2022.1049016 . ISSN 2296-889X . ПМК 9669074 . ПМИД 36406271 .
- ^ Матиас, Патрисия И.; Коннор, Томас Х.; Б'Хаймер, Клейтон (2017). «Обзор высокоэффективных методов жидкостной хроматографии и масс-спектрометрии мочи для определения воздействия противораковых препаратов на медицинских работников» . Журнал хроматографии Б. 1060 : 316–324. дои : 10.1016/j.jchromb.2017.06.028 . ISSN 1570-0232 . ПМК 5585056 . ПМИД 28654869 .
- ^ Эрнандес, Феликс; Санчо, Джон В.; Ибанез, Мэри; Воин, Чарльз (2007). «Определение остатков антибиотиков в экологических водах методом ЖХ-МС» . TrAC Тенденции в аналитической химии . Анализ фармацевтических остатков. 26 (6): 466–485. дои : 10.1016/j.trac.2007.01.012 . ISSN 0165-9936 .
- ^ Сегер, Кристоф; Зальцманн, Линда (2020). «Спустя еще десять лет: ЖХ-МС/МС стала рутиной в клинической диагностике» . Клиническая биохимия . Развитие и применение масс-спектрометрии в лабораторной медицине. 82 : 2–11. doi : 10.1016/j.clinbiochem.2020.03.004 . ISSN 0009-9120 . ПМИД 32188572 . S2CID 213186669 .
- ^ Сундстрем, Мира; Пеландер, Анна; Ангерер, Верена; Хаттер, Мелани; Кнайзель, Стефан; Оянперя, Илкка (01 октября 2013 г.). «Высокочувствительная сверхвысокоэффективная жидкостная хроматография/времяпролетная масс-спектрометрия высокого разрешения (UHPLC-HR-TOFMS) для скрининга синтетических каннабиноидов и других наркотиков в моче». Аналитическая и биоаналитическая химия . 405 (26): 8463–8474. дои : 10.1007/s00216-013-7272-8 . ПМИД 23954996 . S2CID 25743579 .
- ^ Гелб, Майкл Х.; Башируддин, Хаджа; Бурлина, Альберто; Чен, Сяо-Янь; Цзянь, Инь-Сю; Дизикес, Джордж; Дорли, Кристина; Джулиани, Роберто; Хиетала, Эми; Хун, Синьин; Као, Шу-Мин; Халеди, Хамид; Клюг, Трейси; Кубаски, Франсин; Ляо, Сюань-Чье (2022). «Жидкостная хроматография – тандемная масс-спектрометрия в лабораториях скрининга новорожденных» . Международный журнал неонатального скрининга . 8 (4): 62. дои : 10.3390/ijns8040062 . ISSN 2409-515X . ПМК 9781967 . ПМИД 36547379 .
- ^ Ван, Яньюнь; Сунь, Юн; Цзян, Тао (2019). «Клиническое применение ЖХ-МС/МС в последующем лечении детей с метилмалоновой ацидурией» . Достижения в терапии . 36 (6): 1304–1313. дои : 10.1007/s12325-019-00955-0 . ISSN 1865-8652 . ПМИД 31049874 . S2CID 143432183 .
- ^ Арункумар, Ниветитха; Ланган, Томас Дж.; Стэплтон, Молли; Кубаски, Франсин; Мейсон, Роберт В.; Сингх, Раджендра; Кобаяши, Хиронори; Ямагучи, Сейджи; Сузуки, Ясуюки; Ории, Кенджи; Ории, Тадао; Фукао, Тосиюки; Томацу, Сюндзи (2020). «Скрининг мукополисахаридозов новорожденных: прошлое, настоящее и будущее» . Журнал генетики человека . 65 (7): 557–567. дои : 10.1038/s10038-020-0744-8 . ISSN 1435-232X . ПМИД 32277174 . S2CID 92042115 .
- ^ Скогволд, Ханне Бендиксен; Рутвельт, Хельге; Реубсет, Леон; Эльгстен, Катя Бенедикте Престо; Уилсон, Стивен Рэй (2023). «Анализ сухих пятен крови методами жидкостной хроматографии и масс-спектрометрии: Тенденции клинической химии» . Журнал науки о разделении . 46 (15): e2300210. дои : 10.1002/jssc.202300210 . hdl : 10852/105845 . ISSN 1615-9306 . ПМИД 37269205 . S2CID 259047202 .
- ^ Захеди Рад, Малихе; Неестани, Тиранг Реза; Никойе, Бахаре; Шариатзаде, Настаран; Калайи, Али; Халаджи, Нилуфар; Гарави, Азам (1 января 2015 г.). «Метод конкурентного иммуноферментного анализа на основе белков-связывающего анализа по сравнению с жидкостной хроматографией высокого давления имеет очень низкую диагностическую ценность для выявления дефицита витамина D у детей 9–12 лет» . Международный журнал профилактической медицины . 6:67 . дои : 10.4103/2008-7802.161069 . ПМЦ 4542329 . ПМИД 26330983 .
Дальнейшее чтение
[ редактировать ]- Л. Р. Снайдер, Дж. Дж. Киркланд и Дж. В. Долан, Введение в современную жидкостную хроматографию, John Wiley & Sons, Нью-Йорк, 2009.
- М.В. Донг, Современная ВЭЖХ для практикующих ученых. Уайли, 2006.
- Л. Р. Снайдер, Дж. Дж. Киркланд и Дж. Л. Глайч, Разработка практического метода ВЭЖХ, John Wiley & Sons, Нью-Йорк, 1997.
- С. Ахуджа и Х.Т. Расмуссен (редакторы), Разработка метода ВЭЖХ для фармацевтических препаратов, Academic Press, 2007.
- С. Ахуджа и М.В. Донг (редакторы), Справочник по фармацевтическому анализу с помощью ВЭЖХ, Elsevier/Academic Press, 2005.
- Ю.В. Казакевич и Р. ЛоБрутто (ред.), ВЭЖХ для ученых-фармацевтов, Wiley, 2007.
- UD Neue, Колонки для ВЭЖХ: теория, технология и практика, Wiley-VCH, Нью-Йорк, 1997.
- MC McMaster, ВЭЖХ, практическое руководство пользователя, Wiley, 2007.