Биологическая фиксация углерода

Биологическая фиксация углерода , или ассимиляция сарбонов , является процессом , с помощью которого живые организмы превращают неорганический углерод (особенно углекислый газ ) в органические соединения . Эти органические соединения затем используются для хранения энергии и в качестве структур для других биомолекул . Углерод в основном фиксируется с помощью фотосинтеза , но некоторые организмы используют хемосинтез в отсутствие солнечного света . Хемосинтез - это фиксация углерода, обусловленная химической энергией, а не солнечным светом.
Процесс биологической фиксации углерода играет решающую роль в глобальном углеродном цикле, поскольку он служит основным механизмом удаления CO 2 (углекислый газ) из атмосферы и включает в себя его в живую биомассу. Первичная продукция органических соединений позволяет углероду входить в биосферу . [ 1 ] Углерод считается необходимым для жизни в качестве базового элемента для построения органических соединений. [ 2 ] Элемент углерода образует базы биогеохимические циклы (или циклы питательных веществ ) и стимулирует сообщества живых организмов. [ 2 ] Понимание биологической фиксации углерода имеет важное значение для понимания динамики экосистемы , климатической регуляции и устойчивости жизни на Земле. [ 3 ]
Организмы, которые растут путем фиксации углерода, таких как большинство растений и водорослей , называются автотрофами . К ним относятся фотоавтотрофы (которые используют солнечный свет) и литоавтотрофы (которые используют неорганическое окисление ). Гетеротрофы , такие как животные и грибы , не способны к фиксации углерода, но способны расти, потребляя углерод, фиксированный автотрофами или другими гетеротрофами.
Шесть естественных или автотрофных путей фиксации углерода в настоящее время известны. Это: i) Calvin-Benson-Bassham (Calvin Cycle), ii) обратный Krebs цикл (RTCA), iii) Редоссуальный ацетил-КоА (Wood-Ljungdahl Pathway), iv) 3-гидрокси пропионат [3-HP] Велосипед , v) 3-гидроипропионат/4- Гидроксибутират (3-сильный/4-hb) цикл и VI) цикл дикарбоксилат/4-гидроксибутират (DC/4-HB). [ 1 ] «Фиксированный углерод», «уменьшенный углерод» и «органический углерод» может быть использован взаимозаменяемо для обозначения различных органических соединений. [ 4 ]
Net vs. Gross CO 2 Фиксация
[ редактировать ]
Основной формой фиксированного неорганического углерода является углекислый газ (CO 2 ). По оценкам, примерно 250 миллиардов тонн углекислого газа конвертируются с помощью фотосинтеза ежегодно. Большая часть фиксации происходит в наземной среде, особенно в тропиках. Валовое количество фиксированного углекислого газа намного больше, поскольку приблизительно 40% потребляется дыханием после фотосинтеза. [ 5 ] [ 6 ] Исторически подсчитано, что приблизительно 2 × 10 11 миллиарды тонн углерода были фиксированы с момента происхождения жизни. [ 7 ]
Обзор пути
[ редактировать ]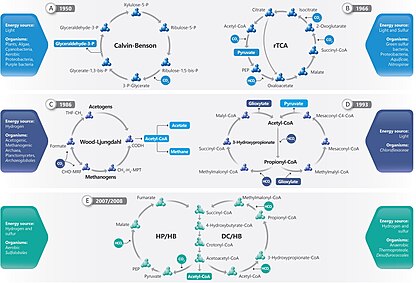
Шесть путей фиксации автотрофного углерода известны: [ 8 ] Цикл Кальвина, цикл обратного Кребса, восстановительный ацетил-КоА, велосипед 3 л.с., цикл 3 л.с./4-HB и циклы DC/4-HB.
Организмы, которые цикл Кальвина обнаруживают, - это растения, водоросли, цианобактерии , аэробные протеобактерии и фиолетовые бактерии. [ 1 ] Цикл Кальвина фиксирует углерод в хлоропластах растений и водорослей, а также в цианобактериях . Он также фиксирует углерод в аноксигенном фотосинтезе в одном типе псевдомонадоты, называемых фиолетовыми бактериями , и в некоторых нефототрофических псевдомонадоте. [ 9 ]
Из других автотрофических путей два известны только у бактерий ( цикл редуцирующей лимонной кислоты и 3-гидроксипропионатный цикл ), два только в археи (два варианта 3-гидроксипропионатного цикла) и один в бактериях и археи (The 3-Hydroxypropionate Cycle) и один в бактериях и археи (The 3-Hydroxypropionate Cycle) и один в бактериях и археи (в 3-гидроксипропионатном Редоссуальный путь ацетилового COA ). Бактерии с окислениями серы и водородно-окисления часто используют цикл Кальвина или цикл восстановительной лимонной кислоты. [ 10 ]
Список путей
[ редактировать ]
Цикл Кальвина
[ редактировать ]Цикл Кальвина составляет 90% биологической фиксации углерода. Потребляя аденозин трихосфат (АТФ) и никотинамид аденин -динуклеотидфосфат (NADPH), цикл Кальвина в растениях учитывает преобладание углеродной фиксации на земле. У водорослей и цианобактерий это объясняет доминирование углеродной фиксации в океанах. Цикл Кальвина превращает диоксид углерода в сахар, как триозофосфат (TP), который представляет собой глицеральдегид 3-фосфат (GAP) вместе с дигидроксиацетоном фосфатом (DHAP): [ 11 ]
- 3 CO 2 + 12 E − + 12 ч + + P i → Tp + 4 H 2 O
Альтернативная перспектива учитывает NADPH (источник E − ) и АТФ:
- 3 CO 2 + 6 NADPH + 6 ч + + 9 ATP + 5 H 2 O → TP + 6 NADP + + 9 ADP + 8 P i
Формула неорганического фосфата (P i ) - HOPO 3 2− + 2H + Полем Формулы для триоза и TP составляют C 2 H 3 O 2 -Ch 2 OH и C 2 H 3 O 2 -CH 2 OPO 3 2− + 2H +

Обратный цикл Кребса
[ редактировать ]Обратный цикл Кребса , также известный как цикл обратного TCA (RTCA) или цикл восстановительной лимонной кислоты , является альтернативой стандартному циклу Кальвина-Бенсона для фиксации углерода. Это было обнаружено в строгих анаэробных или микроаэробных бактериях (как Aquificales ) и анаэробной археи . Это было обнаружено Эвансом, Бьюкененом и Арноном в 1966 году, работая с фотосинтетической бактерией зеленого серы -хлорбиума Limicola . [ 12 ] В частности, это один из наиболее используемых путей в вентиляционных отверстиях Campylobacterota гидротермальных . [ 13 ] Эта функция обеспечивает первичное производство океана в афотических средах или «темное первичное производство». [ 14 ] Без этого не было бы первичного производства в афотической среде, что приведет к среде обитания без жизни.
Цикл включает в себя биосинтез ацетил -КоА из двух молекул CO 2 . [ 15 ] Ключевыми этапами обратного цикла Krebs являются:
- Оксалоацетат для малата , используя NADH + H +
- Фумарат для сукцината , катализируется оксидоредуктазой, фумаратредуктаза
- Сукцинат к сукцинил-КоА , АТФ-зависимую шаг
- Сукцинил-КоА в альфа-кетоглутарат , используя одну молекулу CO 2
- Альфа-кетоглутарат на изоцитрат , используя NADPH + H + и другая молекула CO 2
- Цитрат, превращенный в оксалоацетат и ацетил-КоА , это зависимая АТФ, а ключевым ферментом является цитрат АТФ цитрат-лиаза
Этот путь является циклическим из -за регенерации оксалоацетата. [ 16 ]
Бактерий Gammaproteobacteria и Riftia pachyptila переключаются из цикла Кальвина-Бенсона к циклу RTCA в ответ на концентрации H 2 с . [ 17 ]

Регуляционный путь ацетил -коа
[ редактировать ]Путь восстановительного пути ацетилового COA (COA), также известный как путь Wood-Ljungdahl, использует CO 2 в качестве электронного акцептора и источника углерода и H 2 в качестве донора электронов для формирования уксусной кислоты. [ 18 ] Этот метаболизм широко распространяется в рамках бациллоты , особенно в Clostridia . [ 19 ]
Путь также используется метаногенами , которые в основном являются Euryarchaeota , и несколькими анаэробными хемолитоатотрофами, такими как сульфат-восстановительные бактерии и археи. Вероятно, это также выполняется также Brocadiales, порядок Planctomycetota , который окисляет аммиак в анаэробном состоянии. [ 15 ] [ 19 ] [ 20 ] Гидрогенотрофный метаногенез , который обнаруживается только в определенной археи и приходится на 80% глобального метаногенеза, также основан на пути восстановительного ацетилового COA.
Моноксидсидсидгеназа является / ацетил-КоА-синтаза кислородом, чувствительным к кислороду фермента, который позволяет восстановить CO 2 до CO и синтез ацетил-КоА в нескольких реакциях. [ 21 ]
Одна ветвь этого пути, метиловая ветвь, похожа, но не гомологичная между бактериями и археей. В этой ветви случается восстановление CO 2 до метильного остатка, связанного с кофактором. Промежуточные соединения являются формиатами для бактерий и формалметанофурана для археи, а также носители, тетрагидрофолат и тетрагидроптерины соответственно у бактерий и археи, такие, как ферменты, образующие кофакторную метильную группу. [ 15 ]
В противном случае карбонильная ветвь гомологична между двумя доменами и состоит из восстановления другой молекулы CO 2 до карбонильного остатка, связанного с ферментом, катализируемой Co-дегидрогеназой/ацетил-КоА-синтазой. Этот ключевой фермент также является катализатором для образования ацетил-КоА, начиная с продуктов предыдущих реакций, метила и карбонильных остатков. [ 21 ]
Этот путь фиксации углерода требует только одной молекулы АТФ для производства одной молекулы пирувата, что делает этот процесс одним из основных выборов для хемолитоавтотрофов ограниченной по энергии и жизни в анаэробных условиях. [ 15 ]
3-гидроксипропионат [3-HP] Велосипед
[ редактировать ]3 -гидроксипропионатный велосипед , также известный как цикл 3-л.с./малил-КоА, обнаруженный только в 1989 году, используется зелеными фототрофами, не являющимися сульфурными фототрофами, хлорфлексных , включая максимальный показатель этого семейства . семейства и продемонстрировано. [ 22 ] 3-гидроксипропионатный велосипед состоит из двух циклов, и название такого пути происходит от 3-гидроксипоропионата, который соответствует его промежуточной характеристике.

Первый цикл - это способ синтеза глиоксилата . Во время этого цикла два эквивалента бикарбоната фиксируются в результате действия двух ферментов: ацетил-КоА-карбоксилаза, катализирующая карбоксилирование ацетил-КоА для малонил-коа и пропионил-коа-карбоксилазу катализирует карбоксилирование пропионил-CoA to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to to-coa каталиция Полем С этого момента серия реакций приводит к образованию глиоксилата, который, таким образом, станет частью второго цикла. [ 23 ] [ 24 ]

Во втором цикле глиоксилат является приблизительно одним эквивалентом пропионил-КоА, образующей метиламалонил-КоА. Это, в свою очередь, затем превращается через серию реакций в цитрамалил-КоА. Цитрамалил-КоА разделен на пируват и ацетил-КоА благодаря ферменту MMC Lyase. В этот момент пируват высвобождается, в то время как ацетил-КоА повторно используется и снова карбоксилируется в малонил-Коа, тем самым восстанавливая цикл. [ 25 ]
В общей сложности 19 реакций участвуют в 3-гидроксипропионатном велосипеде и 13 многофункциональных ферментах. Многофункциональность этих ферментов является важной особенностью этого пути, который, таким образом, позволяет фиксацию трех бикарбонатных молекул. [ 25 ]
Это очень дорогой путь: 7 молекул АТФ используются для синтеза нового пирувата и 3 АТФ для фосфатного триоза. [ 24 ]
Важной характеристикой этого цикла является то, что он позволяет совместно ассимилировать многочисленные соединения, что делает его подходящим для миксотрофных организмов. [ 24 ]
Циклы, связанные с 3-гидроксипропионатным циклом
[ редактировать ]Было обнаружено, что вариант 3-гидроксипропионатного цикла работает в аэробном экстремальном термофидофиле археонов Metallosphaera sedula . Этот путь называется 3-гидроксипропионатным/4-гидроксибутиратом (3-сильный/4-hb) цикла. [ 26 ]
Еще одним вариантом 3-гидроксипропионатного цикла является цикл дикарбоксилата/4-гидроксибутирата (DC/4-HB). Это было обнаружено в анаэробной археи. Он был предложен в 2008 году для Hyperthermophile Archeon Ignicoccus Hospitalis . [ 27 ]
Enoyl-CoA карбоксилазы/редуктузы
[ редактировать ]Фиксация CO 2 катализируется эноил-КоА-карбоксилазами/редуктазами. [ 28 ]
Неавтотрофные пути
[ редактировать ]Хотя ни один гетеротрофы не используют углекислый газ в биосинтезе, в их метаболизме включается некоторый углекислый газ. [ 29 ] Примечательно, что пируват -карбоксилаза потребляет углекислый газ (как бикарбонатные ионы) как часть глюконеогенеза , а углекислый газ потребляется в различных анаплеротических реакциях .
6-фосфоглюконатдегидрогеназа катализирует восстановительное карбоксилирование рибулозы 5-фосфата до 6-фосфоглюконата в E. coli при повышенных концентрациях CO 2 . [ 30 ]
Дискриминация изотопа углерода
[ редактировать ]Некоторые карбоксилазы , особенно Rubisco , преимущественно связывают более легкий углерод-стабильный изотопный углерод-12 с более тяжелым углеродом-13 . Это известно как дискриминация изотопа углерода и приводит к соотношению углерода-12 и углерода-13 на растении, которые выше, чем в свободном воздухе. Измерение этого соотношения важно при оценке эффективности использования воды у растений, [ 31 ] [ 32 ] [ 33 ] а также при оценке возможных или вероятных источников углерода в глобальных исследованиях углеродного цикла.
Биологическая фиксация углерода в почвах
[ редактировать ]В дополнение к фотосинтетическим и хемосинтетическим процессам, биологическая фиксация углерода происходит в почве посредством активности микроорганизмов, таких как бактерии и грибы. Эти почвенные микробы играют решающую роль в глобальном углеродном цикле путем секвестрирования углерода от разложенного органического вещества и переработки его обратно в почву, что способствует плодородию почвы и продуктивности экосистемы. [ 34 ]
В почвенной среде органическое вещество, полученное из мертвого растения и материала для животных, подвергается разложению , процесс, проведенный разнообразным сообществом микроорганизмов. Во время разложения сложные органические соединения разбиваются на более простые молекулы в результате действия ферментов, продуцируемых бактериями, грибами и другими организмами почвы. Поскольку органическое вещество разлагается, углерод высвобождается в различных формах, включая углекислый газ (CO2) и растворенный органический углерод (DOC).
Однако не весь углерод, выпущенный во время разложения, немедленно теряется в атмосфере; Значительная часть сохраняется в почве посредством процессов, известных как секвестрация углерода в почве. Почвенные микробы, особенно бактерии и грибы, играют ключевую роль в этом процессе, включив разлагаемый органический углерод в их биомассу или облегчая образование стабильных органических соединений, таких как гумус и органическое вещество почвы. [ 35 ]
Одним из ключевых механизма, с помощью которого почвенные микробы секвестра углерода является через процесс производства микробной биомассы. Бактерии и грибы ассимилируют углерод из разложенного органического вещества в свои клеточные структуры по мере их роста и воспроизведения. Эта микробная биомасса служит резервуаром для сохраненного углерода в почве, эффективно секвестрируя углерод от атмосферы.
Кроме того, микробы почвы способствуют образованию стабильного органического вещества почвы посредством синтеза внеклеточных полимеров , ферментов и других биохимических соединений . Эти вещества помогают связывать частицы почвы вместе, образуя агрегаты, которые защищают органический углерод от микробного разложения и физической эрозии . Со временем эти агрегаты накапливаются в почве, что приводит к формированию органического вещества почвы, которое может сохраняться на протяжении веков до тысячелетий.
Секвестрация углерода в почве не только помогает смягчить накопление атмосферного CO2 и смягчить изменение климата , но и повышает плодородие почвы, удержание воды и цикл питательных веществ , тем самым поддерживая рост растений и продуктивность экосистемы. Следовательно, понимание роли почвенных микробов в биологической фиксации углерода имеет важное значение для управления здоровьем почвы , смягчения изменения климата и содействия устойчивой практике управления земельными ресурсами.
Биологическая фиксация углерода является фундаментальным процессом, который поддерживает жизнь на Земле, регулируя уровни атмосферного CO2, поддерживая рост растений и других фотосинтетических организмов и поддержания экологического баланса.
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный в Santos Correa S, Schultz J, Lauersen KJ, Soares Rosado A (1 мая 2023 г.). «Естественная фиксация углерода и достижения в области синтетической инженерии для переработки и создания новых путей фиксации» . Журнал передовых исследований . 47 : 75–92. doi : 10.1016/j.jare.2022.07.011 . HDL : 10754/680126 . ISSN 2090-1232 . PMC 10173188 . PMID 35918056 .
- ^ Jump up to: а беременный Santos Correa S, Schultz J, Lauersen KJ, Soares Rosado A (1 мая 2023 г.). «Естественная фиксация углерода и достижения в области синтетической инженерии для переработки и создания новых путей фиксации» . Журнал передовых исследований . 47 : 75–92. doi : 10.1016/j.jare.2022.07.011 . HDL : 10754/680126 . ISSN 2090-1232 . PMC 10173188 . PMID 35918056 .
- ^ Berg JM, Tymoczko JL, Stryer L (2013). Страйер биохимия . Doi : 10.1007/978-3-8274-2989-6 . ISBN 978-3-8274-2988-9 .
- ^ Geider RJ, et al. (2001). «Первичная продуктивность планеты Земля: биологические детерминанты и физические ограничения в наземных и водных средах обитания» . Глобальная биология изменений . 7 (8): 849–882. Bibcode : 2001gcbio ... 7..849g . doi : 10.1046/j.1365-2486.2001.00448.x . S2CID 41335311 .
- ^ Geider RJ, et al. (2001). «Первичная продуктивность планеты Земля: биологические детерминанты и физические ограничения в наземных и водных средах обитания» . Глобальная биология изменений . 7 (8): 849–882. Bibcode : 2001gcbio ... 7..849g . doi : 10.1046/j.1365-2486.2001.00448.x . S2CID 41335311 .
- ^ Raghavendra, AS (2003-01-01), Томас, Брайан (ред.), «Фотосинтез и разделение | C3 растения», Энциклопедия прикладных наук о растениях , Оксфорд: Elsevier, pp. 673–680, ISBN 978-0-12-227050-5 , извлечен 2021-03-21
- ^ Crockford PW, бар на YM, Ward LM, Milo R, Halevy I (ноябрь 2023 г.). «Геологическая история первичной продуктивности» . Текущая биология . 33 (21): 4741–4750.e5. Bibcode : 2023cbio ... 33e4741c . doi : 10.1016/j.cub.2023.09.040 . ISSN 0960-9822 . PMID 37827153 . S2CID 263839383 .
- ^ Santos Correa S, Schultz J, Lauersen KJ, Soares Rosado A (1 мая 2023 г.). «Естественная фиксация углерода и достижения в области синтетической инженерии для переработки и создания новых путей фиксации» . Журнал передовых исследований . 47 : 75–92. doi : 10.1016/j.jare.2022.07.011 . HDL : 10754/680126 . ISSN 2090-1232 . PMC 10173188 . PMID 35918056 .
- ^ Swan BK, Martinez-Garcia M, Preston CM, Sczyrba A, Woyke T, Lamy D, et al. (Сентябрь 2011). «Потенциал хемолитоавтотрофии среди вездесущих линий бактерий в темном океане». Наука . 333 (6047): 1296–300. Bibcode : 2011sci ... 333.1296s . doi : 10.1126/science.1203690 . PMID 21885783 . S2CID 206533092 .
- ^ Энциклопедия микробиологии . Академическая пресса. 2009. С. 83–84. ISBN 978-0-12-373944-5 .
- ^ Raines CA (1 января 2003 г.). «Цикл Кальвина повторно» . Фотосинтез исследования . 75 (1): 1–10. doi : 10.1023/a: 1022421515027 . ISSN 1573-5079 . PMID 16245089 .
- ^ Fuchs G (13 октября 2011 г.). «Альтернативные пути фиксации углекислого газа: понимание ранней эволюции жизни?». Ежегодный обзор микробиологии . 65 (1): 631–58. doi : 10.1146/annurev-micro-090110-102801 . PMID 21740227 .
- ^ Grzymski JJ, Murray AE, Campbell BJ, Kaplarevic M, Gao GR, Lee C, et al. (Ноябрь 2008 г.). «Анализ метагенома экстремального микробного симбиоза выявляет эйритермальную адаптацию и метаболическую гибкость» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (45): 17516–21. Bibcode : 2008pnas..10517516G . doi : 10.1073/pnas.0802782105 . PMC 2579889 . PMID 18987310 .
- ^ Baltar F, Herndl GJ (11 июня 2019 г.). "Является ли фиксация темного углерода актуальна для оценочных оценок первичного производства?" (PDF) . Биогеонов . doi : 10.5194/bg-2019-223 .
- ^ Jump up to: а беременный в дюймовый Hügler M, Sievert SM (15 января 2011 г.). «Помимо цикла Кальвина: автотрофная фиксация углерода в океане». Ежегодный обзор морской науки . 3 (1): 261–89. Bibcode : 2011Arms .... 3..261H . doi : 10.1146/annurev-marine-120709-142712 . PMID 21329206 . S2CID 44800487 .
- ^ Бьюкенен Б.Б., Арнон Ди (апрель 1990 г.). «Обратный цикл Кребса в фотосинтезе: наконец -то консенсус». Фотосинтез исследования . 24 (1): 47–53. Bibcode : 1990phore..24 ... 47b . doi : 10.1007/bf00032643 . PMID 24419764 . S2CID 2753977 .
- ^ Markert S, Arndt C, Felbeck H, Becher D, Sievert SM, Hügler M, et al. (Январь 2007 г.). «Физиологическая протеомика некультурированного эндосимбионта рифтиа -пахиптилы». Наука . 315 (5809): 247–50. Bibcode : 2007sci ... 315..247M . doi : 10.1126/science.1132913 . HDL : 1912/1514 . OCLC 655249163 . PMID 17218528 . S2CID 45745396 .
- ^ Ljungdahl LG (2009). «Жизнь с ацетогенами, термофилами и целлюлолитическими анаээробами» . Ежегодный обзор микробиологии . 63 (1): 1–25. doi : 10.1146/annurev.micro.091208.073617 . PMID 19575555 .
- ^ Jump up to: а беременный Drake HL, Gössner AS, Daniel SL (март 2008 г.). «Старые ацетогены, новый свет». Анналы нью -йоркской академии наук . 1125 (1): 100–28. BIBCODE : 2008NASA1125..100D . doi : 10.1196/annals.1419.016 . PMID 18378590 . S2CID 24050060 .
- ^ Strous M, Pelletier E, Mangenot S, Rattei T, Lehner A, Taylor MW, et al. (Апрель 2006 г.). «Расшифровка эволюции и метаболизма бактерии анаммса из генома сообщества». Природа . 440 (7085): 790–4. Bibcode : 2006natur.440..790s . doi : 10.1038/nature04647 . HDL : 2066/35981 . PMID 16598256 . S2CID 4402553 .
- ^ Jump up to: а беременный Pezacka E, Wood Hg (октябрь 1984 г.). «Роль монооксида углерода дегидрогеназы в автотрофном пути, используемом ацетогенными бактериями» . Труды Национальной академии наук Соединенных Штатов Америки . 81 (20): 6261–5. Bibcode : 1984pnas ... 81.6261p . doi : 10.1073/pnas.81.20.6261 . PMC 391903 . PMID 6436811 .
- ^ Штраус G, Fuchs G (август 1993 г.). «Ферменты нового пути автотрофической фиксации CO2 в фототрофической бактерии хлорфлекс aurantiacus, 3-гидроксипропионатный цикл» . Европейский журнал биохимии . 215 (3): 633–43. doi : 10.1111/j.1432-1033.1993.tb18074.x . PMID 8354269 .
- ^ Herter S, Busch A, Fuchs G (ноябрь 2002 г.). «L-малил-коэнзимент лияза/бета-метилмалил-кофермент A-лияза из хлорфлекса aurantiacus, бифункциональный фермент, участвующий в AutoTrophic CO 2 фиксации » . Журнал бактериологии . 184 (21): 5999–6006. doi : 10.1128/jb.184.21.5999-6006.2002 . PMC 135395 . PMID 12374834 .
- ^ Jump up to: а беременный в Берг IA (март 2011 г.). «Экологические аспекты распределения различных путей фиксации AutoTrophic CO 2 » . Прикладная и экологическая микробиология . 77 (6): 1925–36. Bibcode : 2011apenm..77.1925b . doi : 10.1128/aem.02473-10 . PMC 3067309 . PMID 21216907 .
- ^ Jump up to: а беременный Zarzycki J, Brecht V, Müller M, Fuchs G (декабрь 2009 г.). «Идентификация недостающих шагов автотрофного 3-гидроксипропионатного цикла фиксации CO2 в хлорфлексе Aurantiacus» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (50): 21317–22. doi : 10.1073/pnas.0908356106 . PMC 2795484 . PMID 19955419 .
- ^ Берг И.А., Кокелкорн Д., Бакель В., Фукс Г. (декабрь 2007 г.). «3-гидроксипропионат/4-гидроксибутират автотрофный путь ассимиляции углекислого газа в археи». Наука . 318 (5857): 1782–6. Bibcode : 2007sci ... 318.1782b . doi : 10.1126/science.1149976 . PMID 18079405 . S2CID 13218676 .
- ^ Huber H, Gallenberger M, Jahn U, Eylert E, Berg IA, Kockelkorn D, et al. (Июнь 2008 г.). «Дикарбоксилат/4-гидроксибутират автотрофический цикл углеродного углерода в гипертермофильной археуме Ignicoccus Hospitalis» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (22): 7851–6. Bibcode : 2008pnas..105.7851h . doi : 10.1073/pnas.0801043105 . PMC 2409403 . PMID 18511565 .
- ^ Schwander T, Schada Von Borzyskowski L, Burgener S, Cortina NS, ERB TJ (2016). «Синтетический путь для фиксации углекислого газа in vitro» . Наука . 354 (6314): 900–904. Bibcode : 2016sci ... 354..900S . doi : 10.1126/science.aah5237 . PMC 5892708 . PMID 27856910 .
- ^ Николь Кресге, Роберт Д. Саймони, Роберт Л. Хилл (2005). «Открытие гетеротрофной фиксации углекислого газа Харленда Г. Вуда» . Журнал биологической химии . 280 (18): E15.
- ^ Сатановски А., Дронселла Б., Нор, Вёгели Б., Хе Х, Вичманн П. и др. (Ноябрь 2020 г.). "Пробуждение скрытого цикла фиксации углерода в Escheria Coli " Природная связь 11 (1): BIBCODE : 2020NATCO..11.5812S 5812. Doi : 10.1038/ s41467-020-19564-5 PMC 7669889 33199707PMID
- ^ Adiredjo AL, Navaud O, Muños S, Langlade NB, Lamaze T, Grieu P (3 июля 2014 г.). «Генетический контроль эффективности использования воды и дискриминации изотопов углерода в листьях у подсолнечника (Helianthus Annuus L.), подвергшиеся двум сценариям засухи» . Plos один . 9 (7): E101218. Bibcode : 2014ploso ... 9J1218a . doi : 10.1371/journal.pone.0101218 . PMC 4081578 . PMID 24992022 .
- ^ Фаркухар Г.Д., Элерингер -младший, Хубик К.Т. (июнь 1989 г.). «Дискриминация изотопа углерода и фотосинтез». Ежегодный обзор физиологии растений и молекулярной биологии растений . 40 (1): 503–537. doi : 10.1146/annurev.pp.40.060189.002443 . S2CID 12988287 .
- ^ Seibt U, Rajabi A, Griffiths H, Berry Ja (март 2008 г.). «Изотопы углерода и эффективность использования воды: смысл и чувствительность». Oecologia . 155 (3): 441–54. Bibcode : 2008oecol.155..441s . doi : 10.1007/s00442-007-0932-7 . PMID 18224341 . S2CID 451126 .
- ^ Berg JM, Tymoczko JL, Stryer L (2013). Страйер биохимия . Doi : 10.1007/978-3-8274-2989-6 . ISBN 978-3-8274-2988-9 .
- ^ Berg JM, Tymoczko JL, Stryer L (2013). Страйер биохимия . Doi : 10.1007/978-3-8274-2989-6 . ISBN 978-3-8274-2988-9 .
Дальнейшее чтение
[ редактировать ]- Килинг PJ (октябрь 2004 г.). «Разнообразие и эволюционная история пластидов и их хозяев» . Американский журнал ботаники . 91 (10): 1481–93. doi : 10.3732/ajb.91.10.1481 . PMID 21652304 . S2CID 17522125 .
- Килинг PJ (2009). «Хромальвеолаты и эволюция пластидов вторичным эндосимбиозом» (PDF) . Журнал эукариотической микробиологии . 56 (1): 1–8. doi : 10.1111/j.1550-7408.2008.00371.x . PMID 19335769 . S2CID 34259721 . Архивировано из оригинала (PDF) 9 июля 2009 года.
- Килинг PJ (март 2010 г.). «Эндосимбиотическое происхождение, диверсификация и судьба пластидов» . Философские транзакции Королевского общества Лондона. Серия B, биологические науки . 365 (1541): 729–48. doi : 10.1098/rstb.2009.0103 . PMC 2817223 . PMID 20124341 .
- Timme RE, Bachvaroff TR, Delwiche CF (2012). «Широкая филогеномная выборка и родственная линия наземных растений» . Plos один . 7 (1): E29696. BIBCODE : 2012PLOSO ... 729696T . doi : 10.1371/journal.pone.0029696 . PMC 3258253 . PMID 22253761 .
- Spiegel FW (февраль 2012 г.). «Эволюция. Созерцание первых растений». Наука . 335 (6070): 809–10. Bibcode : 2012sci ... 335..809s . doi : 10.1126/science.1218515 . PMID 22344435 . S2CID 36584136 .
- Прайс DC, Chan CX, Yoon HS, Yang EC, Qiu H, Weber AP, et al. (Февраль 2012 г.). «Cyanophora paradoxa геном выясняет происхождение фотосинтеза у водорослей и растений» (PDF) . Наука . 335 (6070): 843–7. Bibcode : 2012sci ... 335..843p . doi : 10.1126/science.1213561 . PMID 22344442 . S2CID 17190180 . Архивировано из оригинала (PDF) 14 мая 2013 года.






