Гликозаминогликан
Эта статья может быть слишком технической для понимания большинства читателей . ( Июль 2015 г. ) |
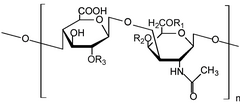
Гликозаминогликаны [1] ( ГАГ ) или мукополисахариды [2] представляют собой длинные линейные полисахариды , состоящие из повторяющихся дисахаридных единиц (т.е. двухсахарных единиц). Повторяющаяся двухсахарная единица состоит из уронового сахара и аминосахара , за исключением сульфатированного гликозаминогликана кератана , где вместо уронового сахара имеется галактозная единица. [3] ГАГ обнаружены у позвоночных, беспозвоночных и бактерий. [4] Потому что ГАГ являются высокополярными молекулами и притягивают воду; организм использует их в качестве смазок или амортизаторов.
Мукополисахаридозы представляют собой группу метаболических нарушений , при которых происходит аномальное накопление гликозаминогликанов из-за дефицита ферментов.
Производство
[ редактировать ]Гликозаминогликаны сильно различаются по молекулярной массе, структуре дисахарида и сульфатированию . Это связано с тем, что синтез ГАГ не управляется матрицей, как белки или нуклеиновые кислоты, а постоянно изменяется под действием процессинговых ферментов. [5]
ГАГ подразделяются на четыре группы в зависимости от их основных дисахаридных структур: [6]
- Гепарин /гепарансульфат (HSGAG)
- Хондроитинсульфат / дерматансульфат (CSGAG), которые вместе с HSGAG синтезируются в аппарате Гольджи , где белковые ядра образующиеся в шероховатой эндоплазматической сети , посттрансляционно модифицируются посредством О-связанного гликозилирования гликозилтрансферазами протеогликаны , образуя таким образом , .
- Кератансульфат , который может модифицировать основные белки посредством N-связанного гликозилирования или О-связанного гликозилирования протеогликана.
- Гиалуроновая кислота (также известная как гиалуронан), которая синтезируется интегральными мембранными синтазами, которые немедленно выделяют динамически удлиненную дисахаридную цепь. [ нужны разъяснения ]
HSGAG и CSGAG
[ редактировать ]Модифицированные HSGAG и CSGAG протеогликаны сначала начинаются с консенсусного мотива Ser-Gly/Ala-X-Gly в коровом белке. Конструирование тетрасахаридного линкера, состоящего из -GlcAβ1–3Galβ1–3Galβ1–4Xylβ1-O-(Ser)-, где ксилозилтрансфераза , β4-галактозилтрансфераза (GalTI), β3-галактозилтрансфераза (GalT-II) и β3-GlcA трансфераза. (GlcAT-I) переносит четыре моносахарида, начинает синтез модифицированного GAG белка. Первая модификация тетрасахаридного линкера определяет, будут ли добавлены HSGAG или CSGAG. Добавление GlcNAc способствует добавлению HSGAG, тогда как добавление GalNAc к тетрасахаридному линкеру способствует развитию CSGAG. [6] GlcNAcT-I переносит GlcNAc на тетрасахаридный линкер, который отличается от гликозилтрансферазы GlcNAcT-II, фермента, который используется для построения HSGAG. Было показано, что EXTL2 и EXTL3, два гена из семейства опухолевых супрессоров EXT, обладают активностью GlcNAcT-I. И наоборот, GalNAc переносится на линкер с помощью фермента GalNAcT, чтобы инициировать синтез CSGAG, фермента, который может иметь или не иметь активность, отличную от трансферазной активности GalNAc хондроитинсинтазы. [6]
Что касается HSGAG, мультимерный фермент, кодируемый EXT1 и EXT2 семейства генов EXT, переносит как GlcNAc, так и GlcA для удлинения цепи HSGAG. При удлинении HSGAG динамически модифицируется, сначала N-деацетилазой, N-сульфотрансферазой ( NDST1 ), которая представляет собой бифункциональный фермент, который отщепляет N-ацетильную группу от GlcNAc и впоследствии сульфатирует N-положение. Затем уронилэпимераза C-5 превращает d-GlcA в l-IdoA с последующим 2- O -сульфатированием сахара уроновой кислоты 2 -O -сульфотрансферазой ( гепарансульфат-2-O-сульфотрансферазой ). Наконец, положения 6- O и 3- O фрагментов GlcNAc сульфатируются 6- O ( гепарансульфат-6-O-сульфотрансферазой ) и 3-O (3-OST) сульфотрансферазами.
Хондроитинсульфат и дерматансульфат, входящие в состав CSGAG, отличаются друг от друга наличием эпимеров GlcA и IdoA соответственно. Подобно продукции HSGAG, уронилэпимераза C-5 превращает d-GlcA в l-IdoA с образованием дерматансульфата. Происходят три события сульфатирования цепей CSGAG: 4- O и/или 6- O сульфатирование GalNAc и 2- O сульфатирование уроновой кислоты. Четыре изоформы 4 -O GalNAc сульфотрансфераз (C4ST-1, C4ST-2, C4ST-3 и D4ST-1) и три изоформы GalNAc 6- O сульфотрансфераз (C6ST, C6ST-2 и GalNAc4S-6ST) ответственен за сульфатирование GalNAc. [7]
Резка типов сульфатов
[ редактировать ]В отличие от HSGAG и CSGAG, GAG третьего класса, принадлежащие к типам кератансульфата , стимулируются к биосинтезу посредством определенных мотивов белковой последовательности. Например, в роговице и хряще кератансульфатный домен агрекана состоит из серии тандемно повторяющихся гексапептидов с консенсусной последовательностью E(E/L)PFPS. [8] Кроме того, для трех других кератансульфатированных протеогликанов, люмикана , кератокана и мимекана ( OGN ), было установлено, что консенсусная последовательность NX(T/S) вместе с вторичной структурой белка участвует в удлинении N -связанных олигосахаридов с помощью кератансульфата. [8] Удлинение кератансульфата начинается с невосстанавливающих концов трех связанных олигосахаридов, которые определяют три класса кератансульфата. Кератансульфат I (KSI) N -связан через олигосахарид-предшественник с высоким содержанием маннозы. Кератансульфат II (KSII) и кератансульфат III (KSIII) связаны O -связями, причем связи KSII идентичны связям основной структуры муцина , а KSIII связан с 2- O -маннозой. Удлинение полимера кератансульфата происходит за счет гликозилтрансферазного добавления Gal и GlcNAc. β-1,4-галактозилтрансферазы Присоединение галактозы происходит в основном за счет фермента (β4Gal-T1), тогда как ферменты, ответственные за β-3-нацетилглюкозамин, четко не идентифицированы. Наконец, сульфатирование полимера происходит в положении 6 обоих остатков сахара. Фермент KS-Gal6ST ( CHST1 ) переносит сульфатные группы на галактозу, тогда как N-ацетилглюкозаминил-6-сульфотрансфераза (GlcNAc6ST) ( CHST2 ) переносит сульфатные группы на концевой GlcNAc в кератансульфате. [9]
Класс гиалуроновой кислоты
[ редактировать ]
Четвертый класс ГАГ, гиалуроновая кислота (ГК), не сульфатируется и синтезируется тремя белками трансмембранной синтазы HAS1 , HAS2 и HAS3 . HA, линейный полисахарид, состоит из повторяющихся дисахаридных единиц →4)GlcAβ(1→3)GlcNAcβ(1→) и имеет очень высокую молекулярную массу, начиная от 10 5 до 10 7 Да. Каждый фермент HAS способен к трансгликозилированию при наличии UDP-GlcA и UDP-GlcNAc. [10] [11] HAS2 отвечает за очень крупные полимеры гиалуроновой кислоты, тогда как ГК меньшего размера синтезируются HAS1 и HAS3. Хотя каждая изоформа HAS катализирует одну и ту же реакцию биосинтеза, каждая изоформа HAS активна независимо. Также было показано, что изоформы HAS имеют разные значения K m для UDP-GlcA и UDPGlcNAc. [12] Считается, что за счет различий в активности и экспрессии ферментов можно регулировать широкий спектр биологических функций, опосредованных ГК, например, ее участие в регуляции нервных стволовых клеток в субгранулярной зоне мозга.
Фармакодинамика
[ редактировать ]- HSGAG
- Эндогенный гепарин локализуется и хранится в секреторных гранулах тучных клеток . Гистамин , присутствующий в гранулах, протонируется (H 2 A 2+ ) при pH внутри гранул (5,2–6,0), поэтому считается, что гепарин, который имеет сильный отрицательный заряд, электростатически удерживает и сохраняет гистамин. [13] В клинике гепарин применяется в качестве антикоагулянта, а также является препаратом первой линии при тромбоэмболических заболеваниях. [14] [15] Гепарансульфат (HS) обладает многочисленными биологическими активностями и функциями, включая клеточную адгезию, регуляцию роста и пролиферации клеток, процессы развития, связывание липопротеинлипазы и других белков с клеточной поверхностью, ангиогенез, вирусную инвазию и метастазирование опухоли. [13]
CSGAG взаимодействуют с белками, связывающими гепарин, в частности, взаимодействие дерматансульфата с фактором роста фибробластов FGF-2 и FGF-7 участвует в клеточной пролиферации и заживлении ран. [16] в то время как взаимодействия с печеночным фактором роста/фактором рассеяния (HGF/SF) активируют сигнальный путь HGF/SF ( c-Met ) через его рецептор. CSGAG играют важную роль в обеспечении поддержки и адгезии костей, кожи и хрящей. Другие биологические функции, для которых CSGAG, как известно, играют решающую роль, включают ингибирование роста аксонов и регенерацию в развитии ЦНС, роль в развитии мозга, нейритогенную активность и инфекцию патогенов. [17]
- Резка сульфатов
- Одна из основных функций ГАГ третьего класса — кератансульфатов — поддержание гидратации тканей. [18] Кератансульфаты содержатся в костях, хрящах и роговице глаза. [19] В нормальной роговице дерматансульфат полностью гидратирован, тогда как кератансульфат гидратирован лишь частично, что позволяет предположить, что кератансульфат может вести себя как динамически контролируемый буфер для гидратации. [18] При болезненных состояниях, таких как макулярная дистрофия роговицы , при которых изменяются уровни ГАГ, таких как КС, потеря гидратации в строме роговицы считается причиной помутнения роговицы, что подтверждает давнюю гипотезу о том, что прозрачность роговицы зависит от правильного уровень кератансульфата. Кератансульфатные ГАГ обнаруживаются во многих других тканях, помимо роговицы, где они, как известно, регулируют макрофагов адгезию , образуют барьеры для роста нейритов , регулируют имплантацию эмбрионов в эндометрий, слизистую оболочку матки во время менструальных циклов и влияют на подвижность эндотелиальных клеток роговицы. [18] Таким образом, KS играет антиадгезивную роль, что предполагает очень важные функции KS в подвижности и прикреплении клеток, а также в других потенциальных биологических процессах.
Дерматансульфаты
Дерматансульфаты действуют в коже, сухожилиях, кровеносных сосудах и сердечных клапанах. [19]
- Гиалуроновая кислота
- Гиалуроновая кислота является основным компонентом синовиальных тканей и жидкости , а также основным веществом других соединительных тканей. Гиалуроновая кислота связывает клетки вместе, смазывает суставы и помогает поддерживать форму глазных яблок. [19] Вязкоэластичность гиалуроновой кислоты делает ее идеальной для смазки суставов и поверхностей , которые движутся друг относительно друга, например хрящей. Раствор гиалуроновой кислоты при низком напряжении сдвига имеет гораздо более высокую вязкость, чем при высоком напряжении сдвига. [20] Гиалуронидаза , фермент, вырабатываемый лейкоцитами, сперматозоидами и некоторыми бактериями, расщепляет гиалуроновую кислоту, в результате чего раствор становится более жидким. [19]
- In vivo гиалуроновая кислота образует хаотично извитые спирали, которые спутываются, образуя гиалуронановую сеть, замедляя диффузию и образуя диффузионный барьер, регулирующий транспорт веществ между клетками. Например, гиалуронан помогает распределять белки плазмы между сосудистыми и внесосудистыми пространствами, что влияет на растворимость макромолекул в интерстиции, изменяет химическое равновесие и стабилизирует структуру коллагеновых волокон. [20]
- Другие функции включают взаимодействие матрикса с белками, связывающими гиалуронан, такими как гиалуронектин, глиальный белок, связывающий гиалуронан, обогащенный мозгом белок, связывающий гиалуронан, коллаген VI , TSG-6 и ингибитор интер-альфа-трипсина . Взаимодействия на клеточной поверхности с участием гиалуронана заключаются в его хорошо известном сочетании с CD44 , которое может быть связано с прогрессированием опухоли, а также с RHAMM ( гиалуронан-опосредованным рецептором подвижности ), который участвует в процессах развития, метастазировании опухоли и патологических репаративных процессах.
- Фибробласты, мезотелиальные клетки и некоторые типы стволовых клеток окружают себя перицеллюлярной «шубой» , часть которой построена из гиалуронана, чтобы защитить себя от бактерий, эритроцитов или других молекул матрикса. Например, что касается стволовых клеток, гиалуронан вместе с хондроитинсульфатом помогает формировать нишу стволовых клеток . Стволовые клетки защищены от воздействия факторов роста щитом из гиалуронана и минимально сульфатированного хондроитинсульфата. Во время деления предшественников дочерняя клетка выходит за пределы этого перицеллюлярного щита, где затем на нее могут влиять факторы роста, чтобы дифференцироваться еще дальше.
Классификация
[ редактировать ]Члены семейства гликозаминогликанов различаются по типу содержащихся в них единиц гексозамина, гексозы или гексуроновой кислоты (например, глюкуроновая кислота , идуроновая кислота , галактоза , галактозамин , глюкозамин ).
Они также различаются по геометрии гликозидной связи .
Примеры GAG включают в себя:
| Имя | Гексуроновая кислота или гексоза (для черенков) | гексозамин | Геометрия связи между преобладающими мономерными звеньями | Уникальные возможности |
|---|---|---|---|---|
| Хондроитина сульфат | GlcUA или ГлкУА(2S) | ГалНАк или ГалНАк(4S) или ГалНАк(6S) или ГалНАк(4S,6S) | GlcUA β (1→3)GalNAc β (1→4) | Наиболее распространенный ГАГ |
| Дерматан сульфат | GlcUA или IdoUA или ИдоUA(2S) | ГалНАк или ГалНАк(4S) или ГалНАк(6S) или ГалНАк(4S,6S) | ' IdoUA β 1-3' GalNAc β 1-4 | Отличается от хондроитинсульфата наличием идуроновой кислоты , хотя некоторые моносахариды гексуроновой кислоты могут быть глюкуроновой кислотой . [16] |
| Сульфатные черенки | Гал или Гал(6S) | GlcNAc или ГлкНАк(6S) | - Гал(6S) β 1-4 GlcNAc(6S) β 1-3 | Кератансульфат типа II может быть фукозилированным . [21] |
| Гепарин | GlcUA или ИдоUA(2S) | GlcNAc или GlcNS или GlcNAc(6S) или ГлкНС(6S) | - IdoUA(2S) α 1-4 GlcNS(6S) α 1-4 | Самая высокая плотность отрицательного заряда среди всех известных биологических молекул. |
| Гепарансульфат | GlcUA или IdoUA или ИдоUA(2S) | GlcNAc или GlcNS или GlcNAc(6S) или ГлкНС(6S) | - GlcUA β 1-4 GlcNAc α 1-4 | По структуре очень похож на гепарин, однако дисахаридные единицы гепарансульфата организованы в отдельные сульфатированные и несульфатированные домены. [22] |
| Гиалуронан | GlcUA | ГлкНАк | - GlcUA β 1-3 GlcNAc β 1-4 | Единственный ГАГ, который является исключительно несульфатированным. |
Сокращения
[ редактировать ]- GlcUA = β -D- глюкуроновая кислота
- GlcUA(2S) = 2-O-сульфо- β -D-глюкуроновая кислота
- IdoUA = α -L- идуроновая кислота
- IdoUA(2S) = 2-O-сульфо- α -L-идуроновая кислота
- Gal = β -D- галактоза
- Gal(6S) = 6-O-сульфо- β -D-галактоза
- GalNAc = β -D- N-ацетилгалактозамин
- GalNAc(4S) = β -DN-ацетилгалактозамин-4-O-сульфат
- GalNAc(6S) = β -DN-ацетилгалактозамин-6-O-сульфат
- GalNAc(4S,6S) = β -DN-ацетилгалактозамин-4-O,6-O-сульфат
- GlcNAc = α -D- N-ацетилглюкозамин
- GlcNS = α -DN-сульфоглюкозамин
- GlcNS(6S) = α -DN-сульфоглюкозамин-6-О-сульфат
См. также
[ редактировать ]- Гликопротеин - белок с модификациями олигосахаридов.
- Липополисахарид - класс молекул, обнаруженных во внешней мембране грамотрицательных бактерий.
- Улиточная слизь - внешние выделения организма, вырабатываемые улитками.
- Гликокаликс – вязкий, богатый углеводами слой на внешней периферии клетки. Перицеллюлярная оболочка.
Ссылки
[ редактировать ]- ^ «гликозаминогликан» в Медицинском словаре Дорланда.
- ^ «мукополисахарид» в Медицинском словаре Дорланда.
- ^ Эско, Джеффри Д.; Кимата, Кодзи; Линдаль, Ульф (2009). «Глава 16: Протеогликаны и сульфатированные гликозаминогликаны». Основы гликобиологии . Лабораторный пресс Колд-Спринг-Харбор. ISBN 978-0879695590 .
- ^ ДеАнджелис, Пол Л. (1 ноября 2002 г.). «Эволюция гликозаминогликанов и их гликозилтрансфераз: значение для внеклеточных матриксов животных и капсул патогенных бактерий» . Анатомическая запись . 268 (3): 317–326. дои : 10.1002/ar.10163 . ISSN 0003-276X . ПМИД 12382327 . S2CID 38827411 .
- ^ Калигур, Вики (2008). «Сульфатирование гликозаминогликанов и передача сигналов» . Проверено 25 ноября 2012 г.
- ^ Jump up to: а б с Сасисекхаран, Рам; Раман, Рахул; Прабхакар, Викас (август 2006 г.). «Гликомический подход к структурно-функциональным взаимоотношениям гликозаминогликанов» . Ежегодный обзор биомедицинской инженерии . 8 (1): 181–231. doi : 10.1146/annurev.bioeng.8.061505.095745 . ПМИД 16834555 .
- ^ Куше-Гуллберг М., Челлен Л. (2003). «Сульфотрансферазы в биосинтезе гликозаминогликанов». Современное мнение в области структурной биологии . 13 (5): 605–11. дои : 10.1016/j.sbi.2003.08.002 . ПМИД 14568616 .
- ^ Jump up to: а б Фундербург Дж.Л. (2002). «Биосинтез кератансульфата» . ИУБМБ Жизнь . 54 (4): 187–94. дои : 10.1080/15216540214932 . ПМЦ 2874674 . ПМИД 12512857 .
- ^ Ямамото Ю., Такахаси И., Огата Н., Накадзава К. (2001). «Очистка и характеристика N-ацетилглюкозаминилсульфотрансферазы из куриной роговицы». Архив биохимии и биофизики . 392 (1): 87–92. дои : 10.1006/abbi.2001.2422 . ПМИД 11469798 .
- ^ Ёсида М., Итано Н., Ямада Ю., Кимата К. (2000). «Синтез гиалуронана in vitro с помощью одного белка, полученного из мышиного гена HAS1, и характеристика аминокислотных остатков, необходимых для его активности» . Журнал биологической химии . 275 (1): 497–506. дои : 10.1074/jbc.275.1.497 . ПМИД 10617644 .
- ^ ДеАнджелис П.Л., Вейгель П.Х. (1994). «Иммунохимическое подтверждение первичной структуры стрептококковой гиалуронансинтазы и синтез высокомолекулярного продукта рекомбинантным ферментом». Биохимия . 33 (31): 9033–39. дои : 10.1021/bi00197a001 . ПМИД 8049203 .
- ^ Итано Н; Савай Т; Ёсида М; Ленас П; Ямада Ю; Имагава М; Шиномура Т; Хамагучи М; Ёсида Ю; Онуки Ю; Мияучи С; Спайсер АП; Макдональд Дж.А.; Кимата К. (1999). «Три изоформы гиалуронансинтазы млекопитающих обладают различными ферментативными свойствами» . Журнал биологической химии . 274 (35): 25085–92. дои : 10.1074/jbc.274.35.25085 . ПМИД 10455188 .
- ^ Jump up to: а б Рабенштейн ДЛ. (2002). «Гепарин и гепарансульфат: строение и функции». Отчеты о натуральных продуктах . 19 (3): 312–31. дои : 10.1039/B100916H . ПМИД 12137280 .
- ^ Джин Л., Абрахамс Дж.П., Скиннер Р., Петиту М., Пайк Р.Н., Каррелл Р.В. (1997). «Антикоагулянтная активация антитромбина гепарином» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (26): 14683–88. Бибкод : 1997PNAS...9414683J . дои : 10.1073/pnas.94.26.14683 . ПМК 25092 . ПМИД 9405673 .
- ^ Роден, Л. (1989). Лейн, Д.А. (ред.). Гепарин: химические и биологические свойства, клиническое применение . CRC Press, Inc. с. 1.
- ^ Jump up to: а б Троубридж Дж. М., Галло Р. Л. (2002). «Дерматансульфат: новые функции старого гликозаминогликана» . Гликобиология . 12 (9): 117П–125П. дои : 10.1093/гликоб/cwf066 . ПМИД 12213784 .
- ^ Сугахара К., Миками Т., Уяма Т., Мизугути С., Номура К., Китагава Х. (2003). «Последние достижения в структурной биологии хондроитинсульфата и дерматансульфата». Современное мнение в области структурной биологии . 13 (5): 612–20. дои : 10.1016/j.sbi.2003.09.011 . ПМИД 14568617 .
- ^ Jump up to: а б с Фундербург, Дж.Л. (2000). «Кератансульфат: строение, биосинтез и функции» . Гликобиология . 10 (10): 951–58. дои : 10.1093/гликоб/10.10.951 . ПМИД 11030741 .
- ^ Jump up to: а б с д Тортора, Джерард Дж. (31 декабря 2013 г.). Основы анатомии и физиологии . Дерриксон, Брайан (14-е изд.). Дэнверс, Массачусетс. ISBN 978-1-118-34500-9 . OCLC 871018672 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Jump up to: а б Лоран TC, Лоран UB, Фрейзер-младший (1996). «Структура и функции гиалуронана: обзор». Иммунология и клеточная биология . 74 (2): А1-7. дои : 10.1038/icb.1996.32 . ПМИД 8724014 .
- ^ Фундербург Дж.Л. (2000). «Кератансульфат: строение, биосинтез и функции» . Гликобиология . 10 (10): 951–58. дои : 10.1093/гликоб/10.10.951 . ПМИД 11030741 .
- ^ Галлахер, Дж. Т., Лион, М. (2000). «Молекулярная структура гепарансульфата и взаимодействие с факторами роста и морфогенами». В Иоццо, М, В. (ред.). Протеогликаны: строение, биология и молекулярные взаимодействия . Нью-Йорк: Marcel Dekker Inc., стр. 27–59. ISBN 978-0-8247-0334-9 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )
Внешние ссылки
[ редактировать ]- Кинг М. 2005. Гликозаминогликаны. Архивировано 8 февраля 2023 г. в Wayback Machine . Медицинский факультет Университета Индианы, доступ осуществлен 31 декабря 2006 г.
- Гликозаминогликаны Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- МРТ-оценка потери гликозаминогликанов (оценка dGEMRIC). Архивировано 22 августа 2011 г. в Wayback Machine.