ДНКаза, активируемая каспазой
| ДФФБ | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | DFFB , фактор фрагментации ДНК, 40 кДа, бета-полипептид (каспаза-активируемая ДНКаза), CAD, CPAN, DFF-40, DFF2, DFF40, субъединица бета фактора фрагментации ДНК | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 601883 ; МГИ : 1196287 ; Гомологен : 3241 ; GeneCards : DFFB ; ОМА : DFFB – ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Фактор фрагментации ДНК 40 кДа | |||
|---|---|---|---|
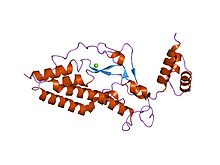 Кристаллическая структура ДНКазы, активируемой каспазой (CAD) | |||
| Идентификаторы | |||
| Символ | ДФФ40 | ||
| Пфам | PF09230 | ||
| ИнтерПро | ИПР015311 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1в0д / СКОПе / СУПФАМ | ||
| |||
Активируемая каспазой ДНКаза ( CAD ) или субъединица бета фактора фрагментации ДНК представляет собой белок , который у человека кодируется DFFB геном . [ 5 ] [ 6 ] [ 7 ] Он разрушает ДНК во время апоптоза и способствует дифференцировке клеток. Обычно это неактивный мономер, ингибируемый ICAD. Он расщепляется перед димеризацией.
Функция
[ редактировать ]Апоптоз — это процесс самоуничтожения клеток, который удаляет токсичные и/или бесполезные клетки во время развития млекопитающих и других жизненных процессов. Апоптозный процесс сопровождается сжатием и фрагментацией клеток и ядер, а также деградацией хромосомной ДНК на нуклеосомные единицы. Фактор фрагментации ДНК (DFF) представляет собой гетеродимерный белок, состоящий из субъединиц массой 40 кДа (DFFB) и 45 кДа ( DFFA ). DFFA является субстратом каспазы-3 и запускает фрагментацию ДНК во время апоптоза. DFF активируется, когда DFFA расщепляется каспазой-3. Расщепленные фрагменты DFFA диссоциируют от DFFB, активного компонента DFF. Было обнаружено, что DFFB вызывает как фрагментацию ДНК, так и конденсацию хроматина во время апоптоза. Для этого гена было обнаружено множество альтернативно сплайсированных вариантов транскриптов, кодирующих различные изоформы, но биологическая ценность некоторых вариантов не определена. [ 7 ]

Несмотря на то, что этот ген присутствует в каждой клетке, этот белок экспрессируется только в различных тканях и типах клеток, таких как поджелудочная железа, сердце, толстая кишка, лейкоциты, простата, яичники, плацента, почки, селезенка и тимус. [ 8 ]
Он также известен как нуклеаза, активируемая каспазой (CPAN), фактор фрагментации ДНК 40 (DFF-40), DFF2 и DFFB. Кроме того, в результате объединения предыдущих номенклатур возникают и другие. [ 8 ] [ 9 ] [ 10 ] [ 11 ]
Структура
[ редактировать ]Этот гетеродимер представляет собой эндонуклеазу. [ 9 ] [ 12 ] [ 13 ] с высоким содержанием остатков цистеина . [ 11 ] Он остается неактивным в растущих клетках, пока он связан со своим ингибитором (ICAD, субъединица фактора фрагментации ДНК 45 кДа, DFFA или DFF45), что приводит к образованию комплекса ICAD-CAD. [ 8 ] [ 9 ] [ 11 ] [ 12 ] [ 14 ] [ 15 ] [ 16 ] [ 17 ] Их диссоциация позволяет DFF40 олигомеризоваться с образованием большого функционального комплекса, который сам по себе является активной ДНКазой. [ 11 ] [ 12 ] [ 15 ] [ 16 ] [ 17 ]
Субъединица DFF40 или CAD
[ редактировать ]Он весит 40 кДа. Более того, он содержит три домена, составляющих мономер CAD: C1 или N-концевой CAD; C2, которые соответствуют трем отдельным α-цепям, и, наконец, C3, который является самым крупным и функционально важным. Более того, объединение аминокислот C3 приводит к образованию 5 α-спиралей, 4 β-ламины и петли на каталитическом C-конце, которые взаимодействуют друг с другом. Таким образом, образуется полость (активный центр), в которую может поместиться ДНК, хотя существует другая область связывания, ответственная за стабильность комплекса ДНК во время его фрагментации. [ 8 ] [ 14 ] [ 18 ]
Субъединица DFF45 или ICAD
[ редактировать ]DFFA кодируется альтернативно зашифрованными мРНК, имеющими две разные формы: короткую (ICAD-S) и длинную (ICAD-L), которые действуют как специфический шаперон, обеспечивающий правильное сворачивание CAD. [ 10 ] [ 11 ] [ 17 ] Кроме того, он содержит два остатка аспарагиновой кислоты (Asp117 и Asp224), в которых идентифицируется CAD, и, следовательно, он остается связанным до тех пор, пока каспаза-3 не расщепит этот союз. [ 10 ] [ 14 ]
Процесс активации
[ редактировать ]Обычно в неапоптозных растущих клетках активируемая каспазой ДНКаза удерживается в цитоплазме в инактивированном виде благодаря ассоциации с ее ингибитором, ингибитором каспазо-активируемой ДНКазы (ICAD), также известным как фактор фрагментации ДНК 45 кДа (DFF45).
ICAD кодируется альтернативно сплайсированными мРНК, которые образуют длинную (ICAD-L) и короткую (ICAD-S) формы ICAD. Таким образом, ICAD имеет двойную функцию; он действует как ингибитор CAD, а также как сопровождающий для синтеза CAD, помогая правильной сборке белка. [ 19 ]
ICAD имеет два сайта распознавания каспаз: Asp117 и Asp224. Освобождение CAD от ингибирования ICAD достигается за счет расщепления ICAD по этим остаткам Asp каспазой -3 . [ 20 ]
Каспаза-3 активируется в апоптотической клетке. [ 9 ] Активация каспазы-3 необходима клеткам на ранних стадиях дифференцировки скелетных миобластов. Его каталитический сайт включает сульфогидрильную группу Cys-285 и имидазольное кольцо His-237. Каспаза-3 His-237 стабилизирует целевой аспартат, вызывая разрыв ассоциации ICAD и CAD, оставляя эндонуклеазу CAD активной, что позволяет ей разрушать хромосомную ДНК.
После высвобождения ингибитора для правильного функционирования два мономера CAD должны объединиться, чтобы сформировать функциональный димер, обладающий вертикальной симметрией.
Взаимодействия
[ редактировать ]Было показано, что DFFB взаимодействует с DFFA . [ 21 ] [ 22 ]
Дифференциация клеток
[ редактировать ]Каспаза 3 отвечает за клеточную дифференцировку , хотя неясно, как этот вид белка может способствовать апоптозу клеток . Сигналы каспаз, возникающие в результате активации нуклеазы CAD, указывают на то, что дифференцировка клеток обусловлена модификацией CAD в структуре хроматина.
ИБС приводит к инициированию разрыва цепи ДНК, который происходит во время терминальной дифференцировки некоторых клеток, таких как клетки скелетных мышц. Нацеливание на промотор р21 отвечает за индуцирование дифференцировки клеток, чему способствует модификация ядерного микроокружения ДНК. [ 23 ]
Разнообразие клеток возникает в результате дифференцировки клеток, которую объясняют активацией специфических факторов транскрипции. Это также зависит от активности белка или общего сигнала. Фактором, который, по-видимому, индуцирует большую дифференцировку клеток, является протеаза каспаза-3. [ 24 ] Это было идентифицировано как предпоследняя стадия пути апоптоза клетки.
Некоторые исследования показали, что эта дифференциация обусловлена многими субстратами CAD-киназы. На примере скелетных клеток их дифференцировка связана с расщеплением киназы MST1. [ 25 ]
Более того, было замечено, что CAD участвует в формировании генома, ДНК которого разрывается на ранних стадиях дифференцировки клеток. Кроме того, каспаза 3 индуцирует разрывы ДНК в промоторе фактора р21, и этот разрыв цепи связан с экспрессией гена р21.
Апоптозная смерть клеток
[ редактировать ]Протеин-каспаза ДНКаза представляет собой эндонуклеазу, участвующую в процессе апоптоза клеток, который облегчает разрыв ДНК. [ 26 ] Апоптозная гибель клеток — это процесс, осуществляемый цистеиновыми протеазами. [ 27 ] это позволяет животным сохранять гомеостаз , который также регулируется другими механизмами, такими как рост и дифференцировка клеток. Этот биологический ответ характеризуется деградацией хромосомной ДНК на крошечные фрагменты внутри ядра клетки. [ 28 ] После многих исследований и исследований удалось убедиться, что ДНКаза, активируемая каспазой, является основной причиной этого разрушения из-за длинного списка стимулов.
Один из экспериментов, проведенных исследователями с целью доказать эту теорию, был основан на введении мутированной формы этого белка как в клетки человека TF-1, так и в клетки Jurkat , которые уже отреагировали на обычную (не мутированную) форму эндонуклеаза, и они умерли от апоптоза. В результате эти клетки погибли с учетом этой генетической модификации, но разрыва ДНК в них не произошло. Это было ключевым доказательством того, что форма САПР вовлечена в эту часть процесса, поскольку без ее участия фрагментация не произошла бы. [ 29 ]
Позднее выяснилось, что то, как этот белок индуцирует разрыв ДНК, объясняется его формами CAD и ICAD, которые облегчают как вход, так и выход в ядро клетки. [ 28 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000169598 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000029027 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Лю X, Цзоу Х, Слотер С, Ван X (апрель 1997 г.). «DFF, гетеродимерный белок, который действует ниже каспазы-3, вызывая фрагментацию ДНК во время апоптоза» . Клетка . 89 (2): 175–84. doi : 10.1016/S0092-8674(00)80197-X . ПМИД 9108473 . S2CID 14800864 .
- ^ Халенбек Р., Макдональд Х., Роулстон А., Чен Т.Т., Конрой Л., Уильямс Л.Т. (апрель 1998 г.). «CPAN, нуклеаза человека, регулируемая чувствительным к каспазам ингибитором DFF45» . Современная биология . 8 (9): 537–40. Бибкод : 1998CBio....8..537H . дои : 10.1016/S0960-9822(98)79298-X . ПМИД 9560346 . S2CID 9837862 .
- ^ Перейти обратно: а б «Ген Энтрез: фактор фрагментации ДНК DFFB, 40 кДа, бета-полипептид (ДНаза, активируемая каспазой)» .
- ^ Перейти обратно: а б с д Дэвидсон Колледж. «Каспазо-активируемая дезоксирибонуклеаза (CAD)» . Проверено 21 января 2016 г.
- ^ Перейти обратно: а б с д Юсте В.Дж., Санчес-Лопес И., Соле С., Мубарак Р.С., Байаскас Дж.Р., Дольчет Икс и др. (октябрь 2005 г.). «Вклад фактора, индуцирующего апоптоз, ДНКазы, активируемой каспазой, и ингибитора ДНКазы, активируемой каспазой, в ядерный фенотип и деградацию ДНК во время апоптоза» . Журнал биологической химии . 280 (42): 35670–83. дои : 10.1074/jbc.M504015200 . ПМИД 16049016 .
- ^ Перейти обратно: а б с Сакахира Х., Ивамацу А., Нагата С. (март 2000 г.). «Специфическая шапероноподобная активность ингибитора каспазо-активируемой ДНКазы для каспазо-активируемой ДНКазы» . Журнал биологической химии . 275 (11): 8091–6. дои : 10.1074/jbc.275.11.8091 . ПМИД 10713130 .
- ^ Перейти обратно: а б с д и Сакахира Х., Энари М., Нагата С. (май 1999 г.). «Функциональные различия двух форм ингибитора каспазо-активируемой ДНКазы, ICAD-L и ICAD-S» . Журнал биологической химии . 274 (22): 15740–4. дои : 10.1074/jbc.274.22.15740 . ПМИД 10336474 .
- ^ Перейти обратно: а б с Джог Н.Р., Фризони Л., Ши К., Монестье М., Эрнандес С., Крафт Дж. и др. (апрель 2012 г.). «ДНКаза, активируемая каспазой, необходима для поддержания толерантности к ядерным аутоантигенам волчанки» . Артрит и ревматизм . 64 (4): 1247–56. дои : 10.1002/арт.33448 . ПМЦ 3292632 . ПМИД 22127758 .
- ^ Видлак П., Ланушевска Дж., Кэри Р.Б., Гаррард В.Т. (июль 2003 г.). «Субъединичные структуры и стехиометрия белков фактора фрагментации ДНК человека до и после индукции апоптоза» . Журнал биологической химии . 278 (29): 26915–22. дои : 10.1074/jbc.M303807200 . ПМИД 12748178 .
- ^ Перейти обратно: а б с Рех С., Корн С., Гимадутдинов О., Мейсс Г. (декабрь 2005 г.). «Структурные основы образования стабильного комплекса ДНК с помощью ДНКазы, активируемой каспазой» . Журнал биологической химии . 280 (50): 41707–15. дои : 10.1074/jbc.m509133200 . ПМИД 16236713 .
- ^ Перейти обратно: а б Видлак П., Ли П., Ван Х, Гаррард В.Т. (март 2000 г.). «Предпочтения расщепления апоптотической эндонуклеазы DFF40 (активируемой каспазой ДНКазы или нуклеазы) на обнаженной ДНК и субстратах хроматина» . Журнал биологической химии . 275 (11): 8226–32. дои : 10.1074/jbc.275.11.8226 . ПМИД 10713148 .
- ^ Перейти обратно: а б Шариф-Аскари Э., Алам А., Реом Э., Бересфорд П.Дж., Скотто С., Шарма К. и др. (июнь 2001 г.). «Прямое расщепление фактора фрагментации ДНК-45 человека гранзимом B индуцирует активируемую каспазой высвобождение ДНКазы и фрагментацию ДНК» . Журнал ЭМБО . 20 (12): 3101–13. дои : 10.1093/emboj/20.12.3101 . ПМК 150191 . ПМИД 11406587 .
- ^ Перейти обратно: а б с Лю X, Цзоу Х, Видлак П., Гаррард В., Ван Х (май 1999 г.). «Активация апоптотической эндонуклеазы DFF40 (активируемая каспазой ДНКаза или нуклеаза). Олигомеризация и прямое взаимодействие с гистоном H1» . Журнал биологической химии . 274 (20): 13836–40. дои : 10.1074/jbc.274.20.13836 . ПМИД 10318789 .
- ^ Уэгаки К., Отомо Т., Сакахира Х., Симидзу М., Юмото Н., Кёгоку Ю. и др. (апрель 2000 г.). «Структура CAD-домена каспазо-активируемой ДНКазы и взаимодействие с CAD-доменом ее ингибитора». Журнал молекулярной биологии . 297 (5): 1121–8. дои : 10.1006/jmbi.2000.3643 . ПМИД 10764577 .
- ^ ВВП : 1V0D ; Ву Э.Дж., Ким Ю.Г., Ким М.С., Хан В.Д., Шин С., Робинсон Х. и др. (май 2004 г.). «Структурный механизм инактивации и активации CAD/DFF40 на апоптотическом пути» . Молекулярная клетка . 14 (4): 531–9. дои : 10.1016/S1097-2765(04)00258-8 . ПМИД 15149602 .
- ^ «CASP3 каспаза 3 [Homo sapiens (человек)] - Ген - NCBI» .
- ^ Юинг Р.М., Чу П., Элизма Ф., Ли Х., Тейлор П., Клими С. и др. (2007). «Крупномасштабное картирование белково-белковых взаимодействий человека методом масс-спектрометрии» . Молекулярная системная биология . 3 (1): 89. дои : 10.1038/msb4100134 . ПМЦ 1847948 . ПМИД 17353931 .
- ^ Маккарти Дж.С., Тох С.Ю., Ли П. (октябрь 1999 г.). «Исследование DFF45 в роли шаперона и ингибитора: два независимых ингибирующих домена нуклеазной активности DFF40». Связь с биохимическими и биофизическими исследованиями . 264 (1): 176–80. дои : 10.1006/bbrc.1999.1497 . ПМИД 10527860 .
- ^ Ларсен Б.Д., Рампалли С., Бернс Л.Е., Брюнетка С., Дилворт Ф.Дж., Мегени Л.А. (март 2010 г.). «Каспаза-3/активируемая каспазой ДНКаза способствуют дифференцировке клеток, вызывая разрывы цепей ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (9): 4230–5. Бибкод : 2010PNAS..107.4230L . дои : 10.1073/pnas.0913089107 . ПМК 2840077 . ПМИД 20160104 .
- ^ Фернандо П., Мегени Л.А. (январь 2007 г.). «Является ли каспазозависимый апоптоз всего лишь дифференцировкой клеток, доведенной до крайности?» . Журнал ФАСЭБ . 21 (1): 8–17. дои : 10.1096/fj.06-5912hyp . ПМИД 17093139 . S2CID 11933880 .
- ^ Фернандо П., Келли Дж. Ф., Балажи К., Слэк Р. С., Мегени Л. А. (август 2002 г.). «Активность каспазы 3 необходима для дифференцировки скелетных мышц» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (17): 11025–30. Бибкод : 2002PNAS...9911025F . дои : 10.1073/pnas.162172899 . ПМЦ 123204 . ПМИД 12177420 .
- ^ Лай С.К., Вонг Ч. , Ли Ю.П. , Ли ХИ (июнь 2011 г.). «Опосредованная каспазой-3 деградация конденсина Cap-H регулирует митотическую гибель клеток» . Смерть клеток и дифференцировка . 18 (6): 996–1004. дои : 10.1038/cdd.2010.165 . ПМК 3131938 . ПМИД 21151026 .
- ^ Марсден В.С., О'Коннор Л., О'Рейли Л.А., Силке Дж., Меткалф Д., Экерт П.Г. и др. (октябрь 2002 г.). «Апоптоз, инициируемый активацией каспазы, регулируемой Bcl-2, независимо от апоптосомы цитохрома c/Apaf-1/каспазы-9». Природа . 419 (6907): 634–7. Бибкод : 2002Natur.419..634M . дои : 10.1038/nature01101 . ПМИД 12374983 . S2CID 4415828 .
- ^ Перейти обратно: а б Энари М., Сакахира Х., Ёкояма Х., Окава К., Ивамацу А., Нагата С. (январь 1998 г.). «ДНКаза, активируемая каспазой, которая разрушает ДНК во время апоптоза, и ее ингибитор ICAD». Природа 391 (6662): 43–50. Бибкод : 1998Nature.391...43E . дои : 10.1038/34112 . ПМИД 9422506 . S2CID 4407426 .
- ^ Макилрой Д., Сакахира Х., Таланиан Р.В., Нагата С. (август 1999 г.). «Участие ДНКазы, активируемой каспазой 3, в межнуклеосомном расщеплении ДНК, индуцированном различными апоптотическими стимулами» . Онкоген . 18 (31): 4401–8. дои : 10.1038/sj.onc.1202868 . ПМИД 10442630 .
Дальнейшее чтение
[ редактировать ]- Индукция апоптоза (Видео). Гирлянда Наука / YouTube . 2009. Из Мерфи К., Трэверс П., Уолдпорт М., Эренштейн М. (2008). Иммунобиология Лейнуэя (7-е изд.). Нью-Йорк: Garland Science. ISBN 978-0-8153-4123-9 .
- Энари М., Сакахира Х., Ёкояма Х., Окава К., Ивамацу А., Нагата С. (январь 1998 г.). «ДНКаза, активируемая каспазой, которая разрушает ДНК во время апоптоза, и ее ингибитор ICAD». Природа 391 (6662): 43–50. Бибкод : 1998Nature.391...43E . дои : 10.1038/34112 . ПМИД 9422506 . S2CID 4407426 .
- Лю X, Ли П, Видлак П, Цзоу Х, Луо X, Гаррард WT и др. (июль 1998 г.). «Субъединица фактора фрагментации ДНК массой 40 кДа индуцирует фрагментацию ДНК и конденсацию хроматина во время апоптоза» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (15): 8461–6. Бибкод : 1998PNAS...95.8461L . дои : 10.1073/pnas.95.15.8461 . ПМК 21098 . ПМИД 9671700 .
- Мукаэ Н., Энари М., Сакахира Х., Фукуда Ю., Инадзава Дж., То Х. и др. (август 1998 г.). «Молекулярное клонирование и характеристика человеческой ДНКазы, активируемой каспазой» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (16): 9123–8. Бибкод : 1998PNAS...95.9123M . дои : 10.1073/pnas.95.16.9123 . ПМК 21302 . ПМИД 9689044 .
- Гу Дж, Донг Р.П., Чжан С., Маклафлин Д.Ф., Ву MX, Шлоссман С.Ф. (июль 1999 г.). «Функциональное взаимодействие DFF35 и DFF45 с активируемой каспазой нуклеазой фрагментации ДНК DFF40» . Журнал биологической химии . 274 (30): 20759–62. дои : 10.1074/jbc.274.30.20759 . ПМИД 10409614 .
- Маккарти Дж.С., Тох С.Ю., Ли П. (октябрь 1999 г.). «Исследование DFF45 в роли шаперона и ингибитора: два независимых ингибирующих домена нуклеазной активности DFF40». Связь с биохимическими и биофизическими исследованиями . 264 (1): 176–80. дои : 10.1006/bbrc.1999.1497 . ПМИД 10527860 .
- Маккарти Дж.С., Тох С.Ю., Ли П. (октябрь 1999 г.). «Несколько доменов DFF45 синергически связываются с DFF40: роль расщепления каспазы и секвестрации активаторного домена DFF40». Связь с биохимическими и биофизическими исследованиями . 264 (1): 181–5. дои : 10.1006/bbrc.1999.1498 . ПМИД 10527861 .
- Луговской А.А., Чжоу П., Чоу Дж.Дж., Маккарти Дж.С., Ли П., Вагнер Г. (декабрь 1999 г.). «Структура раствора домена CIDE-N CIDE-B и модель взаимодействия CIDE-N/CIDE-N в пути фрагментации ДНК при апоптозе» . Клетка . 99 (7): 747–55. дои : 10.1016/S0092-8674(00)81672-4 . ПМИД 10619428 .
- Джадсон Х., ван Рой Н., Штейн Л., Вандесомпель Дж., Ван Геле М., Спелеман Ф. и др. (апрель 2000 г.). «Анализ структуры и мутаций гена, кодирующего фактор фрагментации ДНК 40 (каспаза-активируемая нуклеаза), кандидатный ген-супрессор опухоли нейробластомы». Генетика человека . 106 (4): 406–13. дои : 10.1007/s004390000257 . ПМИД 10830907 . S2CID 38271068 .
- Отомо Т., Сакахира Х., Уэгаки К., Нагата С., Ямадзаки Т. (август 2000 г.). «Структура гетеродимерного комплекса между CAD-доменами CAD и ICAD». Структурная биология природы . 7 (8): 658–62. дои : 10.1038/77957 . ПМИД 10932250 . S2CID 12925074 .
- Дурье Ф., Самедзима К., Форчун Дж.М., Кандельс-Льюис С., Ошерофф Н., Эрншоу В.К. (2001). «ДНК-топоизомераза IIальфа взаимодействует с нуклеазой CAD и участвует в конденсации хроматина во время апоптоза» . Современная биология . 10 (15): 923–6. дои : 10.1016/S0960-9822(00)00620-5 . ПМИД 10959840 . S2CID 17443069 .
- Чжоу П., Луговской А.А., Маккарти Дж.С., Ли П., Вагнер Г. (май 2001 г.). «Структура раствора N-концевого доменного комплекса DFF40 и DFF45 и взаимная шаперонная активность DFF40 и DFF45» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (11): 6051–5. Бибкод : 2001PNAS...98.6051Z . дои : 10.1073/pnas.111145098 . ПМК 33420 . ПМИД 11371636 .
- Ни З., Феникс Б.Н., Лам Дж.Дж., Алам А., Линч Д.Х., Беккет Б. и др. (ноябрь 2002 г.). «Протеаза ВИЧ-1 обрабатывает прокаспазу 8, вызывая митохондриальное высвобождение цитохрома с, расщепление каспазы и фрагментацию ядра». Смерть клеток и дифференцировка . 9 (11): 1172–84. дои : 10.1038/sj.cdd.4401094 . ПМИД 12404116 . S2CID 38809690 .
- Се С.Ю., Ляу С.Ф., Ли С.Н., Се П.С., Лин К.Х., Чу СМ и др. (январь 2003 г.). «Аберрантные транскрипты ДНКазы, активируемой каспазой (CAD), в клетках гепатомы человека» . Британский журнал рака . 88 (2): 210–6. дои : 10.1038/sj.bjc.6600695 . ПМК 2377037 . ПМИД 12610505 .
- Лю К.Л., Киши Х., Оцука К., Мурагути А. (сентябрь 2003 г.). «Белок теплового шока 70 связывает активируемую каспазой ДНКазу и усиливает ее активность в TCR-стимулированных Т-клетках» . Кровь . 102 (5): 1788–96. дои : 10.1182/кровь-2002-11-3499 . ПМИД 12738667 .
- Видлак П., Ланушевска Дж., Кэри Р.Б., Гаррард В.Т. (июль 2003 г.). «Субъединичные структуры и стехиометрия белков фактора фрагментации ДНК человека до и после индукции апоптоза» . Журнал биологической химии . 278 (29): 26915–22. дои : 10.1074/jbc.M303807200 . ПМИД 12748178 .
- Хиллман Р.Т., Грин Р.Э., Бреннер С.Е. (2005). «Недооцененная роль надзора за РНК» . Геномная биология . 5 (2): С8. дои : 10.1186/gb-2004-5-2-r8 . ПМЦ 395752 . ПМИД 14759258 .
- Баяскас-младший, Юсте В.Дж., Соле С., Санчес-Лопес И., Сегура М.Ф., Перера Р. и др. (май 2004 г.). «Характеристика сплайсинговых вариантов ДНКазы, активируемой каспазой человека, со структурой и функцией CIDE-N» . Письма ФЭБС . 566 (1–3): 234–40. Бибкод : 2004FEBSL.566..234B . doi : 10.1016/j.febslet.2004.04.050 . ПМИД 15147901 . S2CID 22464440 .