Аденин фосфорибозилтрансфераза
| Апрель | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | APRT , AMP, APRTD, Аденин -фосфорибозилтрансфераза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 102600 ; MGI : 88061 ; Гомологен : 413 ; Genecards : Aprt ; OMA : APRT - Ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Аденинфосфорибозилтрансфераза ( APRTase ) представляет собой фермент , кодируемый APRT геном , обнаруженным у людей на хромосоме 16 . [ 5 ] Он является частью семейства Prtase I типа и участвует в пути спасения нуклеотидов , который обеспечивает альтернативу биосинтезу нуклеотидов de novo у людей и большинства других животных. [ 6 ] В паразитарных простейших , таких как Giardia , Aprtase обеспечивает единственный механизм, с помощью которого усилитель может быть получен. [ 7 ] Дефицит апрелязы способствует образованию камней почек ( уролитиаз ) и потенциальной почечной недостаточности . [ 8 ]
Функция
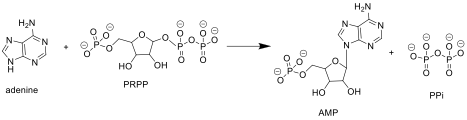
[ редактировать ]APRTASE катализирует следующую реакцию в пути спасения пуриновых нуклеотидов :
Аденин + фосфорибозилпирофосфат ( PRPP ) → аденилат ( AMP ) + пирофосфат ( PPI )
В организмах, которые могут синтезировать пурины de novo, путь спасения нуклеотидов обеспечивает альтернативу, которая энергетически более эффективна. Он может спасти аденин от полиаминового биосинтетического пути или из диетических источников пуринов. [ 6 ] Хотя APRTASE функционально избыточно в этих организмах, она становится более важным в периоды быстрого роста, таких как эмбриогенез и рост опухоли. [ 9 ] Это конститутивно экспрессируется во всех тканях млекопитающих. [ 10 ]
У простейших паразитов путь спасения нуклеотидов обеспечивает единственные средства для синтеза нуклеотидов. Поскольку последствия дефицита APRTASE у людей являются сравнительно мягкими и поддающимися лечению, возможно лечить определенные паразитические инфекции путем нацеливания на функцию APRTASE. [ 11 ]
У растений , как и в других организмах, арптаза функционирует главным образом для синтеза аденилата . Он обладает уникальной способностью метаболизировать цитокинины - гормон растений , который может существовать в качестве основания , нуклеотида или нуклеозида - into аденилат нуклеотиды. [ 12 ]
APRT функционально связан с гипоксантино-гуаниновой фосфорибозилтрансферазой (HPRT).
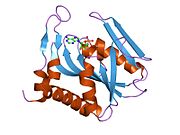
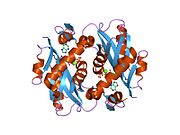
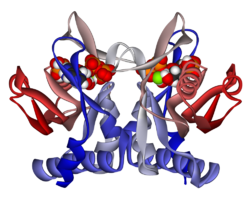
Структура
[ редактировать ]Aprtase - это гомодимер с 179 аминокислотными остатками на мономер . Каждый мономер содержит следующие регионы:
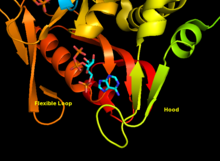
- «Ядро» домен (остатки 33-169) с пятью параллельными β-листами
- Домен «капюшона» (остатки 5-34) с 2 α-спиралями и 2 β-листами
- Домен «Гибкой петли» (остатки 95-113) с 2 антипараллельными β-листами [ 10 ]
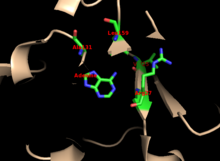
Ядро высоко консервативно во многих PrTases. Капюшон, который содержит аденина сайт связывания , имеет большую изменчивость в семействе ферментов. Мотив из 13 ресурсов содержит область связывания PRPP и включает в себя два соседних кислотных остатка и, по крайней мере, один окружающий гидрофобный остаток. [ 13 ]
Специфичность фермента для аденина включает в себя гидрофобные остатки ALA131 и LEU159 в домене CORE. У людей два остатка в водородной связи домена капюшона с пурином для дальнейшей специфичности: Val25 с гидрогинами на N6 и Arg27 с N1. Хотя гибкий цикл не взаимодействует с капюшоном во время распознавания пурина, считается, что он закрывает активное сайт и изолирует реакцию растворителей . [ 10 ]
Большинство исследований по Aprtase сообщает, что Mg 2+ имеет важное значение для переноса фосфорибозила, и это консервативно между протазами I типа. [ 12 ] Тем не менее, недавние усилия по решению структуры человеческой апрелязы не смогли найти один сайт для MG 2+ , но нашел доказательства, чтобы предложить CL − Атом возле TRP98. Несмотря на сложность размещения MG 2+ Общепринято, что каталитический механизм зависит от этого иона. [ 6 ]
Механизм
[ редактировать ]APRTASE проходит посредством упорядоченного последовательного механизма BI BI, включающего образование тройного комплекса. Фермент сначала связывает PRPP , за которым следует аденин . После возникновения фосфорибозильного переноса сначала пирофосфатные листья с последующим усилителем . Кинетические исследования показывают, что перенос фосфорибозила является относительно быстрым, в то время как высвобождение продукта (особенно высвобождение AMP) ограничивает скорость . [ 9 ]
В человеке Aprtase считается, что Glu104 оксарбения с образованием переходного состояния абстрагирована Adenine's N9 Proton . Это функционирует как нуклеофил для атаки аномерного углерода PRPP, образуя AMP и вытесняя пирофосфат из PRPP. Механизм APRTASE, как правило, согласуется с механизмом других PRTases, которые сохраняют функцию вытеснения α-1-пирофосфата PRPP с использованием азотного нуклеофила, либо в атаке S N 1 или S N 2. [ 6 ]
Дефицит
[ редактировать ]Когда AprTase имеет снижение или несуществующую активность, аденин накапливается из других путей. Он деградируется ксантинодегидрогеназой до 2,8-дигидроксиаденина (DHA). Хотя DHA является белком в плазме , он имеет низкую растворимость в моче и постепенно осаждается в канальцах почек , что приводит к образованию камней почек ( уролитиаз ). Если оставить необработанное, это состояние может в конечном итоге вызвать почечную недостаточность . [ 8 ]
Дефицит арптазы был впервые диагностирован в Великобритании в 1976 году. С тех пор у людей были определены две категории дефицита апрелязы. [ 14 ]
Дефицит типа I приводит к полной потере активности APRTase и может возникнуть у пациентов с гомозиготными или сложными гетерозиготными для различных мутаций . [ 15 ] Секвенирование выявило множество различных мутаций, которые могут объяснить тип 1, включая миссенс -мутации , бессмысленные мутации , дублированный набор из 4 пар оснований в экзоне 3, [ 16 ] и одна тимина вставка в интроне 4. [ 17 ] Эти мутации вызывают эффекты, которые сгруппированы в три основные области: в связывании β-фосфата PRPP, в связывании 5'-фосфата PRPP и в сегменте гибкого цикла, который закрывается над активным сайтом во время катализа [ 10 ] Дефицит типа I наблюдался в различных этнических группах, но изучался преимущественно среди белых популяций. [ 17 ]
Дефицит типа II приводит к снижению аффинности к PRPP, что приводит к десятикратному увеличению значения M. K [ 6 ] Это было наблюдалось и изучалось в основном в Японии . [ 17 ]
Диагноз дефицита APRTase может быть поставлен путем анализа камней почек , измерения концентраций DHA в моче или анализа активности APRTase в эритроцитах . Он поддается регулярным дозам аллопуринола или фебуксостата , которые ингибируют активность ксантинодегидрогеназы для предотвращения накопления и осаждения DHA. [ 18 ] Состояние также может быть ослаблено с низкой пищей и высоким потреблением жидкости. [ 14 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в GRCH38: Ensembl Release 89: ENSG00000198931 - ENSEMBL , май 2017 г.
- ^ Jump up to: а беременный в GRCM38: Ensembl Release 89: Ensmusg00000006589 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Valaperta R, Rizzo V, Lombardi F, Verdelli C, Piccoli M, Ghiroldi A, Creo P, Colombo A, Valisi M, Margiotta E, Panella R, Costa и (1 июля 2014 г.). «Дефицит аденинфосфорибозилтрансферазы (APRT): идентификация новой бессмысленной мутации» . BMC нефрология . 15 : 102. DOI : 10.1186/1471-2369-15-102 . PMC 4094445 . PMID 24986359 .
- ^ Jump up to: а беременный в дюймовый и Silva CH, Silva M, Iulek J, Thiemann OH (Jun 2008). «Структурные комплексы человеческой адениновой фосфорибозилтрансферазы показывают новые особенности каталитического механизма APRT». Журнал биомолекулярной структуры и динамики . 25 (6): 589–97. doi : 10.1080/07391102.2008.10507205 . PMID 18399692 . S2CID 40788077 .
- ^ Sarver AE, Wang CC (октябрь 2002 г.). «Аденин -фосфорибозилтрансфераза из Giardia Lamblia имеет уникальный механизм реакции и необычные субстратные связывающие свойства» . Журнал биологической химии . 277 (42): 39973–80. doi : 10.1074/jbc.m205595200 . PMID 12171924 .
- ^ Jump up to: а беременный Shi W, Tanaka KS, Crother TR, Taylor MW, Almo SC, Schramm VL (сентябрь 2001 г.). «Структурный анализ аденинфосфорибозилтрансферазы из Saccharomyces cerevisiae». Биохимия . 40 (36): 10800–9. doi : 10.1021/bi010465h . PMID 11535055 .
- ^ Jump up to: а беременный Bashor C, Denu JM, Brennan RG, Ullman B (март 2002 г.). «Кинетический механизм адениновой фосфорибозилтрансферазы из Лейшмании Доновани». Биохимия . 41 (12): 4020–31. doi : 10.1021/bi0158730 . PMID 11900545 .
- ^ Jump up to: а беременный в дюймовый Сильва М., Сильва Ч., Иулек Дж., Тиманн О, (июнь 2004 г.). «Трехмерная структура человеческой адениновой фосфорибозилтрансферазы и ее связь с дха-аролитиазом». Биохимия . 43 (24): 7663–71. doi : 10.1021/bi0360758 . PMID 15196008 .
- ^ Shi W, Sarver AE, Wang CC, Tanaka KS, Almo SC, Schramm VL (октябрь 2002 г.). «Комплексы закрытого участка аденинфосфорибозилтрансферазы из Giardia Lamblia выявляют механизм рибозильной миграции» . Журнал биологической химии . 277 (42): 39981–8. doi : 10.1074/jbc.m205596200 . PMID 12171925 .
- ^ Jump up to: а беременный Аллен М., Цинь В., Моро Ф., Моффатт Б (май 2002). «Аденин -фосфорибозилтрансфераза изоформ арабидопсиса и их потенциальный вклад в метаболизм аденина и цитокинина». Physiologia plantarum . 115 (1): 56–68. doi : 10.1034/j.1399-3054.2002.1150106.x . PMID 12010467 .
- ^ Лю Q, Хироно С., Моригучи I (август 1990 г.). «Количественная структура-активность отношений для ингибиторов кальмодулина» . Химический и фармацевтический бюллетень . 38 (8): 2184–9. doi : 10.1248/cpb.38.2184 . PMID 2279281 .
- ^ Jump up to: а беременный Cassidy MJ, McCulloch T, Fairbanks LD, Simmonds HA (март 2004 г.). «Диагностика дефицита аденинфосфорибозилтрансферазы в качестве основной причины почечной недостаточности у реципиента почечной трансплантации» . Нефрология, диализ, трансплантация . 19 (3): 736–8. doi : 10.1093/ndt/gfg562 . PMID 14767036 .
- ^ Bollée G, Harambat J, Bensman A, Knebelmann B, Daudon M, Ceballos-Picot I (сентябрь 2012 г.). "Аденин -фосфорбебсилтрансфераза дефицит " Клинический журнал Американского общества нефрологии 7 (9): 1521–7 Doi : 10.2215/ cjn.02320312 22700886PMID
- ^ Каматани Н., Хакода М., Оцука С., Йошикава Х., Кашивазаки С. (июль 1992). «Только три мутации объясняют почти все дефектные аллели, вызывающие дефицит аденинфосфорибозилтрансферазы у японских пациентов» . Журнал клинических исследований . 90 (1): 130–5. doi : 10.1172/jci115825 . PMC 443071 . PMID 1353080 .
- ^ Jump up to: а беременный в Bollée G, Dollinger C, Boutaud L, Guillemot D, Bensman A, Harambat J, Deteix P, Daudon M, Knebelmann B, Ceballos-Picot I (апрель 2010 г.). «Фенотип и характеристика генотипа адениновой фосфорибозилтрансферазы» . Журнал Американского общества нефрологии . 21 (4): 679–88. doi : 10.1681/asn.2009080808 . PMC 2844298 . PMID 20150536 .
- ^ Edvardsson VO, Palsson R, Sahota A (1993). Ра Панд, Адам М.П., Х.Х. Ардинг, Уоллес, Амемия А., Бин Л.Дж., Т.Д. Берд, Фонг К.Т., Меффорд Х.К., Смит Р.Дж., Стивенс К (ред.). "Аденин Цели дефицита" Sourcerews PMID 22934314 .
Дальнейшее чтение
[ редактировать ]- Тишфилд Дж.А., Энгл С.Дж., Гупта П.К., Бой С., Бояджиев С., Шао С., О'Нил П., Альбертини Р.Дж., Стамбрук П.Дж., Сахота А.С. (1995). «Зародышевая линия и соматическая мутация в локусе APRT мышей и человека». Метаболизм пурина и пиримидина у человека VIII . Достижения в области экспериментальной медицины и биологии. Тол. 370. С. 661–4. doi : 10.1007/978-1-4615-2584-4_137 . ISBN 978-1-4613-6105-3 Полем PMID 7660991 .
- Takeuchi H, Kaneko Y, Fujita J, Yoshida O (апрель 1993 г.). «Случай составной гетерозиготы для дефицита адениновой фосфорибозилтрансферазы (APRT*J/APRT*Q0), приводящий к 2,8-дигидроксиаденину-уролитиазу: обзор сообщенных случаев с 2,8-дигидроксиадениновыми камнями в Японии». Журнал урологии . 149 (4): 824–6. doi : 10.1016/s0022-5347 (17) 36222-5 . PMID 8455250 .
- Ludwig H, Kuzmits R, Pietschmann H, Müller MM (ноябрь 1979 г.). «Ферменты системы пуриновой взаимосвязи при хронической лимфатической лейкозе: снижение активности пуриновой нуклеозидфосфорилазы и аденозин -деаминазы». Блут 39 (5): 309–15. doi : 10.1007/bf01014193 . PMID 116697 . S2CID 6283377 .
- Джонсон Л.А., Гордон Р.Б., Эммерсон Б.Т. (апрель 1977). «Аденинфосфорибозилтрансфераза: простой спектрофотометрический анализ и частота мутации в нормальной популяции». Биохимическая генетика . 15 (3–4): 265–72. doi : 10.1007/bf00484458 . PMID 869896 . S2CID 41264715 .
- Каматани Н., Хакода М., Оцука С., Йошикава Х., Кашивазаки С. (июль 1992). «Только три мутации объясняют почти все дефектные аллели, вызывающие дефицит аденинфосфорибозилтрансферазы у японских пациентов» . Журнал клинических исследований . 90 (1): 130–5. doi : 10.1172/jci115825 . PMC 443071 . PMID 1353080 .
- Chen J, Sahota A, Laxdal T, Scrine M, Bowman S, Cui C, Stambrook PJ, Tischfield JA (Dec 1991). «Идентификация единой миссенс -мутации в гене адениновой фосфорибозилтрансферазы (APRT) от пяти исландских пациентов и британского пациента» . Американский журнал человеческой генетики . 49 (6): 1306–11. PMC 1686459 . PMID 1746557 .
- Mimori A, Hidaka Y, Wu VC, Tarlé SA, Kamatani N, Kelley WN, Pallela TD (январь 1991). «Мутантный аллель, общий для дефицита адениновой фосфорибозилтрансферазы типа I у японских субъектов» . Американский журнал человеческой генетики . 48 (1): 103–7. PMC 1682758 . PMID 1985452 .
- Чен Дж., Сахота А., Стамбрук П.Дж., Тишфилд Дж.А. (июль 1991). «Амплификация полимеразной цепной реакции и анализ последовательности мутантных генов аденин -фосфорибозилтрансферазы человека: природа и частота ошибок, вызванные ДНК -полимеразой TAQ». Мутационные исследования . 249 (1): 169–76. doi : 10.1016/0027-5107 (91) 90143-c . PMID 2067530 .
- Gathof BS, Sahota A, Gresser U, Chen J, Stambrook PJ, Tischfield Yes, Zöllner N (Dec 1990). «Идентификация мутации сплайсинга в локусе адениновой фосфорибозилтрансферазы в немецком семействе». Клинический еженедельный . 69 (24): 1152–5. Doi : 10.1007/bf01815434 . PMID 2135300 . S2CID 11791868 .
- Каматани Н., Куросима С., Хакода М., Палелла Т.Д., Хидака Y (октябрь 1990). «Кроссеры в короткой последовательности ДНК указывают на длинную эволюционную историю мутации APRT*J» (PDF) . Человеческая генетика . 85 (6): 600–4. doi : 10.1007/bf00193582 . HDL : 2027.42/47628 . PMID 2227951 . S2CID 10595601 .
- Каматани Н., Куросима С., Терай С., Хидака Ю., Палелла Т.Д., Нишиока К (август 1989 г.). «Обнаружение аминокислотной замещения в мутантном ферменте для специального типа дефицита аденинфосфорибозилтрансферазы (APRT) с помощью специфического расщепления белка последовательно» . Американский журнал человеческой генетики . 45 (2): 325–31. PMC 1683345 . PMID 2502918 .
- Hidaka Y, Tarlé SA, Fujimori S, Kamatani N, Kelley WN, Palella TD (март 1988 г.). «Дефицит человеческого аденина фосфорибозилтрансферазы. Демонстрация одного мутантного аллеля, общего для японцев» . Журнал клинических исследований . 81 (3): 945–50. doi : 10.1172/jci113408 . PMC 442550 . PMID 3343350 .
- Wilson JM, O'toole TE, Argos P, Shewach DS, Daddona PE, Kelley WN (октябрь 1986 г.). «Человеческая аденинфосфорибозилтрансфераза. Полная аминокислотная последовательность фермента эритроцитов» . Журнал биологической химии . 261 (29): 13677–83. doi : 10.1016/s0021-9258 (18) 67074-7 . PMID 3531209 .
- Бродерик Т.П., Шафф Д.А., Бертино А.М., Душ М.К., Тишфилд Дж.А., Стамбрук П.Дж. (май 1987). «Сравнительная анатомия гена и фермента человека APRT: дивергенция нуклеотидов и сохранение нерушительного динуклеотидного расположения CPG» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (10): 3349–53. Bibcode : 1987pnas ... 84.3349b . doi : 10.1073/pnas.84.10.3349 . PMC 304867 . PMID 3554238 .
- Hidaka Y, Palella TD, O'toole TE, Tarlé SA, Kelley WN (ноябрь 1987). «Человеческий аденинфосфорибозилтрансфераза. Идентификация аллельных мутаций на нуклеотидном уровне в качестве причины полного дефицита фермента» . Журнал клинических исследований . 80 (5): 1409–15. doi : 10.1172/jci113219 . PMC 442397 . PMID 3680503 .
- Hidaka Y, Tarlé SA, O'toole TE, Kelley WN, Palella TD (ноябрь 1987). «Нуклеотидная последовательность гена APRT человека» . Исследование нуклеиновых кислот . 15 (21): 9086. DOI : 10.1093/NAR/15.21.9086 . PMC 306432 . PMID 3684585 .
- Чен Дж., Сахота А., Мартин Г.Ф., Хакода М., Каматани Н., Стамбрук П.Дж., Тишфилд Дж.А. (июнь 1993 г.). «Анализ зародышевой линии и in vivo соматических мутаций в гене адениновой фосфорибозилтрансферазы человека: мутационные горячие точки на донорном сайте интрон 4 и в кодоне 87». Мутационные исследования . 287 (2): 217–25. doi : 10.1016/0027-5107 (93) 90014-7 . PMID 7685481 .
- Sahota A, Chen J, Boyadjiev SA, Gault MH, Tischfield JA (май 1994). «Миссенс-мутация в аденин-фосфорибозилтрансферазе, вызывающей 2,8-дигидроксиаденин-уролитиаз». Молекулярная генетика человека . 3 (5): 817–8. doi : 10.1093/hmg/3.5.817 . PMID 7915931 .
Внешние ссылки
[ редактировать ]- Аденин+фосфорибозилтрансфераза в Национальной медицинской библиотеке Медицинской библиотеки США (Mesh)
- Human Aprt Геном APRT и страница генов в браузере UCSC Genome .