Клеточный цикл


Клеточный цикл или цикл клеточного деления — это последовательная серия событий, которые происходят в клетке и заставляют ее делиться на две дочерние клетки. Эти события включают рост клетки, дупликацию ее ДНК ( репликация ДНК ) и некоторых ее органелл , а затем разделение ее цитоплазмы, хромосом и других компонентов на две дочерние клетки в процессе, называемом клеточным делением .
В эукариотических клетках (имеющих клеточное ядро ), включая клетки животных , растений , грибов и простейших , клеточный цикл делится на две основные стадии: интерфазу и фазу М , которая включает митоз и цитокинез. [1] Во время интерфазы клетка растет, накапливая питательные вещества, необходимые для митоза, и реплицирует свою ДНК и некоторые из своих органелл. Во время фазы М реплицированные хромосомы , органеллы и цитоплазма разделяются на две новые дочерние клетки. Чтобы обеспечить правильную репликацию клеточных компонентов и деление, существуют механизмы контроля, известные как контрольные точки клеточного цикла, после каждого из ключевых этапов цикла, которые определяют, может ли клетка перейти к следующей фазе.
В безъядерных клетках прокариотов , бактерий и архей клеточный цикл делится на периоды В, С и D. Период B простирается от окончания деления клетки до начала репликации ДНК. Репликация ДНК происходит в период C. Период D относится к этапу между окончанием репликации ДНК и разделением бактериальной клетки на две дочерние клетки. [2]
В одноклеточных организмах один цикл деления клеток — это способ размножения организма, обеспечивающий его выживание. В многоклеточных организмах, таких как растения и животные, серия циклов деления клеток — это то, как организм развивается из одноклеточной оплодотворенной яйцеклетки в зрелый организм, а также процесс, посредством которого волосы , кожа , клетки крови и некоторые внутренние клетки органы регенерируются повреждение и излечиваются (за исключением нервов ; см. нервов ). После деления клеток каждая из дочерних клеток начинает интерфазу нового клеточного цикла. Хотя различные стадии интерфазы обычно не различимы морфологически, каждая фаза клеточного цикла имеет особый набор специализированных биохимических процессов, которые подготавливают клетку к началу клеточного деления.
Фазы
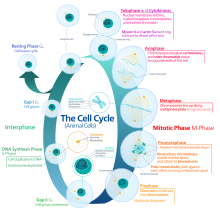
[ редактировать ]Эукариотический клеточный цикл состоит из четырех отдельных фаз: , фаза G1 фаза S (синтез), G2 ( митоз фаза (вместе известная как интерфаза ) и фаза М и цитокинез). Фаза М сама по себе состоит из двух тесно связанных процессов: митоза, при котором делится ядро клетки, и цитокинеза клетки , при котором цитоплазма и клеточная мембрана делятся, образуя две дочерние клетки. Активация каждой фазы зависит от правильного развития и завершения предыдущей. вошли в состояние покоя, называемое G0 Говорят, что клетки, которые временно или обратимо прекратили деление , фазой или фазой покоя.
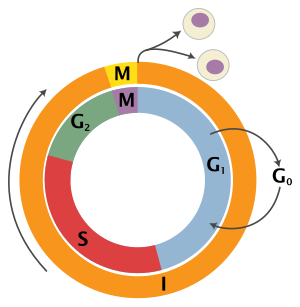
| Состояние | Фаза | Аббревиатура | Описание |
|---|---|---|---|
| Отдых | Разрыв 0 | г 0 | Фаза, когда клетка вышла из цикла и перестала делиться. |
| Интерфаза | Пробел 1 | Г 1 | Рост клеток. G гарантирует , 1 Контрольная точка что все готово для синтеза ДНК . |
| Синтез | С | Репликация ДНК . | |
| Пробел 2 | Г 2 | Рост и подготовка к митозу. G гарантирует 2 Контрольная точка , что все готово к переходу в фазу М (митоз) и делению. | |
| Деление клеток | Митоз | М | Происходит деление клеток. Метафазная контрольная точка гарантирует, что клетка готова к завершению клеточного деления. |
G 0 фаза (покой)
[ редактировать ]
G 0 — фаза покоя, когда клетка вышла из цикла и прекратила делиться. Клеточный цикл начинается с этой фазы. Непролиферативные (неделящиеся) клетки у многоклеточных эукариот обычно переходят в состояние покоя G0 из G1 и могут оставаться в состоянии покоя в течение длительных периодов времени, возможно, бесконечно (как это часто бывает для нейронов ). Это очень характерно для клеток, которые полностью дифференцированы . Некоторые клетки переходят в фазу G0 полупостоянно и считаются постмитотическими, например, некоторые клетки печени, почек и желудка. Многие клетки не входят в G 0 и продолжают делиться на протяжении всей жизни организма, например эпителиальные клетки.
Слово «постмитотический» иногда используется для обозначения как покоящихся , так и стареющих клеток. Клеточное старение происходит в ответ на повреждение ДНК и внешний стресс и обычно представляет собой остановку G1 . Клеточное старение может сделать потомство клетки нежизнеспособным; часто это биохимическая альтернатива самоуничтожению такой поврежденной клетки путем апоптоза .
Интерфаза
[ редактировать ]Интерфаза представляет собой фазу между двумя последовательными фазами М. Интерфаза — это серия изменений, происходящих во вновь образовавшейся клетке и ее ядре, прежде чем она снова станет способна делиться. Его еще называют подготовительной фазой или интермитозом. Обычно интерфаза длится не менее 91% от общего времени, необходимого для клеточного цикла.
Интерфаза протекает в три стадии: G 1 , S и G 2 , за которыми следует цикл митоза и цитокинеза. Содержимое ядерной ДНК клетки дублируется во время S-фазы.
Фаза G 1 (первая фаза роста или фаза после митотического разрыва)
[ редактировать ]
Первая фаза интерфазы, от конца предыдущей М-фазы до начала синтеза ДНК, называется ( G1 G указывает на разрыв ). Ее еще называют фазой роста. Во время этой фазы биосинтетическая деятельность клетки, которая значительно замедляется во время М-фазы, возобновляется с высокой скоростью. Продолжительность G 1 сильно варьирует даже среди разных клеток одного и того же вида. [4] На этом этапе клетка увеличивает запас белков, увеличивает количество органелл (таких как митохондрии, рибосомы) и увеличивается в размерах. В фазе G 1 у клетки есть три варианта.
- Чтобы продолжить клеточный цикл и войти в фазу S
- Остановите клеточный цикл и войдите в G0 фазу для прохождения дифференцировки .
- Становится остановленным в фазе G 1 , следовательно, он может войти в фазу G 0 или повторно войти в клеточный цикл.
Решающая точка называется контрольной точкой ( Restriction Point ). Эта контрольная точка называется точкой ограничения или СТАРТ и регулируется циклинами G 1 /S, которые вызывают переход от фазы G 1 к фазе S. Прохождение через контрольную точку G 1 приводит к делению клетки.
S-фаза (репликация ДНК)
[ редактировать ]Последующая S-фаза начинается, когда начинается синтез ДНК ; когда он завершен, все хромосомы реплицированы, т. е. каждая хромосома состоит из двух сестринских хроматид . Таким образом, во время этой фазы количество ДНК в клетке увеличивается вдвое, хотя плоидность и число хромосом не изменяются. Скорость транскрипции РНК и синтеза белка на этой фазе очень низкая. Исключением является производство гистонов , большая часть которого происходит во время S-фазы. [5] [6] [7]
G 2 фаза (рост)
[ редактировать ]Фаза G 2 наступает после репликации ДНК и представляет собой период синтеза белка и быстрого роста клеток для подготовки клетки к митозу. Во время этой фазы микротрубочки начинают реорганизовываться в веретено (препрофаза). Прежде чем перейти к митотической фазе , клетки необходимо проверить в контрольной точке G2 на наличие повреждений ДНК внутри хромосом. точка G2 Контрольная в основном регулируется опухолевым белком р53 . Если ДНК повреждена, р53 либо восстановит ДНК, либо вызовет апоптоз клетки. Если р53 дисфункционален или мутировал, клетки с поврежденной ДНК могут продолжать клеточный цикл, что приводит к развитию рака.
Митотическая фаза (разделение хромосом)
[ редактировать ]Относительно короткая фаза М состоит из деления ядра ( кариокинез ) и деления цитоплазмы ( цитокинез ). Это относительно короткий период клеточного цикла. Фаза М сложна и строго регулируется. Последовательность событий разделена на фазы, соответствующие завершению одного набора действий и началу следующего. Эти фазы последовательно называются:

Митоз — это процесс, посредством которого эукариотическая клетка разделяет хромосомы в ядре клетки на два идентичных набора в двух ядрах. [8] В процессе митоза пары хромосом конденсируются и прикрепляются к микротрубочкам , которые тянут сестринские хроматиды к противоположным сторонам клетки. [9]
Митоз происходит исключительно в эукариотических клетках, но у разных видов происходит по-разному. Например, клетки животных подвергаются «открытому» митозу, при котором ядерная оболочка разрушается до разделения хромосом, тогда как грибы, такие как Aspergillus nidulans и Saccharomyces cerevisiae ( дрожжи ), подвергаются «закрытому» митозу, при котором хромосомы делятся внутри неповрежденного ядра клетки. . [10]
Фаза цитокинеза (разделение всех компонентов клетки)
[ редактировать ]Сразу за митозом следует цитокинез , который делит ядра, цитоплазму , органеллы и клеточную мембрану на две клетки, содержащие примерно равные доли этих клеточных компонентов. Цитокинез происходит по-разному в растительных и животных клетках. В то время как клеточная мембрана образует бороздку, которая постепенно углубляется для разделения цитоплазмы в животных клетках, клеточная пластинка в растительных клетках образуется для ее отделения. Положение клеточной пластинки определяется положением препрофазной полосы микротрубочек и актиновых филаментов. Митоз и цитокинез вместе определяют деление родительской клетки на две дочерние клетки, генетически идентичные друг другу и своей родительской клетке. Это составляет примерно 10% клеточного цикла.
Поскольку цитокинез обычно происходит в сочетании с митозом, «митоз» часто используется как синоним «М-фазы». Однако во многих клетках митоз и цитокинез происходят отдельно, образуя отдельные клетки с множеством ядер в процессе, называемом эндорепликацией . Это чаще всего встречается среди грибов и слизевиков , но встречается и в различных группах. Даже у животных цитокинез и митоз могут происходить независимо, например, на определенных стадиях эмбрионального развития плодовых мух . [11] Ошибки в митозе могут привести к гибели клеток в результате апоптоза или вызвать мутации , которые могут привести к раку .
Регуляция эукариотического клеточного цикла
[ редактировать ]
Регуляция клеточного цикла включает процессы, имеющие решающее значение для выживания клетки, включая обнаружение и восстановление генетических повреждений, а также предотвращение неконтролируемого деления клеток. Молекулярные события, контролирующие клеточный цикл, упорядочены и направлены; то есть каждый процесс происходит последовательно, и «обратить» цикл невозможно.
Роль циклинов и CDK
[ редактировать ] Нобелевский лауреат Пол Нерс |  Нобелевский лауреат Тим Хант |
Два ключевых класса регуляторных молекул, циклины и циклин-зависимые киназы (CDK), определяют прогресс клетки в клеточном цикле. [12] Леланд Х. Хартвелл , Р. Тимоти Хант и Пол М. Нерс получили в 2001 году Нобелевскую премию по физиологии и медицине за открытие этих центральных молекул. [13] Многие из генов, кодирующих циклины и CDK, консервативны среди всех эукариот, но в целом более сложные организмы имеют более сложные системы контроля клеточного цикла, которые включают больше отдельных компонентов. Многие из соответствующих генов были впервые идентифицированы при изучении дрожжей, особенно Saccharomyces cerevisiae ; [14] генетическая номенклатура дрожжей называет многие из этих генов cdc (от «цикла деления клеток»), за которым следует идентификационный номер, например, cdc25 или cdc20 .
Циклины образуют регуляторные субъединицы, а CDK — каталитические субъединицы активированного гетеродимера ; циклины не обладают каталитической активностью, а CDK неактивны в отсутствие партнерского циклина. При активации связанным циклином CDK выполняют общую биохимическую реакцию, называемую фосфорилированием , которая активирует или инактивирует целевые белки для организации скоординированного перехода в следующую фазу клеточного цикла. Различные комбинации циклин-CDK определяют целевые нижестоящие белки. CDK конститутивно экспрессируются в клетках, тогда как циклины синтезируются на определенных стадиях клеточного цикла в ответ на различные молекулярные сигналы. [15]
Общий механизм взаимодействия циклин-CDK
[ редактировать ]При получении промитотического внеклеточного сигнала комплексы G1 циклин -CDK становятся активными, подготавливая клетку к S-фазе, способствуя экспрессии факторов транскрипции , которые, в свою очередь, способствуют экспрессии S-циклинов и ферментов, необходимых для репликации ДНК . Комплексы G1 циклин -CDK также способствуют деградации молекул, которые действуют как ингибиторы S-фазы, направляя их на убиквитинирование . После убиквитинирования белка он подвергается протеолитической деградации с помощью протеасомы . Однако результаты недавнего исследования динамики транскрипции E2F на уровне отдельных клеток показывают, что роль активности циклина-CDK G1, в частности циклина D-CDK4/6, заключается в настройке времени, а не в обеспечении вступления в клеточный цикл. . [16]
Активные комплексы S-циклин-CDK фосфорилируют белки, которые составляют пререпликационные комплексы, собранные во время G 1 фазы в точках начала репликации ДНК . Фосфорилирование служит двум целям: активировать каждый уже собранный пререпликационный комплекс и предотвратить образование новых комплексов. клетки Это гарантирует, что каждая часть генома будет реплицирована один и только один раз. Причина предотвращения пробелов в репликации довольно ясна, поскольку дочерние клетки, в которых отсутствуют все или часть важнейших генов, погибнут. Однако по причинам, связанным с эффектом количества копий генов , наличие дополнительных копий определенных генов также вредно для дочерних клеток.
Митотические комплексы циклин-CDK, которые синтезируются, но инактивируются во время фаз S и G2 , способствуют инициации митоза путем стимуляции нижестоящих белков, участвующих в конденсации хромосом и сборке митотического веретена . Критическим комплексом, активируемым во время этого процесса, является убиквитинлигаза , известная как комплекс, способствующий анафазе (APC), который способствует деградации структурных белков, связанных с хромосомными кинетохорами . APC также нацелен на деградацию митотических циклинов, обеспечивая возможность продолжения телофазы и цитокинеза. [17]
Специфическое действие комплексов циклин-ЦДК
[ редактировать ]Циклин D — это первый циклин, вырабатываемый в клетках, которые вступают в клеточный цикл в ответ на внеклеточные сигналы (например, факторы роста ). Уровни циклина D остаются низкими в покоящихся клетках, которые не пролиферируют. Кроме того, CDK4/6 и CDK2 также неактивны, поскольку CDK4/6 связываются членами семейства INK4 (например, p16), ограничивая киназную активность. Между тем, комплексы CDK2 ингибируются белками CIP/KIP, такими как p21 и p27. [18] Когда приходит время клетке войти в клеточный цикл, который запускается митогенными стимулами, уровень циклина D увеличивается. В ответ на этот триггер циклин D связывается с существующим CDK4 /6, образуя активный комплекс циклин D-CDK4/6. Комплексы циклин D-CDK4/6, в свою очередь, монофосфорилируют ретинобластомы белок восприимчивости ( Rb ) до pRb. Нефосфорилированный опухолевый супрессор Rb вызывает выход клеточного цикла и поддерживает арест G0 (старение). [19]
В последние несколько десятилетий получила широкое признание модель, согласно которой белки pRB инактивируются посредством фосфорилирования, опосредованного циклином D-Cdk4/6. Rb имеет более 14 потенциальных сайтов фосфорилирования. Циклин D-Cdk 4/6 постепенно фосфорилирует Rb до гиперфосфорилированного состояния, что запускает диссоциацию комплексов pRB- E2F , тем самым индуцируя экспрессию генов клеточного цикла G1/S и переход в S-фазу. [20]
Однако научные наблюдения недавнего исследования показывают, что Rb присутствует в трех типах изоформ: (1) нефосфорилированный Rb в состоянии G0; (2) монофосфорилированный Rb, также называемый «гипофосфорилированным» или «частично» фосфорилированным Rb в раннем состоянии G1; и (3) неактивный гиперфосфорилированный Rb в позднем состоянии G1. [21] [22] [23] В ранних клетках G1 монофосфорилированный Rb существует в виде 14 различных изоформ, каждая из которых имеет различную E2F . аффинность связывания [23] Было обнаружено, что Rb связывается с сотнями различных белков. [24] и идея о том, что разные монофосфорилированные изоформы Rb имеют разные белковые партнеры, была очень привлекательной. [25] Недавний отчет подтвердил, что монофосфорилирование контролирует связь Rb с другими белками и создает функциональные различные формы Rb. [26] Все различные монофосфорилированные изоформы Rb ингибируют программу транскрипции E2F и способны арестовывать клетки в G1-фазе. Важно отметить, что различные монофосфорилированные формы Rb имеют разные результаты транскрипции, выходящие за рамки регуляции E2F. [26]
В общем, связывание pRb с E2F ингибирует экспрессию гена-мишени E2F некоторых генов перехода G1/S и S, включая циклины E-типа . Частичное фосфорилирование Rb де-репрессирует Rb-опосредованное подавление экспрессии гена-мишени E2F, начинает экспрессию циклина E. Молекулярный механизм, который вызывает переключение клетки на активацию циклина E, в настоящее время неизвестен, но по мере повышения уровня циклина E образуется активный комплекс циклин E-CDK2, в результате чего Rb инактивируется путем гиперфосфорилирования. [23] Гиперфосфорилированный Rb полностью диссоциирован от E2F, что обеспечивает дальнейшую экспрессию широкого спектра генов-мишеней E2F, необходимых для перехода клеток в S-фазу [1]. Недавно было идентифицировано, что циклин D-Cdk4/6 связывается с C-концевой областью альфа-спирали Rb, которая отличима только от циклина D, а не от других циклинов, E , A и B. циклинов [27] Это наблюдение, основанное на структурном анализе фосфорилирования Rb, подтверждает, что Rb фосфорилируется на другом уровне посредством множества комплексов циклин-Cdk. Это также делает возможной текущую модель одновременной переключающей инактивации всех монофосфорилированных изоформ Rb посредством одного типа механизма гиперфосфорилирования Rb. Кроме того, мутационный анализ специфичной для циклина D-Cdk 4/6 С-концевой спирали Rb показывает, что нарушение связывания циклина D-Cdk 4/6 с Rb предотвращает фосфорилирование Rb, останавливает клетки в G1 и усиливает функции Rb в супрессоре опухоли. . [27] Этот переходный механизм клеточного цикла, управляемый циклином-Cdk, управляет клеткой, вовлеченной в клеточный цикл, который обеспечивает клеточную пролиферацию. Рост раковых клеток часто сопровождается нарушением регуляции активности Cyclin D-Cdk 4/6.
Гиперфосфорилированный Rb диссоциирует от комплекса E2F/DP1/Rb (который был связан с генами, чувствительными к E2F , эффективно «блокируя» их транскрипцию), активируя E2F. Активация E2F приводит к транскрипции различных генов, таких как циклин E , циклин A , ДНК-полимераза , тимидинкиназа и т. д. Циклин E, полученный таким образом, связывается с CDK2 , образуя комплекс циклин E-CDK2, который переводит клетку из G 1 в S-фазу. (G 1 /S, который инициирует переход G 2 /M). [28] Активация комплекса циклин B -cdk1 вызывает разрушение ядерной оболочки и инициацию профазы , а затем его дезактивация приводит к выходу клетки из митоза. [15] Количественное исследование динамики транскрипции E2F на уровне отдельных клеток с использованием сконструированных флуоресцентных репортерных клеток обеспечило количественную основу для понимания логики контроля входа в клеточный цикл, бросив вызов канонической модели учебника. Гены, которые регулируют амплитуду накопления E2F, такие как Myc, определяют участие в клеточном цикле и вход в S-фазу. Активность G1-циклина-CDK не является движущей силой входа в клеточный цикл. Вместо этого они в первую очередь регулируют время увеличения E2F, тем самым модулируя темп прогрессирования клеточного цикла. [16]
Ингибиторы
[ редактировать ]Эндогенный
[ редактировать ]
Два семейства генов, семейство cip/kip ( с CDK/белок, ингибирующий киназу ) и семейство INK4a/ARF ( 4 / киназы альтернативная рамка белок, взаимодействующий ) чтения ингибитор , предотвращают прогрессирование клеточного цикла. Поскольку эти гены играют важную роль в предотвращении образования опухолей , они известны как опухолевые супрессоры .
Семейство cip/kip включает гены p21 , p27 и p57 . Они останавливают клеточный цикл в фазе G1 путем связывания и инактивации комплексов циклин-CDK. p21 активируется p53 (который, в свою очередь, запускается повреждением ДНК, например, вследствие радиации). p27 активируется трансформирующим фактором роста β ( TGF β ), ингибитором роста.
Семейство INK4a/ARF включает p16. INK4a , который связывается с CDK4 и останавливает клеточный цикл в фазе G1 , а p14 АРФ что предотвращает деградацию р53.
Синтетический
[ редактировать ]Синтетические ингибиторы Cdc25 также могут быть полезны для остановки клеточного цикла и, следовательно, в качестве противоопухолевых и противораковых средств. [29]
Многие виды рака человека обладают гиперактивированной активностью Cdk 4/6. [30] Учитывая наблюдения за функциями циклина D-Cdk 4/6, ингибирование Cdk 4/6 должно приводить к предотвращению пролиферации злокачественной опухоли. Следовательно, ученые попытались изобрести синтетический ингибитор Cdk4/6, поскольку Cdk4/6 считается терапевтической мишенью для достижения противоопухолевой эффективности. Три ингибитора Cdk4/6 — палбоциклиб , рибоциклиб и абемациклиб — в настоящее время получили одобрение FDA для клинического применения для лечения поздней стадии или гормон метастатического -рецептор-положительного (HR-положительного, HR+) и HER2-негативного (HER2-) рака молочной железы. . [31] [32] Например, палбоциклиб является перорально активным ингибитором CDK4/6, который продемонстрировал улучшение результатов при ER-положительном/HER2-негативном распространенном раке молочной железы. Основным побочным эффектом является нейтропения , которую можно купировать путем снижения дозы. [33]
Таргетная терапия Cdk4/6 будет лечить только те виды рака, где экспрессируется Rb. Раковые клетки с потерей Rb обладают первичной устойчивостью к ингибиторам Cdk4/6.
Транскрипционная регуляторная сеть
[ редактировать ]Имеющиеся данные свидетельствуют о том, что полуавтономная транскрипционная сеть действует совместно с механизмом CDK-циклина, регулируя клеточный цикл. Несколько исследований экспрессии генов у Saccharomyces cerevisiae выявили 800–1200 генов, экспрессия которых меняется в течение клеточного цикла. [14] [34] [35] Они транскрибируются на высоких уровнях в определенные моменты клеточного цикла и остаются на более низких уровнях на протяжении остальной части цикла. Хотя набор идентифицированных генов различается в разных исследованиях из-за вычислительных методов и критериев, используемых для их идентификации, каждое исследование показывает, что большая часть генов дрожжей регулируется во времени. [36]
Многие периодически экспрессируемые гены управляются транскрипционными факторами , которые также периодически экспрессируются. Один скрининг нокаутов одного гена выявил 48 факторов транскрипции (около 20% всех несущественных факторов транскрипции), которые демонстрируют дефекты прогрессирования клеточного цикла. [37] Полногеномные исследования с использованием высокопроизводительных технологий выявили факторы транскрипции, которые связываются с промоторами дрожжевых генов, а корреляция этих результатов с временными паттернами экспрессии позволила идентифицировать факторы транскрипции, которые управляют фазоспецифичной экспрессией генов. [34] [38] Профили экспрессии этих факторов транскрипции определяются факторами транскрипции, пик которых приходится на предыдущую фазу, а вычислительные модели показали, что CDK-автономная сеть этих факторов транскрипции достаточна для создания устойчивых колебаний экспрессии генов). [35] [39]
Экспериментальные данные также свидетельствуют о том, что экспрессия генов может колебаться в зависимости от периода, наблюдаемого при делении клеток дикого типа, независимо от механизма CDK. Орландо и др. использовали микрочипы для измерения экспрессии набора из 1271 гена, который они идентифицировали как периодический как в клетках дикого типа, так и в клетках, лишенных всех S-фазы и митотических циклинов ( clb1,2,3,4,5,6 ). Из 1271 проанализированного гена 882 продолжали экспрессироваться в клетках с дефицитом циклина в то же время, что и в клетках дикого типа, несмотря на то, что клетки с дефицитом циклина арестовываются на границе между G 1 и S фазой . Однако 833 из проанализированных генов изменили поведение между клетками дикого типа и мутантными клетками, что указывает на то, что эти гены, вероятно, прямо или косвенно регулируются механизмом CDK-циклин. Некоторые гены, которые продолжали вовремя экспрессироваться в мутантных клетках, также экспрессировались на разных уровнях в мутантных клетках и клетках дикого типа. Эти данные свидетельствуют о том, что, хотя транскрипционная сеть может колебаться независимо от осциллятора CDK-циклин, они связаны таким образом, что требуется и то, и другое, чтобы гарантировать правильное время событий клеточного цикла. [35] Другая работа показывает, что фосфорилирование , посттрансляционная модификация факторов транскрипции клеточного цикла с помощью Cdk1, может изменить локализацию или активность факторов транскрипции, чтобы жестко контролировать время срабатывания генов-мишеней. [37] [40] [41]
Хотя осциллирующая транскрипция играет ключевую роль в развитии дрожжевого клеточного цикла, механизм CDK-циклина работает независимо на раннем эмбриональном клеточном цикле. До мидбластулы перехода зиготическая транскрипция не происходит, и все необходимые белки, такие как циклины B-типа, транслируются с материнской мРНК . [42]
Репликация ДНК и активность источника репликации ДНК
[ редактировать ]Анализ синхронизированных культур Saccharomyces cerevisiae в условиях, которые предотвращают инициацию репликации ДНК без задержки прогрессирования клеточного цикла, показал, что лицензирование происхождения снижает экспрессию генов с происхождением вблизи их 3'-концов, показывая, что нижележащие источники происхождения могут регулировать экспрессию вышестоящих генов. [43] Это подтверждает предыдущие предсказания математического моделирования глобальной причинно-следственной координации между активностью источника репликации ДНК и экспрессией мРНК. [44] [45] [46] и показывает, что математическое моделирование данных микрочипов ДНК можно использовать для правильного предсказания ранее неизвестных биологических способов регуляции.
Контрольно-пропускные пункты
[ редактировать ]Контрольные точки клеточного цикла используются клеткой для мониторинга и регулирования хода клеточного цикла. [47] Контрольные точки предотвращают развитие клеточного цикла в определенных точках, позволяя проверять необходимые фазовые процессы и восстанавливать повреждения ДНК . Ячейка не может перейти к следующему этапу, пока не будут выполнены требования контрольной точки. Контрольные точки обычно состоят из сети регуляторных белков, которые контролируют и определяют продвижение клетки на различных стадиях клеточного цикла.
Подсчитано, что в нормальных клетках человека около 1% одноцепочечных повреждений ДНК преобразуются примерно в 50 эндогенных двухцепочечных разрывов ДНК на клетку за клеточный цикл. [48] Хотя такие двухцепочечные разрывы обычно восстанавливаются с высокой точностью, считается, что ошибки в их восстановлении вносят значительный вклад в рост заболеваемости раком у людей. [48]
Существует несколько контрольных точек, гарантирующих, что поврежденная или неполная ДНК не перейдет в дочерние клетки. Существуют три основные контрольные точки: контрольная точка G 1 /S, контрольная точка G 2 /M и контрольная точка метафазы (митотическая). Еще одна контрольная точка — это контрольная точка Go, в которой ячейки проверяются на зрелость. Если клетки не смогут пройти эту контрольную точку, поскольку еще не готовы, они будут исключены из деления.
Переход G 1 /S является этапом, ограничивающим скорость клеточного цикла, и также известен как точка ограничения . [15] Здесь клетка проверяет, достаточно ли у нее сырья для полной репликации своей ДНК (нуклеотидных оснований, ДНК-синтазы, хроматина и т. д.). Нездоровая или истощенная клетка застрянет на этом контрольно-пропускном пункте.
Контрольная точка G 2 /M — это точка, где клетка гарантирует, что у нее достаточно цитоплазмы и фосфолипидов для двух дочерних клеток. Но иногда, что более важно, он проверяет, подходящее ли сейчас время для репликации. В некоторых ситуациях всем клеткам необходимо реплицироваться одновременно (например, растущий эмбрион должен иметь симметричное распределение клеток, пока он не достигнет перехода средней бластулы). Это осуществляется путем управления контрольной точкой G 2 /M.
Контрольная точка метафазы является довольно незначительной контрольной точкой: как только клетка находится в метафазе, она начинает митоз. Однако это не значит, что это не важно. В этой контрольной точке клетка проверяет, сформировалось ли веретено и что все хромосомы выровнены по экватору веретена, прежде чем начнется анафаза. [49]
Хотя это три «основные» контрольные точки, не все клетки должны проходить через каждую из этих контрольных точек в указанном порядке для репликации. Многие виды рака вызваны мутациями, которые позволяют клеткам проходить через различные контрольные точки или даже вообще их пропускать. Переход от фазы S к фазе M к фазе S почти последовательно. Поскольку эти клетки потеряли свои контрольные точки, любые мутации ДНК, которые могли возникнуть, игнорируются и передаются дочерним клеткам. Это одна из причин, почему раковые клетки имеют тенденцию экспоненциально приобретать мутации. За исключением раковых клеток, многие полностью дифференцированные типы клеток больше не размножаются, поэтому они покидают клеточный цикл и остаются в G0 до своей смерти. Таким образом устраняется необходимость в сотовых контрольно-пропускных пунктах. Также была предложена альтернативная модель ответа клеточного цикла на повреждение ДНК, известная как контрольная точка пострепликации .
Регуляция контрольных точек играет важную роль в развитии организма. При половом размножении, когда происходит оплодотворение яйцеклетки, когда сперматозоид связывается с яйцеклеткой, он высвобождает сигнальные факторы, которые уведомляют яйцеклетку о том, что она оплодотворена. Среди прочего, это заставляет оплодотворенный ооцит вернуться из своего ранее дремлющего состояния G 0 обратно в клеточный цикл и перейти к митотической репликации и делению.
p53 играет важную роль в запуске механизмов контроля как в G1 / S, так и в G2 / M контрольных точках. Помимо р53, регуляторы контрольных точек активно исследуются на предмет их роли в росте и распространении рака.
Флуоресцентная визуализация клеточного цикла
[ редактировать ]
Новаторская работа Ацуши Мияваки и его коллег разработала флуоресцентный индикатор клеточного цикла на основе убиквитинирования ( FUCCI ), который позволяет флуоресцентно отображать клеточный цикл. Первоначально зеленый флуоресцентный белок mAG был слит с hGem (1/110), а оранжевый флуоресцентный белок (mKO 2 ) был слит с hCdt1 (30/120). Обратите внимание, что эти слияния представляют собой фрагменты, которые содержат сигнал ядерной локализации и убиквитинирования сайты для деградации , но не являются функциональными белками. Зеленый флуоресцентный белок образуется во время фазы S, G2 или M и разлагается во время фазы G0 или G1 , тогда как оранжевый флуоресцентный белок образуется во время фазы G0 или G1 и разрушается во время S, G2 . , или М-фаза. [50] FUCCI в дальнем красном и ближнем инфракрасном диапазоне был разработан с использованием цианобактерий полученного из флуоресцентного белка, ( smURFP ), и бактериофитохрома полученного из флуоресцентного белка, ( фильм можно найти по этой ссылке ). [51]
Роль в образовании опухоли
[ редактировать ]Нарушение регуляции компонентов клеточного цикла может привести к образованию опухоли . [52] Как упоминалось выше, когда некоторые гены, такие как ингибиторы клеточного цикла, RB , p53 и т. д., мутируют, они могут вызвать бесконтрольное размножение клеток, образуя опухоль. Хотя продолжительность клеточного цикла в опухолевых клетках равна или превышает продолжительность нормального клеточного цикла, доля клеток, находящихся в активном клеточном делении (по сравнению с покоящимися клетками в фазе G0 ) , в опухолях намного выше, чем в нормальной ткани. . [53] Таким образом, происходит чистое увеличение числа клеток, поскольку количество клеток, умирающих в результате апоптоза или старения, остается прежним.
Клетки, которые активно проходят клеточный цикл, являются целью терапии рака, поскольку ДНК относительно открыта во время клеточного деления и, следовательно, восприимчива к повреждению лекарствами или радиацией . Этот факт используется при лечении рака; с помощью процесса, известного как уменьшение объема , удаляется значительная масса опухоли, что выталкивает значительное количество оставшихся опухолевых клеток из фазы G 0 в фазу G 1 (из-за увеличения доступности питательных веществ, кислорода, факторов роста и т. д.). Лучевая или химиотерапия после процедуры уменьшения объема убивает эти клетки, которые недавно вступили в клеточный цикл. [15]
Самые быстрые циклические клетки млекопитающих в культуре — клетки крипт кишечного эпителия — имеют продолжительность цикла всего от 9 до 10 часов. Стволовые клетки в покоящейся коже мыши могут иметь продолжительность цикла более 200 часов. Большая часть этой разницы обусловлена различной длиной G 1 , наиболее изменчивой фазы цикла. М и S не сильно различаются.
В целом клетки наиболее радиочувствительны в поздних фазах M и G2 и наиболее устойчивы в поздней S-фазе. Для клеток с более длительным временем клеточного цикла и значительно продолжительной фазой G1 имеется второй пик устойчивости в конце G1 . Характер резистентности и чувствительности коррелирует с уровнем сульфгидрильных соединений в клетке. Сульфгидрилы — это природные вещества, которые защищают клетки от радиационного повреждения и имеют тенденцию иметь самые высокие уровни в S и самые низкие вблизи митоза.
Гомологичная рекомбинация (HR) — это точный процесс ДНК восстановления двухцепочечных разрывов . ЧСС практически отсутствует в фазе G1 , наиболее активна в фазе S и снижается в фазе G2 / M. [54] Ономологичное соединение концов — менее точный и более мутагенный процесс восстановления двухцепочечных разрывов — активен на протяжении всего клеточного цикла.
Эволюция клеточного цикла
[ редактировать ]Эволюция генома
[ редактировать ]Клеточный цикл должен дублировать все клеточные компоненты и в равной степени разделять их на две дочерние клетки. Многие компоненты, такие как белки и рибосомы , производятся непрерывно на протяжении всего клеточного цикла (за исключением М-фазы ). Однако хромосомы и другие связанные элементы, такие как MTOC , дублируются только один раз в течение клеточного цикла. Центральным компонентом клеточного цикла является его способность координировать непрерывные и периодические дупликации различных клеточных элементов, которые развивались при формировании генома.
Доклеточная среда содержала функциональные и самореплицирующиеся РНК . [55] Все концентрации РНК зависели от концентраций других РНК, которые могли помогать или препятствовать сбору ресурсов. В этой среде рост был просто непрерывным производством РНК. Этим доклеточным структурам пришлось бы бороться с паразитическими РНК, проблемами наследственности и контролем количества копий специфических РНК. [55] [56]
Разделение «геномной» РНК на «функциональную» РНК помогло решить эти проблемы. [57] Слияние нескольких РНК в геном дало матрицу, от которой были отщеплены функциональные РНК. Теперь, чтобы выжить, паразитическим РНК придется внедриться в геном, что является гораздо более серьезным барьером. Контроль количества копий геномной РНК также позволил определять концентрацию РНК через скорость синтеза и период полураспада РНК, а не через конкуренцию. [55] Отделение дупликации геномных РНК от генерации функциональных РНК позволило добиться гораздо большей точности дублирования геномных РНК без ущерба для производства функциональных РНК. Наконец, замена геномной РНК ДНК , которая является более стабильной молекулой, позволила увеличить геномы. Переход от самокаталитического синтеза ферментов к геном-направленному синтезу ферментов был критическим шагом в эволюции клеток и имел долгосрочные последствия для клеточного цикла, который должен регулировать функциональный синтез и дупликацию генома самыми разными способами. [55]
Циклинзависимая киназа и эволюция циклинов
[ редактировать ]Развитие клеточного цикла контролируется колебательными концентрациями различных циклинов и возникающими в результате молекулярными взаимодействиями различных циклин-зависимых киназ (CDK). У дрожжей только один CDK (Cdc28 у S. cerevisiae и Cdc2 у S. pombe ) контролирует клеточный цикл. [58] Однако у животных развились целые семейства CDK. [59] [60] Cdk1 контролирует вход в митоз, а Cdk2, Cdk4 и Cdk6 регулируют вход в S-фазу. Несмотря на эволюцию семейства CDK у животных, эти белки имеют родственные или дублирующие функции. [61] [62] [63] Например, клетки мышей с тройным нокаутом cdk2, cdk4, cdk6 все еще могут проходить основной клеточный цикл. [64] Нокаут cdk1 является летальным, что предполагает, что наследственная киназа типа CDK1 в конечном итоге контролирует клеточный цикл. [64]
Arabidopsis thaliana имеет гомолог Cdk1, называемый CDKA;1, однако cdka;1 мутанты A. thaliana все еще жизнеспособны, [65] что противоречит опистоконтному паттерну киназ типа CDK1 как важных регуляторов, контролирующих клеточный цикл. [66] Растения также имеют уникальную группу CDK B-типа, функции которых могут варьироваться от функций, специфичных для развития, до основных участников митотической регуляции. [67] [68]
Эволюция контрольной точки G1/S
[ редактировать ]
Контрольная точка G1 /S — это точка, в которой клетка совершает деление в течение клеточного цикла. Сложные регуляторные сети приводят к принятию решения о переходе G1/S. У опистоконтов наблюдаются как сильно дивергентные белковые последовательности, так и поразительно схожие топологии сетей. [66] [69]
Вход в S-фазу как у дрожжей, так и у животных контролируется уровнями двух противоположных регуляторов. [66] Сети, регулирующие эти факторы транскрипции, представляют собой петли двойной отрицательной обратной связи и петли положительной обратной связи как у дрожжей, так и у животных. [66] [69] [70] Дополнительная регуляция регуляторной сети контрольной точки G1/S у дрожжей и животных включает фосфорилирование /дефосфорилирование комплексов CDK-циклин. Сумма этих регуляторных сетей создает гистерезисную и бистабильную схему, несмотря на то, что конкретные белки сильно дивергентны. [71] [72] Для дрожжей Whi5 должен быть подавлен фосфорилированием Cln3, чтобы SBF мог экспрессироваться. [73] в то время как у животных Rb должен быть подавлен комплексом Cdk4/6-циклин D для E2F . экспрессии [74] И Rb, и Whi5 ингибируют транскрипт посредством привлечения белков гистондеацетилазы к промоторам. [75] [76] Оба белка дополнительно имеют несколько сайтов фосфорилирования CDK, посредством которых они ингибируются. [77] [74] Однако эти белки не имеют сходства последовательностей.
Исследования A. thaliana расширяют наши знания о переходе G1/S у эукариот в целом. Растения также имеют ряд консервативных сетевых особенностей с опистоконтами, и многие растительные регуляторы имеют прямых гомологов животных. [78] Например, растениям также необходимо подавлять Rb для трансляции E2F в сети. [79] Эти консервативные элементы клеточных циклов растений и животных могут быть предковыми у эукариот. Хотя дрожжи имеют консервативную топологию сети с растениями и животными, сильно различающаяся природа дрожжевых регуляторов предполагает возможную быструю эволюцию по линии дрожжей. [66]
См. также
[ редактировать ]- Сотовая модель
- Репликация эукариотической ДНК
- Митотическая катастрофа
- Комплекс распознавания происхождения
- Белок ретинобластомы
- Синхронная культура – синхронизация клеточных культур.
- Ви1
Ссылки
[ редактировать ]- ^ Альбертс Б., Хопкин К., Джонсон А., Морган Д., Рафф М., Робертс К., Уолтер П. (2019). Основная клеточная биология (Пятое изд.). Нью-Йорк Лондон: WW Norton & Company. стр. 624–625. ISBN 9780393680393 .
- ^ Ван Дж.Д., Левин П.А. (ноябрь 2009 г.). «Метаболизм, рост клеток и клеточный цикл бактерий» . Обзоры природы. Микробиология . 7 (11): 822–827. дои : 10.1038/nrmicro2202 . ПМК 2887316 . ПМИД 19806155 .
- ^ Купер GM (2000). «Глава 14: Эукариотический клеточный цикл» . Клетка: молекулярный подход (2-е изд.). Вашингтон, округ Колумбия: ASM Press. ISBN 978-0-87893-106-4 .
- ^ Смит Дж. А., Мартин Л. (апрель 1973 г.). «Есть ли клеточный цикл?» . Труды Национальной академии наук Соединенных Штатов Америки . 70 (4): 1263–1267. Бибкод : 1973PNAS...70.1263S . дои : 10.1073/pnas.70.4.1263 . ПМЦ 433472 . ПМИД 4515625 .
- ^ Ву Р.С., Боннер В.М. (декабрь 1981 г.). «Отделение базального синтеза гистонов от синтеза гистонов S-фазы в делящихся клетках». Клетка . 27 (2 ч. 1): 321–330. дои : 10.1016/0092-8674(81)90415-3 . ПМИД 7199388 . S2CID 12215040 .
- ^ Нельсон Д.М., Йе X, Холл С., Сантос Х., Ма Т., Као Г.Д. и др. (ноябрь 2002 г.). «Сочетание синтеза ДНК и синтеза гистонов в S-фазе независимо от активности циклина/cdk2» . Молекулярная и клеточная биология . 22 (21): 7459–7472. дои : 10.1128/MCB.22.21.7459-7472.2002 . ПМК 135676 . ПМИД 12370293 .
- ^ Кэмерон И.Л., Грейлих Р.К. (июль 1963 г.). «Доказательства практически постоянной продолжительности синтеза ДНК при обновлении эпителия взрослой мыши» . Журнал клеточной биологии . 18 (1): 31–40. дои : 10.1083/jcb.18.1.31 . ПМК 2106275 . ПМИД 14018040 .
- ^ Рубинштейн I, Вик С.М. (2008). "Клетка" . Справочный онлайн-центр World Book Online . Архивировано из оригинала 30 мая 2011 года . Проверено 10 июля 2009 г.
- ^ Матон А., Лахарт Д., Хопкинс Дж., Уорнер М.К., Джонсон С., Райт Дж.Д. (1997). Клетки: строительные блоки жизни . Нью-Джерси: Прентис Холл. стр. 70–4 . ISBN 978-0-13-423476-2 .
- ^ Де Соуза CP, Османи С.А. (сентябрь 2007 г.). «Митоз, а не только открытый или закрытый» . Эукариотическая клетка . 6 (9): 1521–1527. дои : 10.1128/EC.00178-07 . ПМК 2043359 . ПМИД 17660363 .
- ^ Лилли М.А., Дуронио Р.Дж. (апрель 2005 г.). «Новое понимание контроля клеточного цикла эндоцикла дрозофилы». Онкоген . 24 (17): 2765–2775. дои : 10.1038/sj.onc.1208610 . ПМИД 15838513 . S2CID 25473573 .
- ^ Нигг EA (июнь 1995 г.). «Циклин-зависимые протеинкиназы: ключевые регуляторы эукариотического клеточного цикла». Биоэссе . 17 (6): 471–480. doi : 10.1002/bies.950170603 . ПМИД 7575488 . S2CID 44307473 .
- ^ «Нобелевская премия по физиологии и медицине 2001 г. – Пресс-релиз» . Нобелевская премия.org.
- ^ Перейти обратно: а б Спеллман П.Т., Шерлок Дж., Чжан М.К., Айер В.Р., Андерс К., Эйзен М.Б. и др. (декабрь 1998 г.). «Комплексная идентификация генов, регулирующих клеточный цикл дрожжей Saccharomyces cerevisiae, методом гибридизации на микрочипах» . Молекулярная биология клетки . 9 (12): 3273–3297. дои : 10.1091/mbc.9.12.3273 . ПМК 25624 . ПМИД 9843569 .
- ^ Перейти обратно: а б с д Роббинс С.Л., Котран Р.С. (2004). Кумар В., Аббас А.К., Фаусто Н. (ред.). Патологическая основа заболевания . Эльзевир . ISBN 978-81-8147-528-2 .
- ^ Перейти обратно: а б Донг П., Маддали М.В., Шримани Дж.К., Телот Ф., Невинс-младший, Мэти-Прево Б., Ю Л. (сентябрь 2014 г.). «Разделение труда между циклинами Myc и G1 в обеспечении приверженности клеточного цикла и контроле темпа» . Природные коммуникации . 5 : 4750. Бибкод : 2014NatCo...5.4750D . дои : 10.1038/ncomms5750 . ПМК 4164785 . ПМИД 25175461 .
- ^ Махмуди М., Азадманеш К., Шокргозар М.А., Джорни В.С., Лоран С. (май 2011 г.). «Влияние наночастиц на жизненный цикл клетки». Химические обзоры . 111 (5): 3407–3432. дои : 10.1021/cr1003166 . ПМИД 21401073 .
- ^ Гоэл С., ДеКристо М.Дж., Макаллистер С.С., Чжао Дж.Дж. (ноябрь 2018 г.). «Ингибирование CDK4/6 при раке: помимо остановки клеточного цикла» . Тенденции в клеточной биологии . 28 (11): 911–925. дои : 10.1016/j.tcb.2018.07.002 . ПМК 6689321 . ПМИД 30061045 .
- ^ Беркхарт Д.Л., Сейдж Дж. (сентябрь 2008 г.). «Клеточные механизмы подавления опухоли геном ретинобластомы» . Обзоры природы. Рак . 8 (9): 671–682. дои : 10.1038/nrc2399 . ПМК 6996492 . ПМИД 18650841 .
- ^ Морган Д.О. (2007). Клеточный цикл: принципы управления . Лондон: New Science Press. ISBN 978-0-19-920610-0 . ОСЛК 70173205 .
- ^ Патерно С., Бокстале Л., Бисто Х., Кукен Х., Кулонваль К., Роджер П.П. (февраль 2010 г.). «Инактивация Rb в клеточном цикле и раке: загадка высокорегулируемого активирующего фосфорилирования CDK4 в сравнении с конститутивно активной киназой, активирующей CDK» . Клеточный цикл . 9 (4): 689–699. дои : 10.4161/cc.9.4.10611 . ПМИД 20107323 .
- ^ Хенли С.А., Дик Ф.А. (март 2012 г.). «Семейство белков ретинобластомы и их регуляторные функции в цикле деления клеток млекопитающих» . Отделение клеток . 7 (1): 10. дои : 10.1186/1747-1028-7-10 . ПМЦ 3325851 . ПМИД 22417103 .
- ^ Перейти обратно: а б с Нарасимха А.М., Каулич М., Шапиро Г.С., Чой Ю.Дж., Сичински П., Дауди С.Ф. (июнь 2014 г.). «Циклин D активирует опухолевый супрессор Rb путем монофосфорилирования» . электронная жизнь . 3 : e02872. doi : 10.7554/eLife.02872 . ПМК 4076869 . ПМИД 24876129 .
- ^ Моррис Э.Дж., Дайсон, штат Нью-Джерси (1 января 2001 г.). Белковые партнеры ретинобластомы . Достижения в области исследований рака. Том. 82. Академическая пресса. стр. 1–54 . дои : 10.1016/s0065-230x(01)82001-7 . ISBN 9780120066827 . ПМИД 11447760 .
- ^ Дайсон, штат Нью-Джерси (июль 2016 г.). «RB1: прототип супрессора опухоли и загадка» . Гены и развитие . 30 (13): 1492–1502. дои : 10.1101/gad.282145.116 . ПМЦ 4949322 . ПМИД 27401552 .
- ^ Перейти обратно: а б Санидас И., Моррис Р., Фелла К.А., Румде П.Х., Бухали М., Тай Э.К. и др. (март 2019 г.). «Код монофосфорилирования модулирует функцию RB» . Молекулярная клетка . 73 (5): 985–1000.e6. doi : 10.1016/j.molcel.2019.01.004 . ПМК 6424368 . ПМИД 30711375 .
- ^ Перейти обратно: а б Топасио Б.Р., Затуловский Е., Кристеа С., Се С., Тамбо К.С., Рубин С.М. и др. (май 2019 г.). «Циклин D-Cdk4,6 стимулирует развитие клеточного цикла через С-концевую спираль белка ретинобластомы» . Молекулярная клетка . 74 (4): 758–770.e4. doi : 10.1016/j.molcel.2019.03.020 . ПМК 6800134 . ПМИД 30982746 .
- ^ Норбери С. (1995). «Протеинкиназа Cdk2 (позвоночные)» . В Харди Д.Г., Хэнкс С. (ред.). Факты о протеинкиназахКнига . Бостон: Академическая пресса. стр. 184 . ISBN 978-0-12-324719-3 .
- ^ «Презентация CDC25-ФОСФАТАЗ: потенциальная мишень для новых противораковых агентов» . Архивировано из оригинала 3 марта 2016 года . Проверено 11 марта 2010 г.
- ^ Шерр Си Джей, Бич Д., Шапиро Джи (апрель 2016 г.). «Нацеливание на CDK4 и CDK6: от открытия к терапии» . Открытие рака . 6 (4): 353–367. дои : 10.1158/2159-8290.cd-15-0894 . ПМЦ 4821753 . ПМИД 26658964 .
- ^ О'Лири Б., Финн Р.С., Тернер, Северная Каролина (июль 2016 г.). «Лечение рака селективными ингибиторами CDK4/6». Обзоры природы. Клиническая онкология . 13 (7): 417–430. дои : 10.1038/nrclinonc.2016.26 . ПМИД 27030077 . S2CID 23646632 .
- ^ Билгин Б., Сендур М.А., Шенер Деде Д., Акынджи М.Б., Ялчин Б. (сентябрь 2017 г.). «Текущий и всесторонний обзор ингибиторов циклинзависимых киназ для лечения метастатического рака молочной железы». Текущие медицинские исследования и мнения . 33 (9): 1559–1569. дои : 10.1080/03007995.2017.1348344 . ПМИД 28657360 . S2CID 205542255 .
- ^ Шмидт М., Себастьян М. (август 2018 г.). «Палбоциклиб — первый представитель нового класса ингибиторов клеточного цикла». Малые молекулы в онкологии . Последние результаты исследований рака. Том. 211. С. 153–175. дои : 10.1007/978-3-319-91442-8_11 . ISBN 978-3-319-91441-1 . ПМИД 30069766 .
- ^ Перейти обратно: а б Прамила Т., Ву В., Майлз С., Ноубл В.С., Бриден Л.Л. (август 2006 г.). «Транскрипционный фактор Forkhead Hcm1 регулирует гены сегрегации хромосом и заполняет пробел S-фазы в транскрипционной схеме клеточного цикла» . Гены и развитие . 20 (16): 2266–2278. дои : 10.1101/gad.1450606 . ПМЦ 1553209 . ПМИД 16912276 .
- ^ Перейти обратно: а б с Орландо Д.А., Лин С.И., Бернард А., Ван Дж.Ю., Соколар Дж.Е., Иверсен Э.С. и др. (июнь 2008 г.). «Глобальный контроль транскрипции клеточного цикла с помощью связанных CDK и сетевых осцилляторов» . Природа . 453 (7197): 944–947. Бибкод : 2008Natur.453..944O . дои : 10.1038/nature06955 . ПМЦ 2736871 . ПМИД 18463633 .
- ^ де Лихтенберг У, Йенсен Л.Дж., Фаусбёлль А., Йенсен Т.С., Борк П., Брунак С. (апрель 2005 г.). «Сравнение вычислительных методов идентификации генов, регулирующих клеточный цикл» . Биоинформатика . 21 (7): 1164–1171. doi : 10.1093/биоинформатика/bti093 . ПМИД 15513999 .
- ^ Перейти обратно: а б Уайт М.А., Райлз Л., Коэн Б.А. (февраль 2009 г.). «Систематический скрининг регуляторов транскрипции клеточного цикла дрожжей» . Генетика . 181 (2): 435–446. doi : 10.1534/genetics.108.098145 . ПМК 2644938 . ПМИД 19033152 .
- ^ Ли Т.И., Ринальди Н.Дж., Роберт Ф., Одом Д.Т., Бар-Джозеф З., Гербер Г.К. и др. (октябрь 2002 г.). «Сети регуляции транскрипции у Saccharomyces cerevisiae». Наука . 298 (5594): 799–804. Бибкод : 2002Sci...298..799L . дои : 10.1126/science.1075090 . ПМИД 12399584 . S2CID 4841222 .
- ^ Саймон И., Барнетт Дж., Ханнетт Н., Харбисон К.Т., Ринальди Н.Дж., Волкерт Т.Л. и др. (сентябрь 2001 г.). «Последовательная регуляция регуляторов транскрипции в клеточном цикле дрожжей» . Клетка . 106 (6): 697–708. дои : 10.1016/S0092-8674(01)00494-9 . ПМИД 11572776 . S2CID 9308235 .
- ^ Сидорова Дж.М., Майкселл Г.Е., Бриден Л.Л. (декабрь 1995 г.). «Регулируемое клеточным циклом фосфорилирование Swi6 контролирует его ядерную локализацию» . Молекулярная биология клетки . 6 (12): 1641–1658. дои : 10.1091/mbc.6.12.1641 . ПМК 301322 . ПМИД 8590795 .
- ^ Уберсакс Дж.А., Вудбери Э.Л., Куанг П.Н., Параз М., Блетроу Дж.Д., Шах К. и др. (октябрь 2003 г.). «Цели циклинзависимой киназы Cdk1». Природа . 425 (6960): 859–864. Бибкод : 2003Natur.425..859U . дои : 10.1038/nature02062 . ПМИД 14574415 . S2CID 4391711 .
- ^ Морган Д.О. (2007). «2–3». Клеточный цикл: принципы управления . Лондон: New Science Press. п. 18. ISBN 978-0-9539181-2-6 .
- ^ Омберг Л., Мейерсон-младший, Кобаяши К., Друри Л.С., Диффли Дж.Ф., Альтер О (октябрь 2009 г.). «Глобальное влияние репликации ДНК и активности источника репликации ДНК на экспрессию генов эукариот» . Молекулярная системная биология . 5 : 312. дои : 10.1038/msb.2009.70 . ПМК 2779084 . ПМИД 19888207 .
- ^ Альтер О, Голуб Г.Х., Браун П.О., Ботштейн Д. (февраль 2004 г.). Дойчер М.П., Блэк С., Бемер П.Е., Д'Урсо Г., Флетчер Т.М., Хуэйцзин Ф. и др. (ред.). Новая корреляция в масштабе генома между репликацией ДНК и транскрипцией РНК во время клеточного цикла дрожжей прогнозируется с помощью моделей, управляемых данными (PDF) . Зимний симпозиум по биотехнологиям в Майами. Клеточный цикл, хромосомы и рак. Том. 15. Майами-Бич, Флорида: Медицинский факультет Университета Майами. Архивировано из оригинала (PDF) 9 сентября 2014 года . Проверено 7 февраля 2014 г.
- ^ Альтер О, Голуб Г.Х. (ноябрь 2004 г.). «Интегративный анализ данных в масштабе генома с использованием псевдообратной проекции предсказывает новую корреляцию между репликацией ДНК и транскрипцией РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (47): 16577–16582. Бибкод : 2004PNAS..10116577A . дои : 10.1073/pnas.0406767101 . ПМК 534520 . ПМИД 15545604 .
- ^ Омберг Л., Голуб Г.Х., Альтер О (ноябрь 2007 г.). «Тензорное разложение по сингулярным значениям высшего порядка для интегративного анализа данных микрочипов ДНК из различных исследований» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (47): 18371–18376. Бибкод : 2007PNAS..10418371O . дои : 10.1073/pnas.0709146104 . ПМК 2147680 . ПМИД 18003902 .
- ^ Элледж С.Дж. (декабрь 1996 г.). «Контрольные точки клеточного цикла: предотвращение кризиса идентичности». Наука . 274 (5293): 1664–1672. Бибкод : 1996Sci...274.1664E . дои : 10.1126/science.274.5293.1664 . ПМИД 8939848 . S2CID 39235426 .
- ^ Перейти обратно: а б Виленчик М.М., Кнудсон А.Г. (октябрь 2003 г.). «Двухцепочечные разрывы эндогенной ДНК: образование, точность восстановления и индукция рака» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (22): 12871–12876. Бибкод : 2003PNAS..10012871V . дои : 10.1073/pnas.2135498100 . ПМК 240711 . ПМИД 14566050 .
- ^ ЛеМэр-Адкинс Р., Радке К., Хант П.А. (декабрь 1997 г.). «Отсутствие контроля контрольных точек при переходе метафаза/анафаза: механизм мейотического нерасхождения у самок млекопитающих» . Журнал клеточной биологии . 139 (7): 1611–1619. дои : 10.1083/jcb.139.7.1611 . ПМЦ 2132649 . ПМИД 9412457 .
- ^ Сакауэ-Савано А., Курокава Х., Моримура Т., Ханью А., Хама Х., Осава Х. и др. (февраль 2008 г.). «Визуализация пространственно-временной динамики развития многоклеточного клеточного цикла» . Ячейка 132 (3): 487–498. дои : 10.1016/j.cell.2007.12.033 . ПМИД 18267078 . S2CID 15704902 .
- ^ Родригес Э.А., Тран Г.Н., Гросс Л.А., Крисп Дж.Л., Шу X, Лин Дж.Ю., Цянь Р.Ю. (сентябрь 2016 г.). «Дальнекрасный флуоресцентный белок произошел из цианобактериального фикобилипротеина» . Природные методы . 13 (9): 763–769. дои : 10.1038/nmeth.3935 . ПМК 5007177 . ПМИД 27479328 .
- ^ Чамперис Цанирас С., Канеллакис Н., Симеониду И.Е., Николопулу П., Лигероу З., Таравирас С. (июнь 2014 г.). «Лицензирование репликации ДНК, рака, плюрипотентности и дифференциации: взаимосвязанный мир?» . Семинары по клеточной биологии и биологии развития . 30 : 174–180. дои : 10.1016/j.semcdb.2014.03.013 . ПМИД 24641889 .
- ^ Басерга Р. (июнь 1965 г.). «Связь клеточного цикла с ростом опухоли и контролем деления клеток: обзор». Исследования рака . 25 (5): 581–595. ПМИД 14347544 .
- ^ Мао З., Боззелла М., Селуанов А., Горбунова В. (сентябрь 2008 г.). «Репарация ДНК путем негомологичного соединения концов и гомологичной рекомбинации во время клеточного цикла в клетках человека» . Клеточный цикл . 7 (18): 2902–2906. дои : 10.4161/cc.7.18.6679 . ПМК 2754209 . ПМИД 18769152 .
- ^ Перейти обратно: а б с д Нэсмит К. (сентябрь 1995 г.). «Эволюция клеточного цикла». Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 349 (1329): 271–281. дои : 10.1098/rstb.1995.0113 . ПМИД 8577838 .
- ^ Кавалер-Смит Т. (июль 1987 г.). «Происхождение эукариотических и архебактериальных клеток». Анналы Нью-Йоркской академии наук . 503 (1): 17–54. Бибкод : 1987NYASA.503...17C . дои : 10.1111/j.1749-6632.1987.tb40596.x . ПМИД 3113314 . S2CID 38405158 .
- ^ Майзелс Н., Вайнер А.М. (июль 1994 г.). «Филогения исходя из функции: данные молекулярной летописи окаменелостей свидетельствуют о том, что тРНК возникла в результате репликации, а не трансляции» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (15): 6729–6734. Бибкод : 1994PNAS...91.6729M . дои : 10.1073/pnas.91.15.6729 . ПМК 44276 . ПМИД 8041690 .
- ^ Морган Д.О. (ноябрь 1997 г.). «Циклин-зависимые киназы: двигатели, часы и микропроцессоры». Ежегодный обзор клеточной биологии и биологии развития . 13 (1): 261–291. дои : 10.1146/annurev.cellbio.13.1.261 . ПМИД 9442875 .
- ^ Малумбрес М., Харлоу Э., Хант Т., Хантер Т., Лахти Дж.М., Мэннинг Г. и др. (ноябрь 2009 г.). «Циклинзависимые киназы: семейный портрет» . Природная клеточная биология . 11 (11): 1275–1276. дои : 10.1038/ncb1109-1275 . ПМК 2914104 . ПМИД 19884882 .
- ^ Сатьянараяна А., Калдис П. (август 2009 г.). «Регуляция клеточного цикла млекопитающих: несколько Cdks, многочисленные циклины и разнообразные компенсаторные механизмы». Онкоген . 28 (33): 2925–2939. дои : 10.1038/onc.2009.170 . ПМИД 19561645 . S2CID 3096776 .
- ^ Барьер С, Сантамария Д, Серкейра А, Галан Х, Мартин А, Ортега С и др. (июнь 2007 г.). «Мыши процветают без Cdk4 и Cdk2» . Молекулярная онкология . 1 (1): 72–83. дои : 10.1016/j.molonc.2007.03.001 . ПМЦ 5543859 . ПМИД 19383288 .
- ^ Ортега С., Прието И., Одазима Дж., Мартин А., Дубус П., Сотильо Р. и др. (сентябрь 2003 г.). «Циклин-зависимая киназа 2 необходима для мейоза, но не для митотического деления клеток у мышей». Природная генетика . 35 (1): 25–31. дои : 10.1038/ng1232 . ПМИД 12923533 . S2CID 19522248 .
- ^ Алим Э., Киёкава Х., Калдис П. (август 2005 г.). «Комплексы Cdc2-циклин E регулируют фазовый переход G1/S». Природная клеточная биология . 7 (8): 831–836. дои : 10.1038/ncb1284 . ПМИД 16007079 . S2CID 10842071 .
- ^ Перейти обратно: а б Сантамария Д., Барьер С., Серкейра А., Хант С., Тарди С., Ньютон К. и др. (август 2007 г.). «Cdk1 достаточно для управления клеточным циклом млекопитающих». Природа . 448 (7155): 811–815. Бибкод : 2007Natur.448..811S . дои : 10.1038/nature06046 . ПМИД 17700700 . S2CID 4412772 .
- ^ Новак М.К., Харашима Х., Диссмейер Н., Чжао Х., Буйер Д., Веймер А.К. и др. (май 2012 г.). «Генетическая основа функции циклинзависимой киназы у арабидопсиса» . Развивающая клетка . 22 (5): 1030–1040. дои : 10.1016/j.devcel.2012.02.015 . ПМИД 22595674 .
- ^ Перейти обратно: а б с д и ж Харашима Х., Диссмейер Н., Шнитгер А. (июль 2013 г.). «Контроль клеточного цикла в эукариотическом царстве». Тенденции в клеточной биологии . 23 (7): 345–356. дои : 10.1016/j.tcb.2013.03.002 . ПМИД 23566594 .
- ^ Будольф В., Барроко Р., Энглер Дж., Веркест А., Бикман Т., Наудтс М. и др. (апрель 2004 г.). «Циклин-зависимые киназы B1-типа необходимы для образования устьичных комплексов Arabidopsis thaliana» . Растительная клетка . 16 (4): 945–955. дои : 10.1105/tpc.021774 . ПМК 412868 . ПМИД 15031414 .
- ^ Андерсен С.У., Бючел С., Чжао З., Люнг К., Новак О., Буш В. и др. (январь 2008 г.). «Требование циклин-зависимых киназ B2-типа для целостности меристемы Arabidopsis thaliana» . Растительная клетка . 20 (1): 88–100. дои : 10.1105/tpc.107.054676 . ПМК 2254925 . ПМИД 18223038 .
- ^ Перейти обратно: а б Кросс Ф.Р., Бухлер Н.Е., Скотхайм Дж.М. (декабрь 2011 г.). «Эволюция сетей и последовательностей в управлении эукариотическим клеточным циклом» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 366 (1584): 3532–3544. дои : 10.1098/rstb.2011.0078 . ПМК 3203458 . ПМИД 22084380 .
- ^ Скотхайм Дж. М., Ди Талия С., Сиггиа Э.Д., Cross FR (июль 2008 г.). «Положительная обратная связь циклинов G1 обеспечивает согласованное вступление в клеточный цикл» . Природа . 454 (7202): 291–296. Бибкод : 2008Natur.454..291S . дои : 10.1038/nature07118 . ПМК 2606905 . ПМИД 18633409 .
- ^ Феррелл Дж. Э. (апрель 2002 г.). «Самовоспроизводящиеся состояния в передаче сигнала: положительная обратная связь, двойная отрицательная обратная связь и бистабильность». Современное мнение в области клеточной биологии . 14 (2): 140–148. дои : 10.1016/S0955-0674(02)00314-9 . ПМИД 11891111 .
- ^ Вента Р., Валк Э., Кыйвомяги М., Луг М. (2012). «Двойная отрицательная обратная связь между S-фазой циклин-CDK и CKI вызывает резкость переключения G1/S» . Границы в физиологии . 3 : 459. doi : 10.3389/fphys.2012.00459 . ПМЦ 3515773 . ПМИД 23230424 .
- ^ Эсер У., Фаллёр-Феттиг М., Джонсон А., Скотхайм Дж. М. (август 2011 г.). «Приверженность клеточному переходу предшествует общегеномным транскрипционным изменениям» . Молекулярная клетка . 43 (4): 515–527. doi : 10.1016/j.molcel.2011.06.024 . ПМК 3160620 . ПМИД 21855792 .
- ^ Перейти обратно: а б Нарасимха А.М., Каулич М., Шапиро Г.С., Чой Ю.Дж., Сичински П., Дауди С.Ф. (июнь 2014 г.). Дэвис Р. (ред.). «Циклин D активирует опухолевый супрессор Rb путем монофосфорилирования» . электронная жизнь . 3 : e02872. doi : 10.7554/eLife.02872 . ПМК 4076869 . ПМИД 24876129 .
- ^ Харбор Дж.В., Луо Р.С., Дей Санти А., Постиго А.А., Дин, округ Колумбия (сентябрь 1999 г.). «Фосфорилирование Cdk запускает последовательные внутримолекулярные взаимодействия, которые постепенно блокируют функции Rb по мере того, как клетки проходят через G1» . Клетка . 98 (6): 859–869. дои : 10.1016/s0092-8674(00)81519-6 . ПМИД 10499802 .
- ^ Такахата С., Ю Ю, DJ Stillman (ноябрь 2009 г.). «Функциональный аналог E2F SBF рекрутирует HDAC Rpd3(L) через Whi5 и Stb1, а также реорганизатор хроматина FACT к промоторам циклина G1 дрожжей» . Журнал ЭМБО . 28 (21): 3378–3389. дои : 10.1038/emboj.2009.270 . ПМК 2776103 . ПМИД 19745812 .
- ^ де Брюин Р.А., Макдональд У.Х., Калашникова Т.И., Йейтс Дж., Виттенберг С. (июнь 2004 г.). «Cln3 активирует G1-специфическую транскрипцию посредством фосфорилирования SBF-связанного репрессора Whi5» . Клетка . 117 (7): 887–898. дои : 10.1016/j.cell.2004.05.025 . ПМИД 15210110 .
- ^ Чжао X, Харашима Х., Диссмейер Н., Пуш С., Веймер А.К., Брамзипе Дж. и др. (2 августа 2012 г.). Паланивелу Р. (ред.). «Общий модуль контроля клеточного цикла G1/S-фазы цветущего растения Arabidopsis thaliana» . ПЛОС Генетика . 8 (8): e1002847. дои : 10.1371/journal.pgen.1002847 . ПМЦ 3410867 . ПМИД 22879821 .
- ^ Веймер А.К., Новак М.К., Буйер Д., Чжао X, Харашима Х., Насир С. и др. (октябрь 2012 г.). «Связанная с ретинобластомой1 регулирует асимметричное деление клеток арабидопсиса» . Растительная клетка 24 (10): 4083–4 дои : 10.1105/tpc.112.104620 . ПМЦ 3517237 . ПМИД 23104828 .
Дальнейшее чтение
[ редактировать ]- Морган Д.О. (2007). Клеточный цикл: принципы управления . Лондон: Опубликовано New Science Press совместно с Oxford University Press. ISBN 978-0-87893-508-6 .
- Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2008). «Глава 17». Молекулярная биология клетки (5-е изд.). Нью-Йорк: Garland Science. ISBN 978-0-8153-4111-6 .
- Кригер М., Скотт М.П., Мацудайра П.Т., Лодиш Х.Ф., Дарнелл Дж.Э., Зипурски Л., Кайзер С., Берк А. (2004). Молекулярно-клеточная биология . Нью-Йорк: WH Freeman and CO. ISBN 978-0-7167-4366-8 .
- Уотсон Дж.Д., Бейкер Т.А., Белл С.П., Ганн А., Левин М., Лосик Р. (2004). «Глава 7». Молекулярная биология гена (5-е изд.). Сан-Франциско: Пирсон/Бенджамин Каммингс. ISBN 978-0-8053-4642-8 .
Внешние ссылки
[ редактировать ] В этой статье использованы общедоступные материалы из Научный букварь . НКБИ . Архивировано из оригинала 8 декабря 2009 года.
В этой статье использованы общедоступные материалы из Научный букварь . НКБИ . Архивировано из оригинала 8 декабря 2009 года. - Семинар Дэвида Моргана: Управление клеточным циклом
- Клеточный цикл и смерть клеток. Архивировано 30 октября 2018 года в Wayback Machine.
- Транскрипционная программа клеточного цикла: время с высоким разрешением
- Транскрипция, регулируемая клеточным циклом и метаболическим циклом у дрожжей
- Анимация клеточного цикла 1Lec.com
- Клеточный цикл
- Фуччи: Использование GFP для визуализации клеточного цикла
- Обзор клеточного цикла журнала Science Creative Quarterly
- KEGG - Цикл клеток человека. Архивировано 3 ноября 2008 г. в Wayback Machine.