Пентахлорид сурьмы
| |||
 | |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена Пентахлорид сурьмы Antimony(V) chloride | |||
| Другие имена Сурьмы хлорид Перхлорид сурьмы | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.028.729 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| Кл 5 Сб | |||
| Молярная масса | 299.01 g·mol −1 | ||
| Появление | бесцветная или красновато-желтая (дымящая) жидкость, маслянистая | ||
| Запах | острый, оскорбительный | ||
| Плотность | 2,336 г/см 3 (20 °С) [1] 2,36 г/см 3 (25 °С) [2] | ||
| Температура плавления | 2,8 ° C (37,0 ° F; 275,9 К) | ||
| Точка кипения | 140 ° С (284 ° F; 413 К) разлагается при 106 °C [3] 79 ° С (174 ° F; 352 К) при 22 мм рт.ст. [1] 92 ° С (198 ° F; 365 К) при 30 мм рт.ст. [2] | ||
| реагирует | |||
| Растворимость | растворим в спирте , HCl , винной кислоте , CHCl 3 , CS 2 , CCl 4 | ||
| Растворимость в оксихлориде селена(IV) | 62,97 г/100 г (25 °С) | ||
| Давление пара | 0,16 кПа (25 °С) 4 кПа (40 °С) 7,7 кПа (100 °С) [4] | ||
| -120.0·10 −6 см 3 /моль | |||
Показатель преломления ( n D ) | 1.59255 | ||
| Вязкость | 2034 сП (29,4 ° С) [1] 1,91 сП (35 °С) | ||
| Структура | |||
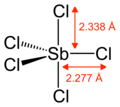
| Треугольная бипирамида | |||
| 0 Д | |||
| Термохимия [3] | |||
Теплоемкость ( С ) | 120,9 Дж/моль К (газ) | ||
Стандартный моляр энтропия ( S ⦵ 298 ) | 295 Дж/моль·К | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -437,2 кДж/моль | ||
Свободная энергия Гиббса (Δ f G ⦵ ) | -345,35 кДж/моль | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Опасности при вдыхании | Токсичный | ||
| СГС Маркировка : [2] | |||
  | |||
| Опасность | |||
| Х314 , Х411 | |||
| П273 , П280 , П305+П351+П338 , П310 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 77 ° С (171 ° F; 350 К) | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | 1115 мг/кг (крыса, перорально) [3] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
ПЭЛ (допустимо) | СВВ 0,5 мг/м 3 (как Сб) [5] | ||
РЕЛ (рекомендуется) | СВВ 0,5 мг/м 3 (как Сб) [5] | ||
| Родственные соединения | |||
Другие анионы | Пентафторид сурьмы | ||
Другие катионы | Пентахлорид фосфора | ||
Родственные соединения | Сурьмы трихлорид | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Пентахлорид сурьмы представляет собой химическое соединение формулы SbCl 5 . Это бесцветное масло, но типичные образцы имеют желтоватый оттенок из-за растворенного хлора . Из-за своей склонности к гидролизу до соляной кислоты SbCl 5 является сильнокоррозионным веществом и его следует хранить в стеклянных или ПТФЭ контейнерах.
Подготовка и структура
[ редактировать ]Пентахлорид сурьмы получают пропусканием газообразного хлора в расплавленный трихлорид сурьмы :
- SbCl 3 + Cl 2 → SbCl 5
Газообразный SbCl 5 имеет тригонально-бипирамидальную структуру. [6]
Реакции
[ редактировать ]Это соединение реагирует с водой с образованием пятиокиси сурьмы и соляной кислоты : [7]
- 2 SbCl 5 + 5 H 2 O → Sb 2 O 5 + 10 HCl
Известны моно- и тетрагидраты SbCl 5 ·H 2 O и SbCl 5 ·4H 2 O.
Это соединение образует аддукты со многими основаниями Льюиса. SbCl 5 представляет собой мягкую кислоту Льюиса ее модели ECW , параметры составляют E A = 3,64 и CA = 10,42. Он используется в качестве стандартной кислоты Льюиса в шкале основности Льюиса Гутмана . [8] [9]
Это также сильный окислитель . [10] Например, ароматические эфиры окисляются до катион-радикалов в соответствии со следующей стехиометрией: [11]
- 3 SbCl 5 + 2 ArH → 2 (ArH+)(SbCl 6 − ) + SbCl 3
Приложения
[ редактировать ]Пентахлорид сурьмы используется в качестве полимеризации катализатора и для хлорирования органических соединений.
Меры предосторожности
[ редактировать ]Пентахлорид сурьмы — сильнокоррозионное вещество, которое следует хранить вдали от источников тепла и влаги. Это хлорирующий агент, который в присутствии влаги выделяет газообразный хлористый водород. Из-за этого он может протравить даже инструменты из нержавеющей стали (например, иглы), если обращаться с ними во влажной атмосфере. С ним нельзя обращаться с нефторированными пластиками (такими как пластиковые шприцы, пластиковые перегородки или иглы с пластиковыми фитингами), поскольку они плавят и обугливают пластиковые материалы. [12]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с «Пентахлорид сурьмы (PID Великобритании)» .
- ^ Перейти обратно: а б с Sigma-Aldrich Co. , Хлорид сурьмы(V) . Проверено 29 мая 2014 г.
- ^ Перейти обратно: а б с «Хлорид сурьмы(V)» .
- ^ Пентахлорид сурьмы в Линстреме, Питере Дж.; Маллард, Уильям Г. (ред.); Интернет-книга NIST по химии , справочная база данных стандартов NIST № 69 , Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд) (получено 29 мая 2014 г.)
- ^ Перейти обратно: а б Карманный справочник NIOSH по химическим опасностям. «#0036» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Прадьот Патнаик. Справочник неорганических химикатов . МакГроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ В. Гутманн (1976). «Влияние растворителей на реакционную способность металлоорганических соединений». Коорд. хим. Откр. 18 (2): 225–255. дои : 10.1016/S0010-8545(00)82045-7 .
- ^ Крамер, Р.Э.; Бопп, Т.Т. (1977). «Графическое отображение энтальпий образования аддуктов кислот и оснований Льюиса». Журнал химического образования . 54 : 612–613. дои : 10.1021/ed054p612 . На графиках, показанных в этой статье, использовались более старые параметры. Улучшенные параметры E&C перечислены в модели ECW .
- ^ Коннелли, Нью-Йорк; Гейгер, МЫ (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии». хим. Откр. 96 (2): 877–922. дои : 10.1021/cr940053x . ПМИД 11848774 .
- ^ Ратор, Р.; Кумар, А.С.; Линдеман, С.В.; Кочи, Дж. К. (1998). «Получение и строение кристаллических ароматических катион-радикальных солей. Гексахлорантимонат триэтилоксония как новый (одноэлектронный) окислитель» . Журнал органической химии . 63 (17): 5847–5856. дои : 10.1021/jo980407a . ПМИД 11672186 .
- ^ Шекарчи, М.; Бехбахани, Ф. К. Катал. Летт. 2017 147 2950. doi:10.1007/s10562-017-2194-2