Аллильная группа

В органической химии аллильная группа является заместителем со структурной формулой -СН 2 -HC=СН 2 . Он состоит из метиленового мостика ( −CH 2 − ), присоединенный к винильной группе ( −СН=СН 2 ). [ 1 ] [ 2 ] Название происходит от научного названия чеснока sativum Allium . В 1844 году Теодор Вертхайм аллильное производное выделил из чесночного масла и назвал его « Швефелаллил ». [ 3 ] [ 4 ] Термин «аллил» применяется ко многим соединениям, связанным с H 2 C=CH-CH 2 , некоторые из которых имеют практическое или повседневное значение, например, аллилхлорид .
Аллилирование – это любая химическая реакция добавляется аллильная группа , в ходе которой к субстрату . [ 1 ]
Номенклатура
[ редактировать ]
Участок, соседний с ненасыщенным атомом углерода, называется аллильным положением или аллильным участком . Группу, прикрепленную к этому сайту, иногда называют allylic . Таким образом, CH 2 =CHCH 2 OH «имеет аллильную гидроксильную группу ». Аллильные связи C-H примерно на 15% слабее, чем связи C-H в обычных sp. 3 углеродные центры и, следовательно, более реакционноспособны.
Бензильная и аллильная кислоты родственны по структуре, силе связи и реакционной способности. Другими реакциями, которые имеют тенденцию происходить с аллильными соединениями, являются аллильное окисление , еновые реакции и реакция Цуджи-Троста . Бензильные группы родственны аллильным группам; оба демонстрируют повышенную реактивность.
Пентадиенильная группа
[ редактировать ]А Группа CH 2 , соединенная с двумя винильными группами, называется двойной аллильной . Энергия диссоциации связей C-H на двуаллильном центре примерно на 10% меньше энергии диссоциации связи C-H, которая является одноаллильной. Ослабление связей С-Н отражается на легком окислении соединений, содержащих 1,4- пентадиен ( C=C-CH 2 -C=C ) связи. Некоторые полиненасыщенные жирные кислоты содержат эту пентадиеновую группу: линолевая кислота , α- линоленовая кислота и арахидоновая кислота . Они чувствительны к ряду реакций с кислородом (O 2 ), начиная с перекисного окисления липидов . жирных кислот Продукты включают гидропероксиды , эпокси-гидрокси полиненасыщенные жирные кислоты, жасмонаты , дивинилэфиры жирных кислот и листовые альдегиды . Некоторые из этих производных являются сигнальными молекулами, некоторые используются для защиты растений ( антифиданты ), некоторые являются предшественниками других метаболитов, используемых растением. [ 5 ]
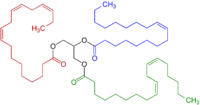
Одним из практических последствий их высокой реакционной способности является то, что полиненасыщенные жирные кислоты имеют плохой срок хранения из-за их склонности к самоокислению , что в случае пищевых продуктов приводит к прогорканию . Металлы ускоряют деградацию. Эти жиры склонны к полимеризации, образуя полутвердые вещества. Эта модель реактивности является фундаментальной для пленкообразующего поведения «олифы » , которые являются компонентами масляных красок и лаков .
гомоаллильный
[ редактировать ]Термин гомоаллильный относится к положению на углеродном скелете рядом с аллильным положением. В бут-3-енилхлориде CH 2 =CHCH 2 CH 2 Cl , хлорид является гомоаллильным, поскольку он связан с гомоаллильным участком.

Склеивание
[ редактировать ]Аллильная группа широко встречается в органической химии. [ 1 ] Аллильные радикалы , анионы и катионы часто рассматриваются как промежуточные соединения в реакциях . Все они имеют три смежных sp²-гибридных углеродных центра и все обеспечивают стабильность за счет резонанса. [ 6 ] Каждый вид может быть представлен двумя резонансными структурами , в которых заряд или неспаренный электрон распределены в обеих позициях 1,3.

Резонансная структура аллил-аниона. Катион идентичен, но несет заряд противоположного знака. [ 7 ]
С точки зрения теории МО , диаграмма МО имеет три молекулярные орбитали: первая связывающая, вторая несвязывающая и орбиталь с более высокой энергией является разрыхляющей. [ 2 ]

МО-диаграмма для аллильных π-орбиталей. В радикале (показано) промежуточная орбиталь Ψ 2 занята одиночно; в катионе незанятый; а в анионе полный.
Реакции и применение
[ редактировать ]Эта повышенная реактивность аллильных групп имеет множество практических последствий. При серной вулканизации различных каучуков используется превращение аллильных кислот. СН 2 группируются в Сшивки CH-S x -CH . Аналогично олифы, такие как льняное масло , сшиваются посредством окисления аллильных (или дважды аллильных) участков. Это сшивание лежит в основе свойств красок и порчи пищевых продуктов из-за прогоркания .
В промышленном производстве акрилонитрила путем аммоксидирования пропена используется легкое окисление аллильных центров C-H:
По оценкам, 800 000 тонн (1997 г.) производится путем хлорирования пропилена аллилхлорида :
Это предшественник аллилового спирта и эпихлоргидрина .
Аллилирование
[ редактировать ]Аллирование — это присоединение аллильной группы к субстрату, обычно другому органическому соединению. Классически аллилирование включает реакцию карбаниона с аллилхлоридом. Альтернативы включают аллилирование карбонила аллилметаллическими реагентами, такими как аллилтриметилсилан , [ 9 ] [ 10 ] [ 11 ] или катализируемое иридием аллилирование Крише .
Аллилирование может осуществляться также путем сопряженного присоединения : присоединения аллильной группы к бета-положению енона . Реакция Хосоми-Сакураи является распространенным методом сопряженного аллилирования. [ 12 ]
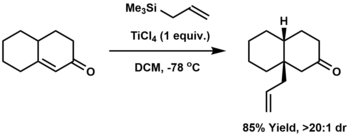
Окисление
[ редактировать ]Аллильные связи CH подвержены окислению. [ 13 ] Одним из коммерческих применений аллильного окисления является синтез нооткатона , аромата грейпфрута , из валентцена , более доступного сесквитерпеноида : [ 14 ]

При синтезе некоторых химических веществ диоксид селена используется для превращения алкенов в аллильные спирты: [ 15 ]
- R 2 C=CR'-CHR" 2 + [O] → R 2 C=CR'-C(OH)R" 2
где R, R', R" могут представлять собой алкильные или арильные заместители.
С промышленной точки зрения окисление бензильных связей CH проводится в особенно крупных масштабах, например, при производстве терефталевой кислоты , бензойной кислоты и гидроперекиси кумола . [ 16 ]
Аллильные соединения
[ редактировать ]К аллильной группе можно присоединить множество заместителей, образуя стабильные соединения. Коммерчески важные аллильные соединения включают:
- Кротиловый спирт (CH 3 CH=CH−CH 2 OH)
- Диметилаллилпирофосфат , центральный элемент в биосинтезе терпенов , предшественник многих натуральных продуктов, включая натуральный каучук .
- Аллильные комплексы переходных металлов , такие как димер хлорида аллилпалладия.
См. также
[ редактировать ]- Аллильный штамм
- Перегруппировка Кэрролла
- Аллиловый палладиевый комплекс
- Реакция Цудзи-Троста
- Пропаргиловый/гомопропаргиловый
- бензиловый
- Виниловый
- ацетиленовый
- Налоксон
- Аллильная перегруппировка
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Джерри Марч, «Передовая органическая химия», 4-е изд. Дж. Уайли и сыновья, 1992: Нью-Йорк. ISBN 0-471-60180-2 .
- ^ Перейти обратно: а б Моррисон, Роберт Торнтон; Бойд, Роберт Нилсон (1987). Органическая химия (4-е изд.). Аллин и Бэкон.
- ^ Теодор Вертхайм (1844 г.). «Исследование чесночного масла» . Анналы химии и фармации . 51 (3): 289–315. дои : 10.1002/jlac.18440510302 .
- ^ Эрик Блок (2010). Чеснок и другие луки: знания и наука . Королевское химическое общество. ISBN 978-0-85404-190-9 .
- ^ Фойсснер, Иво; Вастернак, Клаус (2002). «Липоксигеназный путь». Ежегодный обзор биологии растений . 53 : 275–297. doi : 10.1146/annurev.arplant.53.100301.135248 . ПМИД 12221977 .
- ^ Органическая химия Джон Макмерри 2-е изд. 1988 год
- ^ Ричи, Герман Г. (1970). «Свойства алкеновых ионов карбония и карбанионов». В Забицком, Джейкоб (ред.). Химия алкенов . Химия функциональных групп. Том. 2. Лондон: Интерсайенс / Уильям Клоуз и сыновья. стр. 56–57. ISBN 0471980501 . LCCN 64-25218 .
- ^ Ноги, Кейсуке; Ёримицу, Хидеки (2021). «Расщепление углерод-углеродной связи в аллильных положениях: ретро-аллилирование и деаллилирование». Химические обзоры . 121 (1): 345–364. doi : 10.1021/acs.chemrev.0c00157 . ПМИД 32396335 . S2CID 218617434 .
- ^ Юс, Мигель; Гонсалес-Гомес, Хосе К.; Фубело, Франциско (2013). «Диастереоселективное аллилирование карбонильных соединений и иминов: применение к синтезу натуральных продуктов». Химические обзоры . 113 (7): 5595–5698. дои : 10.1021/cr400008h . hdl : 10045/38276 . ПМИД 23540914 .
- ^ Уивер, Джимми Д.; Ресио, Антонио; Греннинг, Александр Дж.; Тунге, Джон А. (2011). «Реакции декарбоксилативного аллилирования и бензилирования, катализируемые переходными металлами» . Химические обзоры . 111 (3): 1846–1913. дои : 10.1021/cr1002744 . ПМК 3116714 . ПМИД 21235271 .
- ^ Юс, Мигель; Гонсалес-Гомес, Хосе К.; Фубело, Франциско (2011). «Каталитическое энантиоселективное аллилирование карбонильных соединений и иминов». Химические обзоры . 111 (12): 7774–7854. дои : 10.1021/cr1004474 . ПМИД 21923136 .
- ^ Сакурай Хидеки; Хосоми Акира; Хаяси Джосабро (1984). «Сопряженное аллилирование α,β-ненасыщенных кетонов аллилсиланом: 4-фенил-6-гептен-2-он». Органические синтезы . 62 : 86. дои : 10.15227/orgsyn.062.0086 .
- ^ Мезон, Вольфганг; Вайдманн, Верена (2013). «Аллильное окисление олефинов до енонов». Синтез . 45 (16): 2201–2221. дои : 10.1055/s-0033-1338491 . S2CID 196767407 .
- ^ Хорн, Эван Дж.; Розен, Брэндон Р.; Чен, Юн; Тан, Цзязе; Чен, Кэ; Истгейт, Мартин Д.; Бэран, Фил С. (2016). «Масштабируемое и устойчивое электрохимическое аллильное окисление C – H» . Природа . 533 (7601): 77–81. Бибкод : 2016Natur.533...77H . дои : 10.1038/nature17431 . ПМК 4860034 . ПМИД 27096371 .
- ^ Хекстра, Уильям Дж.; Фэйрлэмб, Ян Дж.С.; Жиру, Симон; Чен, Юйчжун (2017). «Оксид селена (IV)». Энциклопедия реагентов для органического синтеза . стр. 1–12. дои : 10.1002/047084289X.rs008.pub3 . ISBN 978-0-470-84289-8 .
- ^ Рекуперо, Франческо; Пунта, Карло (2007). «Свободнорадикальная функционализация органических соединений, катализируемая N- гидроксифталимидом». Химические обзоры . 107 (9): 3800–3842. дои : 10.1021/cr040170k . ПМИД 17848093 .



