Этан
 Молекулярная геометрия этана на основе вращательной спектроскопии .
| |||

| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
Этан [ 1 ] | |||
| Систематическое название ИЮПАК
Дикарбан (никогда не рекомендуется [ 2 ] ) | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 1730716 | |||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.000.741 | ||
| Номер ЕС |
| ||
| 212 | |||
| МеШ | Этан | ||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1035 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 2 Ч 6 | |||
| Молярная масса | 30.070 g·mol −1 | ||
| Появление | Бесцветный газ | ||
| Запах | Без запаха | ||
| Плотность |
544,0 кг/м 3 (жидкость при -88,5 °С) | ||
| Температура плавления | −182,8 °С; −296,9 ° F; 90,4 К | ||
| Точка кипения | −88,5 °С; −127,4 ° F; 184,6 К | ||
| Критическая точка ( T , P ) | 305,32 К (32,17 °C; 89,91 °F) 48,714 бар (4871,4 кПа) | ||
| 56,8 мг л −1 [ 4 ] | |||
| Давление пара | 3,8453 МПа (при 21,1 °С) | ||
Закон Генри
постоянная ( k H ) |
19 нмоль Па −1 кг −1 | ||
| Кислотность ( pKa ) | 50 | ||
| Основность (p K b ) | −36 | ||
| Конъюгатная кислота | Этаниум | ||
| -37.37·10 −6 см 3 /моль | |||
| Термохимия | |||
Теплоемкость ( С )
|
52,14±0,39 ДжК −1 моль −1 при 298 Кельвинах [ 5 ] | ||
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
-84 кДж моль −1 | ||
Стандартная энтальпия
горение (Δ c H ⦵ 298 ) |
−1561,0–−1560,4 кДж моль −1 | ||
| Опасности | |||
| СГС Маркировка : | |||

| |||
| Опасность | |||
| Х220 , Х280 | |||
| П210 , П410+П403 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -135 ° C (-211 ° F; 138 К) | ||
| 472 ° С (882 ° F; 745 К) | |||
| Взрывоопасные пределы | 2.9–13% | ||
| Паспорт безопасности (SDS) | inchem.org | ||
| Родственные соединения | |||
Родственные алканы
|
|||
Родственные соединения
|
|||
| Страница дополнительных данных | |||
| Этан (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Этан ( США : / ˈɛθeɪn θeɪ ayn / ETH - , Великобритания : / ˈ iː -/ EE - ) — встречающееся в природе органическое химическое соединение с химической формулой C.
22Ч
6 . При стандартной температуре и давлении этан представляет собой бесцветный газ без запаха . Как и многие углеводороды , этан выделяют в промышленных масштабах из природного газа и как нефтехимический побочный продукт переработки нефти . Его основное применение — в качестве сырья для производства этилена .
Родственные соединения могут быть образованы путем замены атома водорода другой функциональной группой ; этановый фрагмент называется этильной группой . Например, этильная группа, связанная с гидроксильной группой, дает этанол , алкоголь в напитках .
История
[ редактировать ]Этан был впервые синтезирован в 1834 году Майклом Фарадеем , применив электролиз раствора ацетата калия . Он принял углеводородный продукт этой реакции за метан и не стал его исследовать дальше. [ 6 ] Этот процесс теперь называется электролизом Кольбе :
- CH 3 COO − → СН 3 • + СО 2 + е −
- СН 3 • + • СН 3 → C 2 H 6
В период 1847–1849 годов, стремясь оправдать радикальную теорию органической химии , Герман Кольбе и Эдвард Франкланд получили этан путем восстановления пропионитрила ( этилцианида ). [ 7 ] и этилйодид [ 8 ] с металлическим калием и, как это сделал Фарадей, электролизом водных ацетатов. Продукт этих реакций они приняли за метильный радикал ( CH 3 ), из которых этан ( C 2 H 6 ) представляет собой димер .
Эту ошибку исправил в 1864 году Карл Шорлеммер , показавший, что продуктом всех этих реакций на самом деле является этан. [ 9 ] Этан был обнаружен в растворенном виде в Пенсильвании легкой сырой нефти Эдмундом Рональдсом в 1864 году. [ 10 ] [ 11 ]
Характеристики
[ редактировать ]При стандартных температуре и давлении этан представляет собой бесцветный газ без запаха. Он имеет температуру кипения -88,5 ° C (-127,3 ° F) и температуру плавления -182,8 ° C (-297,0 ° F). Твердый этан существует в нескольких модификациях. [ 12 ] При охлаждении под нормальным давлением первой появляется модификация — пластичный кристалл , кристаллизующийся в кубической системе. В этой форме положения атомов водорода не фиксированы; молекулы могут свободно вращаться вокруг длинной оси. Охлаждение этого этана ниже ок. 89,9 К (-183,2 ° C; -297,8 ° F) превращает его в моноклинный метастабильный этан II ( пространственная группа P 21/n). [ 13 ] Этан очень мало растворим в воде.
Параметры связи этана были измерены с высокой точностью методами микроволновой спектроскопии и дифракции электронов: r C-C = 1,528(3) Å, r C-H = 1,088(5) Å и ∠CCH = 111,6(5)° с помощью микроволновое излучение и r C-C = 1,524(3) Å, r C-H = 1,089(5) Å и ∠CCH = 111,9(5)° по данным электронной дифракции (цифры в скобках представляют собой неопределенности в последних цифрах). [ 14 ]
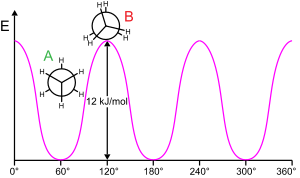
Вращение молекулярной субструктуры вокруг скручиваемой связи обычно требует энергии. Минимальная энергия, необходимая для вращения связи на 360°, называется вращательным барьером .
Этан дает классический и простой пример такого вращательного барьера, иногда называемого «этанным барьером». Среди самых ранних экспериментальных подтверждений существования этого барьера (см. диаграмму слева) было получено моделирование энтропии этана. [ 16 ] Три атома водорода на каждом конце могут свободно вращаться вокруг центральной связи углерод-углерод, если им предоставлена достаточная энергия для преодоления барьера. Физическое происхождение барьера до сих пор окончательно не установлено. [ 17 ] хотя перекрытие (обмен) отталкиванием [ 18 ] между атомами водорода на противоположных концах молекулы, пожалуй, самый сильный кандидат, причем стабилизирующий эффект гиперконъюгации на шахматную конформацию. этому явлению способствует [ 19 ] Теоретические методы, использующие подходящую отправную точку (ортогональные орбитали), показывают, что гиперконъюгация является наиболее важным фактором в возникновении барьера вращения этана. [ 20 ] [ 21 ]
Еще в 1890–1891 годах химики предположили, что молекулы этана предпочитают шахматную конформацию, при которой два конца молекулы отклоняются друг от друга. [ 22 ] [ 23 ] [ 24 ] [ 25 ]
Атмосферные и внеземные
[ редактировать ]
Этан встречается в виде газовых примесей в атмосфере Земли , его концентрация на уровне моря в настоящее время составляет 0,5 частей на миллиард . [ 26 ] Глобальные объемы этана менялись с течением времени, вероятно, из-за сжигания на факелах месторождений природного газа . [ 27 ] Глобальные темпы выбросов этана снизились с 1984 по 2010 год. [ 27 ] хотя увеличение добычи сланцевого газа на формации Баккен в США остановило снижение вдвое. [ 28 ] [ 29 ]
Хотя этан является парниковым газом , его гораздо меньше, чем метана, и его срок жизни составляет всего несколько месяцев по сравнению с более чем десятилетием. [ 30 ] а также менее эффективно поглощает радиацию по сравнению с массой. Фактически, потенциал глобального потепления этана во многом обусловлен его преобразованием в атмосфере в метан. [ 31 ] Он был обнаружен в качестве следового компонента в атмосферах всех четырех планет-гигантов , а также в атмосфере Сатурна спутника Титана . [ 32 ]
воздействия Солнца Атмосферный этан возникает в результате фотохимического на газообразный метан, который также присутствует в этих атмосферах: ультрафиолетовые фотоны с длиной волны короче 160 нм могут фотодиссоциировать молекулу метана на метильный радикал и атом водорода . При рекомбинации двух метильных радикалов образуется этан:
- СН 4 → СН 3 • + •H
- СН 3 • + • СН 3 → C 2 H 6
В атмосфере Земли гидроксильные радикалы преобразуют этан в пары метанола с периодом полураспада около трех месяцев. [ 30 ]
Предполагается, что этан, произведенный таким образом на Титане, попадает обратно на поверхность Луны и со временем накапливается в углеводородных морях, покрывающих большую часть полярных регионов Луны. В середине 2005 года орбитальный аппарат Кассини обнаружил озеро Онтарио в южных полярных регионах Титана. Дальнейший анализ данных инфракрасной спектроскопии, представленный в июле 2008 г. [ 33 ] предоставила дополнительные доказательства присутствия жидкого этана в Онтарио-Лакус. Несколько значительно более крупных углеводородных озер, два из которых являются Лигейя-Маре и Кракен-Маре , были обнаружены возле северного полюса Титана с помощью радиолокационных данных, собранных Кассини. Считается, что эти озера заполнены в основном смесью жидкого этана и метана.
В 1996 году этан был обнаружен в комете Хьякутаке . [ 34 ] и с тех пор он был обнаружен в некоторых других кометах . Существование этана в этих далеких телах Солнечной системы может указывать на то, что этан был первичным компонентом солнечной туманности, из которой, как полагают, образовались Солнце и планеты.
В 2006 году Дейл Крукшанк из НАСА/Исследовательского центра Эймса ( соисследователь «Новых горизонтов ») и его коллеги объявили о спектроскопическом открытии этана на поверхности Плутона . [ 35 ]
Химия
[ редактировать ]В химии этана участвуют главным образом свободнорадикальные реакции . Этан может реагировать с галогенами , особенно с хлором и бромом , путем свободнорадикального галогенирования . Эта реакция протекает за счет распространения этильного радикала:
- C 2 H 5 • + Cl 2 → C 2 H 5 Cl + Cl•
- Cl• + C 2 H 6 → C 2 H 5 • + HCl
При горении этана выделяется 1559,7 кДж/моль или 51,9 кДж/г тепла и образуются углекислый газ и вода в соответствии с химическим уравнением :
Горение также может происходить без избытка кислорода с образованием угарного газа , ацетальдегида , метана , метанола и этанола . При более высоких температурах, особенно в диапазоне 600–900 ° C (1112–1652 ° F), этилен является важным продуктом:
- 2 С 2 Ч 6 + О 2 → 2 С 2 Ч 4 + Н 2 О
Такие реакции окислительного дегидрирования имеют отношение к производству этилена . [ 36 ]
Производство
[ редактировать ]После метана этан является вторым по величине компонентом природного газа . Содержание этана в природном газе различных месторождений варьируется от менее 1% до более 6% по объему. До 1960-х годов этан и более крупные молекулы обычно не отделялись от метанового компонента природного газа, а просто сжигались вместе с метаном в качестве топлива. Сегодня этан является важным нефтехимическим сырьем и отделяется от других компонентов природного газа на большинстве хорошо разрабатываемых газовых месторождений. Этан также можно отделить от нефтяного газа — смеси газообразных углеводородов, получаемой как побочный продукт переработки нефти .
Этан наиболее эффективно отделяется от метана путем его сжижения при криогенных температурах. Существуют различные стратегии охлаждения: наиболее экономичный процесс, широко используемый в настоящее время, использует турбодетандер и позволяет восстановить более 90% этана в природном газе. В этом процессе охлажденный газ расширяется через турбину , снижая температуру примерно до -100 ° C (-148 ° F). При такой низкой температуре газообразный метан можно отделить от сжиженного этана и более тяжелых углеводородов путем перегонки . Дальнейшая перегонка отделяет этан от пропана и более тяжелых углеводородов.
Использование
[ редактировать ]Основное применение этана — производство этилена (этена) путем парового крекинга . При разбавлении паром и кратковременном нагревании до очень высоких температур (900°С и более) тяжелые углеводороды распадаются на более легкие углеводороды, а насыщенные углеводороды становятся ненасыщенными . Этан предпочтителен для производства этилена, поскольку паровой крекинг этана достаточно селективен по отношению к этилену, в то время как паровой крекинг более тяжелых углеводородов дает смесь продуктов, бедную этиленом и более богатую более тяжелыми алкенами (олефинами) , такими как пропен (пропилен) и бутадиен . и в ароматических углеводородах .
Экспериментально этан исследуется как сырье для других химических веществ. Окислительное хлорирование этана уже давно считается потенциально более экономичным способом получения винилхлорида, чем хлорирование этилена. Многие процессы проведения этой реакции были запатентованы , но плохая селективность по отношению к винилхлориду и агрессивные условия реакции (в частности, реакционная смесь, содержащая соляную кислоту при температуре выше 500 ° C), препятствовали коммерциализации большинства из них. время INEOS / мощностью 1000 т год В настоящее управляет пилотным заводом по производству винилхлорида из этана в Вильгельмсхафене в Германии .
Аналогичным образом, в 2005 году саудовская фирма SABIC завод мощностью 34 000 т/год запустила в Янбу по производству уксусной кислоты путем окисления этана. [ 37 ] Экономическая жизнеспособность этого процесса может зависеть от низкой стоимости этана вблизи нефтяных месторождений Саудовской Аравии, и он может не конкурировать с карбонилированием метанола в других странах мира. [ 38 ]
Этан может использоваться в качестве хладагента в криогенных холодильных системах. В гораздо меньших масштабах в научных исследованиях жидкий этан используется для остеклования богатых водой образцов для криоэлектронной микроскопии . Тонкая пленка воды, быстро погруженная в жидкий этан при температуре -150 ° C или ниже, замерзает слишком быстро, чтобы вода могла кристаллизоваться. Более медленные методы замораживания могут привести к образованию кубических кристаллов льда, которые могут разрушить мягкие структуры , повредив образцы, и снизить качество изображения из-за рассеяния электронного луча до того, как он достигнет детектора.
MAN Energy Solutions в настоящее время производит двухтактные двухтопливные двигатели (B&W ME-GIE), которые могут работать как на морском дизельном топливе, так и на этане.
Здоровье и безопасность
[ редактировать ]При комнатной температуре этан является чрезвычайно легковоспламеняющимся газом. При смешивании с воздухом в концентрации 3,0–12,5 % по объему образует взрывоопасную смесь.
Некоторые дополнительные меры предосторожности необходимы при хранении этана в виде криогенной жидкости. Прямой контакт с жидким этаном может привести к серьезному обморожению . Пока они не нагреются до комнатной температуры, пары жидкого этана тяжелее воздуха и могут стекать по полу или земле, собираясь в низких местах; если пары сталкиваются с источником возгорания, химическая реакция может вернуться к источнику этана, из которого они испарились.
Этан может вытеснять кислород и представлять опасность удушья . Этан не представляет известного острого или хронического токсикологического риска. Это не канцероген . [ 39 ]
См. также
[ редактировать ]- Биогаз : углеродно-нейтральная альтернатива природному газу
- Биопереработка
- Биоразлагаемый пластик
- Вставной биопластик
Ссылки
[ редактировать ]- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 133. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
Насыщенные неразветвленные ациклические углеводороды C 2 H 6 , C 3 H 8 и C 4 H 10 имеют сохраненные названия этан, пропан и бутан соответственно.
- ^ ИЮПАК 2014 , с. 4. «Аналогично, сохраненные названия «этан», «пропан» и «бутан» никогда не заменялись систематическими названиями «дикарбан», «трикарбан» и «тетракарбан», рекомендованными для аналогов силана, «дисилана»; фосфана. , «трифосфан» и сульфан, «тетрасульфан».
- ^ «Этан – Краткое описание соединений» . Пабхим соединение . США: Национальный центр биотехнологической информации. 16 сентября 2004 года . Проверено 7 декабря 2011 г.
- ^ Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. п. 8.88. ISBN 0-8493-0486-5 .
- ^ «Этан» . webbook.nist.gov . Национальный институт стандартов и технологий . Проверено 16 мая 2024 г.
- ^ Фарадей, Майкл (1834). «Экспериментальные исследования по электричеству: Седьмая серия». Философские труды . 124 : 77–122. Бибкод : 1834RSPT..124...77F . дои : 10.1098/rstl.1834.0008 . S2CID 116224057 .
- ^ Кольбе, Герман; Франкленд, Эдвард (1849). «О продуктах действия калия на цианид этила» . Журнал Химического общества . 1 : 60–74. дои : 10.1039/QJ8490100060 .
- ^ Франкленд, Эдвард (1850). «О выделении органических радикалов» . Журнал Химического общества . 2 (3): 263–296. дои : 10.1039/QJ8500200263 .
- ^ Шорлеммер, Карл (1864). «О тождестве этилового водорода и метилового» . Анналы химии и фармации . 132 (2): 234–238. дои : 10.1002/jlac.18641320217 .
- ^ Роско, HE; Шорлеммер, К. (1881). Трактат по химии . Том. 3. Макмиллан. стр. 144–145.
- ^ Уоттс, Х. (1868). Словарь химии . Том. 4. с. 385.
- ^ Ван Нес, GJH; Вос, А. (1978). «Монокристаллические структуры и распределения электронной плотности этана, этилена и ацетилена. I. Определение монокристаллической рентгеновской структуры двух модификаций этана» (PDF) . Acta Crystallographica Раздел B. 34 (6): 1947. Бибкод : 1978AcCrB..34.1947V . дои : 10.1107/S0567740878007037 . S2CID 55183235 .
- ^ «Этан как твердое тело» . Проверено 10 декабря 2019 г.
- ^ Гармония, Марлин Д. (15 ноября 1990 г.). «Равновесная длина одинарной связи углерод-углерод в этане». Журнал химической физики . 93 (10): 7522–7523. Бибкод : 1990JChPh..93.7522H . дои : 10.1063/1.459380 . ISSN 0021-9606 .
- ^ Дж, Макмерри (2012). Органическая химия (8-е изд.). Бельмонт, Калифорния: Брукс. п. 95. ИСБН 9780840054449 .
- ^ Кемп, доктор медицинских наук; Питцер, Кеннет С. (1937). «Энтропия этана и третий закон термодинамики. Затрудненное вращение метильных групп». Журнал Американского химического общества . 59 (2): 276. doi : 10.1021/ja01281a014 .
- ^ Эрколани, Г. (2005). «Определение вращательного барьера в этане методами колебательной спектроскопии и статистической термодинамики». Дж. Хим. Образование . 82 (11): 1703–1708. Бибкод : 2005JChEd..82.1703E . дои : 10.1021/ed082p1703 .
- ^ Питцер, Р.М. (1983). «Барьер внутренней ротации в этане». Акк. хим. Рез . 16 (6): 207–210. дои : 10.1021/ar00090a004 .
- ^ Мо, Ю.; Ву, В.; Песня, Л.; Лин, М.; Чжан, К.; Гао, Дж. (2004). «Величина гиперконъюгации в этане: взгляд на теорию валентных связей Ab Initio». Энджью. хим. Межд. Эд . 43 (15): 1986–1990. дои : 10.1002/anie.200352931 . ПМИД 15065281 .
- ^ Пофристик, В.; Гудман, Л. (2001). «Гиперконъюгация, а не стерическое отталкивание приводит к шахматной структуре этана». Природа . 411 (6837): 565–8. Бибкод : 2001Natur.411..565P . дои : 10.1038/35079036 . ПМИД 11385566 . S2CID 205017635 .
- ^ Шрайнер, PR (2002). «Обучение правильным причинам: уроки ошибочного происхождения барьера вращения в этане». Angewandte Chemie, международное издание . 41 (19): 3579–81, 3513. doi : 10.1002/1521-3773(20021004)41:19<3579::AID-ANIE3579>3.0.CO;2-S . ПМИД 12370897 .
- ^ Бишофф, Калифорния (1890 г.). «Об отмене свободного вращения односвязанных атомов углерода» . хим . 23 : 623. doi : 10.1002/cber.18900230197 .
- ^ Бишофф, Калифорния (1891 г.). «Теоретические результаты исследований группы янтарной кислоты» . хим . 24 : 1074–1085. дои : 10.1002/cber.189102401195 .
- ^ Бишофф, Калифорния (1891 г.). «Динамическая гипотеза применительно к группе янтарной кислоты» . хим . 24 : 1085–1095. дои : 10.1002/cber.189102401196 .
- ^ Бишофф, Калифорния; Уолден, П. (1893). «Применение динамической гипотезы к производным кетоновой кислоты» . Отчеты Немецкого химического общества . 26 (2): 1452. doi : 10.1002/cber.18930260254 .
- ^ «Микрогазы (в архиве)» . Атмосфера.mpg.de . Архивировано из оригинала 22 декабря 2008 г. Проверено 8 декабря 2011 г.
- ^ Jump up to: а б Симпсон, Изобель Дж.; Сулбек Андерсен, Мадс П.; Мейнарди, Симона; Брювилер, Лори; Блейк, Никола Дж.; Хельмиг, Детлев; Роуленд, Ф. Шервуд; Блейк, Дональд Р. (2012). «Долгосрочное снижение глобальной концентрации этана в атмосфере и последствия для метана» . Природа . 488 (7412): 490–494. Бибкод : 2012Natur.488..490S . дои : 10.1038/nature11342 . ПМИД 22914166 . S2CID 4373714 .
- ^ Корт, Э.А.; Смит, М.Л.; Мюррей, Лейтенант; Гвахария, А.; Брандт, Арканзас; Пейшль, Дж.; Райерсон, ТБ; Суини, К.; Трэвис, К. (2016). «Неорганизованные выбросы из сланцев Баккен иллюстрируют роль сланцевой добычи в глобальном сдвиге этана» . Письма о геофизических исследованиях . 43 (9): 4617–4623. Бибкод : 2016GeoRL..43.4617K . дои : 10.1002/2016GL068703 . hdl : 2027.42/142509 .
- ^ «Одно нефтяное месторождение является ключевым виновником глобального увеличения содержания этана» . Мичиганский университет. 26 апреля 2016 г.
- ^ Jump up to: а б Айдын, Камиль Мурат; Уильямс, МБ; Зальцман, ES (апрель 2007 г.). «Возможность реконструкции палеоатмосферных записей отдельных алканов, метилгалогенидов и сернистых газов из кернов льда Гренландии». Журнал геофизических исследований . 112 (Д7). Бибкод : 2007JGRD..112.7312A . дои : 10.1029/2006JD008027 .
- ^ Ходнеброг, Ойвинд; Далсёрен, Стиг Б.; Мирхе, Гуннар (2018). «Время жизни, прямое и косвенное радиационное воздействие и потенциал глобального потепления этана (C 2 H 6 ), пропана (C 3 H 8 ) и бутана (C 4 H 10 )» . Письма об атмосферной науке . 19 (2). Бибкод : 2018AtScL..19E.804H . дои : 10.1002/asl.804 .
- ^ Браун, Боб; и др. (2008). «НАСА подтверждает жидкое озеро на спутнике Сатурна» . Лаборатория реактивного движения НАСА. Архивировано из оригинала 5 июня 2011 г. Проверено 30 июля 2008 г.
- ^ Браун, Р.Х.; Содерблом, Луизиана; Содерблом, Дж. М.; Кларк, Р.Н.; Яуманн, Р.; Барнс, JW; Сотин, К.; Буратти, Б.; и др. (2008). «Идентификация жидкого этана в озере Онтарио на Титане». Природа 454 (7204): 607–10. Бибкод : 2008Nature.454..607B . дои : 10.1038/nature07100 . ПМИД 18668101 . S2CID 4398324 .
- ^ Мама, Майкл Дж.; и др. (1996). «Обнаружение большого количества этана и метана, а также угарного газа и воды в комете C/1996 B2 Хьякутакэ: доказательства межзвездного происхождения». Наука . 272 (5266): 1310–1314. Бибкод : 1996Sci...272.1310M . дои : 10.1126/science.272.5266.1310 . ПМИД 8650540 . S2CID 27362518 .
- ^ Стерн, А. (1 ноября 2006 г.). «Сделаем старые горизонты новыми» . Перспектива ИП . Лаборатория прикладной физики Университета Джонса Хопкинса. Архивировано из оригинала 28 августа 2008 года . Проверено 12 февраля 2007 г.
- ^ Наджари, Сара; Саиди, Самранд; Консепсьон, Патрисия; Дионисий, Дионисий Д.; Бхаргава, Суреш К.; Ли, Адам Ф.; Уилсон, Карен (2021). «Окислительное дегидрирование этана: каталитические и механистические аспекты и будущие тенденции». Обзоры химического общества . 50 (7): 4564–4605. дои : 10.1039/D0CS01518K . ПМИД 33595011 . S2CID 231946397 .
- ^ Рамкумар, Канзас (26 мая 2005 г.). «Завод уксусной кислоты SABIC введён в эксплуатацию» . Арабские новости . Архивировано из оригинала 9 июня 2013 года . Проверено 4 июля 2024 г.
- ^ Кавани, Фабрицио; Балларини, Никола (2009). Мизуно, Норитака (ред.). Современный катализ гетерогенного окисления . Уайли. п. 291. ИСБН 978-3-527-62755-4 . Проверено 4 июля 2024 г.
- ^ Валлеро, Даниэль (7 июня 2010 г.). «Факторы наклона рака». Экологическая биотехнология: биосистемный подход . Академическая пресса. п. 641. дои : 10.1016/B978-0-12-375089-1.10014-5 . ISBN 9780123750891 .


