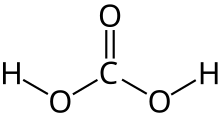
Угольная кислота
| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Угольная кислота [ 1 ]
| |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.133.015 |
| Номер ЕС |
|
| 25554 | |
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| ЧАС 22 3 | |
| Появление | Бесцветный газ |
| Температура плавления | -53 ° C (-63 ° F; 220 К) [ 3 ] (возвышенный) |
| Точка кипения | 127 ° C (261 ° F, 400 К) (разлагается) |
| Реагирует с образованием углекислого газа и воды. | |
| Кислотность ( pKa ) | |
| Сопряженная база | Бикарбонат , карбонат |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Структура | |
| моноклинический | |
| п21/с, № 14 | |
| - | |
а = 5,392 Å, b = 6,661 Å, c = 5,690 Å α = 90°, β = 92,66°, γ = 90° [ 4 ] ( Д
22 3 при 1,85 ГПа, 298 К) | |
Объем решетки ( В )
|
204,12 Å 3 |
Формульные единицы ( Z )
|
4 формулы на ячейку |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Угольная кислота представляет собой химическое соединение с химической формулой Н 2 СО 3 . Молекула . быстро превращается в воду и углекислый газ в присутствии воды Однако в отсутствие воды он вполне стабилен при комнатной температуре . [ 5 ] [ 6 ] Взаимное превращение углекислого газа и углекислоты связано с дыхательным циклом животных и подкислением природных вод . [ 4 ]
В биохимии и физиологии название «угольная кислота» иногда применяется к водным растворам углекислого газа . Эти химические соединения играют важную роль в бикарбонатной буферной системе , используемой для поддержания кислотно-основного гомеостаза . [ 7 ]
Терминология в биохимической литературе
[ редактировать ]В химии термин «угольная кислота» строго относится к химическому соединению с формулой H.
22
3 . В некоторой литературе по биохимии стирается различие между углекислотой и углекислым газом, растворенным во внеклеточной жидкости.
В физиологии углекислый газ, выделяемый легкими, можно назвать летучей кислотой или дыхательной кислотой .
Безводная угольная кислота
[ редактировать ]При температуре окружающей среды чистая угольная кислота представляет собой стабильный газ. [ 6 ] Существует два основных метода получения безводной углекислоты: реакция хлористого водорода и бикарбоната калия при 100 К в метаноле и облучение протонами чистого твердого диоксида углерода . [ 3 ] Химически он ведет себя как дипротонная кислота Бренстеда . [ 8 ] [ 9 ]
угольной кислоты Мономеры имеют три конформационных изомера : цис-цис, цис-транс и транс-транс. [ 10 ]
При низких температурах и атмосферном давлении твердая угольная кислота аморфна и не имеет брэгговских пиков при дифракции рентгеновских лучей . [ 11 ] Но при высоком давлении угольная кислота кристаллизуется, и современная аналитическая спектроскопия позволяет измерить ее геометрию.
По данным нейтронографии дидейтерированной D ( угольной кислоты
22
3 ) в гибридной зажатой ячейке ( российский сплав / медь-бериллий ) при 1,85 ГПа молекулы плоские и образуют димеры , соединенные парами водородных связей . Все три связи CO почти равноудалены на расстоянии 1,34 Å , что является промежуточным между типичными расстояниями CO и C=O (соответственно 1,43 и 1,23 Å). Необычная длина связи CO объясняется делокализованной π-связью в центре молекулы и чрезвычайно прочными водородными связями. Те же эффекты также вызывают очень короткое разделение O—O (2,13 Å) за счет угла OHO 136 ° , создаваемого 8-членными кольцами с двойными водородными связями. [ 4 ] Более длинные расстояния О—О наблюдаются в прочных внутримолекулярных водородных связях, например в щавелевой кислоте , где расстояния превышают 2,4 Å. [ 11 ]
В водном растворе
[ редактировать ]Даже в небольшом присутствии воды угольная кислота дегидратируется до углекислого газа и воды , что затем катализирует дальнейшее разложение. [ 6 ] По этой причине углекислый газ можно считать ангидридом угольной кислоты .
Константа гидратного равновесия при 25 °C равна [ H
22
3 ]/[CO 2 ] ≈ 1,7×10 −3 в чистой воде [ 12 ] и ≈ 1,2×10 −3 в морской воде . [ 13 ] Следовательно, большая часть углекислого газа на геофизических или биологических границах раздела воздух-вода не превращается в угольную кислоту, а остается растворенным CO 2 газом . Однако некаталитическое равновесие достигается довольно медленно: константы скорости составляют 0,039 с. −1 для увлажнения и 23 с −1 для обезвоживания.
В биологических растворах
[ редактировать ]В присутствии фермента карбоангидразы равновесие вместо этого достигается быстро, и следующая реакция имеет приоритет: [ 14 ]
Когда образовавшийся углекислый газ превышает его растворимость, выделяется газ и возникает третье равновесие. также необходимо принять во внимание. Константа равновесия этой реакции определяется законом Генри .
Две реакции можно объединить для достижения равновесия в растворе: Когда закон Генри используется для расчета знаменателя, необходимо внимательно относиться к единицам измерения, поскольку константу закона Генри обычно можно выразить с помощью 8 различных размерностей. [ 15 ]
Под высоким CO 2 парциальным давлением
[ редактировать ]В индустрии напитков газированную или «газированную воду» обычно называют газированной водой . Его получают путем растворения углекислого газа под небольшим положительным давлением в воде. Многие безалкогольные напитки трактуются так же, как шипучие .
Значительные количества молекулярного H
22
3 существуют в водных растворах, подвергающихся давлению в несколько гигапаскалей (десятки тысяч атмосфер) в недрах планет. [ 16 ] [ 17 ] Давления 0,6–1,6 ГПа при 100 К и 0,75–1,75 ГПа при 300 К достигаются в ядрах крупных ледяных спутников, таких как Ганимед , Каллисто и Титан , где присутствуют вода и углекислый газ. Ожидается, что чистая угольная кислота, будучи более плотной, погрузится под слои льда и отделит их от скалистых ядер этих спутников. [ 18 ]
Связь с бикарбонатом и карбонатом
[ редактировать ]
Угольная кислота представляет собой формальную по Бренстеду-Лоури кислоту, сопряженную с бикарбонат- анионом, стабильную в щелочном растворе . Константы протонирования измерены с большой точностью, но зависят от общей силы I. ионной Два равновесия, которые легче всего измерить, таковы: где скобки концентрацию вида указывают . При 25 °C эти равновесия эмпирически удовлетворяют [ 19 ] log( β 1 ) уменьшается с увеличением I , как и log( β 2 ) . В растворе, в котором отсутствуют другие ионы (например, I = 0 ), эти кривые означают следующие константы ступенчатой диссоциации : Прямые значения этих констант в литературе включают p K 1 = 6,35 и p K 2 - p K 1 = 3,49 . [ 20 ]
Чтобы интерпретировать эти числа, обратите внимание, что два химических вещества, находящиеся в кислотном равновесии, , когда p K = p H. равноконцентрированы В частности, внеклеточная жидкость ( цитозоль ) в биологических системах имеет pH ≈ 7,2 , так что угольная кислота в равновесии будет диссоциирована почти на 50%.
Закисление океана
[ редактировать ]
График Бьеррума показывает типичные равновесные концентрации в растворе и морской воде углекислого газа и различных его производных в зависимости от pH . [ 8 ] [ 9 ] Поскольку индустриализация человечества привела к увеличению доли углекислого газа в атмосфере Земли , ожидается, что доля углекислого газа, растворенного в морской и пресной воде в виде углекислоты, также увеличится. Ожидается, что этот рост растворенной кислоты также подкислит эти воды, вызывая снижение pH. [ 21 ] [ 22 ] Было подсчитано, что увеличение содержания растворенного углекислого газа уже привело к снижению среднего pH поверхности океана примерно на 0,1 по сравнению с доиндустриальным уровнем.
Дальнейшее чтение
[ редактировать ] « Климат и углекислота » в журнале Popular Science Monthly Volume 59, июль 1901 г.
« Климат и углекислота » в журнале Popular Science Monthly Volume 59, июль 1901 г. - Уэлч, MJ; Лифтон, Дж. Ф.; Сек, Дж. А. (1969). «Трассерные исследования с радиоактивным кислородом-15. Обмен между углекислым газом и водой». Дж. Физ. хим. 73 (335): 3351. doi : 10.1021/j100844a033 .
- Джолли, WL (1991). Современная неорганическая химия (2-е изд.). МакГроу-Хилл. ISBN 978-0-07-112651-9 .
- Мур, Миннесота; Ханна, Р. (1991). «Инфракрасные и масс-спектральные исследования облученного протонами льда H 2 O+CO 2 : доказательства наличия угольной кислоты. Лед: доказательства наличия угольной кислоты» . Спектрохимика Акта . 47А (2): 255–262. Бибкод : 1991AcSpA..47..255M . дои : 10.1016/0584-8539(91)80097-3 .
- В. Хаге, К. Р. Лидл; Лидл, Э.; Холлбрукер, А; Майер, Э. (1998). «Углекислота в газовой фазе и ее астрофизическая значимость». Наука . 279 (5355): 1332–5. Бибкод : 1998Sci...279.1332H . дои : 10.1126/science.279.5355.1332 . ПМИД 9478889 .
- Хаге, В.; Холлбрукер, А.; Майер, Э. (1995). «Полиморфная модификация угольной кислоты и ее возможная астрофизическая значимость». Дж. Хим. Соц. Фарадей Транс. 91 (17): 2823–6. Бибкод : 1995JCSFT..91.2823H . дои : 10.1039/ft9959102823 .
Ссылки
[ редактировать ]- ^ «Фронт материи». Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. P001–4. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
- ^ Перейти обратно: а б с Перрин, Д.Д., изд. (1982) [1969]. Константы ионизации неорганических кислот и оснований в водных растворах . Химические данные ИЮПАК (2-е изд.). Оксфорд: Пергамон (опубликовано в 1984 г.). «Углекислота, H 2 CO 3 Запись ». ISBN 0-08-029214-3 . LCCN 82-16524 .
- ^ Перейти обратно: а б В. Хаге, К. Р. Лидл; Лидл, Э.; Холлбрукер, А; Майер, Э. (1998). «Углекислота в газовой фазе и ее астрофизическая значимость». Наука . 279 (5355): 1332–5. Бибкод : 1998Sci...279.1332H . дои : 10.1126/science.279.5355.1332 . ПМИД 9478889 .
- ^ Перейти обратно: а б с Бенц, Себастьян; Чен, Да; Мёллер, Андреас; Хофманн, Майкл; Шнидерс, Дэвид; Дронсковски, Ричард (сентябрь 2022 г.). «Кристаллическая структура угольной кислоты» . Неорганика . 10 (9): 132. doi : 10.3390/inorganics10090132 . ISSN 2304-6740 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 310. ИСБН 978-0-08-037941-8 .
- ^ Перейти обратно: а б с Лёртинг, Томас ; Таутерманн, Кристофер; Кремер, Романо Т.; Коль, Ингрид; Холлбрукер, Андреас; Майер, Эрвин; Лидл, Клаус Р.; Лёртинг, Томас; Таутерманн, Кристофер; Коль, Ингрид; Холлбрукер, Андреас; Эрвин, Майер; Лидл, Клаус Р. (2000). «Об удивительной кинетической стабильности угольной кислоты (H 2 CO 3 )». Angewandte Chemie, международное издание . 39 (5): 891–4. doi : 10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E . ПМИД 10760883 .
- ^ Кислотно-щелочная физиология 2.1 - Кислотно-щелочной баланс Керри Брэндис.
- ^ Перейти обратно: а б Панготра, Дхананджай; Чепей, Ленард-Иштван; Рот, Арне; Понсе де Леон, Карлос; Зибер, Волкер; Виейра, Лусиана (2022). «Анодное производство перекиси водорода с использованием промышленных углеродных материалов». Прикладной катализ Б: Экология . 303 : 120848. doi : 10.1016/j.apcatb.2021.120848 . S2CID 240250750 .
- ^ Перейти обратно: а б Андерсен, CB (2002). «Понимание карбонатного равновесия путем измерения щелочности в экспериментальных и природных системах». Журнал геонаучного образования . 50 (4): 389–403. Бибкод : 2002JGeEd..50..389A . дои : 10.5408/1089-9995-50.4.389 . S2CID 17094010 .
- ^ Лёртинг, Томас; Бернард, Юрген (2010). «Водная угольная кислота (H 2 CO 3 )». ChemPhysChem (11): 2305–9. дои : 10.1002/cphc.201000220 .
- ^ Перейти обратно: а б Винкель, Катрин; Хаге, Вольфганг; Лёртинг, Томас; Прайс, Сара Л.; Майер, Эрвин (2007). «Углекислота: от полиаморфизма к полиморфизму». Журнал Американского химического общества . 129 (45): 13863–71. дои : 10.1021/ja073594f . ПМИД 17944463 .
- ^ Хаускрофт, CE; Шарп, AG (2005). Неорганическая химия (2-е изд.). Прентис-Пирсон-Холл. п. 368. ИСБН 0-13-039913-2 . OCLC 56834315 .
- ^ Соли, Алабама; Р. Х. Бирн (2002). «Кинетика гидратации и дегидратации системы CO 2 и равновесное соотношение CO 2 /H 2 CO 3 в водном растворе NaCl». Морская химия . 78 (2–3): 65–73. дои : 10.1016/S0304-4203(02)00010-5 .
- ^ Линдског С (1997). «Строение и механизм карбоангидразы». Фармакология и терапия . 74 (1): 1–20. дои : 10.1016/S0163-7258(96)00198-2 . ПМИД 9336012 .
- ^ Сандер, Рольф; Акри, Уильям Э.; Вишер, Алекс Де; Шварц, Стивен Э.; Уоллингтон, Тимоти Дж. (1 января 2022 г.). «Константы закона Генри (Рекомендации ИЮПАК 2021 г.)» . Чистая и прикладная химия . 94 (1): 71–85. дои : 10.1515/pac-2020-0302 . ISSN 1365-3075 .
- ^ Ван, Хунбо; Цойшнер, Янек; Еремец Михаил; Троян, Иван; Уильямс, Джонатон (27 января 2016 г.). «Стабильный твердый и водный H 2 CO 3 из CO 2 и H 2 O при высоком давлении и высокой температуре» . Научные отчеты . 6 (1): 19902. Бибкод : 2016NatSR...619902W . дои : 10.1038/srep19902 . ПМЦ 4728613 . ПМИД 26813580 .
- ^ Столте, Нор; Пан, Дин (4 июля 2019 г.). «Большое присутствие угольной кислоты в богатых CO 2 водных жидкостях в условиях мантии Земли». Журнал физической химии . 10 (17): 5135–41. arXiv : 1907.01833 . doi : 10.1021/acs.jpclett.9b01919 . ПМИД 31411889 . S2CID 195791860 .
- ^ Г. Салех; А. Р. Оганов (2016). «Новые стабильные соединения в тройной системе CHO при высоком давлении» . Научные отчеты . 6 : 32486. Бибкод : 2016NatSR...632486S . дои : 10.1038/srep32486 . ПМК 5007508 . ПМИД 27580525 .
- ^ ИЮПАК (2006). " Константы устойчивости " (база данных).
- ^ Пайнс, Дина; Диткович, Юлия; Мукра, Цах; Миллер, Ифат; Кифер, Филип М.; Дащакраборти, Снехасис; Хайнс, Джеймс Т.; Пайнс, Эхуд (2016). «Насколько кислой является угольная кислота?» . J Phys Chem B. 120 (9): 2440–51. дои : 10.1021/acs.jpcb.5b12428 . ПМЦ 5747581 . ПМИД 26862781 .
- ^ Кальдейра, К.; Уикетт, Мэн (2003). «Антропогенный углерод и pH океана» . Природа . 425 (6956): 365. Бибкод : 2001AGUFMOS11C0385C . дои : 10.1038/425365a . ПМИД 14508477 . S2CID 4417880 .
- ^ Сабина, CL (2004). «Океанический поглотитель антропогенного CO 2 » . Наука . 305 (5682): 367–371. Бибкод : 2004Sci...305..367S . дои : 10.1126/science.1097403 . hdl : 10261/52596 . ПМИД 15256665 . S2CID 5607281 . Архивировано из оригинала 6 июля 2008 года . Проверено 22 июня 2021 г.



![{\displaystyle {\begin{aligned}{\ce {HCO3^{-}{}+ H+{}<=> CO2(soln){}+ H2O}}&&K_{3}={\frac {[{\ce {H+}}][{\ce {HCO3^-}}]}{[{\ce {CO2(soln)}}]}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3efe827e57da672cf1c617cebeddb8cf04baa81)
![{\displaystyle {\begin{aligned}{\ce {CO3^{2-}{}+ H+{}<=> HCO3^-}}&&\beta _{1}={\frac {[{\ce { HCO3^-}}]}{[{\ce {H+}}][{\ce {CO3^{2-}}}]}}\\{\ce {CO3^{2-}{}+ 2H+{}<=> H2CO3}}&&\beta _{2}={\frac {[{\ce {H2CO3}}]}{[{\ce {H+}}]^{2}[{\ce { CO3^{2-}}}]}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/09f8d396f1143f199cf1136f1ad60c7ce873b848)

