Зингибайн
| Зингибайн | |||
|---|---|---|---|
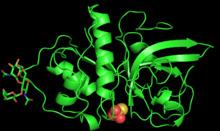 PYMOL создал 3D-структуру мономера зингибаина | |||
| Идентификаторы | |||
| Номер ЕС. | 3.4.22.67 | ||
| Номер CAS. | 246044-91-7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Зингибаин , зингипаин или имбирь протеаза ( EC 3.4.22.67 ) представляет собой цистеиновой протеазы фермент , обнаруженный в имбиря ( Zingiber officinale ) корневищах . [ 1 ] [ 2 ] [ 3 ] Он катализирует преимущественное расщепление пептидов в с остатком пролина положении Р2. Он имеет две различные формы : имбирь протеаза I (GP-I) и имбирь протеаза II (GP-II). [ 4 ]
Будучи членом семейства папаин-подобных протеаз цистеиновых протеаз, зингибаин имеет ряд структурных и функциональных сходств с более хорошо изученными ферментами, такими как папаин , бромелайн и актинидин . Эти пептидазы содержат в своих центрах активный остаток цистеина, который катализирует гидролитическое расщепление пептидных связей. Зингибаин известен своей активностью протеиназы и коллагеназы . [ 1 ]
Впервые он был выделен, очищен и описан в 1973 году Ichikawa et al. в Японском женском университете . [ 5 ] Недавно было обнаружено, что зингибаин существует в виде двух изоферментов , GP-I и GP-II, которые были выделены с помощью хроматографии, с молекулярной массой около 22 500 Да. [ 5 ]
Механизм
[ редактировать ]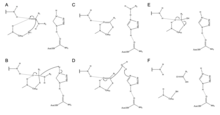
Зингибаин использует каталитическую триаду остатков Cys, His и Asn в своем активном центре для гидролитического расщепления пептидных связей. Присутствие Asn175 стабилизирует имидазольное кольцо His, обеспечивая его оптимальное положение для катализа гидролиза.
Механизм начинается с переноса протона от Cys25 к His159. [ 6 ] аминокислоты Затем сульфид-анион атакует альфа-углерод , вытесняя аминогруппу , которая присоединяется к His159. [ 6 ] Затем альфа-углерод стабилизированной аминокислоты подвергается атаке молекулы воды, которая вытесняет сульфид Cys25, превращая аминокислоту в карбоновую кислоту , которая высвобождается из активного центра фермента. [ 6 ]
Экспериментальное введение дитиотреитола , известного протектора тиоловой группы , улучшает протеолитическую активность, обеспечивая дальнейшее подтверждение важности центрального остатка цистеина для ферментативной активности. [ 7 ]
Зингибаин демонстрирует максимальную скорость оборота при 60 °C и быстро денатурирует при 70 °C. [ 8 ] Во время приготовления с имбирем протеолиз практически не затруднен. Оптимальные температурные диапазоны папаина и фицина выше, чем у зингибаина, тогда как бромелайн действует в несколько более низком диапазоне. [ 7 ]
Максимальная протеолитическая активность зингибаина возникает при pH 6,0, хотя фермент по-прежнему активен в диапазоне pH от 4,5 до 6,0 (оптимальный pH для мясных маринадов ). [ 7 ]
GP-II, более кислый из двух изоферментов, имеет pI 4,82, а GP-I имеет значения pI 5,05 или 5,16. [ 1 ] Эти множественные значения pI подтверждают теорию о том, что GP-I может представлять собой смесь двух белков.
Структура
[ редактировать ]Зингибаин был впервые очищен и охарактеризован с помощью рентгеновской кристаллографии в 2000 году исследователями из Бостонского университета . [ 1 ]
Фермент имеет длину 221 аминокислоту и гликозилирован двумя N-связанными олигосахаридными цепями по Asn96 и Asn154. [ 3 ] Полипептидная цепь зингибаина складывается на два полярных домена примерно одинакового размера, разделенных центральной нейтральной щелью. [ 3 ] Первый домен содержит альфа-спирали , а второй — антипараллельные бета-листы . [ 3 ] Такое разделение полярных и неполярных областей облегчает белок-белковые взаимодействия между ферментом и большим количеством субстратов. [ 3 ]
Активный центр зингибаина, расположенный в центральной щели, имеет глубину 5,5 Å и длину 9,5 Å. [ 3 ] Активный центр содержит каталитическую триаду Cys25, His159 и Asn175, которые совместно обеспечивают кислотно-основной катализ.
Зингибаин проявляет специфичность связывания с пептидными субстратами с пролином в положении P2. [ 1 ] Субсайт S2 зингибаина содержит аминокислотную цепь Trp67-Met68-Asn69-Thr133-Ala157, что делает этот сайт слишком компактным для размещения более крупных остатков гидрофобного ароматического субстрата, предпочитаемых другими ферментами семейства папаина. [ 1 ] Однако пролин стабилизируется за счет множественных нековалентных взаимодействий с этой областью.
Структура фермента стабилизируется за счет водородных связей , а также сшивки сульфидных связей между тремя парами остатков цистеина (Cys22-Cys63, Cys56-Cys95 и Cys153-Cys200), аналогично многим другим папаинам. [ 1 ]
Хотя фермент существует в виде мономера в растворе, кристаллизованный зингибаин образует тетрамеры или димеры димеров, связанные цепями гликозилирования на каждой субъединице. Зингибаин имеет N-связанные олигосахаридные цепи сложного типа по двум остаткам. [ 1 ] Цепи имеют длину от 5 до 13 гликозиловых единиц и состоят из N-ацетилглюкозамина , фукозы , маннозы и ксилозы . Последовательности сахаров зингибаина почти идентичны олигосахаридам, обнаруженным в лектинах из семян японской пагоды , лакказе А из клеток платана и S-гликопротеинах из Brassica Campestris . [ 1 ]
Биологическое значение
[ редактировать ]В корневищах имбиря протеаза имбиря выполняет множество функциональных функций по поддержанию и поддержанию растительных клеток .
Зингибаин, как и большинство цистеиновых протеаз, синтезируется в виде пропротеина массой 40–50 кДа в цитоплазматических полисомах , связанных с клеточными мембранами . [ 9 ] Внутри эндоплазматического ретикулума эти удлиненные цепи помечаются сигналом удержания KDEL ER и помещаются в большие пузырьки KDEL , которые перемещаются из ER в вакуоли хранения белка в клеточных стенках . [ 9 ]
Зингибаин, вероятно, участвует в хранении белков (в семенах или тканях растений ), но преимущественно расщепляет и мобилизует запасные белки. Он также может реагировать на абиотические и биотические стрессы, такие как тепловой шок , низкие температуры и обезвоживание , устраняя любые возникающие в результате неправильно свернутые или денатурированные белки. [ 9 ]
Использование
[ редактировать ]Тендерайзер для мяса
[ редактировать ]Подобно папаину из папайи и бромелайну из ананасов , он используется в качестве размягчителя мяса . [ 10 ] [ 11 ]
Было показано, что при добавлении зингибаина в приготовленное мясо, обычно в сырой или сушеный имбирь, мясо становится нежнее. [ 8 ] [ 12 ] Тендеризация мяса происходит из-за быстрого протеолиза зингибаином основных мышечных белков мяса, особенно актомиозина и коллагена типа I , который содержится в мышечных суставах . [ 8 ]
В то время как другие ферменты папаина, включая папаин, фицин и бромелайн, чаще используются для смягчения мяса, зингибаин проявляет аналогичную или повышенную протеолитическую активность. [ 11 ] Фактически, зингибаин является единственной зарегистрированной растительной протеазой с коллагенолитической активностью. Зингибаин может быть более предпочтительным размягчителем мяса, чем папаин, из-за консистенции получаемого мяса. Хотя папаин может гидролизовать актомиозин, он также расщепляет другие основные тканевые белки, что приводит к образованию мягкой текстуры мяса. [ 11 ] Специфичность связывания зингибаина обеспечивает преимущественный гидролиз актомиозина и коллагена I типа.
Зингибаин также используется для ароматизации колбас и хлебобулочных изделий . [ 8 ]
Заменитель сычужного фермента
[ редактировать ]На протяжении последних 100 лет имбирная протеаза традиционно использовалась для свертывания молока с целью создания имбирного творога — желеобразного блюда кантонской кухни, приготовленного из горячего молока и имбирного сока . Способность свертывать молоко и специфичность протеазы имбиря к протеолизу κ-казеина делают этот фермент потенциальным растительного сычужного фермента заменителем для производства сыра .
Свертывание молока традиционно осуществляется путем коагуляции ферментов, извлеченных из таких источников, как сычужный фермент. В сычужном ферменте три изофермента химозина гидролизуют κ-казеин, основную белковую фракцию молока, между Phe105 и Met106 . Гидрофильные субобласти κ-казеина отщепляются, оставляя после себя в основном гидрофобный агрегат. Таким образом, ферменты дестабилизируют мицеллы κ-казеина и способствуют слипанию гидрофобных белковых остатков, вызывая свертывание молока.
Основные промышленные недостатки сычужного фермента включают его ограниченное предложение и высокую стоимость, его недоступность для вегетарианцев и практикующих членов определенных религиозных групп , а также недавние европейские национальные запреты на использование рекомбинантного телячьего сычужного фермента . [ 13 ] Грибковые протеазы в значительной степени непригодны в качестве заменителей сычужного фермента, а ферменты из многих растительных экстрактов, как было показано, приводят к низким выходам, плохой текстуре и горькому вкусу сыра. [ 13 ]
Коммерческие недостатки
[ редактировать ]Однако сырая протеаза имбиря, экстрагированная из экстракта имбиря, нестабильна, ее период полураспада составляет около 2 дней при 5 ° C, что делает ее проблематичным для коммерческого применения. [ 14 ] Хотя период полураспада фермента не снижает его эффективности во время приготовления, такая низкая стабильность при хранении требует улучшения для коммерциализации.
Коммерческие попытки стабилизировать фермент для крупномасштабного производства исследовали потенциальные методы инактивации свободной сульфгидрильной группы в активном центре фермента. Механические возможности включают окисление сульфгидрила, его замену дисульфидными мостиками , образование хинон -тиоловых аддуктов или связывание сульфгидрила с ионом тяжелого металла . [ 14 ] Было обнаружено, что 0,2% аскорбат натрия стабилизирует зингибаин на срок до 14 дней при 5°C, тогда как сопоставимые концентрации ЭДТА и CaCl 2 оказывали минимальное влияние на стабильность. [ 14 ]
Было обнаружено, что зингибаин деактивируется посредством аутолиза , который можно предотвратить путем взаимодействия активной сульфгидрильной группы с цистином или PCMB. [ 14 ]
Порошки ацетона являются жизнеспособным коммерческим методом стабилизации зингибаина. После удаления гидрофобных растительных полифенолов из сырого имбиря вводят порошок ацетона при низких температурах для обезвоживания мякоти корня. [ 14 ] Фермент стабилизируется за счет снижения активности воды, более низких концентраций растительных пигментов и более жестких трехмерных структур при более низких температурах. [ 14 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я Чой К.Х., Лаурсен Р.А. (2000). «Аминокислотная последовательность и гликановые структуры цистеиновых протеаз с пролиновой специфичностью из корневища имбиря Zingiber officinale» . Евро. Дж. Биохим. 267 (5): 1516–26. дои : 10.1046/j.1432-1327.2000.01152.x . ПМИД 10691991 .
- ^ Оцуки К., Тагучи К., Сато К. и др. (1995). «Очистка протеаз имбиря с помощью DEAE-сефарозы и изоэлектрического фокусирования». Acta биохимии и биофизики (BBA) – общие предметы 1243 (2): 181–4. дои : 10.1016/0304-4165(94)00145-н . ПМИД 7873561 .
- ^ Jump up to: а б с д и ж Чой К.Х., Лаурсен Р.А., Аллен К.Н. (1999). «2.1 Структура цистеиновой протеазы с пролиновой специфичностью из корневища имбиря Zingiber officinale». Биохимия . 38 (36): 11624–33. дои : 10.1021/bi990651b . ПМИД 10512617 .
- ^ Хуан С.В., Чен Л.Дж., Луо Ю.Б. и др. (2011). «Очистка, характеристика и свертывающие молоко свойства протеаз имбиря» . J. Молочная наука. 94 (5): 2259–69. дои : 10.3168/jds.2010-4024 . ПМИД 21524515 .
- ^ Jump up to: а б (1973). и очистка имбирной протеиназы» на Выделение японском языке). « ( Саса ; Кимийо, Мичи ; Ёси, Итикава Хацусэ , 1883-8863 гг .
- ^ Jump up to: а б с Ржихон М., Хмиэль Д., Стек-Ниемчик Дж. (2004). «Режимы ингибирования цистеиновых протеаз». Акта Биохимика Полоника . 51 (4): 861–73. ПМИД 15625558 .
- ^ Jump up to: а б с Томпсон Э.Х., Вольф И.Д., Аллен CE (1973). «Корневище имбиря: новый источник протеолитического фермента». Дж. Пищевая наука. 38 (4): 652–655. дои : 10.1111/j.1365-2621.1973.tb02836.x .
- ^ Jump up to: а б с д Ли Ю.Б., Sehnert DJ, Эшмор CR (1986). «Тендеризация мяса с помощью протеазы корневища имбиря». Дж. Пищевая наука. 51 (6): 1558–1559. дои : 10.1111/j.1365-2621.1986.tb13860.x .
- ^ Jump up to: а б с Грудковска М, Загданьска Б (2004). «Мультифункциональная роль растительных цистеиновых протеиназ» . Акта Биохимика Полоника . 51 (3): 609–24. дои : 10.18388/abp.2004_3547 . ПМИД 15448724 .
- ^ Ха М., Бехит А.Е., Карне А. и др. (2012). «Характеристика коммерческих препаратов протеаз папаина, бромелайна, актинидина и зингибаина и их активности в отношении мясных белков». Пищевая хим. 134 (1): 95–105. doi : 10.1016/j.foodchem.2012.02.071 .
- ^ Jump up to: а б с Ким М., Гамильтон С.Е., Гуддат Л.В. и др. (2007). «Растительная коллагеназа: уникальная коллагенолитическая активность цистеиновых протеаз имбиря». Acta биохимии и биофизики (BBA) – общие предметы 1770 (12): 1627–35. дои : 10.1016/j.bbagen.2007.08.003 . ПМИД 17920199 .
- ^ Луна СС (2018). «Влияние протеолитических ферментов и экстракта имбиря на тендеризацию M. pectoralis profundus голштинской бычки» . Корейский журнал пищевой науки о животных ресурсах . 38 (1): 143–151. дои : 10.5851/kosfa.2018.38.1.143 . ПМЦ 5932962 . ПМИД 29725232 .
- ^ Jump up to: а б Хашим М.М., Миншэн Д., Икбал М.Ф. и др. (2011). «Корневище имбиря как потенциальный источник цистеиновой протеазы, свертывающей молоко». Фитохимия . 72 (6): 458–64. Бибкод : 2011PChem..72..458H . doi : 10.1016/j.phytochem.2010.12.002 . ПМИД 21353685 .
- ^ Jump up to: а б с д и ж Адулятам П., Овусу-Апентен Р. (2005). «Стабилизация и частичная очистка протеазы из корневища имбиря ( Zingiber offinale Roscoe)». Дж. Пищевая наука. 70 (3): C231–C234. дои : 10.1111/j.1365-2621.2005.tb07130.x .
Внешние ссылки
[ редактировать ]- Зингипаин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)