Хлорид висмута
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид висмута | |
| Другие имена Трихлорид висмута, Трихлорвисмут, Трихлорвисмутин, Хлорид висмута(III) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.203 |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| BiClBiCl3 | |
| Молярная масса | 315.34 g/mol |
| Появление | гигроскопичные кристаллы от белого до желтого цвета |
| Плотность | 4,75 г/см 3 |
| Температура плавления | 227 ° С (441 ° F; 500 К) |
| Точка кипения | 447 ° С (837 ° F; 720 К) |
| Растворимый, гидролизуется | |
| Растворимость | растворим в метаноле , диэтиловом эфире , ацетоне |
| -26.5·10 −6 см 3 /моль | |
| Структура | |
| кубический | |
| Термохимия | |
Теплоемкость ( С ) | 0,333 Дж/(г К) |
Стандартный моляр энтропия ( S ⦵ 298 ) | 82,9 Дж/(К моль) |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -1,202 кДж/г |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 3324 мг/кг, перорально (крыса) |
| Паспорт безопасности (SDS) | Джей Ти Бейкер |
| Родственные соединения | |
Другие анионы | фторид висмута , субсалицилат висмута , триоксид висмута |
Другие катионы | хлорид железа(III) , хлорид марганца(II) , хлорид кобальта(II) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорид висмута (или висмутовое масло ) — неорганическое соединение с химической формулой BiCl 3 . Это ковалентное соединение и является общим источником Bi. 3+ ион. В газовой фазе и в кристалле вещество принимает пирамидальную структуру в соответствии с теорией VSEPR .
Подготовка
[ редактировать ]Хлорид висмута можно синтезировать непосредственно, пропуская хлор над висмутом .
- 2 Bi + 3 Cl 2 → 2 BiCl 3
или путем растворения металлического висмута в царской водке и выпаривания смеси с получением BiCl 3 ·2H 2 O, который можно перегнать с образованием безводного трихлорида. [1]
Альтернативно его можно получить добавлением соляной кислоты к оксиду висмута и выпариванием раствора.
- Bi 2 O 3 + 6 HCl → 2 BiCl 3 + 3 H 2 O
Также соединение можно получить, растворив висмут в концентрированной азотной кислоте и затем добавив твердый хлорид натрия . в этот раствор [2]
- Bi + 6 HNO 3 → Bi(NO 3 ) 3 + 3 H 2 O + 3 NO 2
- Bi(NO 3 ) 3 + 3 NaCl → BiCl 3 + 3 NaNO 3
Структура
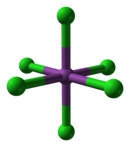
[ редактировать ]В газовой фазе BiCl 3 имеет пирамидальную форму с углом Cl–Bi–Cl 97,5° и длиной связи 242 пм. [3] В твердом состоянии у каждого атома Bi есть три ближайших соседа в 250 часов вечера, два в 324 часа дня и три в среднем в 336 часов вечера. [4] на изображении выше показаны три ближайших соседа. Эта структура аналогична структуре AsCl 3 , AsBr 3 , SbCl 3 и SbBr 3 .
Химия
[ редактировать ]Хлорид висмута легко гидролизуется до оксихлорида висмута BiOCl: [5]
- С 3+
(водный раствор) + Cl −
(вод) + Н
2 O (ж) ⇌ BiOCl (тв) + 2 H +
(вода)
Эту реакцию можно обратить вспять, добавив кислоту, например соляную кислоту . [6]
реакция твердого BiCl 3 Было показано, что с водяным паром при температуре ниже 50 °C приводит к образованию промежуточного моногидрата BiCl 3 ·H 2 O. [7]
Хлорид висмута является окислителем, легко восстанавливается до металлического висмута восстановителями.
Хлорные комплексы
[ редактировать ]В отличие от обычных ожиданий, связанных с периодическими тенденциями, BiCl 3 представляет собой кислоту Льюиса , образующую различные хлорокомплексы, такие как [BiCl 6 ] 3− это сильно нарушает правило октетов . Более того, октаэдрическая структура этого координационного комплекса не соответствует предсказаниям теории VSEPR, поскольку неподеленная пара висмута неожиданно оказывается стереохимически неактивной. Дианионный комплекс [BiCl 5 ] 2− однако принимает ожидаемую квадратно-пирамидальную структуру. [8]
 |  |  |
| Cs 3 [BiCl 6 ] | Cs 3 [BiCl 6 ] | [ BiCl6 ] 3− |
Органический катализ
[ редактировать ]Хлорид висмута используется в качестве катализатора в органическом синтезе . В частности, он катализирует реакцию Михаэля и альдольную реакцию Мукаямы . Добавление йодидов других металлов увеличивает его каталитическую активность. [9]
Ссылки
[ редактировать ]- ^ Годфри, С.М.; Маколифф, Калифорния; Маки, AG; Причард, Р.Г. (1998). Николас К. Норман (ред.). Химия мышьяка, сурьмы и висмута . Спрингер. п. 90. ИСБН 0-7514-0389-Х .
- ^ Прадьот Патнаик. Справочник неорганических химикатов . МакГроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Тёке, Орсоля и Магдольна Харгиттай. «Молекулярная структура трихлорида висмута по данным комбинированного электронографического и колебательного спектроскопического исследования». Структурная химия 6.2 (1995): 127–130.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия , 5-е издание, стр. 879–884, Oxford Science Publications, ISBN 0-19-855370-6
- ^ Джоэл Генри Хильдебранд (2008). Принципы химии . БиблиоБазар, ООО. п. 191. ИСБН 978-0-559-31877-1 .
- ^ Фрэнк Уэлчер (2008). Химические растворы . ЧИТАЙТЕ КНИГИ. п. 48. ИСБН 978-1-4437-2907-9 .
- ^ Восилус, Арон; Хоффманн, Стефан; Шмидт, Маркус; Рак, Майкл (2010). «Исследование на месте твердогазовой реакции BiCl 3 в BiOCl через промежуточный гидрат BiCl 3 ·H 2 O». Европейский журнал неорганической химии . 2010 (10): 1469–1471. дои : 10.1002/ejic.201000032 . ISSN 1434-1948 .
- ^ Холлеман, А.Ф.; Виберг, Э. «Неорганическая химия» Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5 .
- ^ 2001) Хитоми Судзуки , Elsevier, стр. 403–404 . Ёсихиро Матано ( 0-444-20528-4 .
