Атомный радиус

Атомный радиус является химического элемента мерой размера его атома , обычно это среднее или типичное расстояние от центра ядра до самого удаленного изолированного электрона . Поскольку граница не является четко определенным физическим объектом, существуют различные неэквивалентные определения атомного радиуса. Четыре широко используемых определения атомного радиуса: радиус Ван-дер-Ваальса , ионный радиус , металлический радиус и ковалентный радиус . Обычно из-за сложности выделения атомов для отдельного измерения их радиусов атомный радиус измеряется в химически связанном состоянии; однако теоретические расчеты проще, если рассматривать атомы изолированно. Зависимости от среды, зонда и состояния приводят к множеству определений.
В зависимости от определения этот термин может применяться к атомам в конденсированном веществе , ковалентно связанным в молекулах или в ионизированном и возбужденном состояниях ; и его значение может быть получено посредством экспериментальных измерений или вычислено на основе теоретических моделей. Значение радиуса может зависеть от состояния атома и контекста. [ 1 ]
Электроны не имеют ни определенных орбит, ни четко определенных пробегов. Скорее, их положения следует описывать как распределения вероятностей , которые постепенно сужаются по мере удаления от ядра, без резкого обрезания; их называют атомными орбиталями или электронными облаками. Более того, в конденсированном состоянии и молекулах электронные облака атомов обычно в некоторой степени перекрываются, и часть электронов может перемещаться по большой области, охватывающей два или более атомов.
Согласно большинству определений радиусы изолированных нейтральных атомов колеблются от 30 до 300 пм ( триллионные доли метра) или от 0,3 до 3 ангстрем . Следовательно, радиус атома более чем в 10 000 раз превышает радиус его ядра (1–10 Фм ), [ 2 ] и менее 1/1000 длины волны видимого света (400–700 нм ).
Для многих целей атомы можно моделировать как сферы. Это лишь грубое приближение, но оно может дать количественные объяснения и предсказания многих явлений, таких как плотность жидкостей и твердых тел, диффузия жидкостей через молекулярные сита , расположение атомов и ионов в кристаллах , а также размер и форма. молекул . [ нужна ссылка ]
История
[ редактировать ]В 1920 году, вскоре после того, как стало возможным определять размеры атомов с помощью рентгеновской кристаллографии , было высказано предположение, что все атомы одного и того же элемента имеют одинаковые радиусы. [ 3 ] Однако в 1923 году, когда стало доступно больше данных о кристаллах, было обнаружено, что приближение атома как сферы не обязательно справедливо при сравнении одного и того же атома в разных кристаллических структурах. [ 4 ]
Определения
[ редактировать ]Широко используемые определения атомного радиуса включают:
- Радиус Ван-дер-Ваальса : В простейшем определении половина минимального расстояния между ядрами двух атомов элемента, которые иначе не связаны ковалентными или металлическими взаимодействиями. [ 5 ] Радиус Ван-дер-Ваальса можно определить даже для элементов (таких как металлы), в которых силы Ван-дер-Ваальса преобладают над другими взаимодействиями. Поскольку взаимодействия Ван-дер-Ваальса возникают в результате квантовых флуктуаций поляризации атомов , поляризуемость (которую обычно легче измерить или вычислить) можно использовать для косвенного определения радиуса Ван-дер-Ваальса. [ 6 ]
- Ионный радиус : номинальный радиус ионов элемента в определенном состоянии ионизации, выведенный из расстояния между атомными ядрами в кристаллических солях, которые включают этот ион. В принципе, расстояние между двумя соседними противоположно заряженными ионами ( длина между ионной связи ними) должно равняться сумме их ионных радиусов. [ 5 ]
- Ковалентный радиус : номинальный радиус атомов элемента при ковалентной связи с другими атомами, определяемый на основе разделения атомных ядер в молекулах. В принципе, расстояние между двумя атомами, связанными друг с другом в молекуле (длина этой ковалентной связи), должно равняться сумме их ковалентных радиусов. [ 5 ]
- Металлический радиус : номинальный радиус атомов элемента при соединении с другими атомами металлическими связями . [ нужна ссылка ]
- Радиус Бора : радиус орбиты электрона с самой низкой энергией, предсказанный моделью Бора (1913). атома [ 7 ] [ 8 ] Это применимо только к атомам и ионам с одним электроном , таким как водород , однократно ионизированный гелий и позитроний . Хотя сама модель сейчас устарела, радиус Бора для атома водорода по-прежнему считается важной физической константой, поскольку он эквивалентен квантово-механическому наиболее вероятному расстоянию электрона от ядра.
Эмпирически измеренный атомный радиус
[ редактировать ]В следующей таблице показаны эмпирически измеренные ковалентные радиусы элементов, опубликованные Дж. К. Слейтером в 1964 году. [ 9 ] Значения указаны в пикометрах (пм или 1×10 −12 м) с точностью около 17:00. Оттенок поля варьируется от красного до желтого по мере увеличения радиуса; серый цвет указывает на отсутствие данных.
| Группа (столбец) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||
| Период (ряд) |
|||||||||||||||||||||
| 1 | ЧАС 25 |
Он | |||||||||||||||||||
| 2 | Что 145 |
Быть 105 |
Б 85 |
С 70 |
Н 65 |
ТО 60 |
Ф 50 |
Ne | |||||||||||||
| 3 | Уже 180 |
мг 150 |
Ал 125 |
И 110 |
П 100 |
С 100 |
кл. 100 |
С | |||||||||||||
| 4 | К 220 |
Что 180 |
наук 160 |
Из 140 |
V 135 |
Кр 140 |
Мин. 140 |
Фе 140 |
Ко 135 |
В 135 |
С 135 |
Зн 135 |
Здесь 130 |
Ге 125 |
Как 115 |
Се 115 |
Бр 115 |
НОК | |||
| 5 | руб. 235 |
старший 200 |
И 180 |
Зр 155 |
Нб 145 |
Мо 145 |
Тс 135 |
Ру 130 |
резус 135 |
ПД 140 |
В 160 |
компакт-диск 155 |
В 155 |
Сн 145 |
Сб 145 |
Te 140 |
я 140 |
Машина | |||
| 6 | Cs 260 |
Нет 215 |
* |
Лу 175 |
хф 155 |
Облицовка 145 |
В 135 |
Ре 135 |
Ты 130 |
И 135 |
Пт 135 |
В 135 |
ртуть 150 |
Тл 190 |
Pb 180 |
С 160 |
Po 190 |
В |
Рн | ||
| 7 | Пт |
Солнце 215 |
** |
лр |
РФ |
ДБ |
Сг |
Бх |
Хс |
гора |
Дс |
Рг |
Сп |
Нх |
В |
Мак |
Лев |
Ц |
И | ||
| * |
La 195 |
Этот 185 |
Пр 185 |
Нд 185 |
вечера 185 |
см 185 |
Евросоюз 185 |
Б-г 180 |
Тб 175 |
Те 175 |
К 175 |
Является 175 |
Тм 175 |
Ыб 175 | |||||||
| ** |
И 195 |
че 180 |
Хорошо 180 |
В 175 |
Например 175 |
Мог 175 |
Являюсь 175 |
См |
Бк |
См. |
Является |
Фм |
Мэриленд |
Нет | |||||||
Объяснение общих тенденций
[ редактировать ]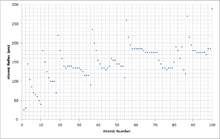
Изменение атомного радиуса с увеличением атомного номера можно объяснить расположением электронов в оболочках фиксированной емкости. Оболочки обычно заполняются в порядке возрастания радиуса, поскольку отрицательно заряженные электроны притягиваются положительно заряженными протонами ядра. По мере увеличения атомного номера в каждой строке таблицы Менделеева дополнительные электроны переходят в ту же самую внешнюю оболочку; радиус которого постепенно сокращается из-за увеличения заряда ядра. У благородного газа внешняя оболочка полностью заполнена; следовательно, дополнительный электрон следующего щелочного металла перейдет в следующую внешнюю оболочку, что приводит к внезапному увеличению атомного радиуса.
Увеличение заряда ядра частично уравновешивается увеличением числа электронов — явление, известное как экранирование ; что объясняет, почему размер атомов обычно увеличивается с каждым столбцом. Однако есть одно заметное исключение, известное как сокращение лантаноидов : блок 5d-элементов намного меньше, чем можно было бы ожидать, из-за слабого экранирования 4f-электронов.
По сути, атомный радиус уменьшается по периодам из-за увеличения числа протонов. Следовательно, между протонами и электронами существует большее притяжение, поскольку противоположные заряды притягиваются, и большее количество протонов создает более сильный заряд. Большее притяжение приближает электроны к протонам, уменьшая размер частицы. Следовательно, атомный радиус уменьшается. Вниз по группам атомный радиус увеличивается. Это связано с тем, что существует больше энергетических уровней и, следовательно, большее расстояние между протонами и электронами. Кроме того, экранирование электронов приводит к уменьшению притяжения, поэтому оставшиеся электроны могут уйти дальше от положительно заряженного ядра. Следовательно, размер или атомный радиус увеличивается.
В следующей таблице суммированы основные явления, влияющие на атомный радиус элемента:
| фактор | принцип | увеличиться с... | склонны к | влияние на радиус |
|---|---|---|---|---|
| электронные оболочки | квантовая механика | главное и азимутальное квантовые числа | увеличивайте вниз каждый столбец | увеличивает атомный радиус |
| ядерный заряд | сила притяжения, действующая на электроны со стороны протонов в ядре | атомный номер | увеличение по каждому периоду (слева направо) | уменьшает атомный радиус |
| экранирование | сила отталкивания, действующая на электроны внешней оболочки внутренними электронами | количество электронов во внутренних оболочках | уменьшить эффект ядерного заряда | увеличивает атомный радиус |
Лантанидное сокращение
[ редактировать ]Электроны в подоболочке 4f , которая постепенно заполняется от лантана ( Z = 57) до иттербия ( Z = 70), не особенно эффективно экранируют растущий ядерный заряд от дальнейших подоболочек. Элементы, следующие сразу за лантанидами, имеют атомные радиусы, которые меньше, чем можно было бы ожидать, и почти идентичны атомным радиусам элементов, находящихся непосредственно над ними. [ 10 ] Следовательно, лютеций на самом деле немного меньше иттрия , гафний имеет практически тот же атомный радиус (и химический состав), что и цирконий , а тантал имеет атомный радиус, аналогичный ниобию , и так далее. Эффект сжатия лантаноидов заметен вплоть до платины ( Z = 78), после чего он маскируется релятивистским эффектом, известным как эффект инертной пары . [ нужна ссылка ]
Из-за сокращения лантаноидов можно сделать 5 следующих наблюдений:
- Размер Ln 3+ ионов регулярно уменьшается с ростом атомного номера. По правилам Фаянса уменьшение размера Ln 3+ ионы увеличивают ковалентный характер и уменьшают основной характер между Ln 3+ и ох − ионы в Ln(OH) 3 , до такой степени, что Yb(OH) 3 и Lu(OH) 3 с трудом растворяются в горячем концентрированном NaOH. Отсюда порядок размера Ln 3+ дано:
3+ > Что 3+ > ..., ... > Читать 3+ . - Происходит закономерное уменьшение их ионных радиусов.
- С увеличением атомного номера наблюдается закономерное снижение их склонности к действию восстановителя.
- Второй и третий ряды переходных элементов d-блока достаточно близки по свойствам.
- Следовательно, эти элементы встречаются в природных минералах вместе и их трудно разделить.
сокращение d-блока
[ редактировать ]Сокращение d-блока менее выражено, чем сокращение лантаноидов, но возникает по той же причине. В данном случае именно плохая экранирующая способность 3d-электронов влияет на атомные радиусы и химический состав элементов, следующих сразу за первым рядом переходных металлов , от галлия ( Z = 31) до брома ( Z = 35). [ 10 ]
Расчетный атомный радиус
[ редактировать ]В следующей таблице показаны атомные радиусы, рассчитанные на основе теоретических моделей, опубликованных Энрико Клементи и другими в 1967 году. [ 11 ] Значения указаны в пикометрах (мкм).
| Группа (столбец) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Период (ряд) |
||||||||||||||||||||
| 1 | ЧАС 53 |
Он 31 | ||||||||||||||||||
| 2 | Что 167 |
Быть 112 |
Б 87 |
С 67 |
Н 56 |
ТО 48 |
Ф 42 |
Ne 38 | ||||||||||||
| 3 | Уже 190 |
мг 145 |
Ал 118 |
И 111 |
П 98 |
С 88 |
кл. 79 |
С 71 | ||||||||||||
| 4 | К 243 |
Что 194 |
наук 184 |
Из 176 |
V 171 |
Кр 166 |
Мин. 161 |
Фе 156 |
Ко 152 |
В 149 |
С 145 |
Зн 142 |
Здесь 136 |
Ге 125 |
Как 114 |
Се 103 |
Бр 94 |
НОК 88 | ||
| 5 | руб. 265 |
старший 219 |
И 212 |
Зр 206 |
Нб 198 |
Мо 190 |
Тс 183 |
Ру 178 |
резус 173 |
ПД 169 |
В 165 |
компакт-диск 161 |
В 156 |
Сн 145 |
Сб 133 |
Te 123 |
я 115 |
Машина 108 | ||
| 6 | Cs 298 |
Нет 253 |
* |
Лу 217 |
хф 208 |
Облицовка 200 |
В 193 |
Ре 188 |
Ты 185 |
И 180 |
Пт 177 |
В 174 |
ртуть 171 |
Тл 156 |
Pb 154 |
С 143 |
Po 135 |
В 127 |
Рн 120 | |
| 7 | Пт |
Солнце |
** |
лр |
РФ |
ДБ |
Сг |
Бх |
Хс |
гора |
Дс |
Рг |
Сп |
Нх |
В |
Мак |
Лев |
Ц |
И | |
| * |
La 226 |
Этот 210 |
Пр 247 |
Нд 206 |
вечера 205 |
см 238 |
Евросоюз 231 |
Б-г 233 |
Тб 225 |
Те 228 |
К 226 |
Является 226 |
Тм 222 |
Ыб 222 | ||||||
| ** |
И |
че |
Хорошо |
В |
Например |
Мог |
Являюсь |
См |
Бк |
См. |
Является |
Фм |
Мэриленд |
Нет | ||||||
См. также
[ редактировать ]- Атомные радиусы элементов (страница данных)
- Химическая связь
- Ковалентный радиус
- Длина связи
- Стерическое препятствие
- Кинетический диаметр
Ссылки
[ редактировать ]- ^ Коттон, ФА; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е изд.). Уайли . п. 1385. ИСБН 978-0-471-84997-1 .
- ^ Басдеван, Ж.-Л.; Рич, Дж.; Спиро, М. (2005). Основы ядерной физики . Спрингер . п. 13, рис 1.1. ISBN 978-0-387-01672-6 .
- ^ Брэгг, WL (1920). «Расположение атомов в кристаллах» . Философский журнал . 6. 40 (236): 169–189. дои : 10.1080/14786440808636111 .
- ^ Вайкофф, RWG (1923). «О гипотезе постоянных атомных радиусов» . Труды Национальной академии наук Соединенных Штатов Америки . 9 (2): 33–38. Бибкод : 1923PNAS....9...33W . дои : 10.1073/pnas.9.2.33 . ПМЦ 1085234 . ПМИД 16576657 .
- ^ Jump up to: а б с Полинг, Л. (1945). Природа химической связи (2-е изд.). Издательство Корнелльского университета . LCCN 42034474 .
- ^ Федоров Дмитрий В.; Садухан, Майнак; Штер, Мартин; Ткаченко, Александр (2018). «Квантово-механическая связь между поляризуемостью атомного диполя и радиусом Ван-дер-Ваальса» . Письма о физических отзывах . 121 (18): 183401. arXiv : 1803.11507 . Бибкод : 2018PhRvL.121r3401F . doi : 10.1103/PhysRevLett.121.183401 . ПМИД 30444421 . S2CID 53564141 . Проверено 9 мая 2021 г.
- ^ Бор, Н. (1913). «О строении атомов и молекул, Часть I. - Связывание электронов положительными ядрами» (PDF) . Философский журнал . 6. 26 (151): 1–24. Бибкод : 1913PMag...26....1B . дои : 10.1080/14786441308634955 . Архивировано (PDF) из оригинала 2 сентября 2011 г. Проверено 8 июня 2011 г.
- ^ Бор, Н. (1913). «О строении атомов и молекул, Часть II. - Системы, содержащие только одно ядро» (PDF) . Философский журнал . 6. 26 (153): 476–502. Бибкод : 1913PMag...26..476B . дои : 10.1080/14786441308634993 . Архивировано (PDF) из оригинала 9 декабря 2008 г. Проверено 8 июня 2011 г.
- ^ Слейтер, Дж. К. (1964). «Атомные радиусы в кристаллах». Журнал химической физики . 41 (10): 3199–3205. Бибкод : 1964ЖЧФ..41.3199С . дои : 10.1063/1.1725697 .
- ^ Jump up to: а б Джолли, WL (1991). Современная неорганическая химия (2-е изд.). МакГроу-Хилл . п. 22. ISBN 978-0-07-112651-9 .
- ^ Клементи, Э.; Раймонд, DL; Рейнхардт, WP (1967). «Константы атомного экранирования из функций SCF. II. Атомы с от 37 до 86 электронов». Журнал химической физики . 47 (4): 1300–1307. Бибкод : 1967JChPh..47.1300C . дои : 10.1063/1.1712084 .