Разметка дорожного покрытия стеклянными шариками
Примеры и перспективы в этой статье могут не отражать мировую точку зрения на предмет . ( Май 2022 г. ) |


Стеклянные шарики, состоящие из натриево-кальциевого стекла, необходимы для обеспечения световозвращающей способности во многих видах дорожной разметки . [1] Световозвращаемость возникает, когда падающий свет от транспортных средств преломляется в стеклянных шариках, которые встроены в разметку дорожного покрытия , а затем отражается обратно в поле зрения водителя. [2] В Северной Америке ежегодно для разметки дорожного покрытия используется около 227 миллионов килограммов стеклянных шариков. [3] При разметке пятиполосной автомагистрали на милю расходуется примерно 520 килограммов стеклянных шариков. [4] а разметка дорог может происходить каждые два-пять лет. [4] В Соединенных Штатах огромный спрос на стеклянные бусины привел к их импорту из стран, использующих устаревшие производственные правила и технологии.
Эти методы включают использование тяжелых металлов, таких как мышьяк , сурьма и свинец, в процессе производства в качестве обесцвечивающих и осветляющих агентов. Было обнаружено, что тяжелые металлы внедряются в стеклянную матрицу шариков и могут выщелачиваться в условиях окружающей среды, в которых находятся дороги. [5]
Состав и изготовление
[ редактировать ]
Синтез этих шариков начинается, когда карбонат кальция нагревается до температуры от 800 до 1300°С. C. Это нагревание вызывает реакцию разложения, в результате которой образуется твердый оксид кальция и выделяется углекислый газ.
Аналогичным образом карбонат натрия разлагается до оксида натрия и выделяет углекислый газ.
Затем оксид натрия реагирует с кремнеземом с получением натриево-силикатного жидкого стекла.
Наконец, для завершения общей структуры натриево-известкового стекла оксид кальция растворяют в растворе с натриево-силикатным стеклом, что в конечном итоге снижает температуру размягчения стекла. [6] К этому расплавленному стеклу добавляют дополнительные металлы и ионы для улучшения его свойств, а затем соединение распыляют и формируют шарики, используя прямой или непрямой метод.
В целом, процентный состав основных соединений, обнаруженных в конечном продукте из стеклянных шариков, показан ниже. [3]
| Сложный | % Состав |
| 70-75% | |
| 11-15% | |
| 2-4% | |
| 6-10% | |
| 1-2% |
В дополнение к этим основным компонентам натриево-известкового стекла производители включают в него тяжелые металлы, мышьяк, сурьму и свинец для очистки и улучшения свойств стеклянных шариков. Свинец в форме PbO добавляется для увеличения долговечности стекла и выдерживания суровых дорожных условий. [8] Мышьяк и сурьма используются в качестве осветлителей, способствующих удалению пузырьков газа из расплавленной смеси. [9] Углекислый газ, образующийся при разложении карбоната кальция и карбоната натрия, удаляется для получения необходимых световозвращающих свойств стекла. Кроме того, как мышьяк, так и сурьма используются в качестве обесцвечивателей. Наличие бесцветного стекла имеет решающее значение для максимального увеличения световозвращающей способности. Мышьяк в своей неорганической форме способствует обесцвечиванию стекла, контролируя степень окисления железа. [3] Мышьяк окисляет оксид железа до менее яркого аналога — оксида железа.
Сурьма в форме Sb 2 O 5 осуществляет аналогичную реакцию с мышьяком, окисляя оксид железа до оксида железа.
Хотя эти три тяжелых металла обычно можно найти как в отечественных, так и в импортных стеклянных шариках, их концентрация различается. По данным Агентства по охране окружающей среды США , Закон об охране и восстановлении ресурсов ограничивает уровни содержания тяжелых металлов в соответствии с их токсичностью. [11] Однако из-за растущего спроса на размеченные дороги большая часть стеклянных шариков, используемых в США, импортируется из стран, где содержание тяжелых металлов практически не регулируется. Например, шарики, полученные из Северной Америки, содержат примерно 15 мг мышьяка на кг шариков, а некоторые из Китая имеют концентрации до 1000 мг/кг. [3] Концентрации импортных частиц каждого из этих металлов указаны в таблице ниже.
| Металл/Металлоид | Концентрация (мг/кг) |
| 103-683 | |
| 23-179 | |
| 62-187 |
Деградация стеклянных бусин
[ редактировать ]Условия окружающей среды могут вызвать деградацию стеклянных шариков, что приведет к выбросу в окружающую среду тяжелых металлов. [3] Хотя абразивное воздействие может привести к смещению этих шариков с дорожной разметки, реакция этих шариков с водной средой значительно ускоряет их разложение и выделение тяжелых металлов.
В коррозии диоксида кремния участвуют три реакции. Первая представляет собой реакцию ионного обмена, при которой подвижные ионы раствора заменяются ионами с аналогичным зарядом в твердом теле. В частности, в этой реакции участвуют катионообменные материалы, где отрицательно заряженная структурная основная цепь позволяет заменять положительно заряженные катионы. [12] Эта реакция, участвующая в разложении шариков натронной извести, показывает различные ионы, которые взаимодействуют с кремний-кислородной сеткой (например, , , , ) заменяется ионом водорода.
Помимо этой реакции, гидроксильный ион может атаковать облигация, вызывающая роспуск матрицу и создание силанольных и немостиковых кислородных групп.
По мере растворения немостиковые кислородные группы могут отрывать ионы водорода из раствора.
Увеличение концентрации гидроксильных ионов сопровождается повышением щелочности водного раствора. В различных исследованиях по выщелачиванию в колонке это увеличение pH показало увеличение потенциала восстановления и концентрации DOC (растворенного органического углерода) в растворе. В конечном итоге это приводит к увеличению подвижности многих металлов, включая мышьяк, медь и никель.
Поэтому на подвижность этих тяжелых металлов влияет присутствие оксидов щелочных металлов. , , , и ионы могут связываться с тетраэдрическими сетками кремния и кислорода, образуя тригональную сетку антипризм. При образовании тригональной антипризмы ионы координируются с тремя атомами кислорода на расстоянии 2,3 ангстрема, а затем еще с тремя атомами кислорода на несвязывающем расстоянии 3 ангстрема. По мере увеличения концентрации оксидов щелочных металлов в металлических шариках вероятность химического воздействия увеличивается из-за более открытой и доступной химической сети и структуры стекла. [3]
Видообразование и выщелачивание тяжелых металлов
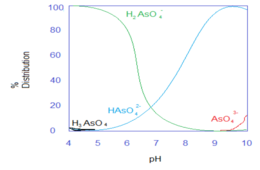
[ редактировать ]Как во время обычного удаления дорожной разметки, так и в суровых условиях окружающей среды эти стеклянные шарики могут разлагаться и выщелачивать содержащиеся в них тяжелые металлы. Хотя точный механизм включения тяжелых металлов в стеклянные шарики неизвестен, в современной литературе предполагается, что тяжелые металлы связаны со щелочными и щелочноземельными металлами на поверхности стеклянных шариков. Условия окружающей среды, связанные с дорожным покрытием, такие как pH, различные соли и ионная сила, сильно влияют на процесс выщелачивания. В частности, pH определяет вид тяжелого металла, который имеет решающее значение для растворимости в водной фазе. На следующих графиках показано образование тяжелых металлов в зависимости от pH. [3]
- Преобладающие виды мышьяка выщелачиваются при высоком pH, так как .
Константа диссоциации: см. Свойства мышьяковой кислоты . - Преобладающие виды свинца выщелачиваются при низком pH, так как .
Pb(OH) 2 Pb 2+ (водный) + 2OH − (водн.): Ksp = 2,8*10 −16 - Сурьма не проявляет большой зависимости от pH. Преобладающими выщелоченными видами являются форма.
Растворимость Sb(V) = 20 г/л.
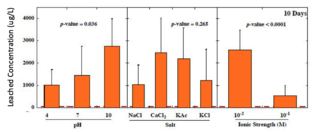
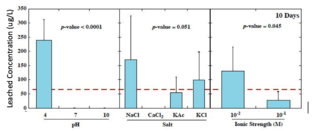
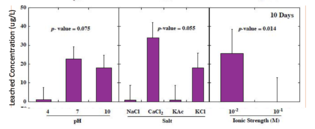
Лишь в немногих штатах действуют правила, регулирующие концентрацию выщелоченных тяжелых металлов. Например, Нью-Джерси ограничивает содержание мышьяка до 3 мкг/л, свинца до 65 мкг/л и сурьмы до 78 мкг/л. В исследованиях, в которых партии стеклянных шариков подвергались воздействию условий окружающей среды в лабораторных условиях, 96% выщелоченных концентраций мышьяка превышали 3 мкг/л, 75% выщелоченных свинцов превысили 65 мкг/л и 27% выщелоченных концентраций сурьмы превысил критерий 78 мкг/л. [13] На следующих графиках показаны общие концентрации тяжелых металлов, выщелоченных из стеклянных шариков через 160 дней, в зависимости от pH, типа соли и ионной силы. [3]
- Концентрации выщелачиваемого мышьяка значительно выше при низкой ионной силе и хлоридных солях. Нет существенной разницы в зависимости от pH.
- Концентрации выщелоченного свинца значительно выше при низком pH, низкой ионной силе и хлоридных солях.
- Концентрации выщелачивания сурьмы значительно выше при низкой ионной силе. Нет существенной разницы в зависимости от pH или типа соли.
Взаимодействие с придорожным грунтом
[ редактировать ]Когда мышьяк мобилизуется в водной форме, гуминовые вещества взаимодействуют с мышьяком. Было показано, что, особенно в кислой среде, гуминовые кислоты вносят огромный вклад в удержание мышьяка в почвенном матриксе. [14] Хотя точный механизм этого не подтвержден, была выдвинута гипотеза, что гуминовые кислоты действуют как анионообменные фрагменты, возможно, за счет взаимодействия аминов внутри гуминового материала с мышьяком. Это вероятно только в том случае, если амин является четвертичным, что оправдывает заявление о низком pH, поскольку аналогичные смолы используются для разделения As(III) и As(V). Другой возможный механизм взаимодействия мышьяка с гуминовыми веществами – через металлокомплексы. Потенциально, адсорбция мышьяка может происходить в виде мостикового лиганда гуминовая кислота-металл-As или, возможно, адсорбироваться на глине, которая также связана с самой гуминовой кислотой. [15]
С другой стороны, было показано, что свинец увеличивает связывание гуминовых веществ с увеличением pH и уменьшением ионной силы. Исследования показали, что монодентатный свинец в относительно высокой степени связывается с группами карбоксильного типа, присутствующими в гуминовых материалах. Имеются также данные о бидентатной форме связывания свинца с группами фенольного типа в орто-положении в гумусовом материале при высоких концентрациях свинца, как это имеет место в почвах вблизи дорог с разметкой. [16]
Что касается антиномии, качественные исследования ее связи с гуминовыми веществами скудны и редко дают окончательные результаты. Однако во многих случаях было показано, что pH мало влияет на эти взаимодействия. Одно исследование показало, что органические лиганды, обладающие карбоксильными или гидроксильными группами, создают стабильные бидентатные хелаты в виде As(III) и As(V). Другой указал, что As(III) при связывании с гуминовым материалом легко окисляется и может высвобождаться обратно в водный раствор в виде (SbOH)6-, тем самым показывая, что As(V) чаще всего связывается с гуминовым материалом. Детали того, как это связывание происходит механически, остаются относительно невыясненными, но знание первичной формы его связывания важно для дальнейшего исследования. [17]
Альтернатива использованию тяжелых металлов
[ редактировать ]Световозвращающая способность необходима для обеспечения безопасных условий вождения. Хотя металлы необходимы для достижения этих целей, существуют и другие, нетоксичные металлы, которые могут достичь тех же результатов. Они могут включать цирконий, вольфрам, титан и барий. [18] Количество этих металлов, которые могут быть включены в стекло, варьируется в зависимости от страны его происхождения и правил, установленных в этих странах, но дальнейшие исследования альтернатив использованию тяжелых металлов в дорожной разметке помогут уменьшить выщелачивание тяжелых металлов вблизи придорожных почв.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Мангалгирл, КП (2012). Тяжелые металлы в стеклянных шариках, используемых в дорожной разметке. Магистерская диссертация, Техасский университет A&M, Колледж-Стейшн, Техас.
- ^ дос Сантос, EJ; Герман, АБ; Прадо, СК; Фантин, Е.Б.; дос Сантос, VW; де Оливейра, АВМ; Куртиус, AJ (2013). Определение токсичных элементов в стеклянных шариках, используемых для разметки дорожного покрытия, методом ICP OES. Микрохимический журнал. 108: 233-238.
- ^ Jump up to: а б с д и ж г час Сандху, Северная Каролина (2012). Выщелачивание металлов и металлоидов из стеклянных шариков для разметки дорог и потенциальное воздействие на окружающую среду. доктор философии Диссертация, Технологический институт Нью-Джерси, Ньюарк, Нью-Джерси.
- ^ Jump up to: а б Буланже, Б.; Карлсон, П.; Фаткин, Х.; и Раут-Десаи А. (2014). Скрининговая оценка концентрации мышьяка и свинца в стеклянных шариках, используемых в разметке тротуаров. Министерство транспорта США. Публикация № FHWA-HRT-14-021.
- ^ Джахан, К., Н.К. Сандху, Л.Б. Акс, ПК Ндиба, К.В. Рамануджачари и Т.Ф. Магделано. 2010. Загрязнение тяжелыми металлами стеклянных шариков для разметки дорог. Нью-Джерси: Департамент транспорта Нью-Джерси.
- ^ Веллер М., Овертон Т., Рурк Дж. и Армстронг Ф. (2014). Неорганическая химия. Оксфорд, Великобритания. Издательство Оксфордского университета.
- ^ Дашейн П., Хили К., Хатмахер Д., Грейнджер Д.В. и Киркпатрик К.Дж. (2015). Комплексные биоматериалы . Амстердам, Нидерланды. Эльзевир.
- ^ Сидек, ХАА, Эль-Малавани, Р., Матори, К.А., и Халима, МК (2016). Влияние PbO на упругое поведение стекольных систем ZnO-P2O5. Результаты по физике . 6: 449-455.
- ^ Хуёва М. и Вернерова М. (2017). Влияние оклеивающих агентов на плавление стекла: обзор, часть I. Керамика-Силикаты. 61(2): 119–126.
- ^ Jump up to: а б П. Стоун, Э. Иган и Дж. Лер. Диоксид церия в качестве осветляющего агента и обесцвечивателя стекла. Журнал Американского керамического общества . 39, № 3 (1956).
- ^ Агентство по охране окружающей среды США (1991b). Процедура выщелачивания характеристик токсичности (TCLP). Метод 1311, Федеральный реестр , 55 (29 марта), Вашингтон, округ Колумбия.
- ^ Кумар С. и Джайн С. (2013). История, введение и кинетика ионообменных материалов. Химический журнал. 2013: 1-13.
- ^ Сандху, Северная Каролина; Акс, Л.; Джахан, К.; Рамануджачари, К.В., Кулахан, К. (2013). Воздействие на окружающую среду выщелачивания металлов и металлоидов из стеклянных бусин дорожной разметки. ACS Технология экологических наук. 47:4383-4391.
- ^ Бушманн Дж., Каппелер А., Линдауэр У., Кистлер Д., Берг М. и Сигг Л. (2006). Связывание арсенита и арсената с растворенными гуминовыми кислотами: влияние pH, типа гуминовой кислоты и алюминия. Экологические науки и технологии . 40(19): 6015-6020.
- ^ Найду, Рави (2006). Управление мышьяком в окружающей среде: от почвы к здоровью человека . Коллингвуд, Австралия: Издательство CSIRO. стр. 120–124.
- ^ Сюн, Дж., Купал, Л.К., Тан, В., Фанг, Л., Ван, М., Чжао, В., Лю, Ф., Чжан, Дж., и Венг, Л. (2013). Связывание свинца с почвенными фульвовыми и гуминовыми кислотами: моделирование NICA-Donnan и XAFS-спектроскопия. Экологические науки и технологии . 47(20): 11634-11642.
- ^ Хокманн, К. (2014). «Выщелачивание сурьмы из загрязненной нефти при изменении окислительно-восстановительных условий» . Сборник исследований ETH Zurich . 21685 .
- ^ Хайден, Дж.С. (2004). «Экологически чистые оптические очки». Новости оптики и фотоники , 15 (8), 36-41.

![{\displaystyle {\ce {CaCO3 ->[{800-1300C}]{CaO(s)}+ CO2(г)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5cb484d3646dade0e69a0ab3d7a7c8e687c4f54)
![{\displaystyle {\ce {Na2CO3 -> [{800-1300C}] {Na2O(s)}+ CO2(г)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fed65d1f113f3b74aea0724141253e1786d3f9a6)