Zingibain
| Zingibain | |||
|---|---|---|---|
 ПИМОЛ Сгенерировал 3D -структуру мономера Zingibain | |||
| Идентификаторы | |||
| ЕС №. | 3.4.22.67 | ||
| CAS №. | 246044-91-7 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| |||
Zingibain , Zingipain или имбирная протеаза ( EC 3.4.22.67 ) представляет собой протеазы цистеина фермент , обнаруженный в имбиря ( Zingiber officinale ) корневище . [ 1 ] [ 2 ] [ 3 ] Он катализирует преимущественное расщепление пептидов в с остатком пролина положении P2. Он имеет две отдельные формы : имбирная протеаза I (GP-I) и имбирная протеаза II (GP-II). [ 4 ]
Будучи членом семейства протеаз протеаз протеаз цистеиновых протеаз, Zingibain разделяет несколько структурных и функциональных сходств с более хорошо изученными ферментами, такими как папаин , бромелейн и актинидин . Эти пептидазы содержат активное остаток цистеина в своих центрах, который катализирует гидролитическое расщепление пептидных связей. Zingibain отмечен своей активностью как протеиназа и коллагеназу . [ 1 ]
Сначала он был изолирован, очищен и сообщил в 1973 году Ichikawa et al. в Японии женский университет . [ 5 ] Недавно было обнаружено, что Zingibain существует в виде двух изозимов , GP-I и GP-II, которые были выделены хроматографией, с молекулярными массами приблизительно 22 500 Да. [ 5 ]
Механизм
[ редактировать ]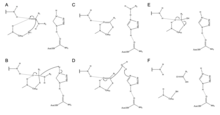
Zingibain использует каталитическую триаду Cys, его остатков и ASN в своем активном участке, чтобы расщеплять пептидные связи гидролитически. Присутствие ASN175 стабилизирует его кольцо имидазола , гарантируя, что оно оптимально позиционируется для катализа гидролиза.
Механизм начинается с переноса протона от Cys25 на HIS159. [ 6 ] аминокислот Затем сульфидный анион атакует альфа -углерод , вытесняя группу аминов , которая прикрепляется к HIS159. [ 6 ] Альфа -углерод на стабилизированной аминокислоте затем атаковается молекулой воды, которая вытесняет сульфид Cys25 для преобразования аминокислоты в карбоновую кислоту , которая выделяется из активного сайта фермента. [ 6 ]
Экспериментальное введение дитиотретола , известного протектора группы тиола , улучшает протеолитическую активность, обеспечивая дальнейшую проверку важности центрального остатка цистеина для ферментативной активности. [ 7 ]
Zingibain демонстрирует максимальную скорость оборота при 60 ° C и быстро денатуру при 70 ° C. [ 8 ] Протеолиз в значительной степени безжалостно во время приготовления пищи с имбирем. Оптимальные температурные диапазоны папаина и фицина повышены по сравнению с зингибейном, тогда как бромелейн работает в немного более низком диапазоне. [ 7 ]
Максимальная протеолитическая активность зингибейна происходит при рН 6,0, хотя фермент все еще активен в рН от 4,5 до 6,0 (оптимальный рН для мясных маринадов ). [ 7 ]
GP-II, более кислый из двух изозимов, демонстрирует PI 4,82, а GP-I демонстрирует значения PI при 5,05 или 5,16. [ 1 ] Эти множественные значения Pi придают поддержку теории, что GP-I может быть смесью двух белков.
Структура
[ редактировать ]Zingibain был впервые очищен и охарактеризован с рентгеновской кристаллографией в 2000 году исследователями из Бостонского университета . [ 1 ]
Фермент составляет 221 аминокислоты длиной и гликозилирован с 2 N-связанными олигосахаридными цепями в ASN96 и ASN154. [ 3 ] Полипептидная цепь Zingibain складывается на два полярных домена примерно одинакового размера, разделенная на центральную нейтральную расщелину. [ 3 ] Первый домен содержит альфа -спирали , а второй имеет антипараллельные бета -листы . [ 3 ] Это разделение полярных и неполярных областей облегчает взаимодействие белкового белка между ферментом и большим диапазоном субстратов. [ 3 ]
Активный сайт Zingibain, расположенный в центральной расщелине, имеет глубину 5,5 Å и длиной 9,5 Å. [ 3 ] Активный сайт содержит каталитическую триаду Cys25, HIS159 и ASN175, которые оба совместно обеспечивают катализ кислоты/основания.
Zingibain демонстрирует специфичность связывания с пептидными субстратами с пролином в положении P2. [ 1 ] S2 Submite Zingibain содержит аминокислотную цепь TRP67-MET68-ASN69-TTR133-ALA157, что делает сайт слишком компактным, чтобы вместить более крупные гидрофобные ароматические остатки субстрата, предпочитаемые другими ферментами в семействе Папаина. [ 1 ] Пролин, однако, стабилизируется множественными нековалентными взаимодействиями с этой областью.
Структура фермента стабилизируется водородными связями , а также сшивая сульфидные связи между тремя парами остатков цистеина (Cys22-Cys63, Cys56-Cys95 и Cys153-Cys200), аналогично многим другим папенам. [ 1 ]
В то время как фермент существует как мономер в растворе, кристаллизованный зингбейн образует тетрамеры или димеры, связанные с гликозилирующими цепями на каждой субъединице. Zingibain демонстрирует N-связанные олигосахаридные цепи сложного типа в двух остатках. [ 1 ] Цепи длиной между 5-13 гликозильными единицами и состоят из N-ацетилглюкозамина , фукозы , маннозы и ксилозы . Последовательности сахара Zingibain практически идентичны олигосахаридам, наблюдаемым на лектинах из японских семян пагодных деревьев , лаккака A от клеток сикамор и S-гликопротеинов из Brassica Campestris . [ 1 ]
Биологическое значение
[ редактировать ]В имбирных корневищах имбирная протеаза участвует в нескольких функциональных ролях для поддержания и содержания растительных клеток .
Зингибейн, как и большинство цистеиновых протеаз, синтезируется в виде протротеина 40-50 кДа в цитоплазматических полисомах, связанных с клеточными мембранами . [ 9 ] В эндоплазматическом ретикулуме эти удлиненные цепи помечены сигналом удержания Kdel ER и помещаются в большие везикулы KDEL , которые перемещаются от ER в вакуоли хранения белка в клеточных стенках . [ 9 ]
Zingibain, вероятно, участвует в хранении белка (в семенах или растительной ткани ), но преимущественно разрушает и мобилизует хранилища. Он также может реагировать на абиотические и биотические стрессы, такие как тепловой шок , холодные температуры и обезвоживание , чтобы устранить любые возникающие неправильно свернутые или денатурированные белки. [ 9 ]
Использование
[ редактировать ]Мясной тендеризатор
[ редактировать ]Как и папаин из папайей и бромелина из ананасов , он используется в качестве мясного тендера . [ 10 ] [ 11 ]
При добавлении в приготовление мяса, обычно в сыром или сушеном имбире, было показано, что Zingibain увеличивает нежность мяса. [ 8 ] [ 12 ] Мясовая тендера происходит из -за быстрого протеолиза Zingibain основных мышечных белков в мясе, особенно актомиозина и коллагена I типа , который обнаруживается в мышечных суставах . [ 8 ]
В то время как другие ферменты папаина, включая папаин, фицин и бромелейн, чаще используются для обмена мясом, Zingibain демонстрирует сходную или повышенную протеолитическую активность. [ 11 ] Фактически, Zingibain является единственной каталогизацией растительной протеазы с коллагенолитической активностью. Zingibain может быть предпочтительным тендером для мяса для папаина из -за полученной текстуры изготовленного мяса. В то время как Папаин может гидролизовать аккомиозин, он также разрушает другие основные белки ткани, которые приводят к мягкому текстуре мяса. [ 11 ] Специфичность связывания Zingibain обеспечивает преобладающую гидролизацию актомиозина и коллагена I типа.
Zingibain также используется для ароматизации колбас и запеки . [ 8 ]
Реннет заменитель
[ редактировать ]В течение последних 100 лет имбирная протеаза традиционно использовалась для сгибания молока , чтобы создать молока с имбирным молоком , кантонское блюдо из приготовленное из горячего молока и имбирного сока . Способность свернуть молоко и специфичность имбирной протеазы к протеолизу κ-casein делает фермент потенциальным овощным применением производства для сыра .
Коагуляция молока традиционно достигается путем коагуляции ферментов, извлеченных из таких источников, как Реннет. В Rennet три κ-казеина Hymosin Isoozymes κ-Casein, основная белковая фракция внутри молока, между PHE105 и Met106 . Гидрофильные субрегионы κ-casein расщепляются, оставляя в основном гидрофобные агрегаты. Таким образом, ферменты дестабилизируют мицеллы κ-casein и способствуют скоплению гидрофобных остатков белка, вызывая молоко для сгибания.
Основные промышленные недостатки Реннета включают его ограниченную поставку и высокую стоимость, его недоступность для вегетарианцев и практикующие члены определенных религиозных групп , а также недавние европейские национальные запреты на использование рекомбинантного теленка Реннет . [ 13 ] Грибковые протеазы в значительной степени не подходят в качестве заменителей Реннета, и было показано, что ферменты из многих растительных экстрактов дают низкую урожайность, плохие текстуры и горькие ароматы сыра. [ 13 ]
Коммерческие недостатки
[ редактировать ]Тем не менее, сырая имбирная протеаза, извлеченная из экстракта имбиря, нестабильна, с полураспадом около 2 дней при 5 ° C, что делает ее проблематичной для коммерческих применений. [ 14 ] Хотя период полураспада фермента не препятствует его эффективности во время приготовления, эта низкая стабильность хранения требует улучшения для коммерциализации.
Коммерческие попытки стабилизировать фермент для крупномасштабного производства исследовали потенциальные методы инактивирования свободной сульфгидрил-группы в активном участке фермента. Механистические возможности включают окисление сульфгидрила, обмен его дисульфидными мостами , образующие аддукты хинона -тиол или связывание сульфгидрила с ионом тяжелых металлов . [ 14 ] Было обнаружено, что 0,2% аскорбата натрия стабилизирует Zingibain в течение до 14 дней при 5 ° C, тогда как сопоставимые концентрации EDTA и CaCl 2 оказывали минимальное влияние на стабильность. [ 14 ]
Наблюдается, что Zingibain деактивирует себя через автолиз , который может быть предотвращен путем реагирования активной сульфгидрил-группы с помощью цистина или PCMB. [ 14 ]
Ацетоновые порошки являются жизнеспособным коммерческим методом стабилизации Zingibain. После того, как гидрофобные растительные полифенолы удаляются из сырого имбиря, порошок ацетона вводится при низких температурах для обезвоживания корневой пульпы. [ 14 ] Фермент стабилизируется из -за снижения активности воды, более низких концентраций пигментов растений и более жестких трехмерных структур при более низких температурах. [ 14 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и фон глин час я Чой К.Х., Лаурсен Р.А. (2000). «Аминокислотная последовательность и гликановые структуры цистеиновых протеаз со специфичностью пролина из имбирного корневища Zingiber officinale» . Евро. J. Biochem. 267 (5): 1516–26. doi : 10.1046/j.1432-1327.2000.01152.x . PMID 10691991 .
- ^ Ohtsuki K, Taguchi K, Sato K, et al. (1995). «Очистка имбирных протеаз DEAE-сефарозы и изоэлектрической фокусировки» Biochimica et Biophysica Acta (BB) - Общие субъекты 1243 (2): 181–4 Doi : 10.1016/0304-4165 (94) 00145- N 7873561PMID
- ^ Jump up to: а беременный в дюймовый и фон Чой К.Х., Лаурсен Р.А., Аллен К.Н. (1999). «2.1 Структура цистеиновой протеазы со специфичностью пролина от имбирного корневища, Zingiber officinale». Биохимия . 38 (36): 11624–33. doi : 10.1021/bi990651b . PMID 10512617 .
- ^ Huang XW, Chen LJ, Luo YB, et al. (2011). «Очистка, характеристика и коагулирующие молоко свойства имбирных протеаз» . J. Dairy Sci. 94 (5): 2259–69. doi : 10.3168/jds.2010-4024 . PMID 21524515 .
- ^ Jump up to: а беременный Мичи , ; Кимио 26.377 .
- ^ Jump up to: а беременный в Rzychon M, Chmiel D, Stec-Niemczyk J (2004). «Моды ингибирования цистеиновых протеаз». Acta Biochimica Polonica . 51 (4): 861–73. PMID 15625558 .
- ^ Jump up to: а беременный в Thompson EH, Wolf Id, Allen CE (1973). «Джинджер -корневище: новый источник протеолитического фермента». J. Food Sci. 38 (4): 652–655. doi : 10.1111/j.1365-2621.1973.tb02836.x .
- ^ Jump up to: а беременный в дюймовый Lee YB, Sehnert DJ, Ashmore CR (1986). «Тендерность мяса с помощью имбирной корневищной протеазы». J. Food Sci. 51 (6): 1558–1559. doi : 10.1111/j.1365-2621.1986.tb13860.x .
- ^ Jump up to: а беременный в Grudkowska M, Zagdańska B (2004). «Многофункциональная роль растительных цистеиновых протеиназ» . Acta Biochimica Polonica . 51 (3): 609–24. doi : 10.18388/abp.2004_3547 . PMID 15448724 .
- ^ Ha M, Bekhit AE, Carne A, et al. (2012). «Характеристика коммерческих препаратов протеазы папаина, бромелана, актинидина и протеазы зингибейна и их активности в отношении мясных белков». Пищевая химия. 134 (1): 95–105. doi : 10.1016/j.foodchem.2012.02.071 .
- ^ Jump up to: а беременный в Kim M, Hamilton SE, Great LW, et al. (2007). «Коллагеназа растений: уникальная коллагенитическая активность цистеиновых протеаз из имбиря» Biochimica et Biophysica Acta (BB) - Общие субъекты 1770 (12): 1627–3 Doi : 10.1016/ j.bbagen.2007.08.0 17920199PMID
- ^ Moon SS (2018). «Влияние протеолитических ферментов и экстракта имбиря на тендеризацию M. pectoralis profundus из гольштейна -руля» . Корейский журнал о продуктах питания животных ресурсов . 38 (1): 143–151. doi : 10.5851/kosfa.2018.38.1.143 . PMC 5932962 . PMID 29725232 .
- ^ Jump up to: а беременный Hashim MM, Mingsheng D, IQBAL MF, et al. (2011). «Джинджер -корневище как потенциальный источник молока, коагулирующего цистеиновую протеазу». Фитохимия . 72 (6): 458–64. Bibcode : 2011pchem..72..458h . doi : 10.1016/j.phytochem.2010.12.002 . PMID 21353685 .
- ^ Jump up to: а беременный в дюймовый и фон Adulyatham P, Owusu-Apenten R (2005). «Стабилизация и частичная очистка протеазы от имбирного корневища ( Zingiber Offinale Roscoe)». J. Food Sci. 70 (3): C231 - C234. doi : 10.1111/j.1365-2621.2005.tb07130.x .
Внешние ссылки
[ редактировать ]- Zingipain в Национальной библиотеке медицинской библиотеки США медицинские заголовки (Mesh)