Репликация ДНК

В молекулярной биологии , [ 1 ] [ 2 ] [ 3 ] Репликация ДНК является биологическим процессом продуцирования двух идентичных реплик ДНК из одной оригинальной молекулы ДНК . [ 4 ] Репликация ДНК происходит у всех живых организмов, действующих как наиболее важная часть биологического наследования . Это важно для деления клеток во время роста и восстановления поврежденных тканей, в то время как это также гарантирует, что каждая из новых клеток получает собственную копию ДНК. [ 5 ] Клетка обладает отличительным свойством деления, что делает репликацию ДНК важнейшей.
ДНК состоит из двойной спирали двух дополнительных прядей . Двойная спираль описывает внешний вид двухцепочечной ДНК, которая, таким образом, состоит из двух линейных цепей, которые бегут напротив друг друга и скручиваются вместе, чтобы сформировать. [ 6 ] Во время репликации эти пряди разделены. Каждая прядь оригинальной молекулы ДНК затем служит шаблоном для производства своего аналога, процесса, называемого полуконсервативной репликацией . В результате полуконсервативной репликации новая спираль будет состоять из оригинальной пряди ДНК, а также вновь синтезированного нити. [ 7 ] Механизмы клеточной корректуры и проверки ошибок обеспечивают почти идеальную верность репликации ДНК. [ 8 ] [ 9 ]
In a cell, DNA replication begins at specific locations, or origins of replication,[10] in the genome[11] which contains the genetic material of an organism.[12] Unwinding of DNA at the origin and synthesis of new strands, accommodated by an enzyme known as helicase, results in replication forks growing bi-directionally from the origin. A number of proteins are associated with the replication fork to help in the initiation and continuation of DNA synthesis. Most prominently, DNA polymerase synthesizes the new strands by adding nucleotides that complement each (template) strand. DNA replication occurs during the S-stage of interphase.[13]
DNA replication (DNA amplification) can also be performed in vitro (artificially, outside a cell).[14] DNA polymerases isolated from cells and artificial DNA primers can be used to start DNA synthesis at known sequences in a template DNA molecule. Polymerase chain reaction (PCR), ligase chain reaction (LCR), and transcription-mediated amplification (TMA) are examples. In March 2021, researchers reported evidence suggesting that a preliminary form of transfer RNA, a necessary component of translation, the biological synthesis of new proteins in accordance with the genetic code, could have been a replicator molecule itself in the very early development of life, or abiogenesis.[15][16]
DNA structure
[edit]
DNA exists as a double-stranded structure, with both strands coiled together to form the characteristic double helix. Each single strand of DNA is a chain of four types of nucleotides. Nucleotides in DNA contain a deoxyribose sugar, a phosphate, and a nucleobase. The four types of nucleotide correspond to the four nucleobases adenine, cytosine, guanine, and thymine, commonly abbreviated as A, C, G, and T. Adenine and guanine are purine[17] bases, while cytosine and thymine are pyrimidines. These nucleotides form phosphodiester bonds, creating the phosphate-deoxyribose backbone of the DNA double helix with the nucleobases pointing inward (i.e., toward the opposing strand). Nucleobases are matched between strands through hydrogen bonds to form base pairs. Adenine pairs with thymine (two hydrogen bonds), and guanine pairs with cytosine (three hydrogen bonds).[18]
DNA strands have a directionality, and the different ends of a single strand are called the "3′ (three-prime) end" and the "5′ (five-prime) end". By convention, if the base sequence of a single strand of DNA is given, the left end of the sequence is the 5′ end, while the right end of the sequence is the 3′ end. The strands of the double helix are anti-parallel, with one being 5′ to 3′, and the opposite strand 3′ to 5′. These terms refer to the carbon atom in deoxyribose to which the next phosphate in the chain attaches. Directionality has consequences in DNA synthesis, because DNA polymerase can synthesize DNA in only one direction by adding nucleotides to the 3′ end of a DNA strand.
Соединение комплементарных оснований в ДНК (с помощью водородной связи ) означает, что информация, содержащаяся в каждой цепи, является избыточной. Фосфодиэфирные (внутрицепочечные) связи более сильнее, чем водород (между ними). Фактическая работа фосфодиэфирных связей заключается в том, что в ДНК -полимерах соединяется 5 -'атом углерода одного нуклеотида с 3' атомом углерода другого нуклеотида, в то время как водородные связи стабилизируют ДНК -двойные спирали через ось спирали, но не в направлении ось. [ 19 ] Это позволяет отделить пряди друг от друга. Следовательно, нуклеотиды на одной цепи могут использоваться для реконструкции нуклеотидов на недавно синтезированной партнерской нити. [ 20 ]
ДНК -полимераза
[ редактировать ]
ДНК -полимеразы представляют собой семейство ферментов , которые выполняют все формы репликации ДНК. [ 22 ] ДНК -полимеразы в целом не могут инициировать синтез новых цепей, но могут расширить только существующую ДНК или РНК -цепь в сочетании с шаблонной цепью. Для начала синтеза, короткий фрагмент РНК, называемый праймером , должен быть создан и сочетаться с шаблоной ДНК.
ДНК -полимераза добавляет новую цепь ДНК, расширяя 3' -конец существующей нуклеотидной цепи, добавляя новые нуклеотиды, соответствующие цепи шаблона, по одному за раз, посредством создания фосфодиэфирных связей . Энергия для этого процесса полимеризации ДНК происходит из-за гидролиза высокоэнергетических фосфатных (фосфоангидридных) связей между тремя фосфатами, прикрепленными к каждому некорпоративному основанию . Свободные основания с их прикрепленными фосфатными группами называются нуклеотидами ; В частности, основания с тремя прикрепленными фосфатными группами называются нуклеозидными трифосфатами . Когда нуклеотид добавляется в растущую ДНК-нить, образование фосфодиэфирной связи между проксимальным фосфатом нуклеотида с растущей цепью сопровождается гидролизом высокоэнергетической фосфатной связи с высвобождением двух дистальных фосфатных групп как пирофосфат . Ферментативный гидролиз полученного пирофосфата в неорганический фосфат потребляет вторую высокоэнергетическую фосфатную связь и делает реакцию эффективно необратимой. [ Примечание 1 ]
В целом, ДНК -полимеразы очень точны, с внутренней частотой ошибок менее одной ошибки на каждые 10 7 Нуклеотиды добавлены. [ 23 ] Некоторые ДНК -полимеразы также могут удалять нуклеотиды с конца развивающейся цепи, чтобы исправить несоответствующие основания. Это известно как корректура. Наконец, механизмы восстановления несоответствия после повторения контролируют ДНК на предмет ошибок, способные различать несоответствия в недавно синтезированной прядью ДНК из исходной цепи. Вместе эти три шага дискриминации позволяют репликации верность менее одной ошибки на каждые 10 9 Нуклеотиды добавлены. [ 23 ]
Скорость репликации ДНК в живой клетке была впервые измерена как скорость удлинения ДНК Фага T4 в инфицированной фагам E. coli . [ 24 ] В течение периода экспоненциального увеличения ДНК при 37 ° C скорость составляла 749 нуклеотидов в секунду. Скорость мутации на пару оснований на репликацию во время синтеза ДНК фага T4 составляет 1,7 на 10 8 . [ 25 ]
Процесс репликации
[ редактировать ]

Репликация ДНК, как и все процессы биологической полимеризации, продолжается в трех ферментативно катализированных и скоординированных шагах: инициация, удлинение и прекращение.
Инициация
[ редактировать ]
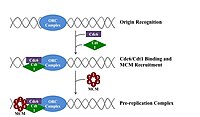
Чтобы ячейка разделила , она должна сначала повторить свою ДНК. [ 26 ] Репликация ДНК является процессом «все или нет»; Как только начинается репликация, она переходит к завершению. Как только репликация завершена, она снова не появляется в том же клеточном цикле. Это стало возможным благодаря разделению инициации комплекса до повторного репликации .
Предварительный комплекс
[ редактировать ]В позднем митозе и ранней фазе G1 большой комплекс инициаторных белков собирается в комплекс пре-репликации в определенных точках ДНК, известный как « происхождение ». [ 11 ] [ 10 ] В E. coli первичный белок инициатора представляет собой ДНК A ; У дрожжей это комплекс распознавания происхождения . [ 27 ] Последовательности, используемые белками инициаторами, имеют тенденцию быть «богатыми» (богатыми основаниями аденина и тимина), потому что у паров оснований есть две водородные связи (а не три, образованные в паре CG) и, следовательно, легче в разделе цепочки. [ 28 ] У эукариот комплекс распознавания происхождения катализирует сборку белков инициатора в предварительный комплекс. Кроме того, недавний отчет предполагает, что начинающие дрожжевые орк -орки димеризируются в зависимости от клеточного цикла для контроля лицензирования. [ 29 ] [ 30 ] В свою очередь, процесс димеризации ORC опосредуется зависимым от клеточного цикла цикла димеризации NOC3P in vivo, и эта роль NOC3P отделяется от его роли в биогенезе рибосом. Основной цикл димеризации NOC3P опосредует образование с двойным гексамером ORC в репликации Licensing ORC, а NOC3P непрерывно связаны с хроматином во всем клеточном цикле. [ 31 ] Затем CDC6 и CDT1 связывают с комплексом распознавания связанных источников на начале координат, чтобы сформировать больший комплекс, необходимый для загрузки комплекса MCM на ДНК. У эукариот комплекс MCM - это геликаза, которая разделяет спираль ДНК на репликационных вилках и происхождении. Комплекс MCM рекрутируется на поздней фазе G1 и загружается комплексом ORC-CDC6-CDT1 на ДНК через АТФ-зависимое ремоделирование белка. Нагрузка комплекса MCM на ДНК происхождения знаменует собой завершение образования комплекса до репликации. [ 32 ]
ДНК механизма . Если условия окружающей среды имеют право в поздней фазе G1, активируются комплексы CDK G1 и G1/S CDK, которые стимулируют экспрессию генов, которые кодируют компоненты синтетического Активация G1/S-CDK также способствует экспрессии и активации комплексов S-CDK, которые могут играть роль в активации источников репликации в зависимости от видов и типа клеток. Контроль этих CDK варьируется в зависимости от типа ячеек и стадии развития. Это регулирование лучше всего понимается у почкующихся дрожжей , где S -циклины CLB5 и CLB6 в первую очередь ответственны за репликацию ДНК. [ 33 ] Комплексы CLB5,6-CDK1 непосредственно запускают активацию источников репликации и поэтому требуются на протяжении всей фазы S, чтобы непосредственно активировать каждое происхождение. [ 32 ]
Аналогичным образом, CDC7 также требуется через S -фазу для активации источников репликации. CDC7 не активен на протяжении клеточного цикла, и его активация строго приуроченна, чтобы избежать преждевременной инициации репликации ДНК. В позднем G1 активность CDC7 резко возрастает в результате связи с регуляторной субъединицей DBF4 , которая напрямую связывает CDC7 и способствует его активности протеинкиназы. Было обнаружено, что CDC7 является ограничивающим скорость регулятора активности происхождения. Вместе G1/S-CDK и/или S-CDK и CDC7 сотрудничают, чтобы непосредственно активировать происхождение репликации, что приводит к инициации синтеза ДНК. [ 32 ]
Предварительный комплекс
[ редактировать ]В ранней фазе s активация S-CDK и CDC7 приводит к сборке предварительного комплекса, массивный белковый комплекс, образованный на начале координат. Образование предварительного комплекса вытесняет CDC6 и CDT1 из комплекса репликации происхождения, инактивируя и разбирая предварительный комплекс. Загрузка предварительного комплекса на начало коричке активирует Helicase MCM, вызывая разматывание спирали ДНК. Предварительный комплекс также загружает α-прамазу и другие ДНК-полимеразы в ДНК. [ 32 ]
После того, как α-прамаза синтезирует первые праймеры, соединения праймеров-таблица взаимодействуют с загрузчиком зажима, который загружает скользящий зажим на ДНК, чтобы начать синтез ДНК. Компоненты предварительного комплекса остаются связанными с вилками репликации, когда они выходят из начала. [ 32 ]
Удлинение
[ редактировать ]ДНК -полимераза обладает 5' -3 'активностью. Все известные системы репликации ДНК требуют свободной 3' -гидроксильной группы до того, как может быть инициировано синтез (ПРИМЕЧАНИЕ. Шаблон ДНК считывается в направлении от 3 'до 5', тогда как новая цепь синтезируется в направлении 5 до 3 ' - это часто происходит. смущенный). Четыре различных механизма для синтеза ДНК признаются:
- Все формы клеточной жизни и многие вирусы ДНК , фаги и плазмиды используют примазу для синтеза короткого праймера РНК со свободной 3' -группой OH, которая впоследствии удлиняется ДНК -полимеразой.
- В ретроэлементах (включая ретровирусы ) используется трансферная РНК, которая воспроизводит репликацию ДНК, предоставляя свободный 3' -OH, который используется для удлинения обратной транскриптазой .
- В аденовирусах и семействе φ29 бактериофагов 3' -группа ОН обеспечивается боковой цепью аминокислоты генома, прикрепленного белка (терминального белка), к которой нуклеотиды добавляются ДНК -полимеразой с образованием новой цепи.
- В одноцепочечных вирусах ДНК - группе, которая включает в себя цировирусы , геминивирусы , парвовирусы и другие, а также множество фагов и плазмид , которые используют механизм репликации катания (RCR), эндонуклеаза RCR создает ник в плоскости генома (RCR). (Одиночные вирусы) или одна из цепей ДНК (плазмиды). 5' -конец ниседенной прядь переносится в остаток тирозина на нуклеазе, а группа свободной 3' -OH затем используется ДНК -полимеразой для синтеза новой цепи.
Клеточные организмы используют первый из этих путей, так как он является наиболее известным. В этом механизме, как только две нити разделены, Primase добавляет РНК -праймеры к шаблонным цепям. Ведущая нить получает один РНК -праймер, в то время как отставательная прядь получает несколько. Ведущая цепь непрерывно расширяется от праймера с помощью ДНК -полимеразы с высокой процессивностью , в то время как отставающая цепь расширяется от каждого праймера, образующего фрагменты Оказаки . РНКаза удаляет фрагменты РНК праймера, а ДНК -полимераза с низкой процессивностью, отличную от репликативной полимеразы, входит для заполнения пробелов. Когда это будет завершено, можно найти один ник на ведущей пряди и несколько ников на отставающей пряди. Лигаза работает над тем, чтобы заполнить эти заклинания, заполняя вновь реплицированную молекулу ДНК.
Примаза, используемая в этом процессе, значительно отличается между бактериями и археей / эукариотами . Бактерии используют примазу, принадлежащую к суперсемейству белка DNAG , которая содержит каталитический домен типа Toprim сгиба. [ 34 ] Складка Toprim содержит α/β-ядро с четырьмя консервативными цепями в росманн-подобной топологии. Эта структура также обнаруживается в каталитических доменах топоизомеразы Ia, топоизомеразы II, нуклеазах старой семьи и белков репарации ДНК, связанных с белком REMP.
Примаза, используемая Archaea и Eukaryotes, напротив, содержит высоко получаемую версию мотива распознавания РНК (RRM). Эта примаза структурно сходна со многими вирусными РНК-зависимыми РНК-полимеразами, обратными транскрипзазами, циклическими нуклеотидными циклазами и ДНК-полимеразами семейств A/B/Y, которые участвуют в репликации и восстановлении ДНК. При эукариотической репликации примаза образует комплекс с Pol α. [ 35 ]
Множественные ДНК -полимеразы играют разные роли в процессе репликации ДНК. У E. coli ДНК Pol III является полимеразным ферментом, главным образом ответственным за репликацию ДНК. Он собирается в репликационный комплекс в вилке репликации, которая демонстрирует чрезвычайно высокую обработку, оставаясь нетронутой для всего цикла репликации. Напротив, ДНК Pol I является ферментом, ответственным за замену РНК -праймеров ДНК. ДНК POL I обладает 5' -3' -экзонуклеазной активностью в дополнение к своей полимеразной активности и использует свою экзонуклеазующую активность для ухудшения праймеров РНК перед ней, поскольку она расширяет прядь ДНК за ним, в процессе, называемом трансляцией NICK . Пол I гораздо менее обрабатывающая, чем Pol III, потому что его первичная функция в репликации ДНК состоит в том, чтобы создать много коротких областей ДНК, а не несколько очень длинных областей.
У эукариот фермент с низкой процветанием, Pol α, помогает инициировать репликацию, поскольку он образует комплекс с Primase. [ 36 ] Считается, что у эукариот синтез ведущего пряди проводится Pol ε; Тем не менее, эта точка зрения была недавно оспорена, что предполагает роль Pol Δ. [ 37 ] Удаление праймера завершено pol Δ [ 38 ] в то время как восстановление ДНК во время репликации завершается POL ε.
Поскольку синтез ДНК продолжается, исходные пряди ДНК продолжают расслабиться на каждой стороне пузыря, образуя вилку репликации с двумя зубцами. У бактерий, которые имеют единое происхождение репликации на своей круглой хромосоме, этот процесс создает « тета -структуру » (напоминающая греческую букву тета: θ). Напротив, эукариоты имеют более длинные линейные хромосомы и инициируют репликацию при множественном происхождении внутри них. [ 39 ]
Репликация вилка
[ редактировать ]
A: Шаблон, B: Ведущая Страйца, C: Задержка Strand, D: Вилка репликации, E: праймер, F: Фрагменты Оказаки

Вилка репликации - это структура, которая образуется в длинной спиральной ДНК во время репликации ДНК. Он продуцируется ферментами, называемыми геликазами, которые разбивают водородные связи, которые скрепляют пряди ДНК в спирали. Полученная структура имеет два разветвленных «зубчатых вещества», каждая из которых состоит из одной прядь ДНК. Эти две нити служат матрицей для ведущих и отстающих цепей, которые будут созданы как ДНК -полимераза совмещается с комплементарными нуклеотидами с шаблонами; Шаблоны могут быть должным образом названы как ведущий шаблон пряди и шаблон отставания.
ДНК считывается ДНК -полимеразой в направлении от 3 'до 5', что означает, что новая цепь синтезируется в направлении от 5 до 3 '. Поскольку ведущие и отстающие шаблоны пряди ориентированы в противоположных направлениях на вилке репликации, основная проблема заключается в том, как достичь синтеза новой отставной прямой ДНК, направление синтеза, противоположное направлению растущей репликации вилки.
Ведущая прядь
[ редактировать ]Ведущая нить - это прядь новой ДНК, которая синтезируется в том же направлении, что и растущая вилка репликации. Этот вид репликации ДНК непрерывна.
Запальная прядь
[ редактировать ]Запальная прядь - это прядь новой ДНК, направление синтеза, противоположное направлению растущей репликационной вилки. Из -за своей ориентации репликация отставающей пряди более сложна по сравнению с рецензией ведущей нити. Как следствие, видно, что ДНК -полимераза на этой цепи «отстает» от другой пряди.
Запальная прядь синтезируется в коротких, разделенных сегментах. На шаблоне отстающих цепей примаза « считывает» матрицу ДНК и инициирует синтез короткого комплементарного праймера РНК . ДНК -полимераза расширяет заполненные сегменты, образуя фрагменты Оказаки . Затем РНК -праймеры удаляют и заменяют ДНК, а фрагменты ДНК соединяются ДНК -лигазой .
Динамика в репликации вилки
[ редактировать ]
Во всех случаях геликаза состоит из шести полипептидов, которые обертывают только одну цепь ДНК, которая воспроизводится. Две полимеразы связаны с гексамером геликазы. В эукариотах геликаза оборачивается вокруг ведущей пряди, а в прокариотах она оборачивается вокруг отставания. [ 40 ]
Поскольку геликаза разматывает ДНК на вилке репликации, впереди ДНК вынуждена вращаться. Этот процесс приводит к созданию поворотов в предстоящей ДНК. [ 41 ] Это наращивание создает крутящую нагрузку, которая в конечном итоге остановит вилку репликации. Топоизомеразы представляют собой ферменты, которые временно разрушают нити ДНК, снимая напряжение, вызванное раскручиванием двух цепей спирали ДНК; Топоизомеразы (включая ДНК -гиразу ) достигают этого, добавив отрицательные суперклеки в спираль ДНК. [ 42 ]
Голая одноцепочечная ДНК имеет тенденцию складываться на себя, образуя вторичные структуры ; Эти структуры могут мешать движению ДНК -полимеразы. Чтобы предотвратить это, одноцепочечные связывающие белки связываются с ДНК, пока не будет синтезирована вторая цепь, предотвращая образование вторичной структуры. [ 43 ]
Двойная ДНК нависается вокруг гистонов , которые играют важную роль в регуляции экспрессии генов, поэтому реплицированная ДНК должна быть свернута вокруг гистонов в тех же местах, что и исходная ДНК. [ 44 ] Чтобы убедиться, что гистоновые шапероны разбирают хроматин , прежде чем он будет воспроизведен, и заменить гистоны в правильном месте. Некоторые шаги в этой сборке несколько спекулятивны. [ 45 ]
Зажичные белки действуют как скользящий зажим на ДНК, позволяя ДНК -полимеразе связываться с его матрицей и помогать в процессивности. Внутренняя поверхность зажима позволяет протекать через него ДНК. Как только полимераза достигает конца шаблона или обнаруживает двухцепочечную ДНК, скользящий зажим подвергается конформационному изменению, которое высвобождает ДНК-полимеразу. Белки, нагружающие зажим, используются для первоначальной загрузки зажима, распознавая соединение между шаблоном и РНК-праймерами. [ 9 ] :274-5
Белки репликации ДНК
[ редактировать ]На вилке репликации многие репликационные ферменты собираются на ДНК в сложную молекулярную машину, называемую репутацией . Ниже приведен список основных ферментов репликации ДНК, которые участвуют в повторении: [ 46 ]
| Фермент | Функция в репликации ДНК |
|---|---|
| ДНК геликаза | Также известен как дестабилизирующий фермент Helix. Геликаза отделяет две нити ДНК на вилке репликации за топоизомеразой. |
| ДНК -полимераза | Фермент, ответственный за катализирование добавления нуклеотидных субстратов в ДНК в направлении от 5 до 3 'во время репликации ДНК. Также выполняет корректуру и исправление ошибок. Существует много разных типов ДНК -полимеразы, каждый из которых выполняет разные функции в разных типах клеток. |
| ДНК зажим | Белок, который предотвращает удлиненные ДНК -полимеразы от диссоциации от родительской ДНК. |
| Одноцепочечный ДНК-связывающий белок | Свяжитесь с ssDNA и предотвращайте повторную спирали ДНК двойной спирали после того, как ДНК-геликаза разматывает ее, тем самым поддержав разделение цепи и облегчая синтез новой цепи. |
| Топоизомераза | Расслабляет ДНК от его супер-сжатой природы. |
| ДНК гираза | Снимает штамм раскручивания с помощью ДНК геликазы; Это специфический тип топоизомеразы |
| ДНК -лигаза | Пересанирует полуконсервативные нити и присоединяется к фрагментам Оказаки отставания. |
| Примаза | Обеспечивает отправную точку РНК (или ДНК) для ДНК -полимеразы, чтобы начать синтез новой цепи ДНК. |
| Теломераза | Удлиняет теломерную ДНК, добавляя повторяющиеся нуклеотидные последовательности к концам эукариотических хромосом . Это позволяет зародышевым клеткам и стволовым клеткам избежать предела сеного из -за деления клеток. [ 47 ] |
in vitro Эксперименты с одномолекулярными экспериментами (с использованием оптических пинцетов и магнитных пинцетов ) обнаружили синергетические взаимодействия между ферментами реплисом ( геликаза , полимераза и одноцепочечный ДНК-связывающий белок ) и с усилением DNA -вызывчивания ДНК-реплики Полем [ 14 ] Эти результаты приводят к разработке кинетических моделей, учитывая синергетические взаимодействия и их стабильность. [ 14 ]
Машины для репликации
[ редактировать ]
Машины для репликации состоят из факторов, связанных с репликацией ДНК, и появляющиеся на SSDNAS шаблона. Машины для репликации включают primosotors - это ферменты репликации; ДНК -полимераза, ДНК -геликазы, ДНК -зажимы и ДНК -топоизомеразы и репликационные белки; Например, одноцепочечные ДНК-связывающие белки (SSB). В репликационных механизмах эти компоненты координируют. В большинстве бактерий все факторы, связанные с репликацией ДНК, расположены на репликационных вилках, а комплексы остаются на вилках во время репликации ДНК. Машины для репликации также называются реплисомами или системами репликации ДНК. Эти термины являются общими терминами для белков, расположенных на вилках репликации. У эукариотических и некоторых бактериальных клеток реплисомы не образуются.
In an alternative figure, DNA factories are similar to projectors and DNAs are like as cinematic films passing constantly into the projectors. In the replication factory model, after both DNA helicases for leading strands and lagging strands are loaded on the template DNAs, the helicases run along the DNAs into each other. The helicases remain associated for the remainder of replication process. Peter Meister et al. observed directly replication sites in budding yeast by monitoring green fluorescent protein (GFP)-tagged DNA polymerases α. They detected DNA replication of pairs of the tagged loci spaced apart symmetrically from a replication origin and found that the distance between the pairs decreased markedly by time.[48] This finding suggests that the mechanism of DNA replication goes with DNA factories. That is, couples of replication factories are loaded on replication origins and the factories associated with each other. Also, template DNAs move into the factories, which bring extrusion of the template ssDNAs and new DNAs. Meister's finding is the first direct evidence of replication factory model. Subsequent research has shown that DNA helicases form dimers in many eukaryotic cells and bacterial replication machineries stay in single intranuclear location during DNA synthesis.[49]
Фабрики репликации распадаются сестринскими хроматидами. Разрушение необходимо для распределения хроматид в дочерние клетки после репликации ДНК. Поскольку сестринские хроматиды после репликации ДНК держат друг друга с помощью когезиновых колец, есть единственный шанс для распутывания в репликации ДНК. Установка механизма репликации в качестве заводов репликации может улучшить уровень успеха репликации ДНК. Если вилки репликации свободно перемещаются в хромосомах, катенация ядер усугубляется и препятствует митотической сегрегации. [ 48 ]
Завершение
[ редактировать ]Эукариоты инициируют репликацию ДНК в нескольких точках в хромосоме, поэтому репликация вилки встречаются и заканчиваются во многих точках хромосомы. Поскольку эукариоты имеют линейные хромосомы, репликация ДНК не может достичь самого конца хромосом. Из -за этой проблемы ДНК теряется в каждом цикле репликации с конца хромосомы. Теломеры представляют собой области повторяющейся ДНК вблизи концов и помогают предотвратить потерю генов из -за этого укорочения. Сокращение теломер является нормальным процессом в соматических клетках . Это сокращает теломеры дочерней ДНК -хромосомы. В результате клетки могут делить только определенное количество раз, прежде чем потеря ДНК предотвратит дальнейшее деление. (Это известно как предел сена .) В пределах линии зародышевых клеток , которая передает ДНК к следующему поколению, теломераза расширяет повторяющиеся последовательности области теломер для предотвращения деградации. Теломераза может стать ошибочно активной в соматических клетках, иногда приводя к образованию рака . Повышенная активность теломеразы является одним из отличительных признаков рака.
Прекращение требует, чтобы прогресс вилки репликации ДНК должен был остановиться или блокироваться. Прекращение в определенном локусе, когда он происходит, включает взаимодействие между двумя компонентами: (1) последовательность сайта завершения в ДНК и (2) белок, который связывается с этой последовательности, чтобы физически остановить репликацию ДНК. У различных видов бактерий это называется сайт-связывающий сат-сат-сат-сат-репликацию ДНК или белок TER .
Поскольку бактерии имеют круглые хромосомы, прекращение репликации происходит, когда две вилки репликации встречаются друг с другом на противоположном конце родительской хромосомы. E. coli регулирует этот процесс благодаря использованию последовательностей завершения, которые, когда он связан белком TUS , позволяет пройти только одно направление репликации. В результате вилки для репликации ограничены всегда встречаться в области прекращения хромосомы. [ 50 ]
Регулирование
[ редактировать ]
Эукариоты
[ редактировать ]В рамках эукариот репликация ДНК контролируется в контексте клеточного цикла . По мере того, как клетка растет и разделяется, она прогрессирует по стадиям в клеточном цикле; Репликация ДНК происходит во время фазы S (фаза синтеза). Прогресс эукариотической клетки через цикл контролируется контрольно -пропускными пунктами клеточного цикла . Прогрессирование через контрольно-пропускные пункты контролируется через сложные взаимодействия между различными белками, включая циклины и циклин-зависимые киназы . [ 51 ] В отличие от бактерий, эукариотическая ДНК повторяет в ограничениях ядра. [ 52 ]
Контрольная точка G1/S (контрольная точка ограничения) регулирует, входят ли эукариотические клетки в процесс репликации ДНК и последующего деления. Клетки, которые не проходят через эту контрольную точку, остаются на стадии G0 и не повторяют свою ДНК.
Как только ДНК пройдет тест «G1/S», ее можно скопировать только один раз в каждом клеточном цикле. Когда комплекс MCM уходит от происхождения, предварительный комплекс демонтируется. Поскольку новый комплекс MCM не может быть загружен при происхождении до тех пор, пока не будут реактивированы предварительные субъединицы, одно происхождение репликации не может использоваться дважды в одном клеточном цикле. [ 32 ]
Активация S-CDK в ранней фазе S способствует разрушению или ингибированию отдельных компонентов предварительного репликации, предотвращая немедленную повторную сборку. S и M-CDK продолжают блокировать сборку комплекса предварительного репликации даже после завершения фазы S, гарантируя, что сборка не может возникнуть снова, пока вся активность CDK не будет снижена при позднем митозе. [ 32 ]
У почкующихся дрожжей ингибирование сборки вызвано CDK-зависимым фосфорилированием компонентов комплекса до репликации. В начале S -фазы фосфорилирование CDC6 с помощью CDK1 вызывает связывание CDC6 с SCF лигазой убиквитина , которая вызывает протеолитическое разрушение CDC6. CDK-зависимое фосфорилирование белков MCM способствует их экспорту из ядра вместе с CDT1 во время S-фазы, предотвращая нагрузку новых комплексов MCM при происхождении во время одного клеточного цикла. Фосфорилирование CDK исходного репликационного комплекса также ингибирует сборку до репликации. Индивидуальное присутствие любого из этих трех механизмов достаточно для ингибирования сборки комплекса до репликации. Тем не менее, мутации всех трех белков в одной и той же клетке запускают повторную ревизию во многих происхождениях репликации в одном клеточном цикле. [ 32 ] [ 53 ]
В клетках животных белок геминин является ключевым ингибитором сборки комплекса до репликации. Геминин связывает CDT1, предотвращая его связывание с комплексом распознавания происхождения. В G1 уровни геминина сохраняются низкими при APC, который убиквитинирует геминин для его нацеливания на деградацию. Когда геминин уничтожен, CDT1 высвобождается, что позволяет ему функционировать в комплексном комплексе до репликации. В конце G1 APC инактивируется, что позволяет геминину накапливаться и связывать CDT1. [ 32 ]
Репликация хлоропластов и митохондриальных геномов происходит независимо от клеточного цикла посредством процесса репликации D-петли .
Репликация фокуса
[ редактировать ]В клетках позвоночных сайты репликации концентрируются на положения, называемые фокусами репликации . [ 48 ] Сайты репликации могут быть обнаружены путем иммуноокрашивания дочерних прядей и репликации ферментов и мониторинга коэффициентов репликации, меченных GFP. Этими методами обнаруживается, что репликационные очаги различного размера и положений появляются в S -фазе клеточного деления, а их количество на ядро намного меньше, чем количество вилок геномной репликации.
P. Heun et al. В [ 48 ] (2001) отслеживали фокавы репликации, меченные GFP, в почкующихся клетках дрожжей и показали, что происхождение репликации постоянно движутся в фазе G1 и S, а динамика значительно снижалась в S-фазе. [ 48 ] Традиционно сайты репликации были зафиксированы на пространственной структуре хромосом ядерной матрицей или ламинами . Результаты Хеуна отрицали традиционные концепции, начинающие дрожжи не имеют лампов, и подтверждают, что репликация происходит самостоятельно и формирует фокусы репликации.
Ужигая происхождение репликации, контролируемое пространственно и временно, регулируется формирование фокусов репликации. Da Jackson et al. (1998) показали, что соседнее происхождение выстреливает одновременно в клетках млекопитающих. [ 48 ] Пространственное сопоставление сайтов репликации приносит кластеризацию вилок репликации. Кластеризация делает спасение застопорившихся вилок репликации и способствует нормальному прогрессу репликационных вилок. Прогресс репликации вилок подавляется многими факторами; Столкновение с белками или с комплексами, сильно связывающимися с ДНК, дефицитом DNTP, прозвища на матрице DNAS и так далее. Если вилки репликации застряли, а остальные последовательности из застрявших вилок не копируются, то дочерние пряди получают Ника Ника без реплицированных сайтов. Незащитные сайты на пряди одного родителя держат другую прядь вместе, но не дочери. Следовательно, полученные сестринские хроматиды не могут отделиться друг от друга и не могут разделить на 2 дочерние клетки. Когда соседнее происхождение пожар и вилка из одного происхождения застопорится, вилка от другого доступа к происхождению в противоположном направлении застопорившейся вилки и дублировать не повторные участки. Как другой механизм спасения, применение источников неактивной репликации Это избыточное происхождение не стреляет в нормальную репликацию ДНК.
Бактерии
[ редактировать ]
Большинство бактерий не проходят через четко определенный клеточный цикл, а непрерывно копируют свою ДНК; Во время быстрого роста это может привести к одновременному появлению нескольких раундов репликации. [ 54 ] В E. coli , наиболее характерной бактерии, репликация ДНК регулируется с помощью нескольких механизмов, в том числе: гемиметилирование и секвестрирование последовательности происхождения, соотношение аденозинтрифосфата (АТФ) к аденозин дифхосфат (ADP) и уровни белка ДНКА. Все они контролируют связывание белков инициатора с последовательностями происхождения. [ 55 ]
Поскольку E. coli метилирует последовательности ДНК GATC, синтез ДНК приводит к гемиметилированным последовательностям. Эта гемиметилированная ДНК распознается белком SEQA , который связывает и сексетирует последовательность происхождения; Кроме того, ДНКА (необходимый для инициации репликации) более хорошо связывается с гемиметилированной ДНК. В результате недавно воспроизводимые истоки не могут немедленно инициировать еще один раунд репликации ДНК. [ 56 ]
АТФ накапливается, когда ячейка находится в богатой среде, запуская репликацию ДНК, как только ячейка достигла определенного размера. ATP конкурирует с ADP, чтобы связываться с DNAA, а комплекс DNAA-ATP способен инициировать репликацию. Для репликации ДНК также требуется определенное количество белков ДНКа - каждый раз, когда скопируется происхождение, количество сайтов связывания для удваиваний ДНКа, требующих синтеза большего количества ДНКА для обеспечения другого инициации репликации.
У быстрорастущих бактерий, таких как E. coli , репликация хромосом занимает больше времени, чем деление клетки. Бактерии решают это, инициируя новый раунд репликации, прежде чем предыдущий был прекращен. [ 57 ] Новый раунд репликации сформирует хромосому клетки, которая родилась два поколения после разделительной клетки. Этот механизм создает перекрывающиеся циклы репликации.
Проблемы с репликацией ДНК
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к этому . ( Май 2020 г. ) |


Есть много событий, которые способствуют напряжению репликации, в том числе: [ 58 ]
- Неправильное обучение рибонуклеотидов
- Необычные структуры ДНК
- Конфликты между репликацией и транскрипцией
- Недостаточность важных факторов репликации
- Общие хрупкие сайты
- Сверхэкспрессия или конститутивная активация онкогенов
- хроматина Недоступность
Полимеразная цепная реакция
[ редактировать ]Исследователи обычно повторяют ДНК in vitro, используя полимеразную цепную реакцию (ПЦР). ПЦР использует пару праймеров для охвата целевой области в матрице ДНК, а затем полимеризует партнерские нити в каждом направлении от этих праймеров с использованием термостабильной ДНК -полимеразы . Повторение этого процесса через несколько циклов усиливает целевую область ДНК. В начале каждого цикла смесь шаблона и праймеров нагревается, разделяя недавно синтезированную молекулу и шаблон. Затем, когда смесь охлаждается, оба они становятся шаблонами для отжига новых праймеров, и полимераза распространяется от них. В результате количество копий целевой области удваивается каждый раунд, увеличиваясь в геометрической прогрессии . [ 59 ]
Смотрите также
[ редактировать ]- AutoPoiesis
- Клетка (биология)
- Клеточная деление
- Сегрегация хромосом
- Устройство хранения данных
- Ген
- Экспрессия гена
- Эпигенетика
- Геном
- Хахимоджи ДНК
- Жизнь
- Репликация (вычисления)
- Саморепликация
Примечания
[ редактировать ]- ^ Энергетика этого процесса может также помочь объяснить направленность синтеза - если ДНК была синтезирована в направлении от 3 'до 5', энергия для процесса будет поступать из 5' -конца растущей цепи, а не от свободных нуклеотидов. Проблема заключается в том, что если бы высокие энергетические трифосфаты находились на растущей цепи, а не на свободных нуклеотидах, корректировка прочтения путем удаления несоответствующего терминального нуклеотида было бы проблематичным: после добавления нуклеотида трифосфат теряется и остается один фосфат. Магистраль между новым нуклеотидом и остальной частью прямой. Если бы добавленный нуклеотид был несоответствует, удаление приводило бы к цепи ДНК, завернутой монофосфатом в конце «выращивания нити», а не с высокой энергетической трифосфатом. Таким образом, Странд застрял и больше не сможет расти. На самом деле, высокие энергетические трифосфаты, гидролизованные на каждом этапе, происходят из свободных нуклеотидов, а не полимеризованной цепи, поэтому этой проблемы не существует.
Ссылки
[ редактировать ]- ^ О'Доннелл М., Лэнгстон Л, Стиллман Б (июль 2013 г.). «Принципы и концепции репликации ДНК у бактерий, археи и эукарья» . Перспективы Cold Spring Harbor в биологии . 5 (7): A010108. doi : 10.1101/cshperspect.a010108 . PMC 3685895 . PMID 23818497 .
- ^ Приоло М.Н., Макалпин Д.М. (август 2016 г.). "РЕБКА ДНК. Где мы начинаем?" Полем Гены и развитие . 30 (15): 1683–1697. doi : 10.1101/gad.285114.116 . PMC 5002974 . PMID 27542827 .
- ^ Dewar JM, Walter JC (август 2017 г.). «Механизмы прекращения репликации ДНК» . Природные обзоры. Молекулярная клеточная биология . 18 (8): 507–516. doi : 10.1038/nrm.2017.42 . PMC 6386472 . PMID 28537574 .
- ^ Сабхадия А (2022-03-01). "Что такое репликация ДНК и ее шаги?" Полем Получено 2023-08-04 .
- ^ «Генетика / репликация ДНК (базовый) - Pathwayz» . pathwayz.org . Получено 2020-12-10 .
- ^ "Двойная спираль" . Изучить науку в Scileble . Природное образование . Получено 2020-12-10 .
- ^ Молитесь LA (2008). «Полуконсервативная репликация ДНК; Месельсон и Шталь» . Природное образование . 1 (1): 98.
- ^ Несовершенная репликация ДНК приводит к мутациям . Berg JM, Tymoczko JL, Stryer L, Clarke ND (2002). «Глава 27: Репликация, рекомбинация и восстановление ДНК» . Биохимия . WH Freeman and Company. ISBN 0-7167-3051-0 Полем Архивировано из оригинала 2020-03-26 . Получено 2019-08-09 .
- ^ Jump up to: а беременный Lodish H, Berk A, Zipursky SL, et al. (2000). «Репликация, восстановление и рекомбинация ДНК» . Молекулярная клеточная биология (4 -е изд.). WH Freeman. ISBN 0-7167-3136-3 .
- ^ Jump up to: а беременный Ху Y, Стиллман Б (февраль 2023 г.). «Происхождение репликации ДНК у эукариот» . Молекулярная клетка . 83 (3): 352–372. doi : 10.1016/j.molcel.2022.12.024 . PMC 9898300 . PMID 36640769 .
- ^ Jump up to: а беременный Berg JM, Tymoczko JL, Stryer L, Clarke ND (2002). «Глава 27, раздел 4: Репликация ДНК обеих прядей быстро происходит от конкретных участков старта» . Биохимия . WH Freeman and Company. ISBN 0-7167-3051-0 Полем Архивировано из оригинала 2020-03-26 . Получено 2019-08-09 .
- ^ "Что такое геном?" Полем Творое . Получено 2020-12-10 .
- ^ Чагин, Вадим О.; Stear, Jeffrey H.; Кардосо, М. Кристина (апрель 2010 г.). «Организация репликации ДНК» . Перспективы Cold Spring Harbor в биологии . 2 (4): A000737. doi : 10.1101/cshperspect.a000737 . ISSN 1943-0264 . PMC 2845211 . PMID 20452942 .
- ^ Jump up to: а беременный в Jarillo J, Ibarra B, Cao-García FJ (2021). «Репликация ДНК: in vitro анализ и модели данных манипуляций с одномолекуляцией » . Вычислительный и структурный биотехнологический журнал . 19 : 3765–3778. doi : 10.1016/j.csbj.2021.06.032 . PMC 8267548 . PMID 34285777 .
- ^ Kühnlein A, Lanzmich SA, Braun D (март 2021 г.). «Последовательности тРНК могут собираться в репликатор» . элиф . 10 : E63431. doi : 10.7554/elife.63431 . PMC 7924937 . PMID 33648631 .
- ^ Максимилиан L (3 апреля 2021 года). «Решение проблемы курицы и яйца-« на шаг ближе к реконструкции происхождения жизни » . Scitechdaily . Получено 3 апреля 2021 года .
- ^ Фридберг Е.С. (январь 2003 г.). «Повреждение ДНК и восстановление» . Природа . 421 (6921): 436–440. Bibcode : 2003natur.421..436f . doi : 10.1038/nature01408 . PMID 12540918 .
- ^ Сабхадия А (2023-03-13). «Пара оснований: определение, правила в ДНК и РНК» . Получено 2023-08-04 .
- ^ «Функция и структура ДНК (с диаграммой) (статья)» . Ханская академия . Получено 2020-12-10 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки (4 -е изд.). Гарлендская наука. С. 238–240. ISBN 0-8153-3218-1 .
- ^ Эллисон Л. (2007). Фундаментальная молекулярная биология . Blackwell Publishing. п. 112. ISBN 978-1-4051-0379-4 .
- ^ Berg JM, Tymoczko JL, Stryer L, Clarke ND (2002). Биохимия . WH Freeman and Company. ISBN 0-7167-3051-0 Полем Глава 27, Раздел 2: ДНК -полимеразы требуют шаблона и праймера
- ^ Jump up to: а беременный McCulloch SD, Kunkel TA (январь 2008 г.). «Точность синтеза ДНК с помощью эукариотических репликативных и синтеза трансквирования полимеразы» . Клеточные исследования . 18 (1): 148–161. doi : 10.1038/cr.2008.4 . PMC 3639319 . PMID 18166979 .
- ^ McCarthy D, Minner C, Bernstein H, Bernstein C (октябрь 1976 г.). «Скорость удлинения ДНК и распределение точек роста фага T4 дикого типа и мутанта ДНК-задержки». Журнал молекулярной биологии . 106 (4): 963–981. doi : 10.1016/0022-2836 (76) 90346-6 . PMID 789903 .
- ^ Drake JW (1970) Молекулярная основа мутации. Холден-Дэй, Сан-Франциско ISBN 0-8162-2450-1 ISBN 978-0-8162-2450-0
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Глава 5: Механизмы репликации ДНК» . Молекулярная биология клетки . Гарлендская наука. ISBN 0-8153-3218-1 .
- ^ Weigel C, Schmidt A, Rückert B, Lurz R, Meser W (ноябрь 1997 г.). «Белок ДНКа, насыщенные отдельным ящиком ДНКа в эсшерии, происхождение репликации, ORIC » Embo Journal 16 (21): 6574–6 Doi : 10.1093/ emboj/ 16.21.6 1170261PMC 9351837PMID
- ^ Lodish H, Berk A, Zipursky LS, Matsudaira P, Baltimore D, Darnell J (2000). Молекулярная клеточная биология . WH Freeman and Company. ISBN 0-7167-3136-3 Полем 12.1. Общие особенности хромосомной репликации: три общие черты происхождения репликации
- ^ Lin YC, Prasanth SG (июль 2021 г.). «Инициирование репликации: последствия для целостности генома» . Репарация ДНК . 103 : 103131. DOI : 10.1016/j.dnarep.2021.103131 . PMC 8296962 . PMID 33992866 .
- ^ Amin A, Wu R, Cheung MH, Scott JF, Wang Z, Zhou Z, et al. (Март 2020 г.). «Основной и клеточный цикл-зависимый цикл димеризации ORC регулирует репликацию эукариотической хромосомной ДНК» . Сотовые отчеты . 30 (10): 3323–3338.e6. doi : 10.1016/j.celrep.2020.02.046 . PMID 32160540 .
- ^ Zhang Y, Yu Z, Fu X, Liang C (июнь 2002 г.). «NOC3P, белок BHLH, играет неотъемлемая роль в инициации репликации ДНК у почкующихся дрожжей» . Клетка . 109 (7): 849–860. doi : 10.1016/s0092-8674 (02) 00805-x . PMID 12110182 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Морган До (2007). Клеточный цикл: принципы контроля . Лондон: New Science Press. С. 64–75. ISBN 978-0-19-920610-0 Полем OCLC 70173205 .
- ^ Дональдсон А.Д., Рагураман М.К., Фридман К.Л., Кросс Ф.Р., Брюер Б.Дж., Фангман В.Л. (август 1998). «CLB5-зависимая активация последней репликации происхождения у S. cerevisiae» . Молекулярная клетка . 2 (2): 173–182. doi : 10.1016/s1097-2765 (00) 80127-6 . PMID 9734354 .
- ^ Aravind L, Leipe DD, Koonin EV (сентябрь 1998 г.). «Toprim-консервативный каталитический домен в топоизомеразах типа IA и II, примазах типа DNAG, нуклеазах старых семей и белках REST» . Исследование нуклеиновых кислот . 26 (18): 4205–4213. doi : 10.1093/nar/26.18.4205 . PMC 147817 . PMID 9722641 .
- ^ Frick DN, Richardson CC (июль 2001 г.). "ДНК -примазы". Ежегодный обзор биохимии . 70 : 39–80. doi : 10.1146/annurev.biochem.70.1.39 . PMID 11395402 . S2CID 33197061 .
- ^ Барри Эр, Белл С.Д. (декабрь 2006 г.). «Репликация ДНК в археи» . Микробиология и молекулярная биология обзоры . 70 (4): 876–887. doi : 10.1128/mmbr.00029-06 . PMC 1698513 . PMID 17158702 .
- ^ Стиллман Б (июль 2015 г.). «Пересмотр ДНК -полимеразы в репликационной вилке у эукариот» . Молекулярная клетка . 59 (2): 139–141. doi : 10.1016/j.molcel.2015.07.004 . PMC 4636199 . PMID 26186286 .
- ^ Rossi ML (февраль 2009 г.). Различие путей удаления праймера во время эукариотического созревания фрагментов Оказаки (кандидатская диссертация). Школа медицины и стоматологии, Университет Рочестера. HDL : 1802/6537 .
- ^ Huberman JA, Riggs AD (март 1968 г.). «О механизме репликации ДНК в хромосомах млекопитающих». Журнал молекулярной биологии . 32 (2): 327–341. doi : 10.1016/0022-2836 (68) 90013-2 . PMID 5689363 .
- ^ Gao Y, Cui Y, Fox T, Lin S, Wang H, De Val N, et al. (Февраль 2019 г.). «Структуры и принципы эксплуатации повторения» . Наука . 363 (6429): 835. doi : 10.1126/science.aav7003 . PMC 6681829 . PMID 30679383 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Механизмы репликации ДНК: ДНК -топоизомеразы предотвращают запутывание ДНК во время репликации» . Молекулярная биология клетки . Гарлендская наука. ISBN 0-8153-3218-1 .
- ^ Рис Р.Дж., Максвелл А (26 сентября 2008 г.). «ДНК -гираза: структура и функция». Критические обзоры биохимии и молекулярной биологии . 26 (3–4): 335–375. doi : 10.3109/10409239109114072 . PMID 1657531 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Механизмы репликации ДНК: специальные белки помогают открыть двойную спираль ДНК перед вилкой репликации» . Молекулярная биология клетки . Гарлендская наука. ISBN 0-8153-3218-1 .
- ^ Кунин, Юджин В.; Крупович, Март; Ишино, Соноко; Ишино, Йошизуми (2020-06-09). «Механизм репликации Луки: общее происхождение репликации ДНК и транскрипции» . BMC Biology . 18 (1): 61. DOI : 10.1186/S12915-020-00800-9 . ISSN 1741-7007 . PMC 7281927 . PMID 32517760 .
- ^ Ransom M, Dennehey BK, Tyler JK (январь 2010 г.). «Гистоны шаперонирования во время репликации и восстановления ДНК» . Клетка . 140 (2): 183–195. doi : 10.1016/j.cell.2010.01.004 . PMC 3433953 . PMID 20141833 .
- ^ Griffiths AJ, Wessler SR, Lewontin RC, Carroll SB (2008). Введение в генетический анализ . WH Freeman and Company. ISBN 978-0-7167-6887-6 Полем [Глава 7: ДНК: структура и репликация. Стр. 283–290]
- ^ Кларк Дж. (2009-05-11). "Неужели лимит сенофуфков удерживает нас от жизни навсегда?" Полем Howstuffworks . Получено 20 января 2015 года .
- ^ Jump up to: а беременный в дюймовый и фон Meister P, Taddei A, Gasser SM (июнь 2006 г.). «В и из фабрики репликации» . Клетка . 125 (7): 1233–5. doi : 10.1016/j.cell.2006.06.014 . PMID 16814710 . S2CID 15397410 .
- ^ Уотсон Д.Д., Бейкер Т.А., Белл С.П., Ганн А., Левин М., Лосик Р., Инглис К.Х. (2008). Молекулярная биология гена (6 -е изд.). Сан -Франциско: Пирсон/Бенджамин Каммингс. п. 237. ISBN 978-0-8053-9592-1 .
- ^ Браун Т.А. (2002). «Глава 13.2.3. Прекращение репликации» . Геномы . Bios Scientific Publishers . ISBN 1-85996-228-9 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Внутриклеточный контроль событий клеточного цикла: комплексы S-фазы циклина-CDK (S-CDK) инициируют репликацию ДНК один раз на цикл» . Молекулярная биология клетки . Гарлендская наука. ISBN 0-8153-3218-1 .
- ^ Браун Т.А. (2002). «Глава 13: Репликация генома» . Геномы (2 -е изд.). Оксфорд: Уайли-Лисс.
- ^ Nguyen VQ, Co C, Li JJ (июнь 2001 г.). «Циклин-зависимые киназы предотвращают повторную репликацию ДНК с помощью множественных механизмов». Природа . 411 (6841): 1068–1073. Bibcode : 2001natur.411.1068n . doi : 10.1038/35082600 . PMID 11429609 . S2CID 4393812 .
- ^ Tobiason DM, Seifert HS (июнь 2006 г.). «Оверганный патоген человека, Neisseria gonorrhoeae, является полиплоидом» . PLOS Биология . 4 (6): E185. doi : 10.1371/journal.pbio.0040185 . PMC 1470461 . PMID 16719561 .
- ^ О'Доннелл, Майкл; Лэнгстон, Ланс; Стиллман, Брюс (2013-07-01). «Принципы и концепции репликации ДНК у бактерий, археи и эукарья» . Перспективы Cold Spring Harbor в биологии . 5 (7): A010108. doi : 10.1101/cshperspect.a010108 . ISSN 1943-0264 . PMC 3685895 . PMID 23818497 .
- ^ Слейтер С., Волд С., Лу М., Бойе Е., Скарстад К., Клекнер Н. (сентябрь 1995). «Белок Seqa E. coli связывает ORIC в двух различных метилмодулированных реакциях, соответствующих его роли в инициации репликации ДНК и секвестрации происхождения» . Клетка . 82 (6): 927–936. doi : 10.1016/0092-8674 (95) 90272-4 . PMID 7553853 . S2CID 14652024 .
- ^ Cooper S, Helmstetter CE (февраль 1968 г.). «Репликация хромосом и цикл деления Escherichia coli b/r». Журнал молекулярной биологии . 31 (3): 519–540. doi : 10.1016/0022-2836 (68) 90425-7 . PMID 4866337 .
- ^ Zeman Mk, Cimprich Ka (январь 2014 г.). «Причины и последствия напряжения репликации» . Природная клеточная биология . 16 (1): 2–9. doi : 10.1038/ncb2897 . PMC 4354890 . PMID 24366029 .
- ^ Саики Р.К., Гелфанд Д.Х., Стоффель С., Шарф С.Дж., Хигучи Р., Хорн Г.Т. и др. (Январь 1988). «Руководитель праймера ферментативная амплификация ДНК с термостабильной ДНК-полимеразой». Наука . 239 (4839): 487–491. Bibcode : 1988sci ... 239..487s . doi : 10.1126/science.239.4839.487 . PMID 2448875 .