Бороновая кислота

Бороновая кислота — органическое соединение, родственное борной кислоте ( B(OH) 3 ), в котором одна из трех гидроксильных групп ( −OH ) заменяется алкильной или арильной группой (представленной R в общей формуле R-B(OH) 2 ). [1] соединения, содержащие связь Таким образом, представители этого класса, как углерод-бор, принадлежат к более широкому классу органоборанов .
Бороновые кислоты действуют как кислоты Льюиса . Их уникальной особенностью является то, что они способны образовывать обратимые ковалентные комплексы с сахарами , аминокислотами , гидроксамовыми кислотами и т. д. (молекулы с вицинальными , (1,2) или иногда (1,3) замещенными донорами оснований Льюиса ( спирт , амин , карбоксилат)). P боронатные K a бороновой кислоты составляет ~ 9, но они могут образовывать тетраэдрические комплексы с p K a ~ 7. Иногда их используют в области молекулярного распознавания для связывания сахаридов с целью флуоресцентного обнаружения или селективного транспорта сахаридов через мембраны.
Бороновые кислоты широко используются в органической химии в качестве химических строительных блоков и промежуточных продуктов, преимущественно в соединениях Сузуки . Ключевой концепцией его химии является переметаллирование органических остатков в переходный металл.
Соединение бортезомиб с группой бороновой кислоты представляет собой препарат, используемый в химиотерапии . Атом бора в этой молекуле является ключевой субструктурой, поскольку с его помощью определенные протеасомы блокируются , которые в противном случае могли бы разрушить белки. Известно, что бороновые кислоты связываются с серинами активного центра и являются частью ингибиторов липазы поджелудочной железы свиней . [2] самый тонкий [3] и протеаза Kex2 . [4] Кроме того, производные бороновой кислоты представляют собой класс ингибиторов ацилпротеинтиоэстеразы человека 1 и 2, которые являются мишенями противораковых препаратов в цикле Ras . [5]
Функциональная группа бороновой кислоты считается обладающей низкой токсичностью. Это одна из причин популярности муфты Сузуки при разработке и синтезе фармацевтических средств. Однако недавно было обнаружено, что значительная часть широко используемых бороновых кислот и их производных дает положительный результат теста Эймса и действует как химические мутагены . Считается, что механизм мутагенности включает образование органических радикалов путем окисления бороновой кислоты кислородом воздуха. [6]
Структура и синтез
[ редактировать ]В 1860 году Эдвард Франкленд первым сообщил о получении и выделении бороновой кислоты. Этилбороновую кислоту синтезировали двухстадийным способом. Сначала диэтилцинк и триэтилборат прореагировали с образованием триэтилборана . Затем это соединение окисляется на воздухе с образованием этилбороновой кислоты. [7] [8] [9] В настоящее время широко используются несколько способов синтеза, и многие устойчивые на воздухе бороновые кислоты коммерчески доступны.
Бороновые кислоты обычно имеют высокие температуры плавления. Они склонны к образованию ангидридов за счет потери молекул воды, обычно с образованием циклических тримеров .
| Бороновая кислота | Р | Структура | Молярная масса | Номер CAS | Температура плавления °С |
|---|---|---|---|---|---|
| Фенилбороновая кислота | Фенил |  |
121.93 | 98-80-6 | 216–219 |
| 2-тиенилбороновая кислота | Тиофен |  |
127.96 | 6165-68-0 | 138–140 |
| Метилбороновая кислота | Метил |  |
59.86 | 13061-96-6 | 91–94 |
| цис -Пропенилбороновая кислота | пропен | 85.90 | 7547-96-8 | 65–70 | |
| транс -Пропенилбороновая кислота | пропен |  |
85.90 | 7547-97-9 | 123–127 |
Синтез
[ редактировать ]Бороновую кислоту можно получить несколькими способами. Наиболее распространенный путь — реакция металлоорганических соединений на основе лития или магния ( Гриньяра ) с эфирами борной кислоты . [10] [11] [12] [13] Например, фенилбороновую кислоту получают из фенилмагнийбромида и триметилбората с последующим гидролизом. [14]
- PhMgBr + B(OMe) 3 → PhB(OMe) 2 + MeOMgBr
- PhB(OMe) 2 + 2 H 2 O → PhB(OH) 2 + 2 MeOH
Другой метод - реакция арилсилана ( RSiR 3 ) с трибромидом бора (BBr 3 ) при переметаллировании до RBBr 2 с последующим кислотным гидролизом.
Третий метод заключается в катализируемой палладием реакции арилгалогенидов и трифлатов с диборониловыми эфирами в реакции сочетания, известной как реакция борилирования Мияуры . Альтернативой эфирам в этом методе является использование дибороновой кислоты или тетрагидроксидибора ([B(OH 2 )] 2 ). [15] [16] [17]
Эфиры бороновой кислоты (также называемые эфирами бороновой кислоты)
[ редактировать ]Эфиры бороновой кислоты представляют собой сложные эфиры, образующиеся между бороновой кислотой и спиртом.
| Сложный | Общая формула | Общая структура |
|---|---|---|
| Бороновая кислота | РБ(ОН) 2 |  |
| Бороновый эфир | РБ(ОР) 2 |  |
Соединения могут быть получены из эфиров борной кислоты. [18] конденсацией со спиртами и диолами . Фенилбороновая кислота может самоконденсироваться с образованием циклического тримера, называемого трифенилангидрид или трифенилбороксин. [19]
| Бороновый эфир | Диол | Структурная формула | Молярная масса | Номер CAS | Точка кипения (°С) |
|---|---|---|---|---|---|
| Эфир пинакола аллилборной кислоты | пинакол | 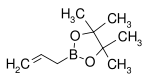 |
168.04 | 72824-04-5 | 50–53 (5 мм рт. ст.) |
| Эфир триметиленгликоля фенилборной кислоты | триметиленгликоль |  |
161.99 | 4406-77-3 | 106 (2 мм рт. ст.) |
| Диизопропоксиметилборан | изопропанол |  |
144.02 | 86595-27-9 | 105 -107 |
Соединения с 5-членной циклической структурой, содержащей связь C–O–B–O–C, называются диоксабороланами , а соединения с 6-членными кольцами – диоксаборинанами .
Применение органической химии
[ редактировать ]Реакция сцепления Сузуки
[ редактировать ]Бороновые кислоты используются в органической химии в реакции Сузуки . В этой реакции атом бора обменивает свою арильную группу на алкоксигруппу палладия.
| ( 1 ) |
Связь Чана – Лама
[ редактировать ]При сочетании Чана-Лама алкил, алкенил или арилбороновая кислота реагирует с соединением, содержащим N-H или O-H, с Cu (II), таким как ацетат меди (II) , и кислородом , а также основанием, таким как пиридин. [20] [21] образование новой связи углерод-азот или связи углерод-кислород , например, в этой реакции 2-пиридона с транс -1-гексенилбороновой кислотой:
Последовательность механизма реакции амина : депротонирование , координация амина до меди(II), трансметаллирование (перенос алкилборной группы на медь и ацетатной группы меди на бор), окисление Cu(II) до Cu(III). кислородом и, наконец, восстановительное отщепление Cu(III) до Cu(I) с образованием продукта. Прямое восстановительное отщепление Cu(II) до Cu(0) также имеет место, но происходит очень медленно. В каталитических системах кислород также регенерирует катализатор Cu(II).
Связь Либескинда – Шрогля
[ редактировать ]При сочетании Либескинда-Срогля сложный соединяется эфир тиола с бороновой кислотой с образованием кетона .
Сопряженное сложение
[ редактировать ]Органический остаток бороновой кислоты представляет собой нуклеофил при сопряженном присоединении также в сочетании с металлом. В одном исследовании пинаколовый эфир аллилбороновой кислоты подвергается реакции с дибензилиденацетоном по такому сопряженному присоединению: [22]
- Каталитическая трис система в этой реакции представляет собой (дибензилиденацетон)дипалладий(0) / трициклогексилфосфин .
Другое сопряженное присоединение - это присоединение граммина к фенилборной кислоте, катализируемое димером циклооктадиенхлорида родия : [23]
Окисление
[ редактировать ]Эфиры борной кислоты окисляются до соответствующих спиртов основанием и перекисью водорода (см. пример: карбеноид ).
Омологация
[ редактировать ]- При гомологизации эфира бороновой кислоты алкильная группа в боронате смещается от бора к углероду: [24]
-
Гомологизация эфира бороновой кислоты
-
Заявка на омологизацию
В этой реакции дихлорметиллитий превращает эфир бороновой кислоты в боронат. Затем кислота Льюиса вызывает перегруппировку алкильной группы со смещением группы хлора. Наконец, металлоорганический реагент, такой как реактив Гриньяра, эффективно замещает второй атом хлора, что приводит к внедрению группы RCH 2 в связь CB. Другой реакцией, характеризующейся миграцией боронатного алкила, является реакция Петасиса .
Электрофильные аллильные сдвиги
[ редактировать ]Аллилбороновые эфиры участвуют в электрофильных аллильных сдвигах, очень похожих на кремниевый кулон в реакции Сакураи . В одном исследовании реагент диаллилирования сочетает в себе оба [25] [примечание 1] :
Гидролиз
[ редактировать ]Гидролиз эфиров бороновой кислоты обратно до бороновой кислоты и спирта может быть осуществлен в некоторых системах с тионилхлоридом и пиридином . [26] Арилбороновые кислоты или сложные эфиры могут быть гидролизованы до соответствующих фенолов реакцией с гидроксиламином при комнатной температуре. [27]
Реакции сочетания C–H
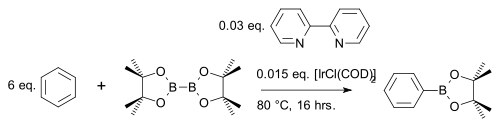
[ редактировать ]Соединение дибора бис(пинаколато)дибор. [28] реагирует с ароматическими гетероциклами [29] или простые арены [30] к сложному арилборонатному эфиру с иридиевым катализатором [IrCl(COD)] 2 (модификация катализатора Крэбтри ) и основанием 4,4'-ди-трет-бутил-2,2'-бипиридина в реакции сочетания CH , например, с бензолом :
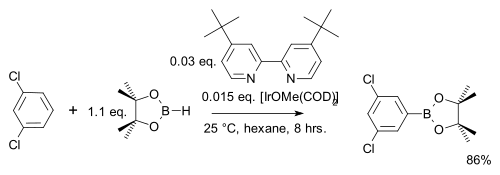
В одной модификации арен реагирует, используя только стехиометрический эквивалент, а не большой избыток с использованием более дешевого пинаколборана : [31]
В отличие от обычного электрофильного ароматического замещения (ЭАС), где электронные эффекты доминируют , региоселективность в этом типе реакции определяется исключительно стерической массой иридиевого комплекса. Это используется при метабромировании м -ксилола , которое по стандарту AES дает орто-продукт: [32] [примечание 2]
Протонолиз
[ редактировать ]Протодеборирование — это химическая реакция, включающая протонолиз бороновой кислоты (или другого органоборанового соединения), в которой связь углерод-бор разрывается и заменяется связью углерод-водород. Протодеборирование — это хорошо известная нежелательная побочная реакция катализируемыми металлами , часто связанная с реакциями сочетания, , в которых используются бороновые кислоты (см. Реакцию Сузуки ). Для данной бороновой кислоты склонность к протодеборонированию сильно варьируется и зависит от различных факторов, таких как используемые условия реакции и органический заместитель бороновой кислоты:

Супрамолекулярная химия
[ редактировать ]Распознавание сахаридов
[ редактировать ]
Ковалентное парное взаимодействие между бороновыми кислотами и гидроксильными группами , обнаруженное в спиртах и кислотах, является быстрым и обратимым в водных растворах . Равновесие, установленное между бороновыми кислотами и гидроксильными группами, присутствующими в сахаридах, было успешно использовано для разработки ряда сенсоров для сахаридов. [34] Одно из ключевых преимуществ этой динамической ковалентной стратегии. [35] заключается в способности бороновых кислот преодолевать проблему связывания нейтральных частиц в водных средах. Если все организовано правильно, введение третичного амина в эти супрамолекулярные системы позволит связыванию происходить при физиологическом pH и позволит механизмам передачи сигнала, таким как переносом электронов, эмиссия, опосредованная фотоиндуцированная флуоресцентная сообщать о событии связывания.
Потенциальные применения этого исследования включают системы мониторинга уровня глюкозы в крови, помогающие контролировать сахарный диабет. Поскольку в датчиках используется оптический отклик, мониторинг может быть достигнут с использованием минимально инвазивных методов. Одним из таких примеров является исследование контактной линзы , которая содержит сенсорную молекулу на основе бороновой кислоты для определения уровней глюкозы в глазных жидкостях . [36]
Примечания
[ редактировать ]- ^ В этой последовательности аллильный сдвиг эфира борной кислоты катализируется трифторидом бора . На втором этапе гидроксильная группа активируется как уходящая группа путем превращения в трифлат трифликовым ангидридом при помощи 2,6-лутидина . Конечным продуктом является винилциклопропан . Примечание: ee означает энантиомерный избыток.
- ^ Вторая стадия реакции боронатного эфира с бромидом меди (II) in situ.
Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Боровые кислоты ». два : 10.1351/goldbook.B00714
- ^ Гарнер, CW (10 июня 1980 г.). «Ингибиторы бороновой кислоты липазы поджелудочной железы свиней» . Журнал биологической химии . 255 (11): 5064–5068. дои : 10.1016/S0021-9258(19)70749-2 . ISSN 0021-9258 . ПМИД 7372625 .
- ^ Линдквист, Р.Н.; Терри, К. (январь 1974 г.). «Ингибирование субтилизина бороновыми кислотами, потенциальными аналогами промежуточных продуктов тетраэдрической реакции». Архив биохимии и биофизики . 160 (1): 135–144. дои : 10.1016/s0003-9861(74)80018-4 . ISSN 0003-9861 . ПМИД 4364061 .
- ^ Холиок, Тодд; Уилсон, Марк А.; Фенн, Тимоти Д.; Кеттнер, Чарльз А.; Пецко, Григорий А.; Фуллер, Роберт С.; Ринге, Дагмар (10 июня 2003 г.). «2.4 Кристаллическая структура разрешения прототипа протеазы Kex2, процессирующей гормоны, в комплексе с ингибитором бороновой кислоты Ala-Lys-Arg». Биохимия . 42 (22): 6709–6718. дои : 10.1021/bi034434t . ISSN 0006-2960 . ПМИД 12779325 .
- ^ Циммерманн, Тобиас Дж.; Бюргер, Марко; Таширо, Эцу; Кондо, Ясумицу; Мартинес, Нэнси Э.; Гёрмер, Кристина; Розин-Штайнер, Сигрид; Симидзу, Такеши; Одзаки, Шойчиро (2 января 2013 г.). «Ингибиторы ацилпротеинтиоэстеразы 1 и 2 на основе бора». ХимБиоХим . 14 (1): 115–122. дои : 10.1002/cbic.201200571 . ISSN 1439-7633 . ПМИД 23239555 . S2CID 205557212 .
- ^ Хансен, Марвин М.; Джолли, Роберт А.; Линдер, Райан Дж. (29 июля 2015 г.). «Боровые кислоты и производные - исследование взаимосвязи структура-активность на предмет мутагенности». Исследования и разработки органических процессов . 19 (11): 1507–1516. дои : 10.1021/acs.oprd.5b00150 . ISSN 1083-6160 .
- ^ Франкленд, Э.; Дуппа, Б.Ф. (1860). «Предварительное замечание о борэтиле» . «Анн» Юстуса Либиха. Chem. 115 (3): 319. doi : 10.1002/jlac.18601150324 .
- ^ Франкленд, Э.; Дуппа, Б. (1860). «О борном этиде» . Труды Королевского общества . 10 : 568–570. дои : 10.1098/rspl.1859.0112 .
- ^ Франкленд, Э. (1862). «О новом ряду органических соединений, содержащих бор» . Дж. Хим. Соц. 15 : 363–381. Бибкод : 1862RSPT..152..167F . дои : 10.1039/JS8621500363 .
- ^ Деннис Дж. Холл, изд. (2005). Бороновая кислота . Уайли. ISBN 978-3-527-30991-7 .
- ^ Пример: Кристенсен, Йеспер Ланггаард; Лисен, Мортен; Ведсё, Пер; Бегтруп, Микаэль (2005). «Синтез ортозамещенных арилбороновых эфиров путем захвата in situ нестабильных литиевых промежуточных продуктов: этилового эфира 2-(5,5-диметил-1,3,2-диоксаборинан-2-ил)бензойной кислоты». Органические синтезы . 81 :134 ; Сборник томов , т. 11, стр. 1015 prep= v81p0134 .
- ^ Пример: Ли, Вэньцзе; Нельсон, Дориан П.; Дженсен, Марк С.; Скотт Херрнер, Р.; Цай, Дунвэй; Ларсен, Роберт Д. (2005). «Синтез 3-пиридилбороновой кислоты и ее пинаколового эфира. Применение 3-пиридилбороновой кислоты в соединении Сузуки для получения 3-пиридин-3-илхинолина» . Органические синтезы . 81:89 ; Сборник томов , т. 11, с. 393 .
- ^ Шаретт, Андре Б.; Лебель, Элен (1999). «(2S , 3S ) -(+)-(3-Фенилциклопропил)метанол» . Органические синтезы . 76:86 ; Сборник томов , т. 10, с. 613 .
- ^ Уошберн, Роберт М.; Левенс, Эрнест; Олбрайт, Чарльз Ф.; Биллиг, Франклин А. (1959). «Бензолборный ангидрид» . Органические синтезы . 39 :3 ; Сборник томов , т. 4, с. 68 .
- ^ Пиларски, Лукаш Т.; Сабо, Кальман Дж. (2011). «Палладий-катализируемый прямой синтез борорганических кислот». Angewandte Chemie, международное издание . 50 (36): 8230–8232. дои : 10.1002/anie.201102384 . ПМИД 21721088 .
- ^ Моландер, Гэри А.; Трайс, Сара Эл.Дж.; Дреер, Спенсер Д. (2010). «Прямой синтез бороновой кислоты из арилхлоридов, катализируемый палладием: упрощенный путь к различным производным боронатных эфиров» . Журнал Американского химического общества . 132 (50): 17701–17703. дои : 10.1021/ja1089759 . ПМК 3075417 . ПМИД 21105666 .
- ^ Исияма, Тацуо; Мурата, Мики; Мияура, Норио (1 ноября 1995 г.). «Реакция кросс-сочетания алкоксидибора с галоаренами, катализируемая палладием (0): прямой метод получения арилбороновых эфиров». Журнал органической химии . 60 (23): 7508–7510. дои : 10.1021/jo00128a024 . S2CID 98029876 .
- ^ Кидвелл, РЛ; Мерфи, М.; Дарлинг, С.Д. (1969). «Фенолы: 6-Метокси-2-Нафтол» . Органические синтезы . 49:90 ; Сборник томов , т. 5, с. 918 .
- ^ Уошберн, Роберт М.; Левенс, Эрнест; Олбрайт, Чарльз Ф.; Биллиг, Франклин А. (1959). «Бензолборный ангидрид» . Органические синтезы . 39 :3 ; Сборник томов , т. 4, с. 68 .
- ^ Чан, Доминик М.Т. (2003). «Медь способствует перекрестному связыванию связей C–N и C–O с фенилом и пиридилборонатами». Буквы тетраэдра . 44 (19): 3863–3865. дои : 10.1016/S0040-4039(03)00739-1 .
- ^ Лам, Патрик Ю.С. (2003). «Кросс-сочетание связей C – N и C – O с промотированием меди / катализируемое с винилборной кислотой и его применение». Буквы тетраэдра . 44 (26): 4927–4931. дои : 10.1016/S0040-4039(03)01037-2 .
- ^ Зибер, Джошуа Д. (2007). «Каталитическое сопряженное присоединение аллильных групп к стирил-активированным енонам». Журнал Американского химического общества . 129 (8): 2214–2215. CiteSeerX 10.1.1.624.3153 . дои : 10.1021/ja067878w . ПМИД 17266312 .
- ^ Габриэла (2007). «Бензильное замещение граминов бороновой кислотой и родиевыми или иридиевыми катализаторами †». Органические письма . 9 (6): 961–964. дои : 10.1021/ol063042m . ПМИД 17305348 .
- ^ Маттесон, Дональд С. (1986). «99% хирально-селективный синтез с помощью бороновых эфиров пинандиола: феромоны насекомых, диолы и аминоспирт». Журнал Американского химического общества . 108 (4): 810–819. дои : 10.1021/ja00264a039 .
- ^ Пэн, Фэн (2007). «Простые, стабильные и универсальные реагенты двойного аллилирования для стереоселективного получения скелетно разнообразных соединений». Журнал Американского химического общества . 129 (11): 3070–3071. дои : 10.1021/ja068985t . ПМИД 17315879 .
- ^ Маттесон, Дональд С. (2003). «Новые асимметричные синтезы с эфирами бороновой кислоты и фторборанами» (PDF) . Чистое приложение. Хим . 75 (9): 1249–1253. дои : 10.1351/pac200375091249 . S2CID 15944330 .
- ^ Кианмер, Эбрагим; Яхьяи, Марьям; Табатабай, Катаюн (2007). «Мягкое преобразование арилбороновых кислот и их пинаколилборонатных эфиров в фенолы с использованием гидроксиламина». Буквы тетраэдра . 48 (15): 2713–2715. дои : 10.1016/j.tetlet.2007.02.069 .
- ^ Исияма, Тацуо; Мурата, Микки; Ахико, Така-аки; Мияура, Норио (2000). «Бис(пиналат)дибор » Органические синтезы . 77 :176 ; Сборник томов , т. 10, с. 115 .
- ^ Такаги, Джун (2002). «Катализируемая иридием реакция сочетания C–H гетероароматических соединений с бис (пинаколато) дибором: региоселективный синтез гетероарилборонатов». Буквы тетраэдра . 43 (32): 5649–5651. дои : 10.1016/S0040-4039(02)01135-8 . hdl : 2115/56222 .
- ^ Исияма, Тацуо (2002). «Мягкое иридий-катализируемое борилирование аренов. Высокие числа оборотов, реакции при комнатной температуре и выделение потенциального промежуточного продукта». Журнал Американского химического общества . 124 (3): 390–391. дои : 10.1021/ja0173019 . ПМИД 11792205 .
- ^ Исияма, Тацуо (2003). «Борилирование аренов и гетероаренов при комнатной температуре с использованием стехиометрических количеств пинаколборана, катализируемое комплексами иридия в инертном растворителе». Химические коммуникации (23): 2924–5. дои : 10.1039/b311103b . hdl : 2115/56377 . ПМИД 14680243 . S2CID 34802662 .
- ^ Мерфи, Жаклин М. (2007). «Метагалогенирование 1,3-дизамещенных аренов посредством иридий-катализируемого борилирования аренов». Журнал Американского химического общества . 129 (50): 15434–15435. дои : 10.1021/ja076498n . ПМИД 18027947 .
- ^ Чжао, Цзяньчжан; Дэвидсон, Мэтью Г.; Махон, Мэри Ф.; Кочок-Кён, Габриэле; Джеймс, Тони Д. (2004). «Энантиоселективный флуоресцентный датчик сахарных кислот». Дж. Ам. хим. Соц . 126 (49): 16179–16186. дои : 10.1021/ja046289s . ПМИД 15584754 .
- ^ Джеймс, Тони Д.; Филлипс, Маркус Д.; Синкай, Сейджи (2006). Бороновые кислоты в распознавании сахаридов . дои : 10.1039/9781847557612 . ISBN 978-0-85404-537-2 .
- ^ Роуэн, Стюарт Дж .; Кантрилл, Стюарт Дж.; Казинс, Грэм Р.Л.; Сандерс, Джереми К.М.; Стоддарт, Дж. Фрейзер (2002). «Динамическая ковалентная химия». Angewandte Chemie, международное издание . 41 (6): 898–952. doi : 10.1002/1521-3773(20020315)41:6<898::AID-ANIE898>3.0.CO;2-E . ПМИД 12491278 .
- ^ США 6850786 , Wayne Front March, «Окулярный датчик аналита», выдан 1 февраля 2005 г.
![Реакция Сузуки {\displaystyle {\begin{matrix}{}\\{\ce {{R1-BY2}+R2-X->[{\underset {\text{catalyst}}{\text{Pd}}}][{ \text{Base}}]R1-R2}}\\{}\end{матрица}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35df36f38fec8abbc8e9d1d9f04e9b2687ae245)