Тканевая инженерия
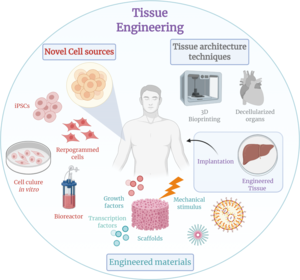
Тканевая инженерия — это биомедицинская инженерная дисциплина, которая использует сочетание клеток , инженерных методов , материалов и подходящих биохимических и физико-химических факторов для восстановления, поддержания, улучшения или замены различных типов биологических тканей. Тканевая инженерия часто предполагает использование клеток, помещенных на тканевые каркасы , для формирования новой жизнеспособной ткани в медицинских целях, но не ограничивается применениями, включающими клетки и тканевые каркасы. Хотя когда-то это направление было отнесено к категории биоматериалов , с ростом масштабов и важности оно может рассматриваться как отдельная область. [ 1 ]
Хотя большинство определений тканевой инженерии охватывают широкий спектр применений, на практике этот термин тесно связан с применениями, которые восстанавливают или заменяют части или целые ткани (т.е. органы , кости , хрящи , [ 2 ] кровеносные сосуды , мочевой пузырь , кожа , мышцы и т. д.). Часто задействованным тканям для правильного функционирования требуются определенные механические и структурные свойства. Этот термин также применялся к усилиям по выполнению определенных биохимических функций с использованием клеток в искусственно созданной системе поддержки (например, искусственной поджелудочной железы или биоискусственной печени ). Термин «регенеративная медицина» часто используется как синоним тканевой инженерии, хотя те, кто занимается регенеративной медициной, уделяют больше внимания использованию стволовых клеток или клеток-предшественников для производства тканей.
Overview
[edit]
A commonly applied definition of tissue engineering, as stated by Langer[3] and Vacanti,[4] is "an interdisciplinary field that applies the principles of engineering and life sciences toward the development of biological substitutes that restore, maintain, or improve [Biological tissue] function or a whole organ".[5] In addition, Langer and Vacanti also state that there are three main types of tissue engineering: cells, tissue-inducing substances, and a cells + matrix approach (often referred to as a scaffold). Tissue engineering has also been defined as "understanding the principles of tissue growth, and applying this to produce functional replacement tissue for clinical use".[6] A further description goes on to say that an "underlying supposition of tissue engineering is that the employment of natural biology of the system will allow for greater success in developing therapeutic strategies aimed at the replacement, repair, maintenance, or enhancement of tissue function".[6]
Developments in the multidisciplinary field of tissue engineering have yielded a novel set of tissue replacement parts and implementation strategies. Scientific advances in biomaterials, stem cells, growth and differentiation factors, and biomimetic environments have created unique opportunities to fabricate or improve existing tissues in the laboratory from combinations of engineered extracellular matrices ("scaffolds"), cells, and biologically active molecules. Among the major challenges now facing tissue engineering is the need for more complex functionality, biomechanical stability, and vascularization in laboratory-grown tissues destined for transplantation.[7]
Etymology
[edit]The historic origin of the term is unclear as the definition of the word has changed throughout the past few decades. The term first appeared in a 1984 publication that described the organization of an endothelium-like membrane on the surface of a long-implanted, synthetic ophthalmic prosthesis.[8]
The first modern use of the term as recognized today was in 1985 by the researcher, physiologist and bioengineer Yuan-Cheng Fung of the Engineering Research Center. He proposed the joining of the terms tissue (in reference to the fundamental relationship between cells and organs) and engineering (in reference to the field of modification of said tissues). The term was officially adopted in 1987.[8]
History
[edit]Ancient era (pre-17th century)
[edit]A rudimentary understanding of the inner workings of human tissues may date back further than most would expect. As early as the Neolithic period, sutures were being used to close wounds and aid in healing. Later on, societies such as ancient Egypt developed better materials for sewing up wounds such as linen sutures. Around 2500 BC in ancient India, skin grafts were developed by cutting skin from the buttock and suturing it to wound sites in the ear, nose, or lips. Ancient Egyptians often would graft skin from corpses onto living humans and even attempted to use honey as a type of antibiotic and grease as a protective barrier to prevent infection. In the 1st and 2nd centuries AD, Gallo-Romans developed wrought iron implants and dental implants could be found in ancient Mayans.
Enlightenment (17th century–19th century)
[edit]While these ancient societies had developed techniques that were way ahead of their time, they still lacked a mechanistic understanding of how the body was reacting to these procedures. This mechanistic approach came along in tandem with the development of the empirical method of science pioneered by René Descartes. Sir Isaac Newton began to describe the body as a "physiochemical machine" and postured that disease was a breakdown in the machine.
In the 17th century, Robert Hooke discovered the cell and a letter from Benedict de Spinoza brought forward the idea of the homeostasis between the dynamic processes in the body. Hydra experiments performed by Abraham Trembley in the 18th century began to delve into the regenerative capabilities of cells. During the 19th century, a better understanding of how different metals reacted with the body led to the development of better sutures and a shift towards screw and plate implants in bone fixation. Further, it was first hypothesized in the mid-1800s that cell-environment interactions and cell proliferation were vital for tissue regeneration.
Modern era (20th and 21st centuries)
[edit]As time progresses and technology advances, there is a constant need for change in the approach researchers take in their studies. Tissue engineering has continued to evolve over centuries. In the beginning people used to look at and use samples directly from human or animal cadavers. Now, tissue engineers have the ability to remake many of the tissues in the body through the use of modern techniques such as microfabrication and three-dimensional bioprinting in conjunction with native tissue cells/stem cells. These advances have allowed researchers to generate new tissues in a much more efficient manner. For example, these techniques allow for more personalization which allow for better biocompatibility, decreased immune response, cellular integration, and longevity. There is no doubt that these techniques will continue to evolve, as we have continued to see microfabrication and bioprinting evolve over the past decade.
In 1960, Wichterle and Lim were the first to publish experiments on hydrogels for biomedical applications by using them in contact lens construction. Work on the field developed slowly over the next two decades, but later found traction when hydrogels were repurposed for drug delivery. In 1984, Charles Hull developed bioprinting by converting a Hewlett-Packard inkjet printer into a device capable of depositing cells in 2-D. Three dimensional (3-D) printing is a type of additive manufacturing which has since found various applications in medical engineering, due to its high precision and efficiency. With biologist James Thompson's development of first human stem cell lines in 1998 followed by transplantation of first laboratory-grown internal organs in 1999 and creation of the first bioprinter in 2003 by the University of Missouri when they printed spheroids without the need of scaffolds, 3-D bioprinting became more conventionally used in medical field than ever before. So far, scientists have been able to print mini organoids and organs-on-chips that have rendered practical insights into the functions of a human body. Pharmaceutical companies are using these models to test drugs before moving on to animal studies. However, a fully functional and structurally similar organ has not been printed yet. A team at University of Utah has reportedly printed ears and successfully transplanted those onto children born with defects that left their ears partially developed.
Today hydrogels are considered the preferred choice of bio-inks for 3-D bioprinting since they mimic cells' natural ECM while also containing strong mechanical properties capable of sustaining 3-D structures. Furthermore, hydrogels in conjunction with 3-D bioprinting allow researchers to produce different scaffolds which can be used to form new tissues or organs. 3-D printed tissues still face many challenges such as adding vasculature. Meanwhile, 3-D printing parts of tissues definitely will improve our understanding of the human body, thus accelerating both basic and clinical research.
Examples
[edit]
As defined by Langer and Vacanti,[5] examples of tissue engineering fall into one or more of three categories: "just cells," "cells and scaffold," or "tissue-inducing factors."
- In vitro meat: Edible artificial animal muscle tissue cultured in vitro.
- Bioartificial liver device, "Temporary Liver", Extracorporeal Liver Assist Device (ELAD): The human hepatocyte cell line (C3A line) in a hollow fiber bioreactor can mimic the hepatic function of the liver for acute instances of liver failure. A fully capable ELAD would temporarily function as an individual's liver, thus avoiding transplantation and allowing regeneration of their own liver.
- Artificial pancreas: Research involves using islet cells to regulate the body's blood sugar, particularly in cases of diabetes . Biochemical factors may be used to cause human pluripotent stem cells to differentiate (turn into) cells that function similarly to beta cells, which are in an islet cell in charge of producing insulin.
- Artificial bladders: Anthony Atala[9] (Wake Forest University) has successfully implanted artificial bladders, constructed of cultured cells seeded onto a bladder-shaped scaffold, into seven out of approximately 20 human test subjects as part of a long-term experiment.[10]
- Cartilage: lab-grown cartilage, cultured in vitro on a scaffold, was successfully used as an autologous transplant to repair patients' knees.[11]
- Scaffold-free cartilage: Cartilage generated without the use of exogenous scaffold material. In this methodology, all material in the construct is cellular produced directly by the cells.[12]
- Bioartificial heart: Doris Taylor's lab constructed a biocompatible rat heart by re-cellularising a de-cellularised rat heart. This scaffold and cells were placed in a bioreactor, where it matured to become a partially or fully transplantable organ.[13] the work was called a "landmark". The lab first stripped the cells away from a rat heart (a process called "decellularization") and then injected rat stem cells into the decellularized rat heart.[14]
- Tissue-engineered blood vessels:[15] Blood vessels that have been grown in a lab and can be used to repair damaged blood vessels without eliciting an immune response. Tissue engineered blood vessels have been developed by many different approaches. They could be implanted as pre-seeded cellularized blood vessels,[16] as acellular vascular grafts made with decellularized vessels or synthetic vascular grafts.[17]
- Artificial skin constructed from human skin cells embedded in a hydrogel, such as in the case of bio-printed constructs for battlefield burn repairs.[18]
- Artificial bone marrow: Bone marrow cultured in vitro to be transplanted serves as a "just cells" approach to tissue engineering.[19]
- Tissue engineered bone: A structural matrix can be composed of metals such as titanium, polymers of varying degradation rates, or certain types of ceramics.[20] Materials are often chosen to recruit osteoblasts to aid in reforming the bone and returning biological function.[21] Various types of cells can be added directly into the matrix to expedite the process.[20]
- Laboratory-grown penis: Decellularized scaffolds of rabbit penises were recellularised with smooth muscle and endothelial cells. The organ was then transplanted to live rabbits and functioned comparably to the native organ, suggesting potential as treatment for genital trauma.[22]
- Oral mucosa tissue engineering uses a cells and scaffold approach to replicate the 3 dimensional structure and function of oral mucosa.
Cells as building blocks
[edit]
Cells are one of the main components for the success of tissue engineering approaches. Tissue engineering uses cells as strategies for creation/replacement of new tissue. Examples include fibroblasts used for skin repair or renewal,[23] chondrocytes used for cartilage repair (MACI–FDA approved product), and hepatocytes used in liver support systems
Cells can be used alone or with support matrices for tissue engineering applications. An adequate environment for promoting cell growth, differentiation, and integration with the existing tissue is a critical factor for cell-based building blocks.[24] Manipulation of any of these cell processes create alternative avenues for the development of new tissue (e.g., cell reprogramming - somatic cells, vascularization).
Isolation
[edit]Techniques for cell isolation depend on the cell source. Centrifugation and apheresis are techniques used for extracting cells from biofluids (e.g., blood). Whereas digestion processes, typically using enzymes to remove the extracellular matrix (ECM), are required prior to centrifugation or apheresis techniques to extract cells from tissues/organs. Trypsin and collagenase are the most common enzymes used for tissue digestion. While trypsin is temperature dependent, collagenase is less sensitive to changes in temperature.
Cell sources
[edit]
Primary cells are those directly isolated from host tissue. These cells provide an ex-vivo model of cell behavior without any genetic, epigenetic, or developmental changes; making them a closer replication of in-vivo conditions than cells derived from other methods.[25] This constraint however, can also make studying them difficult. These are mature cells, often terminally differentiated, meaning that for many cell types proliferation is difficult or impossible. Additionally, the microenvironments these cells exist in are highly specialized, often making replication of these conditions difficult.[26]
Secondary cells A portion of cells from a primary culture is moved to a new repository/vessel to continue being cultured. Medium from the primary culture is removed, the cells that are desired to be transferred are obtained, and then cultured in a new vessel with fresh growth medium.[citation needed] A secondary cell culture is useful in order to ensure that cells have both the room and nutrients that they require to grow. Secondary cultures are most notably used in any scenario in which a larger quantity of cells than can be found in the primary culture is desired. Secondary cells share the constraints of primary cells (see above) but have an added risk of contamination when transferring to a new vessel.
Genetic classifications of cells
[edit]Autologous: The donor and the recipient of the cells are the same individual. Cells are harvested, cultured or stored, and then reintroduced to the host. As a result of the host's own cells being reintroduced, an antigenic response is not elicited. The body's immune system recognizes these re-implanted cells as its own, and does not target them for attack. Autologous cell dependence on host cell health and donor site morbidity may be deterrents to their use. Adipose-derived and bone marrow-derived mesenchymal stem cells are commonly autologous in nature, and can be used in a myriad of ways, from helping repair skeletal tissue to replenishing beta cells in diabetic patients.[27][28][29][30]
Allogenic: Cells are obtained from the body of a donor of the same species as the recipient. While there are some ethical constraints to the use of human cells for in vitro studies (i.e. human brain tissue chimera development[31]), the employment of dermal fibroblasts from human foreskin demonstrates an immunologically safe and thus a viable choice for allogenic tissue engineering of the skin.
Xenogenic: These cells are derived isolated cells from alternate species from the recipient. A notable example of xenogeneic tissue utilization is cardiovascular implant construction via animal cells. Chimeric human-animal farming raises ethical concerns around the potential for improved consciousness from implanting human organs in animals.[32]
Syngeneic or isogenic: These cells describe those borne from identical genetic code. This imparts an immunologic benefit similar to autologous cell lines (see above).[33] Autologous cells can be considered syngenic, but the classification also extends to non-autologously derived cells such as those from an identical twin, from genetically identical (cloned) research models, or induced stem cells (iSC)[34] as related to the donor.
Stem cells
[edit]Stem cells are undifferentiated cells with the ability to divide in culture and give rise to different forms of specialized cells. Stem cells are divided into "adult" and "embryonic" stem cells according to their source. While there is still a large ethical debate related to the use of embryonic stem cells, it is thought that another alternative source – induced pluripotent stem cells – may be useful for the repair of diseased or damaged tissues, or may be used to grow new organs.
Totipotent cells are stem cells which can divide into further stem cells or differentiate into any cell type in the body, including extra-embryonic tissue.
Pluripotent cells are stem cells which can differentiate into any cell type in the body except extra-embryonic tissue. induced pluripotent stem cells (iPSCs) are subclass of pluripotent stem cells resembling embryonic stem cells (ESCs) that have been derived from adult differentiated cells. iPSCs are created by altering the expression of transcriptional factors in adult cells until they become like embryonic stem cells.[citation needed]
Multipotent stem cells can be differentiated into any cell within the same class, such as blood or bone. A common example of multipotent cells is Mesenchymal stem cells (MSCs).
Scaffolds
[edit]Scaffolds are materials that have been engineered to cause desirable cellular interactions to contribute to the formation of new functional tissues for medical purposes. Cells are often 'seeded' into these structures capable of supporting three-dimensional tissue formation. Scaffolds mimic the extracellular matrix of the native tissue, recapitulating the in vivo milieu and allowing cells to influence their own microenvironments. They usually serve at least one of the following purposes: allowing cell attachment and migration, delivering and retaining cells and biochemical factors, enabling diffusion of vital cell nutrients and expressed products, and exerting certain mechanical and biological influences to modify the behaviour of the cell phase.
In 2009, an interdisciplinary team led by the thoracic surgeon Thorsten Walles implanted the first bioartificial transplant that provides an innate vascular network for post-transplant graft supply successfully into a patient awaiting tracheal reconstruction.[35]

To achieve the goal of tissue reconstruction, scaffolds must meet some specific requirements. High porosity and adequate pore size are necessary to facilitate cell seeding and diffusion throughout the whole structure of both cells and nutrients. Biodegradability is often an essential factor since scaffolds should preferably be absorbed by the surrounding tissues without the necessity of surgical removal. The rate at which degradation occurs has to coincide as much as possible with the rate of tissue formation: this means that while cells are fabricating their own natural matrix structure around themselves, the scaffold is able to provide structural integrity within the body and eventually it will break down leaving the newly formed tissue which will take over the mechanical load. Injectability is also important for clinical uses. Recent research on organ printing is showing how crucial a good control of the 3D environment is to ensure reproducibility of experiments and offer better results.
Materials
[edit]Material selection is an essential aspect of producing a scaffold. The materials utilized can be natural or synthetic and can be biodegradable or non-biodegradable. Additionally, they must be biocompatible, meaning that they do not cause any adverse effects to cells.[37] Silicone, for example, is a synthetic, non-biodegradable material commonly used as a drug delivery material,[38][39] while gelatin is a biodegradable, natural material commonly used in cell-culture scaffolds[40][41][42]
The material needed for each application is different, and dependent on the desired mechanical properties of the material. Tissue engineering of long bone defects for example, will require a rigid scaffold with a compressive strength similar to that of cortical bone (100-150 MPa), which is much higher compared to a scaffold for skin regeneration.[43][44]
There are a few versatile synthetic materials used for many different scaffold applications. One of these commonly used materials is polylactic acid (PLA), a synthetic polymer. PLA – polylactic acid. This is a polyester which degrades within the human body to form lactic acid, a naturally occurring chemical which is easily removed from the body. Similar materials are polyglycolic acid (PGA) and polycaprolactone (PCL): their degradation mechanism is similar to that of PLA, but PCL degrades slower and PGA degrades faster.[citation needed] PLA is commonly combined with PGA to create poly-lactic-co-glycolic acid (PLGA). This is especially useful because the degradation of PLGA can be tailored by altering the weight percentages of PLA and PGA: More PLA – slower degradation, more PGA – faster degradation. This tunability, along with its biocompatibility, makes it an extremely useful material for scaffold creation.[45]
Scaffolds may also be constructed from natural materials: in particular different derivatives of the extracellular matrix have been studied to evaluate their ability to support cell growth. Protein based materials – such as collagen, or fibrin, and polysaccharidic materials- like chitosan[46] or glycosaminoglycans (GAGs), have all proved suitable in terms of cell compatibility. Among GAGs, hyaluronic acid, possibly in combination with cross linking agents (e.g. glutaraldehyde, water-soluble carbodiimide, etc.), is one of the possible choices as scaffold material. Due to the covalent attachment of thiol groups to these polymers, they can crosslink via disulfide bond formation.[47] The use of thiolated polymers (thiomers) as scaffold material for tissue engineering was initially introduced at the 4th Central European Symposium on Pharmaceutical Technology in Vienna 2001.[48] As thiomers are biocompatible, exhibit cellular mimicking properties and efficiently support proliferation and differentiation of various cell types, they are extensively used as scaffolds for tissue engineering.[49][50][51] Furthermore thiomers such as thiolated hyaluronic acid[52] and thiolated chitosan[53] were shown to exhibit wound healing properties and are subject of numerous clinical trials.[54] Additionally, a fragment of an extracellular matrix protein, such as the RGD peptide, can be coupled to a non-bioactive material to promote cell attachment.[55] Another form of scaffold is decellularized tissue. This is a process where chemicals are used to extracts cells from tissues, leaving just the extracellular matrix. This has the benefit of a fully formed matrix specific to the desired tissue type. However, the decellurised scaffold may present immune problems with future introduced cells.
Synthesis
[edit]

A number of different methods have been described in the literature for preparing porous structures to be employed as tissue engineering scaffolds. Each of these techniques presents its own advantages, but none are free of drawbacks.
Nanofiber self-assembly
[edit]Molecular self-assembly is one of the few methods for creating biomaterials with properties similar in scale and chemistry to that of the natural in vivo extracellular matrix (ECM), a crucial step toward tissue engineering of complex tissues.[56] Moreover, these hydrogel scaffolds have shown superiority in in vivo toxicology and biocompatibility compared to traditional macro-scaffolds and animal-derived materials.
Textile technologies
[edit]These techniques include all the approaches that have been successfully employed for the preparation of non-woven meshes of different polymers. In particular, non-woven polyglycolide structures have been tested for tissue engineering applications: such fibrous structures have been found useful to grow different types of cells. The principal drawbacks are related to the difficulties in obtaining high porosity and regular pore size.
Solvent casting and particulate leaching
[edit]Solvent casting and particulate leaching (SCPL) allows for the preparation of structures with regular porosity, but with limited thickness. First, the polymer is dissolved into a suitable organic solvent (e.g. polylactic acid could be dissolved into dichloromethane), then the solution is cast into a mold filled with porogen particles. Such porogen can be an inorganic salt like sodium chloride, crystals of saccharose, gelatin spheres or paraffin spheres. The size of the porogen particles will affect the size of the scaffold pores, while the polymer to porogen ratio is directly correlated to the amount of porosity of the final structure. After the polymer solution has been cast the solvent is allowed to fully evaporate, then the composite structure in the mold is immersed in a bath of a liquid suitable for dissolving the porogen: water in the case of sodium chloride, saccharose and gelatin or an aliphatic solvent like hexane for use with paraffin. Once the porogen has been fully dissolved, a porous structure is obtained. Other than the small thickness range that can be obtained, another drawback of SCPL lies in its use of organic solvents which must be fully removed to avoid any possible damage to the cells seeded on the scaffold.
Gas foaming
[edit]To overcome the need to use organic solvents and solid porogens, a technique using gas as a porogen has been developed. First, disc-shaped structures made of the desired polymer are prepared by means of compression molding using a heated mold. The discs are then placed in a chamber where they are exposed to high pressure CO2 for several days. The pressure inside the chamber is gradually restored to atmospheric levels. During this procedure the pores are formed by the carbon dioxide molecules that abandon the polymer, resulting in a sponge-like structure. The main problems resulting from such a technique are caused by the excessive heat used during compression molding (which prohibits the incorporation of any temperature labile material into the polymer matrix) and by the fact that the pores do not form an interconnected structure.
Emulsification freeze-drying
[edit]This technique does not require the use of a solid porogen like SCPL. First, a synthetic polymer is dissolved into a suitable solvent (e.g. polylactic acid in dichloromethane) then water is added to the polymeric solution and the two liquids are mixed in order to obtain an emulsion. Before the two phases can separate, the emulsion is cast into a mold and quickly frozen by means of immersion into liquid nitrogen. The frozen emulsion is subsequently freeze-dried to remove the dispersed water and the solvent, thus leaving a solidified, porous polymeric structure. While emulsification and freeze-drying allow for a faster preparation when compared to SCPL (since it does not require a time-consuming leaching step), it still requires the use of solvents. Moreover, pore size is relatively small and porosity is often irregular. Freeze-drying by itself is also a commonly employed technique for the fabrication of scaffolds. In particular, it is used to prepare collagen sponges: collagen is dissolved into acidic solutions of acetic acid or hydrochloric acid that are cast into a mold, frozen with liquid nitrogen and then lyophilized.
Thermally induced phase separation
[edit]Similar to the previous technique, the TIPS phase separation procedure requires the use of a solvent with a low melting point that is easy to sublime. For example, dioxane could be used to dissolve polylactic acid, then phase separation is induced through the addition of a small quantity of water: a polymer-rich and a polymer-poor phase are formed. Following cooling below the solvent melting point and some days of vacuum-drying to sublime the solvent, a porous scaffold is obtained. Liquid-liquid phase separation presents the same drawbacks of emulsification/freeze-drying.[57]
Electrospinning
[edit]Electrospinning is a highly versatile technique that can be used to produce continuous fibers ranging in diameter from a few microns to a few nanometers. In a typical electrospinning set-up, the desired scaffold material is dissolved within a solvent and placed within a syringe. This solution is fed through a needle and a high voltage is applied to the tip and to a conductive collection surface. The buildup of electrostatic forces within the solution causes it to eject a thin fibrous stream towards the oppositely charged or grounded collection surface. During this process the solvent evaporates, leaving solid fibers leaving a highly porous network. This technique is highly tunable, with variation to solvent, voltage, working distance (distance from the needle to collection surface), flow rate of solution, solute concentration, and collection surface. This allows for precise control of fiber morphology.
On a commercial level however, due to scalability reasons, there are 40 or sometimes 96 needles involved operating at once. The bottle-necks in such set-ups are: 1) Maintaining the aforementioned variables uniformly for all of the needles and 2) formation of "beads" in single fibers that we as engineers, want to be of a uniform diameter. By modifying variables such as the distance to collector, magnitude of applied voltage, or solution flow rate – researchers can dramatically change the overall scaffold architecture.
Historically, research on electrospun fibrous scaffolds dates back to at least the late 1980s when Simon showed that electrospinning could be used to produce nano- and submicron-scale fibrous scaffolds from polymer solutions specifically intended for use as in vitro cell and tissue substrates. This early use of electrospun lattices for cell culture and tissue engineering showed that various cell types would adhere to and proliferate upon polycarbonate fibers. It was noted that as opposed to the flattened morphology typically seen in 2D culture, cells grown on the electrospun fibers exhibited a more rounded 3-dimensional morphology generally observed of tissues in vivo.[58]
CAD/CAM technologies
[edit]Because most of the above techniques are limited when it comes to the control of porosity and pore size, computer assisted design and manufacturing techniques have been introduced to tissue engineering. First, a three-dimensional structure is designed using CAD software. The porosity can be tailored using algorithms within the software.[59] The scaffold is then realized by using ink-jet printing of polymer powders or through Fused Deposition Modeling of a polymer melt.[60]
A 2011 study by El-Ayoubi et al. investigated "3D-plotting technique to produce (biocompatible and biodegradable) poly-L-Lactide macroporous scaffolds with two different pore sizes" via solid free-form fabrication (SSF) with computer-aided-design (CAD), to explore therapeutic articular cartilage replacement as an "alternative to conventional tissue repair".[61] The study found the smaller the pore size paired with mechanical stress in a bioreactor (to induce in vivo-like conditions), the higher the cell viability in potential therapeutic functionality via decreasing recovery time and increasing transplant effectiveness.[61]
Laser-assisted bioprinting
[edit]In a 2012 study,[62] Koch et al. focused on whether Laser-assisted BioPrinting (LaBP) can be used to build multicellular 3D patterns in natural matrix, and whether the generated constructs are functioning and forming tissue. LaBP arranges small volumes of living cell suspensions in set high-resolution patterns.[62] The investigation was successful, the researchers foresee that "generated tissue constructs might be used for in vivo testing by implanting them into animal models" (14). As of this study, only human skin tissue has been synthesized, though researchers project that "by integrating further cell types (e.g. melanocytes, Schwann cells, hair follicle cells) into the printed cell construct, the behavior of these cells in a 3D in vitro microenvironment similar to their natural one can be analyzed", which is useful for drug discovery and toxicology studies.[62]
Self-assembled recombinant spider silk nanomembranes
[edit]Gustafsson et al.[63] demonstrated free‐standing, bioactive membranes of cm-sized area, but only 250 nm thin, that were formed by self‐assembly of spider silk at the interface of an aqueous solution. The membranes uniquely combine nanoscale thickness, biodegradability, ultrahigh strain and strength, permeability to proteins and promote rapid cell adherence and proliferation. They demonstrated growing a coherent layer of keratinocytes. These spider silk nanomembranes have also been used to create a static in-vitro model of a blood vessel.[64]
Tissue engineering in situ
[edit]In situ tissue regeneration is defined as the implantation of biomaterials (alone or in combination with cells and/or biomolecules) into the tissue defect, using the surrounding microenvironment of the organism as a natural bioreactor.[65] This approach has found application in bone regeneration,[66] allowing the formation of cell-seeded constructs directly in the operating room.[67]
Assembly methods
[edit]A persistent problem within tissue engineering is mass transport limitations. Engineered tissues generally lack an initial blood supply, thus making it difficult for any implanted cells to obtain sufficient oxygen and nutrients to survive, or function properly.
Self-assembly
[edit]Self-assembly methods have been shown to be promising methods for tissue engineering. Self-assembly methods have the advantage of allowing tissues to develop their own extracellular matrix, resulting in tissue that better recapitulates biochemical and biomechanical properties of native tissue. Self-assembling engineered articular cartilage was introduced by Jerry Hu and Kyriacos A. Athanasiou in 2006[68] and applications of the process have resulted in engineered cartilage approaching the strength of native tissue.[69] Self-assembly is a prime technology to get cells grown in a lab to assemble into three-dimensional shapes. To break down tissues into cells, researchers first have to dissolve the extracellular matrix that normally binds them together. Once cells are isolated, they must form the complex structures that make up our natural tissues.
Liquid-based template assembly
[edit]The air-liquid surface established by Faraday waves is explored as a template to assemble biological entities for bottom-up tissue engineering. This liquid-based template can be dynamically reconfigured in a few seconds, and the assembly on the template can be achieved in a scalable and parallel manner. Assembly of microscale hydrogels, cells, neuron-seeded micro-carrier beads, cell spheroids into various symmetrical and periodic structures was demonstrated with good cell viability. Formation of 3-D neural network was achieved after 14-day tissue culture.[70]
Additive manufacturing
[edit]It might be possible to print organs, or possibly entire organisms using additive manufacturing techniques. A recent innovative method of construction uses an ink-jet mechanism to print precise layers of cells in a matrix of thermo-reversible gel. Endothelial cells, the cells that line blood vessels, have been printed in a set of stacked rings. When incubated, these fused into a tube.[60][71] This technique has been referred to as "bioprinting" within the field as it involves the printing of biological components in a structure resembling the organ of focus.
The field of three-dimensional and highly accurate models of biological systems is pioneered by multiple projects and technologies including a rapid method for creating tissues and even whole organs involve a 3-D printer that can bio-print the scaffolding and cells layer by layer into a working tissue sample or organ. The device is presented in a TED talk by Dr. Anthony Atala, M.D. the Director of the Wake Forest Institute for Regenerative Medicine, and the W.H. Boyce Professor and Chair of the Department of Urology at Wake Forest University, in which a kidney is printed on stage during the seminar and then presented to the crowd.[72][73][74] It is anticipated that this technology will enable the production of livers in the future for transplantation and theoretically for toxicology and other biological studies as well.
In 2015 Multi-Photon Processing (MPP) was employed for in vivo experiments by engineering artificial cartilage constructs. An ex vivo histological examination showed that certain pore geometry and the pre-growing of chondrocytes (Cho) prior to implantation significantly improves the performance of the created 3-D scaffolds. The achieved biocompatibility was comparable to the commercially available collagen membranes. The successful outcome of this study supports the idea that hexagonal-pore-shaped hybrid organic-inorganic micro-structured scaffolds in combination with Cho seeding may be successfully implemented for cartilage tissue engineering.[75]
Recently, tissue engineering has advanced with a focus on vascularization. Using Two-Photon Polymerization-based additive manufacturing, synthetic 3D microvessel networks are created from tubular hydrogel structures. These networks can perfuse tissues several cubic millimeters in size, enabling long-term viability and cell growth in vitro. This innovation marks a significant step forward in tissue engineering, facilitating the development of complex human tissue models.[76]
Scaffolding
[edit]In 2013, using a 3-D scaffolding of Matrigel in various configurations, substantial pancreatic organoids was produced in vitro. Clusters of small numbers of cells proliferated into 40,000 cells within one week. The clusters transform into cells that make either digestive enzymes or hormones like insulin, self-organizing into branched pancreatic organoids that resemble the pancreas.[77]
Клетки чувствительны к окружающей среде, например к жесткости геля и контакту с другими клетками. Отдельные клетки не процветают; для последующего развития органоидов требовалось минимум четыре близлежащих клетки. Модификации состава среды привели к образованию либо полых сфер, состоящих в основном из предшественников поджелудочной железы, либо сложных органоидов, которые спонтанно подвергаются морфогенезу и дифференцировке поджелудочной железы. Поддержание и экспансия панкреатических предшественников требуют активной передачи сигналов Notch и FGF , повторяя in vivo сигнальные взаимодействия ниш. [ 77 ]
Органоиды рассматривались как потенциальные мини-органы для тестирования лекарств и резервных клеток, продуцирующих инсулин. [ 77 ]
Помимо каркасов Matrigel 3-D, были разработаны и другие системы коллагеновых гелей. Каркасы из коллагена и гиалуроновой кислоты использовались для моделирования молочной железы in vitro при совместном культивировании эпителиальных и адипоцитных клеток. Набор HyStem — это еще одна трехмерная платформа, содержащая компоненты ЕСМ и гиалуроновую кислоту, которая использовалась для исследований рака. Кроме того, компоненты гидрогеля могут быть химически модифицированы, чтобы способствовать сшиванию и улучшению их механических свойств.
Культура ткани
[ редактировать ]Во многих случаях создание функциональных тканей и биологических структур in vitro требует обширного культивирования для обеспечения выживания, роста и стимулирования функциональности. В целом, в культуре необходимо поддерживать основные потребности клеток, которые включают кислород , pH , влажность , температуру , питательные вещества и поддержание осмотического давления .
Тканеинженерные культуры также создают дополнительные проблемы при поддержании условий культивирования. В стандартной культуре клеток диффузия часто является единственным средством транспорта питательных веществ и метаболитов. Однако по мере того, как культура становится больше и сложнее, как в случае с искусственными органами и целыми тканями, для поддержания культуры необходимо использовать другие механизмы, такие как создание капиллярных сетей внутри ткани.

Другая проблема с тканевой культурой — введение правильных факторов или стимулов, необходимых для индукции функциональности. Во многих случаях простой культуры обслуживания недостаточно. факторы роста , гормоны Иногда требуются , специфические метаболиты или питательные вещества, химические и физические стимулы. Например, некоторые клетки реагируют на изменения напряжения кислорода в рамках своего нормального развития, например хондроциты , которые должны адаптироваться к условиям низкого содержания кислорода или гипоксии во время развития скелета. Другие, такие как эндотелиальные клетки, реагируют на напряжение сдвига от потока жидкости, которое возникает в кровеносных сосудах . Механические стимулы, такие как импульсы давления, по-видимому, полезны для всех видов сердечно-сосудистых тканей, таких как сердечные клапаны, кровеносные сосуды или перикард.
Биореакторы
[ редактировать ]В тканевой инженерии биореактор — это устройство, которое пытается имитировать физиологическую среду, чтобы стимулировать рост клеток или тканей in vitro. Физиологическая среда может состоять из множества различных параметров, таких как температура, давление, концентрация кислорода или углекислого газа или осмоляльность жидкой среды, и может распространяться на все виды биологических, химических или механических стимулов. Поэтому существуют системы, которые могут включать в себя приложение к ткани таких сил, как электромагнитные силы, механическое давление или давление жидкости. Эти системы могут быть двух- или трехмерными. Биореакторы могут использоваться как в академических, так и в промышленных целях. Также коммерчески доступны биореакторы общего и специального назначения, которые могут обеспечивать статическую химическую стимуляцию или комбинацию химической и механической стимуляции.
клеток На пролиферацию и дифференцировку в значительной степени влияют механические факторы. [ 78 ] и биохимический [ 79 ] сигналы в окружающей среде внеклеточного матрикса . Биореакторы обычно разрабатываются для имитации конкретной физиологической среды выращиваемой ткани (например, изгиб и сдвиг жидкости для роста ткани сердца). [ 80 ] Это может позволить специализированным клеточным линиям процветать в культурах, копирующих их нативную среду, но также делает биореакторы привлекательными инструментами для культивирования стволовых клеток . Успешный биореактор на основе стволовых клеток эффективен для размножения стволовых клеток с однородными свойствами и/или содействия контролируемой, воспроизводимой дифференцировке в выбранные типы зрелых клеток. [ 81 ]
Существует множество биореакторов, предназначенных для 3D-культур клеток. Существуют небольшие пластиковые цилиндрические камеры, а также стеклянные камеры с регулируемой внутренней влажностью и влажностью, специально разработанные для выращивания клеток в трех измерениях. [ 82 ] В биореакторе используются биоактивные синтетические материалы, такие как мембраны из полиэтилентерефталата, чтобы окружить сфероидные клетки в среде, поддерживающей высокий уровень питательных веществ. [ 83 ] [ 84 ] Их легко открывать и закрывать, поэтому сфероиды клеток можно вынимать для тестирования, при этом в камере сохраняется 100% влажность. [ 85 ] Эта влажность важна для достижения максимального роста и функционирования клеток. Камера биореактора является частью более крупного устройства, которое вращается, чтобы обеспечить одинаковый рост клеток в каждом направлении в трех измерениях. [ 85 ]
Компания QuinXell Technologies, в настоящее время принадлежащая компании Quintech Life Sciences из Сингапура, разработала биореактор, известный как двухосный биореактор TisXell , который специально разработан для целей тканевой инженерии. Это первый биореактор в мире, имеющий сферическую стеклянную камеру с двухосным вращением; специально для имитации вращения плода в утробе матери; что обеспечивает благоприятную среду для роста тканей. [ 86 ]
Несколько форм механической стимуляции также были объединены в одном биореакторе. Используя анализ экспрессии генов, одно академическое исследование показало, что применение комбинации циклического напряжения и ультразвуковой стимуляции к клеткам преостеобластов в биореакторе ускоряет созревание и дифференцировку матрикса. [ 87 ] Технология этого биореактора комбинированной стимуляции может быть использована для более быстрого и эффективного выращивания костных клеток в будущих клинических методах лечения стволовыми клетками. [ 88 ]
MC2 Biotek также разработала биореактор, известный как ProtoTissue. [ 82 ] который использует газообмен для поддержания высокого уровня кислорода в клеточной камере; Улучшение по сравнению с предыдущими биореакторами, поскольку более высокий уровень кислорода помогает клеткам расти и обеспечивать нормальное клеточное дыхание . [ 89 ]
Активные области исследований биореакторов включают увеличение масштабов производства и улучшение физиологической среды, и то, и другое может повысить эффективность и действенность биореакторов в исследованиях или клиническом использовании. Биореакторы в настоящее время используются, среди прочего, для изучения терапии на клеточном и тканевом уровне, реакции клеток и тканей на конкретные изменения физиологической среды, а также развития заболеваний и травм.
Генерация длинных волокон
[ редактировать ]В 2013 году группа из Токийского университета порядка 100 мкм . разработала насыщенные клетками волокна длиной до метра и размером [ 90 ] Эти волокна были созданы с помощью микрофлюидного устройства , формирующего двойной коаксиальный ламинарный поток. Каждый «слой» микрофлюидного устройства (клетки, посеянные в ЕСМ , гидрогелевую оболочку и, наконец, раствор хлорида кальция). Высеянные клетки культивируют внутри гидрогелевой оболочки в течение нескольких дней, а затем оболочку удаляют вместе с жизнеспособными клеточными волокнами. В ядро ЕСМ были вставлены различные типы клеток, включая миоциты , эндотелиальные клетки , волокна нервных клеток и эпителиальных клеток волокна . Затем эта группа показала, что эти волокна можно сплетать вместе для изготовления тканей или органов по механизму, аналогичному текстильному ткачеству . Преимущество фиброзной морфологии состоит в том, что она представляет собой альтернативу традиционной конструкции каркаса, а многие органы (например, мышцы) состоят из фиброзных клеток.
Биоискусственные органы
[ редактировать ]Искусственный орган — это инженерное устройство, которое может быть экстракорпоральным или имплантироваться для поддержки поврежденных или вышедших из строя систем органов. [ 91 ] Биоискусственные органы обычно создаются с целью восстановить критические биологические функции, например, при замене больных сердца и легких, или обеспечить радикальное улучшение качества жизни, например, при использовании искусственной кожи у жертв ожогов. [ 91 ] Хотя некоторые примеры биоискусственных органов все еще находятся на стадии разработки из-за ограничений, связанных с созданием функциональных органов, другие в настоящее время используются в клинических условиях экспериментально и коммерчески. [ 92 ]
Легкое
[ редактировать ]Аппараты экстракорпоральной мембранной оксигенации (ЭКМО), также известные как аппараты сердца и легких, представляют собой адаптацию методов искусственного кровообращения , обеспечивающих поддержку сердца и легких. [ 93 ] Он используется в первую очередь для поддержки легких в течение длительного, но все же временного периода времени (1–30 дней) и обеспечения выздоровления от обратимых заболеваний. [ 93 ] Роберт Бартлетт известен как отец ЭКМО и провел первое лечение новорожденного с помощью аппарата ЭКМО в 1975 году. [ 94 ]
Кожа
Тканеинженерная кожа — это тип биоискусственного органа, который часто используется для лечения ожогов, язв диабетической стопы или других крупных ран, которые не могут хорошо зажить сами по себе. Искусственную кожу можно изготовить из аутотрансплантатов, аллотрансплантатов и ксенотрансплантатов. Аутотрансплантированная кожа получается из собственной кожи пациента, что позволяет дерме быстрее заживлять, а донорский участок можно повторно собирать несколько раз. Аллотрансплантат кожи часто получается из трупной кожи и в основном используется для лечения жертв ожогов. Наконец, ксенотрансплантированная кожа происходит от животных и обеспечивает временную структуру заживления кожи. Они способствуют регенерации кожи, но не могут стать частью кожи хозяина. [ 23 ] Тканеинженерная кожа теперь доступна в коммерческих продуктах. Интегра, первоначально использовавшаяся только для лечения ожогов, состоит из коллагеновой матрицы и хондроитинсульфата, которые можно использовать в качестве заменителя кожи. Хондроитинсульфат действует как компонент протеогликанов, который помогает формировать внеклеточный матрикс. [ 95 ] Интегру можно заселять и реваскуляризировать, сохраняя при этом архитектуру дермального коллагена, что делает ее биоискусственным органом. [ 96 ] Дермаграфт, еще один коммерческий продукт тканеинженерной разработки кожи, сделан из живых фибробластов. Эти фибробласты пролиферируют и производят факторы роста, коллаген и белки ЕСМ, которые помогают создавать грануляционную ткань. [ 97 ]
Сердце
[ редактировать ]Поскольку число пациентов, ожидающих трансплантации сердца, постоянно увеличивается с течением времени, а число пациентов в списке ожидания превышает доступность органов, [ 98 ] искусственные органы, используемые в качестве заместительной терапии при терминальной сердечной недостаточности, помогут облегчить эту трудность. Искусственные сердца обычно используются в качестве альтернативы трансплантации сердца или могут применяться в качестве заместительной терапии при неизлечимой сердечной недостаточности. [ 99 ] Тотальное искусственное сердце (ТАС), впервые предложенное доктором Владимиром Петровичем Демиховым в 1937 году, [ 100 ] оказался идеальной альтернативой. С тех пор он был разработан и усовершенствован как механический насос, который обеспечивает долговременную поддержку кровообращения и заменяет больные или поврежденные желудочки сердца, которые не могут должным образом перекачивать кровь, восстанавливая, таким образом, легочный и системный кровоток. [ 101 ] Некоторые из нынешних TAH включают AbioCor, устройство, одобренное FDA, которое состоит из двух искусственных желудочков и их клапанов, не требует подкожных соединений и показано пациентам с бивентрикулярной сердечной недостаточностью. В 2010 году SynCardia выпустила портативный драйвер Freedom, который позволяет пациентам иметь портативное устройство, не ограничиваясь больницей. [ 102 ]
Почка
[ редактировать ]Хотя трансплантация почки возможна, почечную недостаточность чаще лечат с помощью искусственной почки. [ 103 ] Первые искусственные почки и большинство из тех, что используются в настоящее время, являются экстракорпоральными, например, при гемодиализе, при котором кровь фильтруется напрямую, или при перитонеальном диализе, при котором фильтрация осуществляется через жидкость в брюшной полости. [ 103 ] [ 104 ] Чтобы способствовать биологическим функциям почек, таким как выработка метаболических факторов или гормонов, некоторые искусственные почки включают в себя почечные клетки. [ 103 ] [ 104 ] Достигнут прогресс в том, чтобы сделать эти устройства меньшими по размеру и более мобильными или даже имплантируемыми . Одной из проблем, с которой еще предстоит столкнуться в этих небольших устройствах, является борьба с ограниченным объемом и, следовательно, с ограниченными возможностями фильтрации. [ 103 ]
Также были созданы биокаркасы, обеспечивающие основу для регенерации нормальной ткани почек. Эти каркасы включают естественные каркасы (например, децеллюляризированные почки, [ 105 ] коллагеновый гидрогель, [ 106 ] [ 107 ] или фиброин шелка [ 108 ] ), синтетические каркасы (например, поли[молочная гликолевая кислота] [ 109 ] [ 110 ] или другие полимеры), или комбинацию двух или более натуральных и синтетических каркасов. Эти каркасы можно имплантировать в организм либо без обработки клеток, либо после периода посева и инкубации стволовых клеток. Исследования in vitro и in vivo проводятся для сравнения и оптимизации типа каркаса, а также для оценки того, повышает ли засев клеток перед имплантацией жизнеспособность, регенерацию и эффективное функционирование почек. Недавний систематический обзор и метаанализ сравнили результаты опубликованных исследований на животных и выявили, что улучшение результатов наблюдается при использовании гибридных (смешанных) каркасов и посева клеток; [ 111 ] однако метаанализ этих результатов не соответствовал оценке описательных результатов обзора. Поэтому целесообразны дальнейшие исследования с участием более крупных животных и новых каркасов, а также более прозрачное воспроизведение предыдущих исследований.
Биомиметика
[ редактировать ] этого раздела Тон или стиль могут не отражать энциклопедический тон , используемый в Википедии . ( декабрь 2019 г. ) |
Биомиметика — это область, целью которой является производство материалов и систем, повторяющих те, что присутствуют в природе. [ 112 ] В контексте тканевой инженерии это распространенный подход, используемый инженерами для создания материалов для этих приложений, которые сравнимы с нативными тканями с точки зрения их структуры, свойств и биосовместимости. Свойства материала во многом зависят от физических, структурных и химических характеристик этого материала. Впоследствии биомиметический подход к проектированию систем станет важным в интеграции материалов, и потребуется достаточное понимание биологических процессов и взаимодействий. Репликация биологических систем и процессов также может использоваться при синтезе биоматериалов для достижения условий, обеспечивающих производство желаемого биологического материала. Следовательно, если синтезируется материал, имеющий одинаковые характеристики биологических тканей как структурно, так и химически, то в идеале синтезированный материал будет иметь схожие свойства. Эта техника имеет обширную историю, берущую свое начало в идее использования природных явлений в качестве вдохновения для решения человеческих проблем. Многие современные достижения в области технологий были вдохновлены природой и природными системами, включая самолеты, автомобили, архитектуру и даже промышленные системы. Достижения в области нанотехнологий инициировали применение этого метода в микро- и наномасштабные проблемы, включая тканевую инженерию. Этот метод использовался для разработки синтетических костных тканей, сосудистых технологий, каркасных материалов и методов интеграции, а также функционализированных наночастиц. [ 112 ]
Построение нейронных сетей в мягком материале
[ редактировать ]В 2018 году ученые из Университета Брандейса сообщили о своем исследовании мягкого материала, покрытого химическими сетями, которые могут имитировать плавное и скоординированное поведение нервной ткани. Это исследование финансировалось Исследовательской лабораторией армии США . [ 113 ] Исследователи представили экспериментальную систему нейронных сетей, теоретически смоделированную как системы реакции-диффузии . Внутри сети находился ряд узорчатых реакторов, каждый из которых осуществлял реакцию Белоусова-Жаботинского (БЗ). Эти реакторы могли бы функционировать в масштабе нанолитров. [ 114 ]
Исследователи утверждают, что вдохновением для их проекта послужило передвижение синего ленточного угря . Движениями угря управляют электрические импульсы, определяемые классом нейронных сетей, называемых центральным генератором шаблонов . Центральные генераторы паттернов функционируют в автономной нервной системе, контролируя такие функции организма, как дыхание, движение и перистальтика . [ 115 ]
Спроектированными качествами реактора были топология сети, граничные условия , начальные условия, объем реактора, сила связи и синаптическая полярность реактора (независимо от того, является ли его поведение тормозящим или возбуждающим). [ 115 ] эмульсионная система БЗ с твердым эластомером полидиметилсилоксаном Разработана (ПДМС). Сообщается, что как свето-, так и бромпроницаемые ПДМС являются жизнеспособными методами создания кардиостимулятора для нейронных сетей. [ 114 ]
Рынок
[ редактировать ]Историю рынка тканевой инженерии можно разделить на три основные части. Время до краха биотехнологического рынка в начале 2000-х годов, крах и время после него.
Начало
[ редактировать ]Самый ранний прогресс в исследованиях тканевой инженерии был достигнут в США. Это связано с менее строгими правилами в отношении исследований стволовых клеток и более доступным финансированием, чем в других странах. Это приводит к созданию академических стартапов, многие из которых происходят из Гарварда или Массачусетского технологического института . Примером могут служить BioHybrid Technologies, основатель которой Билл Чик учился в Гарвардской медицинской школе и сосредоточился на создании искусственной поджелудочной железы. Другим примером может служить компания Organogenic Inc., основатель которой учился в Массачусетском технологическом институте и работал над продуктами для инженерии кожи. Другими компаниями, имеющими связи с MIT, являются TEI Biosciences, Therics и Guilford Pharmaceuticals. [ 8 ] Возобновление интереса к биотехнологиям в 1980-х годах привело к тому, что многие частные инвесторы инвестировали в эти новые технологии, хотя бизнес-модели этих ранних стартапов часто были не очень ясными и не обеспечивали пути к долгосрочной прибыльности. [ 116 ] Правительственные спонсоры были более сдержанными в своем финансировании, поскольку тканевая инженерия считалась инвестицией с высоким риском. [ 8 ]
В Великобритании рынок стартовал медленнее, хотя правила в отношении исследований стволовых клеток также не были строгими. В основном это связано с тем, что все больше инвесторов менее готовы вкладывать средства в эти новые технологии, которые считались инвестициями с высоким уровнем риска. [ 116 ] Еще одна проблема, с которой столкнулись британские компании, заключалась в том, чтобы заставить Национальную службу здравоохранения платить за их продукцию. Это особенно важно потому, что Национальная служба здравоохранения проводит анализ экономической эффективности всех поддерживаемых продуктов. Новые технологии часто не преуспевают в этом отношении. [ 116 ]
В Японии ситуация с регулированием была совершенно иной. Во-первых, культивирование клеток было разрешено только в условиях больницы, а во-вторых, академическим ученым, нанятым в государственных университетах, не разрешалось работать вне работы до 1998 года. Более того, японским властям потребовалось больше времени для одобрения новых лекарств и методов лечения, чем их американским и европейским коллегам. [ 116 ]
По этим причинам на заре развития японского рынка основное внимание уделялось получению продуктов, которые уже были одобрены в других местах Японии, и их продаже. В отличие от рынка США, первыми игроками в Японии были в основном крупные фирмы или дочерние компании таких крупных фирм, как J-TEC, Menicon и Terumo, а не маленькие стартапы. [ 116 ] После законодательных изменений в 2014 году, которые позволили культивировать клетки за пределами больниц, скорость исследований в Японии возросла, и японские компании также начали разрабатывать свои собственные продукты. [ 116 ]
Крушение
[ редактировать ]Вскоре после большого бума начали появляться первые проблемы. Были проблемы с одобрением продуктов FDA , и если они были одобрены, часто возникали трудности с тем, чтобы заставить страховых компаний платить за продукты и добиться их принятия поставщиками медицинских услуг. [ 116 ] [ 117 ]
Например, органогенез столкнулся с проблемами сбыта своей продукции и ее интеграции в систему здравоохранения. Частично это связано с трудностями обращения с живыми клетками и возросшими трудностями, с которыми сталкиваются врачи при использовании этих продуктов по сравнению с традиционными методами. [ 116 ]
Другим примером может служить продукт для кожи Advanced Tissue Sciences Dermagraft, который не смог бы создать достаточно высокий спрос без возмещения расходов со стороны страховых компаний. Причинами этого были цена в 4000 долларов и то обстоятельство, что компания Extra Advanced Tissue Sciences изо всех сил пыталась привлечь внимание врачей к своему продукту. [ 116 ]
Приведенные выше примеры демонстрируют, как компании боролись за получение прибыли. Это, в свою очередь, приводит к тому, что инвесторы теряют терпение и прекращают дальнейшее финансирование. В результате несколько компаний тканевой инженерии, таких как Organogenices и Advanced Tissue Sciences, в начале 2000-х годов объявили о банкротстве. В то время это были единственные компании, предлагающие на рынке коммерческие продукты для кожи. [ 117 ]
Возрождение
[ редактировать ]Технологии обанкротившихся или переживающих трудности компаний часто покупались другими компаниями, которые продолжали развитие в рамках более консервативных бизнес-моделей. [ 117 ] Примерами компаний, которые продавали свою продукцию после сворачивания, были Curis. [ 117 ] и Интерцитекс. [ 116 ]
Многие компании отказались от своих долгосрочных целей по разработке полностью функциональных органов в пользу продуктов и технологий, которые могли бы принести прибыль в краткосрочной перспективе. [ 116 ] Примерами таких продуктов являются продукты косметической и испытательной промышленности.
В других случаях, например, в случае с Advanced Tissue Sciences, основатели создавали новые компании. [ 116 ]
В 2010-х годах нормативная база также начала способствовать ускорению выхода на рынок, особенно в США, поскольку FDA создало новые центры и пути, специально нацеленные на продукты, полученные из живых клеток, такие как Центр оценки и исследования биологических препаратов . [ 116 ]
Первые продукты тканевой инженерии начали приносить коммерческую прибыль в 2010-х годах. [ 117 ]
Регулирование
[ редактировать ]В настоящее время в Европе регулирование разделено на три области регулирования: медицинское оборудование , лекарственные препараты и биологические препараты . Продукты тканевой инженерии часто имеют гибридную природу, поскольку зачастую состоят из клеток и несущей структуры. Некоторые продукты могут быть одобрены в качестве лекарственных средств, другие должны получить одобрение в качестве медицинских изделий. [ 118 ] Дерксен объясняет в своей диссертации, что исследователи тканевой инженерии иногда сталкиваются с регулированием, которое не соответствует характеристикам тканевой инженерии. [ 119 ]
В Европе наблюдаются новые режимы регулирования, которые решают эти проблемы. [ 120 ] Объяснение трудностям в нахождении регуляторного консенсуса в этом вопросе дает опрос, проведенный в Великобритании. [ 118 ] Авторы связывают эти проблемы с тесным родством и совпадением с другими технологиями, такими как ксенотрансплантация . Поэтому регулирующие органы не могут заниматься этим отдельно. [ 118 ] Регулирование еще более осложняется этическими противоречиями, связанными с этой и смежными областями исследований (например, споры о стволовых клетках , этика трансплантации органов ). Тот же опрос, о котором говорилось выше. [ 118 ] показывает на примере трансплантации аутологичного хряща, что конкретная технология может рассматриваться как «чистая» или «загрязненная» одним и тем же социальным субъектом.
Два регуляторных движения наиболее актуальны для тканевой инженерии в Европейском Союзе . Это Директива 2004/23/EC о стандартах качества и безопасности при закупке и переработке человеческих тканей. [ 121 ] который был принят Европейским парламентом в 2004 году и предложенный регламент в отношении продуктов, модифицированных тканями человека. Последний был разработан под эгидой Генерального директората по предпринимательству Европейской комиссии и представлен в Брюсселе в 2004 году. [ 122 ]
См. также
[ редактировать ]- Биомедицинская инженерия
- Биологическая инженерия
- Биомолекулярная инженерия
- Биохимическая инженерия
- Клеточная инженерия
- Химическая инженерия
- Биоматериал ЕСМ
- Биореактор in vivo
- Индуцированные стволовые клетки
- Молекулярный процессор
- Молекулярная самосборка
- Инженерия мышечной ткани
- Национальные институты здравоохранения
- Национальный научный фонд
- Контроль качества в тканевой инженерии
- Регенерация у человека
- Мягкие ткани
- Тиомеры
- Международное общество тканевой инженерии и регенеративной медицины
- Тканевая инженерия клапанов сердца
- Ксенотрансплантация
Примечания
[ редактировать ]- ^ Ким, Ю Сон; Смоук, Молли М.; Мельчиорри, Энтони Дж.; Микос, Антониос Г. (1 января 2019 г.). «Обзор рынка тканевой инженерии в США с 2011 по 2018 год» . Тканевая инженерия. Часть А. 25 (1–2): 1–8. дои : 10.1089/ten.tea.2018.0138 . ISSN 1937-3341 . ПМК 6352506 . ПМИД 30027831 .
- ^ Уитни Г.А., Джаяраман К., Деннис Дж.Э., Мансур Дж.М. (февраль 2017 г.). «Хрящ без каркаса, подвергнутый фрикционному сдвиговому напряжению, повреждается в результате растрескивания и отслаивания поверхности» . Журнал тканевой инженерии и регенеративной медицины . 11 (2): 412–24. дои : 10.1002/терм.1925 . ПМЦ 4641823 . ПМИД 24965503 .
- ^ «Лаборатория Лангера – факультет химической инженерии Массачусетского технологического института» . langerlab.mit.edu . Проверено 13 марта 2023 г.
- ^ «Лаборатория тканевой инженерии и изготовления органов» . Массачусетская больница общего профиля, Бостон, Массачусетс. Архивировано из оригинала 1 декабря 2016 года . Проверено 31 октября 2009 г.
- ^ Перейти обратно: а б Лангер Р., Ваканти Дж. П. (май 1993 г.). «Тканевая инженерия». Наука . 260 (5110): 920–26. Бибкод : 1993Sci...260..920L . дои : 10.1126/science.8493529 . ПМИД 8493529 .
- ^ Перейти обратно: а б Макартур Б.Д., Ореффо Р.О. (январь 2005 г.). «Преодоление разрыва» . Природа . 433 (7021): 19. Бибкод : 2005Natur.433...19M . дои : 10.1038/433019а . ПМИД 15635390 . S2CID 2683429 .
- ^ Томас Д., Сингх Д. (июль 2019 г.). «Новые методы разработки трехмерной сосудистой ткани для хирургических процедур». Американский журнал хирургии . 218 (1): 235–236. дои : 10.1016/j.amjsurg.2018.06.004 . ПМИД 29929908 . S2CID 49350846 .
- ^ Перейти обратно: а б с д Виола Дж., Лал Б., Град О. (14 октября 2003 г.). Появление тканевой инженерии как области исследований (PDF) (Отчет). Абт Ассошиэйтс Инк. «Альтернативная веб-страница» . Проверено 28 апреля 2006 г. - через nsf.gov.
- ^ «Энтони Атала, доктор медицины» . Баптистское здоровье Уэйк Форест .
- ^ «Врачи выращивают органы из собственных клеток пациентов» . CNN . 3 апреля 2006 г.
- ^ Симонит Т (5 июля 2006 г.). «Выращенный в лаборатории хрящ лечит поврежденные колени» . Новый учёный .
- ^ Уитни Г.А., Мера Х., Вайденбехер М., Авадалла А., Мансур Дж.М., Деннис Дж.Э. (август 2012 г.). «Методы производства модифицированных хрящевых листов без каркаса из источников аурикулярных и суставных хондроцитов и прикрепления к пористому танталу» . Биоисследования в открытом доступе . 1 (4): 157–65. дои : 10.1089/biores.2012.0231 . ПМЦ 3559237 . ПМИД 23514898 .
- ^ Отт ХК, Маттисен Т.С., Гох С.К., Блэк Л.Д., Крен С.М., Нетофф Т.И., Тейлор Д.А. (февраль 2008 г.). «Перфузионно-децеллюляризованная матрица: использование природной платформы для создания биоискусственного сердца». Природная медицина . 14 (2): 213–21. дои : 10.1038/nm1684 . ПМИД 18193059 . S2CID 12765933 .
- ^ Альтман Л.К. (13 января 2008 г.). «Исследователи создают новое крысиное сердце в лаборатории» . Нью-Йорк Таймс .
- ^ Зилла П., Грейслер Х. (1999). Тканевая инженерия сосудистых протезов . Компания RG Landes. ISBN 978-1-57059-549-3 . [ нужна страница ]
- ^ Нагели К.М., Курал М.Х., Ли Ю, Ван Дж., Хугентоблер Э.А., Никласон Л.Е. (июнь 2022 г.). «Биоинженерия человеческих тканей и будущее сосудистой замены» . Исследование кровообращения . 131 (1): 109–126. дои : 10.1161/CIRCRESAHA.121.319984 . ПМЦ 9213087 . ПМИД 35737757 .
- ^ Чанг В.Г., Никласон Л.Е. (27 марта 2017 г.). «Краткий дискурс о сосудистой тканевой инженерии» . npj Регенеративная медицина . 2 (1): 1–8. дои : 10.1038/s41536-017-0011-6 . ПМК 5649630 . ПМИД 29057097 .
- ^ «Тканевая инженерия» . microfab.com .
- ^ «Кость в бутылке: Попытки создать искусственный костный мозг до сих пор не увенчались успехом» . Экономист . 7 января 2009 г.
- ^ Перейти обратно: а б Амини А.Р., Лоренсен К.Т., Нукаварапу С.П. (2012). «Инженерия костной ткани: последние достижения и проблемы» . Критические обзоры в области биомедицинской инженерии . 40 (5): 363–408. doi : 10.1615/critrevbiomedeng.v40.i5.10 . ПМЦ 3766369 . ПМИД 23339648 .
- ^ Томас Д. (16 апреля 2021 г.). «3D-печать сшиваемых биокомпозитов на основе фосфата кальция для биосовместимой хирургической имплантации». Биопечать . 22 : e00141. doi : 10.1016/j.bprint.2021.e00141 . ISSN 2405-8866 . S2CID 234851322 .
- ^ Чой CQ (9 ноября 2009 г.). «Искусственная ткань пениса оказалась многообещающей в ходе лабораторных испытаний» . Живая наука .
- ^ Перейти обратно: а б Виг К., Чаудхари А., Трипати С., Диксит С., Саху Р., Пиллаи С. и др. (апрель 2017 г.). «Достижения в регенерации кожи с использованием тканевой инженерии» . Международный журнал молекулярных наук . 18 (4): 789. doi : 10.3390/ijms18040789 . ПМЦ 5412373 . ПМИД 28387714 .
- ^ Хит, Калифорния (январь 2000 г.). «Клетки для тканевой инженерии». Тенденции в биотехнологии . 18 (1): 17–19. дои : 10.1016/S0167-7799(99)01396-7 . ПМИД 10631775 .
- ^ Вельзер, Дженнифер и др. (ноябрь 2015 г.). «Первичные клетки против клеточных линий» . Исследовательские лаборатории ScienCell.
- ^ Баттери Л.Д., Бишоп А.Э. (2005). «Введение в тканевую инженерию». Биоматериалы, искусственные органы и тканевая инженерия . Том. 279. стр. 193–200. дои : 10.1533/9781845690861.4.193 . ISBN 9781855737372 .
- ^ Пареккадан Б., Милвид Дж. М. (август 2010 г.). «Мезенхимальные стволовые клетки как терапевтическое средство» . Ежегодный обзор биомедицинской инженерии . 12 : 87–117. doi : 10.1146/annurev-bioeng-070909-105309 . ПМЦ 3759519 . ПМИД 20415588 .
- ^ Домингес-Бендала Х., Ланцони Дж., Инверарди Л., Рикорди К. (январь 2012 г.). «Краткий обзор: мезенхимальные стволовые клетки при диабете» . Трансляционная медицина стволовых клеток . 1 (1): 59–63. дои : 10.5966/sctm.2011-0017 . ПМЦ 3727686 . ПМИД 23197641 .
- ^ Бара Дж.Дж., Ричардс Р.Г., Алини М., Стоддарт М.Дж. (июль 2014 г.). «Краткий обзор: мезенхимальные стволовые клетки, полученные из костного мозга, меняют фенотип после культивирования in vitro: значение для фундаментальных исследований и клиники» . Стволовые клетки . 32 (7): 1713–23. дои : 10.1002/stem.1649 . ПМИД 24449458 . S2CID 30744973 .
- ^ Минтир Д., Марра К.Г., Рубин Дж.П. (2013). «Мезенхимальные стволовые клетки жирового происхождения: биология и потенциальное применение». Достижения в области биохимической инженерии/биотехнологии . 129 : 59–71. дои : 10.1007/10_2012_146 . ISBN 978-3-642-35670-4 . ПМИД 22825719 .
- ^ Фарахани Н.А., Грили Х.Т., Хайман С., Кох С., Грейди С., Пашка С.П. и др. (апрель 2018 г.). «Этика экспериментирования с тканями мозга человека» . Природа . 556 (7702): 429–32. Бибкод : 2018Natur.556..429F . дои : 10.1038/d41586-018-04813-x . ПМК 6010307 . ПМИД 29691509 .
- ^ Бурре Р., Мартинес Э., Виалла Ф., Жикель К., Тоннат-Марен А., Де Вос Дж. (июнь 2016 г.). «Химеры человека и животных: этические проблемы выращивания химерных животных, несущих человеческие органы» . Исследования и терапия стволовыми клетками . 7 (1): 87. дои : 10.1186/s13287-016-0345-9 . ПМЦ 4928294 . ПМИД 27356872 .
- ^ Мерфи К. (2016). Иммунобиология Джейнвей . Norton, WW & Company, Inc. ISBN 978-0815345053 . [ нужна страница ]
- ^ Гробарчик Б, Франко Б, Ханон К, Мальгранж Б (октябрь 2015 г.). «Получение изогенной линии iPS клеток человека, точно скорректированной путем редактирования генома с использованием системы CRISPR / Cas9». Обзоры и отчеты о стволовых клетках . 11 (5): 774–87. дои : 10.1007/s12015-015-9600-1 . ПМИД 26059412 . S2CID 18897400 .
- ^ Мерчинг Х., Шанц Дж., Стегер В., Шандар М., Шенк М., Хансманн Дж. и др. (июль 2009 г.). «Создание и трансплантация аутологичной васкуляризированной биоискусственной ткани человека» . Трансплантация . 88 (2): 203–210. дои : 10.1097/TP.0b013e3181ac15e1 . ПМИД 19623015 . S2CID 46083673 .
- ^ Ньюман П., Минетт А., Эллис-Бенке Р., Зрейкат Х. (ноябрь 2013 г.). «Углеродные нанотрубки: их потенциал и подводные камни для регенерации и инженерии костной ткани». Наномедицина . 9 (8): 1139–1158. дои : 10.1016/j.nano.2013.06.001 . ПМИД 23770067 .
- ^ Патрик К.В., Микос АГ, Макинтайр Л.В. (1998). Границы тканевой инженерии (1-е изд.). Оксфорд, Великобритания: Пергамон. ISBN 978-0-08-042689-1 . OCLC 162130841 .
- ^ Стюарт С.А., Домингес-Роблес Х., Доннелли Р.Ф., Ларраньета Э. (декабрь 2018 г.). «Имплантируемые полимерные устройства для доставки лекарств: классификация, производство, материалы и клиническое применение» . Полимеры . 10 (12): 1379. doi : 10.3390/polym10121379 . ПМК 6401754 . ПМИД 30961303 .
- ^ Кадзихара М., Суги Т., Маэда Х., Сано А., Фудзиока К., Урабе Ю. и др. (январь 2003 г.). «Новое устройство для доставки лекарств с использованием силикона: контролируемое высвобождение нерастворимых лекарств или двух видов водорастворимых лекарств» . Химический и фармацевтический вестник . 51 (1): 15–19. дои : 10.1248/cpb.51.15 . ПМИД 12520121 .
- ^ Афеверки С., Шейхи А., Каннан С., Ахадиан С., Хадемхоссейни А. (январь 2019 г.). «Композитные каркасы из желатина и полисахарида для 3D-культуры клеток и тканевой инженерии: на пути к естественной терапии» . Биоинженерия и трансляционная медицина . 4 (1): 96–115. дои : 10.1002/btm2.10124 . ПМК 6336672 . ПМИД 30680322 .
- ^ Мартин К.А., Радхакришнан С., Нагараджан С., Мутхукури С., Дуэньяс Дж.М., Рибеллес Дж.Л. и др. (2019). «Инновационный биорезорбируемый трехмерный каркас на основе желатина, который поддерживает стволовость стволовых клеток, полученных из жировой ткани, и пластичность дифференцированных нейронов» . РСК Прогресс . 9 (25): 14452–64. Бибкод : 2019RSCAd...914452M . дои : 10.1039/C8RA09688K . ISSN 2046-2069 . ПМК 9064131 . ПМИД 35519343 .
- ^ Такаги Ю, Танака С, Томита С, Акияма С, Маки Ю, Ямамото Т, Уэхара М, Добаши Т (2017). «Приготовление желатинового каркаса и культуры клеток фибробластов» . Журнал биореологии . 31 (1): 2–5. дои : 10.17106/jbr.31.2 . ISSN 1867-0466 .
- ^ Рухани-Исфахани С.И., Ньюман П., Зрейкат Х. (январь 2016 г.). «Проектирование и изготовление 3D-печатных каркасов с механической прочностью, сравнимой с кортикальной костью, для восстановления больших дефектов кости» . Научные отчеты . 6 (1): 19468. Бибкод : 2016NatSR...619468R . дои : 10.1038/srep19468 . ПМЦ 4726111 . ПМИД 26782020 .
- ^ Нокурани Ю.Д., Шамлу А., Бахадоран М., Мораввей Х. (август 2021 г.). «Изготовление и характеристика каркасов, содержащих различное количество аллантоина для инженерии тканей кожи» . Научные отчеты . 11 (1): 16164. Бибкод : 2021NatSR..1116164N . дои : 10.1038/s41598-021-95763-4 . ПМЦ 8352935 . ПМИД 34373593 .
- ^ Джентиле П., Чионо В., Карманьола I, Хаттон П.В. (февраль 2014 г.). «Обзор биоматериалов на основе поли(молочной-ко-гликолевой) кислоты (PLGA) для инженерии костной ткани» . Международный журнал молекулярных наук . 15 (3): 3640–59. дои : 10.3390/ijms15033640 . ПМЦ 3975359 . ПМИД 24590126 .
- ^ Парк Дж.Х., Шварц З., Оливарес-Наваррете Р., Боян Б.Д., Танненбаум Р. (май 2011 г.). «Повышение смачиваемости поверхности путем модификации микротекстурированных поверхностей титановых имплантатов полиэлектролитами» . Ленгмюр . 27 (10): 5976–85. дои : 10.1021/la2000415 . ПМЦ 4287413 . ПМИД 21513319 .
- ^ Лейхнер С., Йелькманн М., Бернкоп-Шнурх А. (2019). «Тиолированные полимеры: биоинспирированные полимеры, использующие одну из наиболее важных мостиковых структур в природе». Обзоры расширенной доставки лекарств . 151–152: 191–221. дои : 10.1016/j.addr.2019.04.007 . ПМИД 31028759 . S2CID 135464452 .
- ^ Каст CE, Фрик В., Лозерт У., Бернкоп-Шнурх А. (апрель 2003 г.). «Конъюгат хитозана и тиогликолевой кислоты: новый каркасный материал для тканевой инженерии?». Международный фармацевтический журнал . 256 (1–2): 183–189. дои : 10.1016/S0378-5173(03)00076-0 . ПМИД 12695025 .
- ^ Пэ И.Х., Чон Б.С., Кук М.С., Ким Ш., Ко Дж.Т. (2013). «Оценка тиолированного хитозанового каркаса для местной доставки BMP-2 при остеогенной дифференцировке и эктопическом костеобразовании» . БиоМед Исследования Интернэшнл . 2013 : 878930. doi : 10.1155/2013/878930 . ПМК 3760211 . ПМИД 24024213 .
- ^ Бянь С., Хэ М., Суй Дж., Цай Х., Сунь Ю., Лян Дж. и др. (апрель 2016 г.). «Самосшивающиеся умные гидрогели гиалуроновой кислоты в качестве инъекционных трехмерных каркасов для культуры клеток» . Коллоиды и поверхности. Б. Биоинтерфейсы . 140 : 392–402. дои : 10.1016/j.colsurfb.2016.01.008 . ПМИД 26780252 .
- ^ Гаджендиран М., Ри Дж.С., Ким К. (февраль 2018 г.). «Последние разработки в области тиолированных полимерных гидрогелей для применения в тканевой инженерии». Тканевая инженерия. Часть Б, Обзоры . 24 (1): 66–74. дои : 10.1089/ten.TEB.2016.0442 . ПМИД 28726576 .
- ^ Бауэр С., Джеякумар В., Никулеску-Моржа Е., Керн Д., Нерер С. (декабрь 2017 г.). «Гиалуронаттиомерный гель/матрица опосредовал заживление дефектов суставного хряща у новозеландских белых кроликов — пилотное исследование» . Журнал экспериментальной ортопедии . 4 (1): 14. дои : 10.1186/s40634-017-0089-1 . ПМЦ 5415448 . ПМИД 28470629 .
- ^ Захир-Джуздани Ф., Махбод М., Сулеймани М., Вахшите Ф., Арефян Э., Шахосейни С. и др. (январь 2018 г.). «Хитозан и тиолированный хитозан: новый терапевтический подход для предотвращения помутнения роговицы после химических повреждений». Углеводные полимеры . 179 : 42–49. дои : 10.1016/j.carbpol.2017.09.062 . ПМИД 29111069 .
- ^ «Клинические испытания на людях» (PDF) .
- ^ Помрой Дж. Э., Хелфер А., Бурсак Н. (1 сентября 2020 г.). «Биоматериализация перспектив инженерии сердечной ткани» . Достижения биотехнологии . 42 : 107353. doi : 10.1016/j.biotechadv.2019.02.009 . ПМК 6702110 . ПМИД 30794878 .
- ^ Кэссиди Дж.В. (ноябрь 2014 г.). «Нанотехнологии в регенерации сложных тканей» (PDF) . Информация о регенерации костей и тканей . 5 : 25–35. дои : 10.4137/BTRI.S12331 . ПМЦ 4471123 . ПМИД 26097381 .
- ^ Нам Ю.С., Пак Т.Г. (октябрь 1999 г.). «Биоразлагаемые полимерные микроячеистые пены, полученные модифицированным методом термического разделения фаз». Биоматериалы . 20 (19): 1783–90. дои : 10.1016/S0142-9612(99)00073-3 . ПМИД 10509188 .
- ^ Саймон Э.М. (1988). «Заключительный отчет фазы I Национального института здравоохранения: волокнистые субстраты для клеточных культур (R3RR03544A)» . Исследовательские ворота . Проверено 22 мая 2017 г.
- ^ Мелчелс Ф., Виггенхаузер П.С., Уорн Д., Барри М., Онг Ф.Р., Чонг В.С. и др. (сентябрь 2011 г.). «Реконструкция груди с помощью CAD/CAM» (PDF) . Биофабрикация . 3 (3): 034114. Бибкод : 2011BioFa...3c4114M . дои : 10.1088/1758-5082/3/3/034114 . ПМИД 21900731 . S2CID 206108959 .
- ^ Перейти обратно: а б Елисеев Дж., Ма ПХ (2005). Строительные леса в тканевой инженерии . Бока-Ратон: CRC. ISBN 978-1-57444-521-3 .
- ^ Перейти обратно: а б Ли Джи, Кенни П.А., Ли Э.Х., Бисселл М.Дж. (апрель 2007 г.). «Трехмерные культуральные модели нормальных и злокачественных эпителиальных клеток молочной железы» . Природные методы . 4 (4): 359–65. дои : 10.1038/nmeth1015 . ПМЦ 2933182 . ПМИД 17396127 .
- ^ Перейти обратно: а б с Лай Ю, Астхана А, Кисаалита В.С. (апрель 2011 г.). «Биомаркеры для упрощения платформ 3D-культуры клеток HTS для открытия лекарств: аргументы в пользу цитокинов». Открытие наркотиков сегодня . 16 (7–8): 293–97. дои : 10.1016/j.drudis.2011.01.009 . ПМИД 21277382 .
- ^ Густафссон Л., Тасиопулос К.П., Янссон Р., Квик М., Дуурсма Т., Гассер Т.К., ван дер Вейнгаарт В., Хедхаммар М. (16 августа 2020 г.). «Рекомбинантный паучий шелк образует прочные и эластичные наномембраны, проницаемые для белков и поддерживающие прикрепление и рост клеток» . Передовые функциональные материалы . 30 (40): 2002982. doi : 10.1002/adfm.202002982 .
- ^ Тасиопулос КП, Густафссон Л, ван дер Вейнгаарт В, Хедхаммар М (июль 2021 г.). «Фибриллярные наномембраны рекомбинантного белка паучьего шелка поддерживают совместную культуру клеток в in vitro модели стенки кровеносного сосуда » . ACS Биоматериалы, наука и инженерия . 7 (7): 3332–3339. doi : 10.1021/acsbimaterials.1c00612 . ПМК 8290846 . ПМИД 34169711 .
- ^ ДИАС, Джулиана Р.; РИБЕЙРО, Нильза; Баптиста-Сильва, Сара; КОСТА-ПИНТО, Ана Рита; Алвес, Нуно; Оливейра, Ана Л. (2020). «Подходы к активации in situ для регенерации тканей: текущие проблемы и новые разработки» . Границы биоинженерии и биотехнологии . 8 : 85. дои : 10.3389/fbioe.2020.00085 . ISSN 2296-4185 . ПМК 7039825 . ПМИД 32133354 .
- ^ Малек-Хатаби А.; Джавар, штат Ха; Даштимогадам, Э.; Ансари, С.; Хасани-Садрабади, премьер-министр; Мошавериния, А. (2020). «Инженерия костной ткани in situ с использованием нанокомплексов доставки генов» . Акта Биоматериалы . 108 : 326–336. doi : 10.1016/j.actbio.2020.03.008 . ISSN 1878-7568 . ПМИД 32160962 . S2CID 212679291 .
- ^ Красильникова О.А.; Барановский, Д.С.; Якимова, АО; Аргучинская, Н.; Кисель, А.; Сосин Д.; Сулина Ю.; Иванов С.А.; Шегай, ПВ ; Каприн А.Д.; Клабуков И.Д. (2022). «Интраоперационное создание тканеинженерных трансплантатов с минимально манипулируемыми клетками: новая концепция инженерии костной ткани in situ» . Биоинженерия . 9 11):704.doi : ( 10.3390/bioengineering9110704 . ISSN 2306-5354 . ПМЦ 9687730 . ПМИД 36421105 .
- ^ Ху Дж.К., Афанасиу К.А. (апрель 2006 г.). «Процесс самосборки в инженерии ткани суставного хряща». Тканевая инженерия . 12 (4): 969–79. дои : 10.1089/ten.2006.12.969 . ПМИД 16674308 .
- ^ Ли Дж.К., Хьюве Л.В., Пашос Н., Арьяи А., Гегг К.А., Ху Дж.К., Атанасиу К.А. (август 2017 г.). «Стимуляция напряжением стимулирует образование тканей в системах без каркасов» . Природные материалы . 16 (8): 864–73. Бибкод : 2017NatMa..16..864L . дои : 10.1038/nmat4917 . ПМК 5532069 . ПМИД 28604717 .
- ^ Чен П., Луо З., Гювен С., Тасоглу С., Ганесан А.В., Венг А., Демирчи У (сентябрь 2014 г.). «Микромасштабная сборка, управляемая шаблоном на жидкой основе» . Продвинутые материалы . 26 (34): 5936–41. Бибкод : 2014AdM....26.5936C . дои : 10.1002/adma.201402079 . ПМК 4159433 . ПМИД 24956442 .
- ^ Миронов В., Боланд Т., Труск Т., Форгач Г., Марквальд Р.Р. (апрель 2003 г.). «Печать органов: компьютерная струйная 3D-инженерия тканей». Тенденции в биотехнологии . 21 (4): 157–61. дои : 10.1016/S0167-7799(03)00033-7 . ПМИД 12679063 .
- ^ Альта А (март 2011 г.). «Печать почки человека» . ТЭД . Архивировано из оригинала 26 февраля 2014 года . Проверено 29 ноября 2013 г.
- ^ Ду Ю, Хан Р., Вэнь Ф., Нг Сан Сан С., Ся Л., Воланд Т. и др. (январь 2008 г.). «Синтетическая сэндвич-культура трехмерного монослоя гепатоцитов». Биоматериалы . 29 (3): 290–301. doi : 10.1016/j.bimaterials.2007.09.016 . ПМИД 17964646 .
- ^ Кан Х.В., Ли С.Дж., Ко И.К., Кенгла С., Ю Дж.Дж., Атала А. (март 2016 г.). «Система 3D-биопечати для производства тканевых конструкций человеческого масштаба со структурной целостностью». Природная биотехнология . 34 (3): 312–19. дои : 10.1038/nbt.3413 . ПМИД 26878319 . S2CID 9073831 .
- ^ Мачюлайтис Ю., Девейките М., Рекштите С., Братчиков М., Даринскас А., Шимбелите А. и др. (март 2015 г.). «Доклиническое исследование трехмерных микроструктурированных каркасов из материала SZ2080 для инженерии хрящевой ткани, изготовленных методом фемтосекундной прямой лазерной литографии». Биофабрикация . 7 (1): 015015. Бибкод : 2015BioFa...7a5015M . дои : 10.1088/1758-5090/7/1/015015 . ПМИД 25797444 . S2CID 40712319 .
- ^ Гребенюк Сергей; Абдель Фаттах, Абдель Рахман; Кумар, Манодж; Топрахисар, Ну; Рустанди, Грегори; Вананрой, Аня; Лосось, Идрис; Верфайи, Кэтрин; Крикет, Марк; Ранга, Адриан (12 января 2023 г.). «Крупномасштабные перфузируемые ткани с помощью синтетической 3D-мягкой микрофлюидики» . Природные коммуникации . 14 (1): 193. Бибкод : 2023NatCo..14..193G . дои : 10.1038/ s41467-022-35619-1 ISSN 2041-1723 . ПМЦ 9837048 . ПМИД 36635264 .
- ^ Перейти обратно: а б с Греджио С., Де Франчески Ф., Фигейредо-Ларсен М., Гобаа С., Ранга А., Семб Х. и др. (ноябрь 2013 г.). «Искусственные трехмерные ниши деконструируют развитие поджелудочной железы in vitro» . Разработка . 140 (21): 4452–4462. дои : 10.1242/dev.096628 . ПМК 4007719 . ПМИД 24130330 .
Краткое содержание: «Новый 3D-метод для выращивания миниатюрной модели поджелудочной железы» . Курцвейл . 17 октября 2013 г. - ^ Мол Т.М., Чу Д.В., Непонице А., Ворп Д.А. (декабрь 2011 г.). «Механические стимулы по-разному контролируют поведение стволовых клеток: морфологию, пролиферацию и дифференцировку» . Биомеханика и моделирование в механобиологии . 10 (6): 939–53. дои : 10.1007/s10237-010-0285-8 . ПМК 3208754 . ПМИД 21253809 .
- ^ Питтенджер М.Ф., Маккей А.М., Бек С.К., Джайсвал Р.К., Дуглас Р., Моска Дж.Д. и др. (апрель 1999 г.). «Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека». Наука . 284 (5411): 143–47. Бибкод : 1999Sci...284..143P . дои : 10.1126/science.284.5411.143 . ПМИД 10102814 .
- ^ Ли Э.Л., фон Рекум ХА (май 2010 г.). «Платформа для культивирования клеток с механическим кондиционированием и не повреждающим отделением клеток». Журнал исследований биомедицинских материалов. Часть А. 93 (2): 411–18. дои : 10.1002/jbm.a.32754 . ПМИД 20358641 .
- ^ Кинг Дж.А., Миллер В.М. (август 2007 г.). «Разработка биореактора для размножения стволовых клеток и контролируемой дифференцировки» . Современное мнение в области химической биологии . 11 (4): 394–98. дои : 10.1016/j.cbpa.2007.05.034 . ПМК 2038982 . ПМИД 17656148 .
- ^ Перейти обратно: а б «MC2 Biotek – 3D культура тканей – 3D ProtoTissue System™» . Архивировано из оригинала 28 мая 2012 года.
- ^ Прествич Г.Д. (январь 2008 г.). «Оценка эффективности и токсикологии лекарств в трех измерениях: использование синтетических внеклеточных матриц при открытии лекарств». Отчеты о химических исследованиях . 41 (1): 139–48. дои : 10.1021/ar7000827 . ПМИД 17655274 .
- ^ Фридрих Дж., Зайдель С., Эбнер Р., Кунц-Шугхарт Л.А. (2009). «Скрининг наркотиков на основе сфероидов: соображения и практический подход». Протоколы природы . 4 (3): 309–24. дои : 10.1038/nprot.2008.226 . ПМИД 19214182 . S2CID 21783074 .
- ^ Перейти обратно: а б Маркс V (апрель 2013 г.). «Клеточная культура: лучший напиток» . Природа . 496 (7444): 253–58. Бибкод : 2013Natur.496..253M . дои : 10.1038/496253а . ПМИД 23579682 . S2CID 4399610 .
- ^ Чжан ЗИ, Тео Ш., Чонг В.С., Фу Т.Т., Чнг Ю.К., Чулани М., Чан Дж. (май 2009 г.). «Двуосный вращающийся биореактор для культуры фетальных мезенхимальных стволовых клеток для инженерии костной ткани». Биоматериалы . 30 (14): 2694–704. doi : 10.1016/j.bimaterials.2009.01.028 . ПМИД 19223070 .
- ^ Кан К.С., Ли С.Дж., Ли Х.С., Мун В., Чо Д.В. (июнь 2011 г.). «Влияние комбинированной механической стимуляции на пролиферацию и дифференцировку преостеобластов» . Экспериментальная и молекулярная медицина . 43 (6): 367–73. дои : 10.3858/эмм.2011.43.6.040 . ПМК 3128915 . ПМИД 21532314 .
- ^ Россер Дж., Томас DJ (январь 2018 г.). «10 – Биореакторные процессы для созревания 3D-биопечатной ткани». В Thomas DJ, Джессоп З.М., Уитакер И.С. (ред.). 3D-биопечать в реконструктивной хирургии . Издательство Вудхед. стр. 191–215. ISBN 978-0-08-101103-4 .
- ^ Гриффит Л.Г., Шварц М.А. (март 2006 г.). «Изучение сложной физиологии трехмерных тканей in vitro». Обзоры природы. Молекулярно-клеточная биология . 7 (3): 211–24. дои : 10.1038/nrm1858 . ПМИД 16496023 . S2CID 34783641 .
- ^ Оноэ Х., Окицу Т., Ито А., Като-Негиши М., Годзё Р., Кирия Д. и др. (июнь 2013 г.). «Нагруженные клетками микроволокна метровой длины демонстрируют морфологию и функции тканей». Природные материалы . 12 (6): 584–90. Бибкод : 2013NatMa..12..584O . дои : 10.1038/nmat3606 . ПМИД 23542870 .
- ^ Перейти обратно: а б Ван Икс (январь 2019 г.). «Технологии изготовления биоискусственных органов» . Трансплантация клеток . 28 (1): 5–17. дои : 10.1177/0963689718809918 . ПМК 6322143 . ПМИД 30477315 .
- ^ Сава Ю., Мацумия Г., Мацуда К., Тацуми Э., Абэ Т., Фукунага К. и др. (март 2018 г.). «Журнал «Искусственные органы» 2017: итоги года: Редакционная комиссия журнала «Искусственные органы» . Журнал искусственных органов . 21 (1): 1–7. дои : 10.1007/s10047-018-1018-5 . ПМК 7102331 . ПМИД 29426998 .
- ^ Перейти обратно: а б Чаухан С., Субин С. (1 сентября 2011 г.). «Экстракорпоральная мембранная оксигенация, взгляд анестезиолога: физиология и принципы. Часть 1» . Анналы сердечной анестезии . 14 (3): 218–29. дои : 10.4103/0971-9784.84030 . ПМИД 21860197 .
- ^ «Как началось ЭКМО?» . Больницы и клиники Университета Айовы . 20 июня 2017 г. Проверено 4 декабря 2020 г.
- ^ «Хондроитинсульфат является компонентом шаблона дермальной регенерации Integra®» . fdocuments.us . Проверено 5 декабря 2020 г.
- ^ «Интегра» (PDF) . Проверено 13 марта 2023 г.
- ^ «Дермопласт, полученный из фибробластов человека, дермальный заменитель» . dermagraft.com . Проверено 5 декабря 2020 г.
- ^ Колвин М., Смит Дж.М., Хэдли Н., Скинс М.А., Уччеллини К., Леман Р. и др. (февраль 2019 г.). «Годовой отчет OPTN/SRTR за 2017 год: сердце» . Американский журнал трансплантологии . 19 (Приложение 2): 323–403. дои : 10.1111/ajt.15278 . hdl : 2027.42/172019 . ПМИД 30811894 . S2CID 73510324 .
- ^ Смит, Пенсильвания, Кон В.Е., Фрейзер, Огайо (1 января 2018 г.). «Глава 7 – Тотальные искусственные сердца». Механическая поддержка кровообращения и дыхания . Академическая пресса. стр. 221–44. дои : 10.1016/B978-0-12-810491-0.00007-2 .
- ^ Хан С., Джехангир В. (октябрь 2014 г.). «Эволюция искусственных сердец: обзор и история» . Кардиологические исследования . 5 (5): 121–25. дои : 10.14740/cr354w . ПМК 5358116 . ПМИД 28348709 .
- ^ Мелтон Н., Сулеймани Б., Даулинг Р. (ноябрь 2019 г.). «Текущая роль полного искусственного сердца в лечении прогрессирующей сердечной недостаточности». Текущие кардиологические отчеты . 21 (11): 142. дои : 10.1007/s11886-019-1242-5 . ПМИД 31758343 . S2CID 208212152 .
- ^ Кук Дж.А., Шах К.Б., Квадер М.А., Кук Р.Х., Касираджан В., Рао К.К. и др. (декабрь 2015 г.). «Полное искусственное сердце» . Журнал торакальных заболеваний . 7 (12): 2172–80. дои : 10.3978/j.issn.2072-1439.2015.10.70 . ПМК 4703693 . ПМИД 26793338 .
- ^ Перейти обратно: а б с д Тасним Ф., Дэн Р., Ху М., Лиур С., Ли Ю., Ни М. и др. (август 2010 г.). «Достижения и проблемы разработки биоискусственной почки» . Фиброгенез и восстановление тканей . 3 (14): 14. дои : 10.1186/1755-1536-3-14 . ПМК 2925816 . ПМИД 20698955 .
- ^ Перейти обратно: а б Хьюмс Х.Д., Баффингтон Д., Вестовер А.Дж., Рой С., Фиссел WH (март 2014 г.). «Биоискусственная почка: современное состояние и перспективы на будущее». Детская нефрология . 29 (3): 343–51. дои : 10.1007/s00467-013-2467-y . ПМИД 23619508 . S2CID 19376597 .
- ^ Су Дж., Сатчелл С.С., Шах Р.Н., Вертхайм Дж.А. (сентябрь 2018 г.). «Децеллюляризированные гидрогели внеклеточного матрикса почек: реологическая характеристика и реакция эндотелиальных клеток клубочков человека на инкапсуляцию» . Журнал исследований биомедицинских материалов. Часть А. 106 (9): 2448–2462. дои : 10.1002/jbm.a.36439 . ПМК 6376869 . ПМИД 29664217 .
- ^ Ли С.Дж., Ван Х.Дж., Ким Т.Х., Чой Дж.С., Кулкарни Дж., Джексон Дж.Д. и др. (февраль 2018 г.). «Регенерация почечной ткани in situ, вызванная инъекцией гидрогеля коллагена» . Трансляционная медицина стволовых клеток . 7 (2): 241–250. дои : 10.1002/sctm.16-0361 . ПМК 5788870 . ПМИД 29380564 .
- ^ У Х, Чжан Р, Ху Б, Хэ Ю, Чжан Ю, Цай Л, Ван Л, Ван Г, Хоу Х, Цю Икс (декабрь 2021 г.). «Пористый гидрогелевый каркас, имитирующий внеклеточный матрикс, с коллагеном, полученным из плавательного пузыря, для регенерации почечной ткани». Китайские химические буквы . 32 (12): 3940–3947. дои : 10.1016/j.cclet.2021.04.043 . S2CID 235570487 .
- ^ Моу Х, Шах Дж., Бхаттачарья Р., Каледжайе Т.Д., Сунь Б., Сюй ПК, Муса С. (апрель 2022 г.). «Биомиметическая электропряденая мембрана поддерживает дифференцировку и созревание эпителия почек из стволовых клеток человека» . Биоинженерия . 9 (5): 188. doi : 10.3390/bioengineering9050188 . ПМЦ 9137565 . ПМИД 35621466 .
- ^ Ли Э, Пак К.В., Чун С.Ю., Ким Х, Квон Т.Г., Чжун Ю.К., Хан Д.К. (август 2016 г.). «Биомиметические пористые каркасы из PLGA, включающие децеллюляризованный внеклеточный матрикс для регенерации тканей почек». Прикладные материалы и интерфейсы ACS . 8 (33): 21145–21154. дои : 10.1021/acsami.6b03771 . ПМИД 27456613 .
- ^ Бертон Т.П., Калланан А. (июнь 2018 г.). «Нетканый путь: электропряденые каркасы из полимолочной кислоты для инженерии тканей почек» . Тканевая инженерия и регенеративная медицина . 15 (3): 301–310. дои : 10.1007/s13770-017-0107-5 . ПМК 6171675 . ПМИД 30603555 .
- ^ Мирмохтадаи М., Хабушан А.С., Мохаммади Б., Садр М., Фарманд Х., Хасаннежад З., Каджбафзаде А.М. (декабрь 2022 г.). «Инженерия почечной ткани в доклинических моделях почечной недостаточности: систематический обзор и метаанализ». Регенеративная медицина . 17 (12): 941–955. дои : 10.2217/rme-2022-0084 . ПМИД 36154467 . S2CID 252543376 .
- ^ Перейти обратно: а б Хван Дж., Чон Й., Пак Дж.М., Ли К.Х., Хон Дж.В., Чхве Дж. (8 сентября 2015 г.). «Биомиметика: прогнозирование будущего науки, техники и медицины» . Международный журнал наномедицины . 10 : 5701–13. дои : 10.2147/IJN.S83642 . ПМЦ 4572716 . ПМИД 26388692 .
- ^ «Ученые имитируют нервную ткань в рамках исследования, финансируемого армией, которое может привести к созданию искусственной кожи» . Исследовательская лаборатория армии США. 20 марта 2018 года . Проверено 22 сентября 2020 г.
- ^ Перейти обратно: а б Личел Т., Нортон М.М., Церунян В., Фраден С. (февраль 2018 г.). «Инженерные реакционно-диффузионные сети со свойствами нервной ткани». Лаборатория на чипе . 18 (5): 714–22. arXiv : 1711.00444 . дои : 10.1039/C7LC01187C . ПМИД 29297916 . S2CID 3567908 .
- ^ Перейти обратно: а б «Мягкие роботы» . фраденлаб . Проверено 22 августа 2018 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м Умемура М. (3 апреля 2019 г.). «Вызов проблемы «пригодности»: развитие отрасли регенеративной медицины в США, Великобритании и Японии». История бизнеса . 61 (3): 456–480. дои : 10.1080/00076791.2018.1476496 . ISSN 0007-6791 . S2CID 158171857 .
- ^ Перейти обратно: а б с д и Буши А. (декабрь 2002 г.). «Фирмы тканевой инженерии терпят крах». Природная биотехнология . 20 (12): 1178–79. дои : 10.1038/nbt1202-1178 . ПМИД 12454657 . S2CID 9682305 .
- ^ Перейти обратно: а б с д Браун Н., Фолкнер А., Кент Дж., Майкл М. (1 февраля 2006 г.). «Регулирование гибридов: «наведение беспорядка» и «очистка» в тканевой инженерии и трансплантации трансформ» . Социальная теория и здоровье . 4 (1): 1–24. дои : 10.1057/palgrave.sth.8700062 . ПМК 7099299 . ПМИД 32226319 .
- ^ Дерксен М.Х. (2008). Инженерная плоть: к профессиональной ответственности за «живые тела» в тканевой инженерии . Эйндховенский технологический университет. ISBN 978-90-386-1428-1 . [ нужна страница ]
- ^ Кент Дж., Фолкнер А., Гисинк И., Фитцпатрик Д. (1 января 2006 г.). «На пути к управлению технологиями тканевой инженерии человека в Европе: обоснование нового режима регулирования». Технологическое прогнозирование и социальные изменения . Технологии и социальные риски. 73 (1): 41–60. doi : 10.1016/j.techfore.2005.06.006 .
- ^ Директива 2004/23/EC Европейского парламента и Совета от 31 марта 2004 г. об установлении стандартов качества и безопасности донорства, закупок, тестирования, обработки, консервации, хранения и распределения человеческих тканей и клеток , vol. OJ L, 7 апреля 2004 г. , дата обращения 7 мая 2020 г.
- ^ Фолкнер А., Кент Дж., Гисинк И., ФитцПатрик Д. (ноябрь 2006 г.). «Чистота и опасности регенеративной медицины: нормативные инновации в области тканевой инженерии человека» . Социальные науки и медицина . 63 (9): 2277–88. doi : 10.1016/j.socscimed.2006.06.006 . ПМК 7130933 . ПМИД 16905231 .
Ссылки
[ редактировать ]- Дэвис М.Э., Motion JP, Нармонева Д.А., Такахаши Т., Хакуно Д., Камм Р.Д. и др. (февраль 2005 г.). «Инъекционные самособирающиеся пептидные нановолокна создают внутримиокардиальную микросреду для эндотелиальных клеток» . Тираж . 111 (4): 442–50. дои : 10.1161/01.CIR.0000153847.47301.80 . ПМЦ 2754569 . ПМИД 15687132 .
- Дерксен М.Х. (2008). Инженерная плоть: к профессиональной ответственности за «живые тела» в тканевой инженерии . Эйндховенский технологический университет. ISBN 978-90-386-1428-1 .
- Фонтан ГА (15 сентября 2012 г.). «Первое: органы, изготовленные по индивидуальному заказу из собственных клеток организма» . Нью-Йорк Таймс .
- Холмс Т.К., де Лакаль С., Су X, Лю Г, Рич А., Чжан С. (июнь 2000 г.). «Обширный рост нейритов и активное образование синапсов на самособирающихся пептидных каркасах» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (12): 6728–6733. Бибкод : 2000PNAS...97.6728H . дои : 10.1073/pnas.97.12.6728 . ЧВК 18719 . ПМИД 10841570 .
- Идрус А.А. (12 сентября 2018 г.). «Показатели жизненно важной терапии падают на 88%, прекращается лечение печени после неудачи 3-й фазы» . Жестокая биотехнология .
- Ма ПХ (май 2004 г.). «Скаффолды для изготовления тканей» . Материалы сегодня . 7 (5): 30–40. дои : 10.1016/s1369-7021(04)00233-0 .
- Микос А.Г., Теменофф Дж.С. (2000). «Формирование высокопористых биоразлагаемых каркасов для тканевой инженерии» (PDF) . Электронный журнал биотехнологии . 3 (2): 114–19. doi : 10.2225/vol3-issue2-fulltext-5 .
- Нерем Р.М. (2000). Ваканти Дж., Ланца Р.П., Лангер Р.С. (ред.). Принципы тканевой инженерии (2-е изд.). Бостон: Академическая пресса. ISBN 978-0-12-436630-5 .
- Семино С.Э., Касахара Дж., Хаяши Ю., Чжан С. (2004). «Захват мигрирующих нервных клеток гиппокампа в трехмерный каркас из пептидных нановолокон». Тканевая инженерия . 10 (3–4): 643–55. дои : 10.1089/107632704323061997 . ПМИД 15165480 .
- Томпсон Дж., Джонс Н., Аль-Хафаджи А., Малик С., Райх Д., Муньос С. и др. (март 2018 г.). «Экстракорпоральная клеточная терапия (ЭЛАД) при тяжелом алкогольном гепатите: многонациональное проспективное контролируемое рандомизированное исследование» . Трансплантация печени . 24 (3): 380–93. дои : 10.1002/lt.24986 . ПМЦ 5873437 . ПМИД 29171941 .
- Вишвакарма А (2014). Биология стволовых клеток и тканевая инженерия в стоматологии . Эльзевир. ISBN 978-0123971579 .
- Виола Дж., Лал Б., Град О. (14 октября 2003 г.). Появление тканевой инженерии как области исследований (PDF) (Отчет). Абт Ассошиэйтс Инк. «Альтернативная веб-страница» – через nsf.gov.
Внешние ссылки
[ редактировать ]- Клеточная инженерия костной ткани
- Клинический центр тканевой инженерии Инициатива штата Огайо по тканевой инженерии (Национальный центр регенеративной медицины)
- Печать органов. Архивировано 28 августа 2008 г. в Wayback Machine , финансируемой NSF. многоцентровой инициативе
- Инициатива Центра LOEX Университета Лаваля в области тканевой инженерии
