Натриево-калиевый насос
| Уже + /К + -АТФазный насос | |||
|---|---|---|---|
 Натрий-калиевый насос, состояние E2-Pi. Рассчитанные углеводородные границы липидного бислоя показаны синей (внутриклеточной) и красной (внеклеточной) плоскостями. | |||
| Идентификаторы | |||
| Номер ЕС. | 7.2.2.13 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||


Натрий -калиевый насос ( натрий - калиевая аденозинтрифосфатаза , также известный как Уже + /К + -АТФаза , Уже + /К + насос , или натриево-калиевая АТФаза ) — фермент ( электрогенная трансмембранная АТФаза ), обнаруженный в мембране всех клеток животных . Он выполняет несколько функций в клеточной физиологии .
The Уже + /К + - Фермент АТФаза активен (т.е. использует энергию АТФ ). На каждую молекулу АТФ, которую использует насос, экспортируются три иона натрия и импортируются два иона калия. [1] Таким образом, за цикл работы насоса происходит чистый экспорт одного положительного заряда. Конечным эффектом является внеклеточная концентрация ионов натрия, которая в 5 раз превышает внутриклеточную концентрацию, и внутриклеточная концентрация ионов калия, которая в 30 раз превышает внеклеточную концентрацию. [1]
Натрий-калиевый насос был открыт в 1957 году датским ученым Йенсом Кристианом Скоу , который был удостоен Нобелевской премии за свою работу в 1997 году. Его открытие ознаменовало важный шаг вперед в понимании того, как ионы попадают в клетки и выходят из них, а также это имеет особое значение для возбудимых клеток, таких как нервные клетки , которые зависят от этого насоса, чтобы реагировать на раздражители и передавать импульсы.
У всех млекопитающих есть четыре различных подтипа или изоформы натриевой помпы. Каждый из них обладает уникальными свойствами и моделями экспрессии в тканях. [2] Этот фермент принадлежит к семейству АТФаз Р-типа .
Функция
[ редактировать ]The Уже + /К + -АТФаза помогает поддерживать потенциал покоя , влияет на транспорт и регулирует объем клеток . [3] Он также действует как преобразователь/интегратор сигнала для регулирования пути МАРК , активных форм кислорода (АФК), а также внутриклеточного кальция. Фактически, все клетки расходуют большую часть вырабатываемого ими АТФ (обычно от 30% до 70% внервные клетки) для поддержания необходимых цитозольных Na и Kконцентрации. [4] Для нейронов, Уже + /К + -АТФаза может отвечать за до 3/4 энергетических затрат клетки. [5] Во многих типах тканей потребление АТФ Уже + /К + -АТФазы связаны с гликолизом . Впервые это было обнаружено в красных кровяных тельцах (Schrier, 1966), но позднее было обнаружено и в почечных клетках. [6] гладкие мышцы, окружающие кровеносные сосуды, [7] и сердечные клетки Пуркинье . [8] Недавно было показано, что гликолиз имеет особое значение для Уже + /К + -АТФаза в скелетных мышцах, где ингибирование распада гликогена (субстрата гликолиза ) приводит к снижению Уже + /К + -АТФазная активность и снижение производства силы. [9] [10] [11]
Потенциал покоя
[ редактировать ]
Чтобы поддерживать потенциал клеточной мембраны, клетки поддерживают низкую концентрацию ионов натрия и высокий уровень ионов калия внутри клетки ( внутриклеточно ). Механизм натрий-калиевой помпы выводит 3 иона натрия и внутрь 2 иона калия, таким образом, в общей сложности удаляя один положительный носитель заряда из внутриклеточного пространства ( см. § Механизм подробнее ). Кроме того, в мембране имеется канал короткого замыкания (т.е. ионный канал с высокой проницаемостью для калия) для калия, поэтому напряжение на плазматической мембране близко к потенциалу Нернста калия.
Потенциал разворота
[ редактировать ]Даже если оба К + и Уже + ионы имеют одинаковый заряд, они все же могут иметь очень разные равновесные потенциалы как для внешней, так и для внутренней концентрации. Натриево-калиевый насос движется к неравновесному состоянию с относительными концентрациями Уже + и К + как внутри, так и снаружи клетки. Например, концентрация К + в цитозоле составляет 100 мМ , тогда как концентрация Уже + составляет 10 мм. С другой стороны, во внеклеточном пространстве обычный диапазон концентраций К + составляет около 3,5-5 мМ, тогда как концентрация Уже + составляет около 135-145 мМ. [ нужна ссылка ]
Транспорт
[ редактировать ]Экспорт ионов натрия из клетки обеспечивает движущую силу для нескольких вторичных активных переносчиков, таких как мембранные транспортные белки , которые импортируют глюкозу , аминокислоты и другие питательные вещества в клетку с помощью градиента ионов натрия.
Еще одна важная задача Уже + - К + насос должен обеспечить Уже + градиент, который используется определенными процессами-носителями. Например, в кишечнике натрий выводится из реабсорбирующих клеток на стороне крови ( интерстициальной жидкости ) через Уже + - К + насос, тогда как на реабсорбирующей (просветной) стороне Уже + глюкозы -симпортер использует созданный Уже + градиент как источник энергии для импорта обоих Уже + и глюкоза, которая гораздо более эффективна, чем простая диффузия. Аналогичные процессы локализуются в почечной канальцевой системе .
Контроль объема клеток
[ редактировать ]Неудача Уже + - К + насосы могут привести к набуханию клетки. клетки Осмолярность представляет собой сумму концентраций различных видов ионов , многих белков и других органических соединений внутри клетки. Когда она выше, чем осмолярность снаружи клетки, вода поступает в клетку посредством осмоса . Это может привести к разбуханию и лизису клеток . Уже + - К + насос помогает поддерживать нужную концентрацию ионов.Более того, когда клетка начинает набухать, это автоматически активирует Уже + - К + насос, поскольку он изменяет внутреннюю концентрацию Уже + - К + к которому чувствителен насос. [12]
Работа в качестве преобразователя сигнала
[ редактировать ]В течение последнего десятилетия [ когда? ] Многие независимые лаборатории продемонстрировали, что, в дополнение к классическому транспорту ионов, этот мембранный белок может также передавать внеклеточную сигнализацию, связывающую уабаин , в клетку посредством регуляции фосфорилирования тирозина белка . Например, в исследовании изучалась функция Уже + /К + -АТФаза в мышцах стопы и гепатопанкреасе наземной улитки Otala Lactea путем сравнения активного и эстивационного состояний. [13] Они пришли к выводу, что обратимое фосфорилирование может контролировать те же способы координации использования АТФ этим ионным насосом со скоростью генерации АТФ катаболическими путями при эстивации O. Lactea . Последующие сигналы посредством событий фосфорилирования белков, запускаемых уабаином, включают активацию сигнальных каскадов митоген-активируемой протеинкиназы (MAPK), выработку митохондриальными активных форм кислорода (АФК), а также активацию фосфолипазы C (PLC) и инозитолтрифосфата (IP3). рецептор ( IP3R ) в различных внутриклеточных компартментах. [14]
Белково-белковые взаимодействия играют очень важную роль в Уже + - К + передача сигнала, опосредованная насосом. Например, Уже + - К + Насос напрямую взаимодействует с Src , нерецепторной тирозинкиназой , с образованием сигнального рецепторного комплекса. [15] Src изначально блокируется Уже + - К + насос. Однако при последующем связывании уабаина киназный домен Src высвобождается и затем активируется. Согласно этому сценарию, NaKtide, пептидный ингибитор Src, полученный из Уже + - К + насос, был разработан как функциональный уабаин- Уже + - К + передача сигнала, опосредованная насосом. [16] Уже + - К + насос также взаимодействует с анкирином , IP3R , PI3K , PLCgamma1 и кофилином . [17]
Управление состояниями активности нейронов
[ редактировать ]The Уже + - К + Было показано, что насос контролирует и устанавливает режим внутренней активности мозжечка нейронов Пуркинье . [18] добавочной обонятельной луковицы Митральные клетки [19] и, возможно, другие типы нейронов. [20] Это предполагает, что насос может быть не просто гомеостатической молекулой, «хозяйственной» для ионных градиентов, но может быть вычислительным элементом в мозжечке и мозге . [21] Действительно, мутация в Уже + - К + насос вызывает быстрое начало дистонии — паркинсонизма , симптомы которого указывают на то, что это патология вычислений мозжечка. [22] Кроме того, уабаина блок Уже + - К + насосы в мозжечке живой мыши приводят к развитию атаксии и дистонии . [23] Алкоголь подавляет натриево-калиевые насосы в мозжечке, и, вероятно, именно поэтому он нарушает работу мозжечка и координацию тела. [24] [25] Распределение Уже + - К + Было продемонстрировано, что насос миелинизированных аксонов в человеческом мозге происходит вдоль межузловой аксолеммы , а не внутри узловой аксолеммы, как считалось ранее. [26] Уже + - К + дисфункция помпы связана с различными заболеваниями, включая эпилепсию и пороки развития головного мозга. [27]
Механизм
[ редактировать ]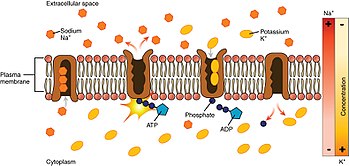
Глядя на процесс, начиная с внутренней части клетки:
- Насос имеет более высокое сродство к Уже + ионы, чем К + ионов, таким образом, после связывания АТФ связывает 3 внутриклеточных Уже + ионы. [3]
- АТФ гидролизуется , что приводит к фосфорилированию насоса по высококонсервативному остатку аспартата и последующему высвобождению АДФ . Этот процесс приводит к конформационному изменению насоса.
- Конформационные изменения обнажают Уже + ионы во внеклеточную область. Фосфорилированная форма насоса имеет низкое сродство к Уже + ионы, поэтому они высвобождаются; напротив, он имеет высокое сродство к К + ионы.
- Насос связывает 2 внеклеточных К + ионов, что вызывает дефосфорилирование насоса, возвращая его в предыдущее конформационное состояние, тем самым высвобождая К + ионы в клетку.
- Нефосфорилированная форма насоса имеет более высокое сродство к Уже + ионы. АТФ связывается, и процесс начинается снова.
Регулирование
[ редактировать ]Эндогенный
[ редактировать ]The Уже + /К + -АТФаза активируется цАМФ . [28] Таким образом, вещества, вызывающие повышение уровня цАМФ, активируют Уже + /К + -АТФаза. К ним относятся лиганды G s -связанных GPCR. Напротив, вещества, вызывающие снижение уровня цАМФ, подавляют Уже + /К + -АТФаза. К ним относятся лиганды G i -связанных GPCR. Примечание. Ранние исследования указывали на противоположный эффект, но позже выяснилось, что они были неточными из-за дополнительных осложняющих факторов. [ нужна ссылка ]
The Уже + /К + -АТФаза эндогенно отрицательно регулируется инозитолпирофосфатом 5-InsP7, внутриклеточной сигнальной молекулой, генерируемой IP6K1 , которая ослабляет аутоингибирующий домен PI3K p85α , вызывая эндоцитоз и деградацию. [29]
The Уже + /К + -АТФаза также регулируется обратимым фосфорилированием. Исследования показали, что при оценке животных Уже + /К + -АТФаза находится в фосфорилированной форме с низкой активностью. Дефосфорилирование Уже + /К + -АТФаза может восстановить его до формы с высокой активностью. [13]
Экзогенный
[ редактировать ]The Уже + /К + -АТФазу можно фармакологически модифицировать путем экзогенного введения лекарств. Его экспрессия также может быть изменена с помощью таких гормонов, как трийодтиронин , гормон щитовидной железы . [13] [30]
Например, Уже + /К + -АТФаза, обнаруженная в мембране клеток сердца, является важной мишенью сердечных гликозидов (например, дигоксина и уабаина ), инотропных препаратов, используемых для улучшения работы сердца за счет увеличения силы его сокращения.
Сокращение мышц зависит от внутриклеточного напряжения, которое в 100–10 000 раз превышает уровень покоя. Что 2+ концентрация внимания, вызванная Что 2+ высвобождение из саркоплазматического ретикулума мышечных клеток. Сразу после мышечного сокращения внутриклеточный Что 2+ быстро возвращается к нормальной концентрации ферментом-переносчиком в плазматической мембране и кальциевым насосом в саркоплазматическом ретикулуме , вызывая расслабление мышц.
Согласно гипотезе Блаустейна, [31] этот фермент-носитель ( Уже + /Что 2+ обменник, NCX) использует градиент Na, генерируемый Уже + - К + насос для удаления Что 2+ из внутриклеточного пространства, что замедляет Уже + - К + насос приводит к постоянно повышенному Что 2+ уровень в мышцах , что может быть механизмом долговременного инотропного эффекта сердечных гликозидов, таких как дигоксин. Проблема с этой гипотезой заключается в том, что при фармакологических концентрациях наперстянки менее 5% молекул Na/K-АТФазы – особенно изоформы α2 в гладких мышцах сердца и артерий ( Kd на = 32 нМ) – ингибируются, чего недостаточно, чтобы повлиять внутриклеточная концентрация Уже + . Однако, помимо популяции Na/K-АТФазы в плазматической мембране, ответственной за транспорт ионов, в кавеолах существует еще одна популяция , которая действует как рецептор наперстянки и стимулирует рецептор EGF . [32] [33] [34] [35]
Фармакологическое регулирование
[ редактировать ]При определенных состояниях, например, при сердечно-сосудистых заболеваниях, Уже + /К + -АТФазу, возможно, необходимо ингибировать фармакологическими средствами. Обычно используемым ингибитором, используемым при лечении сердечно-сосудистых заболеваний, является дигоксин ( сердечный гликозид ), который по существу связывается «с внеклеточной частью фермента, то есть связывает калий, когда он находится в фосфорилированном состоянии, для переноса калия внутрь клетки». [36] После того, как происходит это необходимое связывание, происходит дефосфорилирование альфа-субъединицы, что снижает последствия сердечно-сосудистых заболеваний. Именно за счет ингибирования Уже + /К + -АТФаза вызывает повышение уровня натрия внутри клетки, что в конечном итоге увеличивает концентрацию внутриклеточного кальция через натрий-кальциевый обменник. Повышенное присутствие кальция позволяет увеличить силу сокращения. В случае пациентов, у которых сердце не работает достаточно сильно, чтобы обеспечить организм всем необходимым, использование дигоксина помогает временно преодолеть эту проблему.
Открытие
[ редактировать ]Уже + /К + -АТФаза была предложена Йенсом Кристианом Скоу в 1957 году, когда он работал доцентом кафедры физиологии Орхусского университета , Дания . В том же году он опубликовал свою работу. [37]
В 1997 году он получил половину Нобелевской премии по химии «за первое открытие фермента, переносящего ионы». Уже + ,К + -АТФаза». [38]
Гены
[ редактировать ]- Альфа: АТФ1А1 , АТФ1А2 , АТФ1А3 , АТФ1А4 . ATP1A1 повсеместно экспрессируется у позвоночных, а ATP1A3 — в нервной ткани. ATP1A2 также известен как «альфа (+)». ATP1A4 специфичен для млекопитающих.
- Бета: АТФ1В1 , АТФ1В2 , АТФ1В3.
ATP1B4 , хотя и тесно связан с ATP1B1, ATP1B2 и ATP1B3, утратил свою функцию как Уже + /К + -бета-субъединица АТФазы. [39]
Параллельная эволюция резистентности к кардиотоническим стероидам у многих позвоночных
[ редактировать ]В нескольких исследованиях подробно описана эволюция резистентности к кардиотоническим стероидам семейства генов альфа-субъединицы Na/K-АТФазы (АТФ1А) у позвоночных посредством аминокислотных замен, наиболее часто расположенных в первом домене внеклеточной петли. [40] [41] [42] [43] [44] [45] [46] Аминокислотные замены, обеспечивающие устойчивость к кардиотоническим стероидам, неоднократно развивались независимо во всех основных группах четвероногих. [44] ATP1A1 был дублирован в некоторых группах лягушек, а неофункционализированные дубликаты несут те же самые замены, устойчивые к кардиотоническим стероидам (Q111R и N122D), обнаруженные у мышей, крыс и других муроидов. [47] [40] [41] [42]
У насекомых
[ редактировать ]У Drosophila melanogaster альфа-субъединица Уже + /К + -АТФаза имеет два паралога: ATPα (ATPα1) и JYalpha (ATPα2), возникшие в результате древней дупликации у насекомых. [48] У дрозофилы ATPα1 экспрессируется повсеместно и высоко, тогда как ATPα2 наиболее высоко экспрессируется в семенниках самцов и необходим для мужской фертильности. У насекомых есть по крайней мере одна копия обоих генов, а иногда и дупликации. Низкая экспрессия АТФα2 отмечена и у других насекомых. Дупликации и неофункционализация ATPα1 наблюдались у насекомых, адаптированных к кардиотоническим стероидным токсинам, таким как карденолиды и буфадиенолиды . [48] [49] [50] Насекомые, адаптированные к кардиотоническим стероидам, обычно имеют ряд аминокислотных замен, чаще всего в первой внеклеточной петле АТФα1, которые придают устойчивость к ингибированию кардиотоническими стероидами. [51] [52]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Ганьон КБ, Дельпир Э (2021). «Переносчики натрия в здоровье и болезнях человека (рис. 2)» . Границы в физиологии . 11 : 588664. doi : 10.3389/fphys.2020.588664 . ПМЦ 7947867 . ПМИД 33716756 .
- ^ Клаузен М.В., Хильберс Ф., Поульсен Х. (июнь 2017 г.). «Структура и функции изоформ Na,K-АТФазы в здоровье и болезни» . Границы в физиологии . 8 : 371. дои : 10.3389/fphys.2017.00371 . ПМЦ 5459889 . ПМИД 28634454 .
- ^ Перейти обратно: а б Холл Дж. Э., Гайтон AC (2006). Учебник медицинской физиологии . Сент-Луис, Миссури: Эльзевир Сондерс. ISBN 978-0-7216-0240-0 .
- ^ Voet D, Voet JG (декабрь 2010 г.). «Раздел 20-3: Активный транспорт, управляемый АТФ». Биохимия (4-е изд.). Джон Уайли и сыновья. п. 759. ИСБН 978-0-470-57095-1 .
- ^ Ховарт С., Глисон П., Аттвелл Д. (июль 2012 г.). «Обновленные энергетические балансы для нейронных вычислений в неокортексе и мозжечке» . Журнал церебрального кровотока и метаболизма . 32 (7): 1222–32. дои : 10.1038/jcbfm.2012.35 . ПМК 3390818 . ПМИД 22434069 .
- ^ Сандерс М.Дж., Саймон Л.М., Мисфельдт Д.С. (март 1983 г.). «Трансэпителиальный транспорт в культуре клеток: биоэнергетика транспорта, связанного с Na-, D-глюкозой». Журнал клеточной физиологии . 114 (3): 263–6. дои : 10.1002/jcp.1041140303 . ПМИД 6833401 . S2CID 22543559 .
- ^ Линч Р.М., Пол Р.Дж. (март 1987 г.). «Распределение углеводного обмена в гладких мышцах сосудов». Американский журнал физиологии . 252 (3 ч. 1): C328-34. дои : 10.1152/ajpcell.1987.252.3.c328 . ПМИД 3030131 .
- ^ Глич Х.Г., Таппе А. (январь 1993 г.). "На + /К + Насос сердечных клеток Пуркинье преимущественно питается за счет гликолитической продукции АТФ». Pflügers Archiv . 422 (4): 380–5. : 10.1007 /bf00374294 . PMID 8382364. . S2CID 25076348 doi
- ^ Дутка Т.Л., Лэмб Г.Д. (сентябрь 2007 г.). "На + -К + насосы в поперечной трубчатой системе волокон скелетных мышц преимущественно используют АТФ из гликолиза». American Journal of Physiology. Cell Physiology . 293 (3): C967-77. : 10.1152 /ajpcell.00132.2007 . PMID 17553934. . S2CID 2291836 doi
- ^ Ватанабэ Д., Вада М. (декабрь 2019 г.). «Влияние снижения мышечного гликогена на связь возбуждения и сокращения в быстросокращающихся мышцах крыс: исследование удаления гликогена». Журнал исследований мышц и подвижности клеток . 40 (3–4): 353–364. дои : 10.1007/s10974-019-09524-y . ПМИД 31236763 . S2CID 195329741 .
- ^ Йенсен Р., Нильсен Дж., Ортенблад Н. (февраль 2020 г.). «Ингибирование гликогенолиза продлевает период повторного запуска потенциала действия и ухудшает мышечную функцию скелетных мышц крыс» . Журнал физиологии . 598 (4): 789–803. дои : 10.1113/JP278543 . ПМИД 31823376 . S2CID 209317559 .
- ^ Армстронг CM (май 2003 г.). «Насос Na/K, ион Cl и осмотическая стабилизация клеток» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (10): 6257–62. Бибкод : 2003PNAS..100.6257A . дои : 10.1073/pnas.0931278100 . ПМК 156359 . ПМИД 12730376 .
- ^ Перейти обратно: а б с Рамнанан CJ, Storey KB (февраль 2006 г.). «Подавление Na + /К + -АТФазная активность во время периода созревания у наземной улитки Otala Lactea » . Журнал экспериментальной биологии . 209 (Pt 4): 677–88. : 10.1242 /jeb.02052 . PMID 16449562. . S2CID 39271006 doi
- ^ Юань З., Цай Т., Тянь Дж., Иванов А.В., Джованнуччи Д.Р., Се З. (сентябрь 2005 г.). «Na/K-АТФаза связывает фосфолипазу C и рецептор IP3 в комплекс, регулирующий кальций» . Молекулярная биология клетки . 16 (9): 4034–45. doi : 10.1091/mbc.E05-04-0295 . ПМК 1196317 . ПМИД 15975899 .
- ^ Тянь Дж., Цай Т., Юань З., Ван Х., Лю Л., Хаас М. и др. (январь 2006 г.). «Привязка Src к Na + /К + -АТФаза образует функциональный сигнальный комплекс» . Molecular Biology of the Cell . 17 (1): 317–26. : 10.1091 /mbc.E05-08-0735 . PMC 1345669. . PMID 16267270 doi
- ^ Ли З, Цай Т, Тянь Дж, Се JX, Чжао X, Лю Л и др. (июль 2009 г.). «NaKtide, пептидный ингибитор Src, производный Na/K-АТФазы, противодействует активируемой уабаином сигнальной трансдукции в культивируемых клетках» . Журнал биологической химии . 284 (31): 21066–76. дои : 10.1074/jbc.M109.013821 . ПМЦ 2742871 . ПМИД 19506077 .
- ^ Ли К., Юнг Дж., Ким М., Гуидотти Дж. (январь 2001 г.). «Взаимодействие альфа-субъединицы Na,K-АТФазы с кофилином» . Биохимический журнал . 353 (Часть 2): 377–85. дои : 10.1042/0264-6021:3530377 . ПМЦ 1221581 . ПМИД 11139403 .
- ^ Форрест, доктор медицинских наук, Уолл, MJ, Press DA, Фэн Дж (декабрь 2012 г.). «Натрий-калиевый насос контролирует внутреннюю активность нейрона Пуркинье мозжечка» . ПЛОС ОДИН . 7 (12): e51169. Бибкод : 2012PLoSO...751169F . дои : 10.1371/journal.pone.0051169 . ПМЦ 3527461 . ПМИД 23284664 .
- ^ Зильберталь А., Кахан А., Бен-Шауль Ю., Яром Ю., Вагнер С. (декабрь 2015 г.). «Пролонгированное внутриклеточное Na + луковицы» . PLOS Biology . 13 (12): e1002319. doi : 10.1371/journal.pbio.1002319 . PMC 4684409. . PMID 26674618 Динамика регулирует электрическую активность в митральных клетках добавочной обонятельной
- ^ Зильберталь А., Яром Ю., Вагнер С. (2017). «Медленная динамика внутриклеточной концентрации натрия увеличивает временное окно нейрональной интеграции: моделирование» . Границы вычислительной нейронауки . 11:85 . дои : 10.3389/fncom.2017.00085 . ПМК 5609115 . ПМИД 28970791 .
- ^ Форрест, доктор медицины (декабрь 2014 г.). «Натриево-калиевый насос — это элемент обработки информации в вычислениях мозга» . Границы в физиологии . 5 (472): 472. doi : 10.3389/fphys.2014.00472 . ПМЦ 4274886 . ПМИД 25566080 .
- ^ Кэннон СК (июль 2004 г.). «Расплата за помпу: дистония из-за мутаций Na + /K + -АТФазы» . Нейрон . 43 (2): 153–4. дои : 10.1016/j.neuron.2004.07.002 . ПМИД 15260948 .
- ^ Кальдерон Д.П., Фремонт Р., Краенцлин Ф., Ходаха К. (март 2011 г.). «Нейральные субстраты быстро возникающей дистонии-паркинсонизма» . Природная неврология . 14 (3): 357–65. дои : 10.1038/nn.2753 . ПМК 3430603 . ПМИД 21297628 .
- ^ Форрест, доктор медицины (апрель 2015 г.). «Моделирование действия алкоголя на подробной модели нейронов Пуркинье и более простой суррогатной модели, которая работает более чем в 400 раз быстрее» . BMC Нейронаука . 16 (27): 27. дои : 10.1186/s12868-015-0162-6 . ПМЦ 4417229 . ПМИД 25928094 .
- ^ Форрест М. (4 апреля 2015 г.). «Нейробиологическая причина, по которой мы падаем, когда пьяны» . Наука 2.0 . Проверено 30 мая 2018 г.
- ^ Янг Э.А., Фаулер К.Д., Кидд Г.Дж., Чанг А., Рудик Р., Фишер Э., Трапп Б.Д. (апрель 2008 г.). «Визуализация коррелирует со снижением аксонального Na + /К + АТФаза при хроническом рассеянном склерозе». Annals of Neurology . 63 (4): 428–35. : 10.1002 /ana.21381 . PMID 18438950. . S2CID 14658965 doi
- ^ Смит Р.С., Флорио М., Акула С.К., Нил Дж.Е., Ван Ю., Хилл Р.С. и др. (июнь 2021 г.). «Ранняя роль для Na + ,К + -АТФаза ( АТФ1А3 ) в развитии мозга» . Proceedings of the National Academy of Sciences of the United States of America . 118 (25): e2023333118. : 2021PNAS..11823333S . doi : 10.1073 /pnas.2023333118 . PMC 8237684 . Bibcode 34161264 .
- ^ Бернье М (2008). Натрий в здоровье и болезни . ЦРК Пресс. п. 15. ISBN 978-0-8493-3978-3 .
- ^ Чин А.С., Гао З., Райли А.М., Фуркерт Д., Виттвер С., Датта А. и др. (октябрь 2020 г.). «Инозитолпирофосфат 5-InsP 7 стимулирует деградацию натрий-калиевого насоса, освобождая аутоингибирующий домен PI3K p85α» . Достижения науки . 6 (44): eabb8542. Бибкод : 2020SciA....6.8542C . doi : 10.1126/sciadv.abb8542 . ПМЦ 7608788 . ПМИД 33115740 . S2CID 226036261 .
- ^ Линь Х.Х., Тан MJ (январь 1997 г.). «Гормон щитовидной железы активирует мРНК Na,K-АТФазы α и β в первичных культурах клеток проксимальных канальцев». Науки о жизни . 60 (6): 375–382. дои : 10.1016/S0024-3205(96)00661-3 . ПМИД 9031683 .
- ^ Блаустейн, член парламента (май 1977 г.). «Ионы натрия, ионы кальция, регуляция артериального давления и гипертония: переоценка и гипотеза». Американский журнал физиологии . 232 (5): С165-73. дои : 10.1152/ajpcell.1977.232.5.C165 . ПМИД 324293 . S2CID 9814212 .
- ^ Шонер В., Шайнер-Бобис Г. (сентябрь 2008 г.). «Роль эндогенных кардиотонических стероидов в гомеостазе натрия». Нефрология, Диализ, Трансплантация . 23 (9): 2723–9. дои : 10.1093/ndt/gfn325 . ПМИД 18556748 .
- ^ Член парламента Блаустейна, Хэмлин Дж. М. (декабрь 2010 г.). «Сигнальные механизмы, которые связывают задержку соли с гипертонией: эндогенный уабаин, Na + насос, Na + /Что 2+ обменник и белки TRPC» . Biochimica et Biophysica Acta (BBA) - Molecular Basis of заболеваний . 1802 (12): 1219–29. : 10.1016 /j.bbadis.2010.02.011 . PMC 2909369. . PMID 20211726 doi
- ^ Фюрстенверт Х (2014). «О различиях между уабаином и гликозидами наперстянки». Американский журнал терапии . 21 (1): 35–42. дои : 10.1097/MJT.0b013e318217a609 . ПМИД 21642827 . S2CID 20180376 .
- ^ Павлович Д (2014). «Роль кардиотонических стероидов в патогенезе кардиомиопатии при хронической болезни почек». Клиническая практика Нефрона . 128 (1–2): 11–21. дои : 10.1159/000363301 . ПМИД 25341357 . S2CID 2066801 .
- ^ "На + /К + -АТФаза и ингибиторы (дигоксин)» . Pharmacorama . Архивировано из оригинала 28 сентября 2020 г. Проверено 08 ноября 2019 г.
- ^ Скоу Дж. К. (февраль 1957 г.). «Влияние некоторых катионов на аденозинтрифосфатазу периферических нервов». Биохимика и биофизика Acta . 23 (2): 394–401. дои : 10.1016/0006-3002(57)90343-8 . ПМИД 13412736 . S2CID 32516710 .
- ^ «Нобелевская премия по химии 1997 года» . NobelPrize.org . Нобель Медиа АБ. 15 октября 1997 г.
- ^ «Субъединицы, транспортирующие АТФазу Na+/K+ (АТФ1)» . ХГНК . Проверено 26 июня 2024 г.
- ^ Перейти обратно: а б Мур, Дэвид Дж.; Холлидей, Дэмиен, Коннектикут; Роуэлл, Дэвид М.; Робинсон, Энтони Дж.; Кио, Дж. Скотт (23 августа 2009 г.). «Положительный дарвиновский отбор приводит к устойчивости к кардиоактивным токсинам у настоящих жаб (Anura: Bufonidae)» . Письма по биологии . 5 (4): 513–516. дои : 10.1098/rsbl.2009.0281 . ISSN 1744-9561 . ПМК 2781935 . ПМИД 19465576 .
- ^ Перейти обратно: а б Эрнандес Поведа М. (2022)Конвергентная эволюция неофункционализированных дупликаций ATP1A1 у дендробатидных и травяных лягушек. Кандидатская диссертация. Университет Лос-Андес
- ^ Перейти обратно: а б Мохаммади, Шабнам; Ян, Лу; Харпак, Арбель; Эррера-Альварес, Сантьяго; Родригес-Ордоньес, Мария дель Пилар; Пэн, Джули; Чжан, Карен; Сторц, Джей Ф.; Доблер, Сюзанна; Кроуфорд, Эндрю Дж.; Андольфатто, Питер (21 июня 2021 г.). «Согласованная эволюция выявила коадаптированные аминокислотные замены у лягушек, которые охотятся на токсичных жаб» . Современная биология . 31 (12): 2530–2538.e10. дои : 10.1016/j.cub.2021.03.089 . ISSN 0960-9822 . ПМЦ 8281379 . ПМИД 33887183 .
- ^ Мохаммади, Шабнам; Броди, Эдмунд Д.; Нойман-Ли, Лорин А.; Савицкий, Алан Х. (01 мая 2016 г.). «Мутации в сайте связывания кардиотонических стероидов Na+/K+-АТФазы связаны с высоким уровнем устойчивости к гамабуфоталину у натрициновой змеи» . Токсикон . 114 : 13–15. дои : 10.1016/j.токсикон.2016.02.019 . ISSN 0041-0101 . ПМИД 26905927 .
- ^ Перейти обратно: а б Мохаммади, Шабнам; Эррера-Альварес, Сантьяго; Ян, Лу; Родригес-Ордоньес, Мария дель Пилар; Чжан, Карен; Сторц, Джей Ф.; Доблер, Сюзанна; Кроуфорд, Эндрю Дж.; Андольфатто, Питер (16 августа 2022 г.). «Ограничения на эволюцию устойчивых к токсинам Na,K-АТФаз ограниченно зависят от расхождения последовательностей» . ПЛОС Генетика . 18 (8): e1010323. дои : 10.1371/journal.pgen.1010323 . ISSN 1553-7390 . ПМЦ 9462791 . ПМИД 35972957 .
- ^ Мохаммади, Шабнам; Оздемир, Халил Ибрагим; Озбек, Пемра; Сумбул, Фидан; Стиллер, Жозефин; Дэн, Юань; Кроуфорд, Эндрю Дж; Роуленд, Ханна М; Сторц, Джей Ф; Андольфатто, Питер; Доблер, Сюзанна (06 декабря 2022 г.). «Эпистатические эффекты между вставками и заменами аминокислот опосредуют устойчивость к токсинам Na+,K+-АТФаз позвоночных» . Молекулярная биология и эволюция . 39 (12): msac258. дои : 10.1093/molbev/msac258 . ISSN 0737-4038 . ПМЦ 9778839 . ПМИД 36472530 .
- ^ Уджвари, Беата; Мун, Хи-чан; Конигрейв, Артур Д.; Брей, Алессандра; Остеркамп, Йенс; Холлинг, Петтер; Мэдсен, Томас (январь 2013 г.). «Изоляция порождает наивность: островная жизнь лишает австралийских варанидов иммунитета к жабьему токсину посредством мутации четырех пар оснований» . Эволюция . 67 (1): 289–294. дои : 10.1111/j.1558-5646.2012.01751.x . ПМИД 23289579 .
- ^ Прайс, Элмер М.; Лингрел, Джерри Б. (1 ноября 1988 г.). «Структурно-функциональные взаимоотношения в субъединице натрий-калиевой АТФазы альфа: направленный мутагенез глутамина-111 в аргинин и аспарагина-122 в аспарагиновую кислоту приводит к образованию фермента, устойчивого к уабаину» . Биохимия . 27 (22): 8400–8408. дои : 10.1021/bi00422a016 . ISSN 0006-2960 . ПМИД 2853965 .
- ^ Перейти обратно: а б Чжэнь, Ин; Аардема, Мэтью Л.; Медина, Эдгар М.; Шумер, Молли; Андольфатто, Питер (28 сентября 2012 г.). «Параллельная молекулярная эволюция в сообществе травоядных» . Наука . 337 (6102): 1634–1637. Бибкод : 2012Sci...337.1634Z . дои : 10.1126/science.1226630 . ISSN 0036-8075 . ПМЦ 3770729 . ПМИД 23019645 .
- ^ Ян, Л.; Равикантачари, Н.; Мариньо-Перес, Р.; Дешмук, Р.; Ву, М.; Розенштейн, А.; Кунте, К.; Сонг, Х.; Андольфатто, П. (2019). «Предсказуемость эволюции нечувствительности прямокрылых к карденолидам» . Философские труды Лондонского королевского общества, серия B. 374 (1777): 20180246. doi : 10.1098/rstb.2018.0246 . ПМК 6560278 . ПМИД 31154978 .
- ^ Петщенка Георг, Вера Вагшаль, Михаэль фон Чирнхаус, Александр Донат, Сюзанна Доблер 2017 Пещенко Г.; Вагшаль, В.; фон Чирнхаус, М.; Донат, А.; Доблер, С. (2017). «Конвергентно эволюционировавшие токсичные вторичные метаболиты в растениях стимулируют параллельную молекулярную эволюцию устойчивости к насекомым» . Американский натуралист . 190 (С1): С29–С43. дои : 10.1086/691711 . ПМИД 28731826 . S2CID 3908073 .
- ^ Лабейри Э., Доблер С. (2004). «Молекулярная адаптация листоедов Chrysochus к токсичным соединениям в пищевых растениях» . Молекулярная биология и эволюция . 21 (2): 218–21. дои : 10.1093/molbev/msg240 . ПМИД 12949136 .
- ^ Доблер, Сюзанна; Далла, Сафаа; Вагшаль, Вера; Агравал, Анураг А. (2012). «Конвергентная эволюция в масштабах сообщества в адаптации насекомых к токсичным карденолидам путем замен в Na,K-АТФазе» . Труды Национальной академии наук . 109 (32): 13040–13045. дои : 10.1073/pnas.1202111109 . ПМК 3420205 . ПМИД 22826239 .
Внешние ссылки
[ редактировать ]- Натрий, + Калий + АТФаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Банк данных белков RCSB: натрий-калиевый насос
- Видео от Академии Хана .