Коэнзим Q – цитохром с редуктаза
| Комплекс цитохрома b-c1 | |
|---|---|
 Кристаллическая структура митохондриального комплекса цитохрома bc, связанного с убихиноном . [ 1 ] | |
| Идентификаторы | |
| Символ | (Н/Д) |
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1be3 / SCOPe / СУПФАМ |
| TCDB | 3.D.3 |
| Суперсемейство OPM | 92 |
| белок OPM | 3cx5 |
| Мембраном | 258 |
| убихинол-цитохром-с-редуктаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 7.1.1.8 | ||
| Номер CAS. | 9027-03-6 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
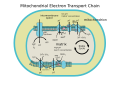
Коэнзим Q: цитохром c -оксидоредуктаза , иногда называемый цитохрома bc 1 комплексом , а иногда комплексом III , является третьим комплексом в цепи переноса электронов ( EC 1.10.2.2 ), играющим решающую роль в биохимической генерации АТФ (EC 1.10.2.2). окислительное фосфорилирование ). Комплекс III представляет собой многосубъединичный трансмембранный белок, кодируемый как митохондриальным ( цитохром b ), так и ядерным геномами (все остальные субъединицы). Комплекс III присутствует в митохондриях всех животных и всех аэробных эукариот, а также во внутренних мембранах большинства бактерий . Мутации в Комплексе III вызывают непереносимость физической нагрузки , а также мультисистемные расстройства. bc1 Комплекс содержит 11 субъединиц, 3 респираторные субъединицы (цитохром В, цитохром С1, белок Риске), 2 коровых белка и 6 низкомолекулярных белков .
Убихинол - цитохром-с-редуктаза катализирует химическую реакцию.
- QH 2 + 2 феррицитохром с Q + 2 ферроцитохром с + 2 H +
Таким образом, двумя субстратами этого фермента являются хинол (QH 2 ) и ферри- (Fe 3+ ) цитохрома с , тогда как его 3 продукта - хинон (Q), ферро- (Fe 2+ ) цитохром с и H + .
Этот фермент принадлежит к семейству оксидоредуктаз , в частности тех, которые действуют на дифенолы и родственные вещества в качестве донора, а цитохром - в качестве акцептора. Этот фермент участвует в окислительном фосфорилировании . Он имеет четыре кофактора : цитохром c1 , цитохром b-562, цитохром b-566 и 2-железный ферредоксин типа Риске .
Номенклатура
[ редактировать ]Систематическое название этого класса ферментов — убихинол:феррицитохром-с-оксидоредуктаза . Другие широко используемые имена включают:
|
|
Структура
[ редактировать ]
По сравнению с другими основными субъединицами цепи переноса протонов , количество обнаруженных субъединиц может быть небольшим, всего три полипептидные цепи. Это число действительно увеличивается, и у высших животных обнаружено одиннадцать субъединиц. [ 2 ] Три субъединицы имеют простетические группы . цитохрома гем c b Субъединица имеет два b -типа гема ( b L и b H ), субъединица цитохрома c имеет один - типа ( c 1 ), а субъединица железо-серного белка Риске (ISP) имеет два гема железа и два гема серы. железо-серный кластер (2Fe•2S).
Структуры комплекса III: PDB : 1KYO , PDB : 1L0L.
Состав комплекса
[ редактировать ]У позвоночных комплекс bc 1 , или Комплекс III, содержит 11 субъединиц: 3 респираторные субъединицы, 2 коровых белка и 6 низкомолекулярных белков. [ 3 ] [ 4 ] Протеобактериальные комплексы могут содержать всего три субъединицы. [ 5 ]
Таблица субъединичного состава комплекса III
[ редактировать ]| Нет. | Название субъединицы | Символ человеческого гена | Описание белка от UniProt | Семейство Pfam с человеческим белком |
|---|---|---|---|---|
| Белки респираторной субъединицы | ||||
| 1 | MT-CYB / Цит b | МТ-КИБ | Цитохром b | Пфам PF13631 |
| 2 | CYC1/Цит с1 | Цикл 1 | Цитохром с1, гем-белок, митохондрии | Пфам PF02167 |
| 3 | Риске/UCR1 | UQCRFS1 | Субъединица комплекса цитохрома b-c1 Риске, митохондриальная EC 1.10.2.2 | Пфам ПФ02921 , Пфам ПФ00355 |
| Субъединицы основного белка | ||||
| 4 | QCR1/SU1 | UQCRC1 | Субъединица 1 комплекса цитохрома b-c1, митохондриальная | Пфам ПФ00675 , Пфам ПФ05193 |
| 5 | КCR2/СУ2 | UQCRC2 | Субъединица 2 комплекса цитохрома b-c1, митохондриальная | Пфам ПФ00675 , Пфам ПФ05193 |
| Низкомолекулярные белковые субъединицы | ||||
| 6 | QCR6/SU6 | UQCRH | Субъединица 6 комплекса цитохрома b-c1, митохондриальная | Пфам PF02320 |
| 7 | QCR7 / SU7 | UQCRB | Субъединица 7 комплекса цитохрома b-c1 | Пфам PF02271 |
| 8 | QCR8 / SU8 | UQCRQ | Субъединица 8 комплекса цитохрома b-c1 | Пфам PF02939 |
| 9 | QCR9/SU9 | UQCRFS1 а | (N-терминал Риске, отдельной записи нет) | Пфам PF09165 |
| 10 | QCR10/SU10 | UQCR10 | Субъединица 9 комплекса цитохрома b-c1 | Пфам PF05365 |
| 11 | QCR11/SU11 | UQCR11 | Субъединица 10 комплекса цитохрома b-c1 | Пфам PF08997 |
- а У позвоночных животных продукт расщепления массой 8 кДа от N-конца белка Риске ( сигнальный пептид ) сохраняется в комплексе в виде субъединицы 9. Таким образом, субъединицы 10 и 11 соответствуют грибковым QCR9p и QCR10p.
Реакция
[ редактировать ]
восстановление цитохрома с Катализирует окисление кофермента Q (CoQ) и сопутствующая перекачка 4 протонов из митохондриального матрикса в межмембранное пространство:
- QH 2 + 2 цитохром с (Fe III ) + 2 Ч +
в → Q + 2 цитохром с (Fe II ) + 4 ч +
вне
В процессе, называемом циклом Q , [ 6 ] [ 7 ] два протона потребляются из матрикса (М), четыре протона высвобождаются в межмембранное пространство (ИМ) и два электрона переходят к цитохрому с .
Механизм реакции
[ редактировать ]
Механизм реакции комплекса III (цитохром bc1, кофермент Q: оксидоредуктаза цитохрома C) известен как цикл убихинона («Q»). В этом цикле четыре протона высвобождаются на положительной стороне «P» (межмембранное пространство), но только два протона захватываются с отрицательной стороны «N» (матрица). В результате протонный градиент через мембрану образуется . В общей реакции два убихинола окисляются до убихинонов , а один убихинон восстанавливается до убихинола . В полном механизме два электрона передаются от убихинола к убихинону через два промежуточных продукта цитохрома с.
Общий :
- 2 x QH 2 окислен до Q
- 1 x Q уменьшено до QH 2
- Cyt c 2 x снижение
- 4 х В + высвобождается в межмембранное пространство
- 2 х В + взял из матрицы
Реакция протекает по следующим стадиям:
Раунд 1 :
- Цитохром b связывает убихинол и убихинон.
- Центр 2Fe/2S и гем B L отрывают по одному электрону от связанного убихинола, высвобождая два протона в межмембранное пространство.
- Один электрон переносится на цитохром c 1 из центра 2Fe/2S, а другой – с гема BL на B H. гем
- Цитохром c 1 передает свой электрон цитохрому c (не путать с цитохромом c1), а гем B H передает свой электрон ближайшему убихинону, что приводит к образованию убисемихинона.
- Цитохром С диффундирует. Первый убихинол (теперь окисленный до убихинона) высвобождается, тогда как семихинон остается связанным.
Раунд 2 :
- Второй убихинол связывается с цитохромом b.
- Центр 2Fe/2S и гем B L отрывают по одному электрону от связанного убихинола, высвобождая два протона в межмембранное пространство.
- Один электрон переносится на цитохром c 1 из центра 2Fe/2S, а другой – с гема BL на B H. гем
- Цитохром c 1 затем передает свой электрон цитохрому c , в то время как ближайший к нему семихинон, образующийся в раунде 1, захватывает второй электрон от гема B H вместе с двумя протонами из матрицы.
- Второй убихинол (теперь окисленный до убихинона) высвобождается вместе с вновь образовавшимся убихинолом. [ 8 ]
Ингибиторы комплекса III
[ редактировать ]Существует три отдельные группы ингибиторов Комплекса III.
- Антимицин А связывается с сайтом Qi и ингибирует перенос электронов в Комплексе III от гема b H к окисленному Q (ингибитор сайта Qi).
- Миксотиазол и стигмателлин связываются с сайтом Q o и ингибируют перенос электронов от восстановленного QH 2 к железо-серному белку Риске. Миксотиазол и стигмателлин связываются с отдельными, но перекрывающимися карманами внутри сайта Qo .
- Миксотиазол связывается ближе к цитохрому bL (поэтому его называют « проксимальным » ингибитором).
- Стигмателлин связывается дальше от гема bL и ближе к железо-серному белку Риске, с которым он сильно взаимодействует.
Некоторые из них были коммерциализированы как фунгициды ( производные стробилурина , наиболее известным из которых является азоксистробин ; ингибиторы QoI ) и как противомалярийные средства ( атоваквон ).
Также пропилгекседрин ингибирует цитохром с-редуктазу. [ 9 ]
Свободные радикалы кислорода
[ редактировать ]Небольшая часть электронов покидает электронтранспортную цепь, не достигнув комплекса IV . Преждевременная утечка электронов к кислороду приводит к образованию супероксида . Актуальность этой незначительной побочной реакции заключается в том, что супероксид и другие активные формы кислорода высокотоксичны и, как полагают, играют роль в ряде патологий, а также в старении ( свободнорадикальная теория старения ). [ 10 ] Утечка электронов происходит главным образом в сайте Qo и стимулируется А. антимицином Антимицин А блокирует гемы b в восстановленном состоянии, предотвращая их повторное окисление в сайте Q i стационарных концентраций семихинона Q o , что, в свою очередь, вызывает повышение , причем последний вид реагирует с кислородом с образованием супероксида. . Считается, что эффект высокого мембранного потенциала имеет аналогичный эффект. [ 11 ] Супероксид, образующийся в сайте Qo, может высвобождаться как в митохондриальный матрикс, так и в митохондриальный матрикс. [ 12 ] [ 13 ] и в межмембранное пространство, где затем может достичь цитозоля. [ 12 ] [ 14 ] Это можно объяснить тем фактом, что Комплекс III может образовывать супероксид в виде мембранопроницаемой HOO. • а не мембранонепроницаемый O −.
2 . [ 13 ]
Названия генов человека
[ редактировать ]Этот раздел может потребовать очистки Википедии , чтобы соответствовать стандартам качества . Конкретная проблема: ее следует объединить с таблицей выше. ( декабрь 2023 г. ) |
- MT-CYB : мтДНК цитохром b, кодируемый ; мутации, связанные с непереносимостью физических упражнений
- CYC1 : цитохром с1
- CYCS : цитохром с
- UQCRFS1 : железо-серный белок Риске.
- UQCRB : белок, связывающий убихинон, мутация, связанная с дефицитом митохондриального комплекса III, ядерный тип 3.
- UQCRH : шарнирный белок
- UQCRC2 : Core 2, мутации, связанные с дефицитом митохондриального комплекса III, ядерный тип 5.
- UQCRC1 : Ядро 1
- UQCR : субъединица 6,4KD
- UQCR10 : субъединица 7,2KD
- TTC19 : недавно идентифицированная субъединица, мутации связаны с дефицитом комплекса III ядерного типа 2. Помогает удалить N-концевой фрагмент UQCRFS1, который в противном случае мешал бы функции комплекса III. [ 15 ]
Мутации в генах комплекса III при заболеваниях человека
[ редактировать ]Мутации в генах, связанных с комплексом III, обычно проявляются как непереносимость физических упражнений. [ 16 ] [ 17 ] Сообщалось, что другие мутации вызывают септооптическую дисплазию. [ 18 ] и мультисистемные расстройства. [ 19 ] Однако мутации в BCS1L , гене, ответственном за правильное созревание комплекса III, могут привести к синдрому Бьернстада и синдрому GRACILE , которые у новорожденных являются летальными состояниями, имеющими мультисистемные и неврологические проявления, типичные для тяжелых митохондриальных нарушений. Патогенность нескольких мутаций была подтверждена на модельных системах, таких как дрожжи. [ 20 ]
, в какой степени эти различные патологии обусловлены биоэнергетическим дефицитом или перепроизводством супероксида В настоящее время неизвестно .
См. также
[ редактировать ]Дополнительные изображения
[ редактировать ]-
И Т. Д
Ссылки
[ редактировать ]- ^ PDB : 1нтц ; Гао X, Вэнь X, Эссер Л, Куинн Б, Ю Л, Ю CA, Ся Д (август 2003 г.). «Структурные основы восстановления хинона в комплексе bc1: сравнительный анализ кристаллических структур митохондриального цитохрома bc1 со связанным субстратом и ингибиторами в сайте Qi». Биохимия . 42 (30): 9067–80. дои : 10.1021/bi0341814 . ПМИД 12885240 .
- ^ Ивата С., Ли Дж.В., Окада К., Ли Дж.К., Ивата М., Расмуссен Б., Линк Т.А., Рамасвами С., Яп Б.К. (июль 1998 г.). «Полная структура 11-субъединичного комплекса бычьего митохондриального цитохрома bc1». Наука . 281 (5373): 64–71. Бибкод : 1998Sci...281...64I . дои : 10.1126/science.281.5373.64 . ПМИД 9651245 .
- ^ Чжан З, Хуан Л., Шульмейстер В.М., Чи И., Ким К.К., Хунг Л.В. и др. (1998). «Перенос электронов путем движения домена в цитохроме bc1». Природа . 392 (6677): 677–84. Бибкод : 1998Natur.392..677Z . дои : 10.1038/33612 . ПМИД 9565029 . S2CID 4380033 .
- ^ Хао Г.Ф., Ван Ф., Ли Х., Чжу С.Л., Ян В.К., Хуан Л.С. и др. (2012). «Вычислительное открытие ингибиторов пикомолярного сайта Q (o) комплекса цитохрома bc1». J Am Chem Soc . 134 (27): 11168–76. дои : 10.1021/ja3001908 . ПМИД 22690928 .
- ^ Ян XH, Trumppower BL (1986). «Очистка трехсубъединичного комплекса убихинол-цитохром с оксидоредуктазы из Paracoccus denitrificans» . J Биол Хим . 261 (26): 12282–9. дои : 10.1016/S0021-9258(18)67236-9 . ПМИД 3017970 .
- ^ Крамер Д.М. , Робертс А.Г., Мюллер Ф., Кейп Дж., Боуман М.К. (2004). «Реакции обхода Q-цикла на сайте Qo комплексов цитохрома bc1 (и родственных ему)». Хиноны и хиноновые ферменты, часть B. Методы энзимологии. Том. 382. стр. 21–45. дои : 10.1016/S0076-6879(04)82002-0 . ISBN 978-0-12-182786-1 . ПМИД 15047094 .
- ^ Крофтс А.Р. (2004). «Комплекс цитохрома bc1: функция в контексте структуры». Анну. Преподобный физиол . 66 : 689–733. doi : 10.1146/annurev.phyol.66.032102.150251 . ПМИД 14977419 .
- ^ Фергюсон С.Дж., Николлс Д., Фергюсон С. (2002). Биоэнергетика (3-е изд.). Сан-Диего: Академик. стр. 100-1 114–117. ISBN 978-0-12-518121-1 .
- ^ Холмс, Дж. Х.; Сапейка, Н; Зваренштайн, Х (1975). «Ингибирующее действие препаратов против ожирения на НАДН-дегидрогеназу гомогенатов сердца мышей». Научные коммуникации в области химической патологии и фармакологии . 11 (4): 645–6. ПМИД 241101 .
- ^ Мюллер, Флорида; Люстгартен, Миссисипи; Джанг, Ю.; Ричардсон А. и Ван Реммен Х. (2007). «Тенденции в теориях окислительного старения». Свободный Радик. Биол. Мед . 43 (4): 477–503. doi : 10.1016/j.freeradbiomed.2007.03.034 . ПМИД 17640558 .
- ^ Скулачев В.П. (май 1996 г.). «Роль несвязанных и несвязанных окислений в поддержании безопасно низких уровней кислорода и его одноэлектронных восстановителей». В. Преподобный Биофиз . 29 (2): 169–202. дои : 10.1017/s0033583500005795 . ПМИД 8870073 . S2CID 40859585 .
- ^ Перейти обратно: а б Мюллер Ф (2000). «Природа и механизм производства супероксида цепью переноса электронов: его значение для старения» . ВОЗРАСТ . 23 (4): 227–253. дои : 10.1007/s11357-000-0022-9 . ПМЦ 3455268 . ПМИД 23604868 .
- ^ Перейти обратно: а б Мюллер Ф.Л., Лю Ю., Ван Реммен Х. (ноябрь 2004 г.). «Комплекс III высвобождает супероксид на обе стороны внутренней митохондриальной мембраны» . Ж. Биол. Хим . 279 (47): 49064–73. дои : 10.1074/jbc.M407715200 . ПМИД 15317809 .
- ^ Хан Д., Уильямс Э., Каденас Э. (январь 2001 г.). «Зависимая от митохондриальной дыхательной цепи генерация супероксид-аниона и его выход в межмембранное пространство» . Биохим. Дж . 353 (Часть 2): 411–6. дои : 10.1042/0264-6021:3530411 . ПМК 1221585 . ПМИД 11139407 .
- ^ Боттани, Э; Черутти, Р; Харбор, Мэн; Равалья, С.; Доган, ЮАР; Джордано, К; Фернли, ИМ; Д'Амати, Дж; Вискоми, К; Фернандес-Визарра, Э; Зевиани, М (6 июля 2017 г.). «TTC19 играет управляющую роль в обмене UQCRFS1 в биогенезе митохондриального дыхательного комплекса III» . Молекулярная клетка . 67 (1): 96–105.e4. doi : 10.1016/j.molcel.2017.06.001 . ПМИД 28673544 .
- ^ ДиМауро С. (ноябрь 2006 г.). «Митохондриальные миопатии» (PDF) . Курр Опин Ревматол . 18 (6): 636–41. дои : 10.1097/01.bor.0000245729.17759.f2 . ПМИД 17053512 . S2CID 29140366 .
- ^ ДиМауро С. (июнь 2007 г.). «Митохондриальная ДНК-медицина». Биология. Представитель . 27 (1–3): 5–9. дои : 10.1007/s10540-007-9032-5 . ПМИД 17484047 . S2CID 5849380 .
- ^ Шуэльке М, Круде Х, Финк Б, Маятепек Е, Янссен А, Шмельц М, Трефц Ф, Трийбелс Ф, Смейтинк Дж (март 2002 г.). «Септооптическая дисплазия, связанная с новой мутацией митохондриального цитохрома b». Энн. Нейрол . 51 (3): 388–92. дои : 10.1002/ана.10151 . ПМИД 11891837 . S2CID 12425236 .
- ^ Вибранд Ф., Равн К., Шварц М., Розенберг Т., Хорн Н., Виссинг Дж. (октябрь 2001 г.). «Мультисистемное расстройство, связанное с миссенс-мутацией в гене митохондриального цитохрома b». Энн. Нейрол . 50 (4): 540–3. дои : 10.1002/ана.1224 . ПМИД 11601507 . S2CID 8944744 .
- ^ Фишер Н., Каслден К.К., Бурж И., Брассер Г., Дюжарден Г., Менье Б. (март 2004 г.). «Мутации цитохрома b, связанные с болезнями человека, изучены у дрожжей» . Ж. Биол. Хим . 279 (13): 12951–8. дои : 10.1074/jbc.M313866200 . ПМИД 14718526 .
Дальнейшее чтение
[ редактировать ]- Маррес CM, Слейтер EC (1977). «Полипептидная композиция очищенной QH2: цитохром с оксидоредуктазы из митохондрий говяжьего сердца». Биохим. Биофиз. Акта . 462 (3): 531–548. дои : 10.1016/0005-2728(77)90099-8 . ПМИД 597492 .
- Риске Дж.С. (1976). «Состав, строение и функции III комплекса дыхательной цепи» . Биохим. Биофиз. Акта . 456 (2): 195–247. дои : 10.1016/0304-4173(76)90012-4 . ПМИД 788795 .
- Викстрем М., Краб К., Сарасте М. (1981). «Протон-транслоцирующие цитохромные комплексы». Анну. Преподобный Биохим . 50 : 623–655. дои : 10.1146/annurev.bi.50.070181.003203 . ПМИД 6267990 .
Внешние ссылки
[ редактировать ]- цитохрома bc 1 Сайт комплекса (Эдвард А. Берри) на Wayback Machine (архивировано 9 октября 2006 г.) на lbl.gov
- цитохрома bc 1 Сайт комплекса (Энтони Р. Крофтс). Архивировано 17 сентября 2007 г. на Wayback Machine на uiuc.edu.
- База данных PROMISE: цитохрома bc 1 комплекс на archive.today (архив от 27 августа 1999 г.) на scripps.edu
- Интерактивная молекулярная модель комплекса III на Wayback Machine (архивировано 12 января 2009 г.) (требуется MDL Chime )
- UMich Ориентация белков в семействах мембран/суперсемействе-3 - Расчетные положения bc1 и родственных комплексов в мембранах
- Коэнзим + Q-цитохром-с + редуктаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- #124000 ДЕФИЦИТ МИТОХОНДРИАЛЬНОГО КОМПЛЕКСА III, ЯДЕРНЫЙ ТИП 1; MC3DN1 на OMIM ; перечислены все другие типы дефицита комплекса III.