Ксилол
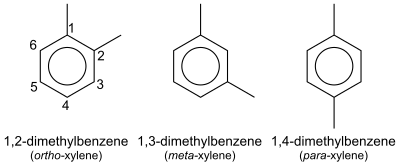
В органической химии — ксилол или ксилол (от греческого ξύλον (ксилон) — дерево; [ 1 ] [ 2 ] Название ИЮПАК : диметилбензол ) — любое из трёх органических соединений формулы (СН 3 ) 2 С 6 Н 4 . Они образуются в результате замещения двух водорода атомов метильными группами в бензольном кольце; то, какие атомы водорода будут замещены, определяет, какой из трех структурных изомеров получится. Это бесцветная, легковоспламеняющаяся, слегка жирная жидкость, имеющая большое промышленное значение. [ 3 ]
Смесь называют одновременно ксилолом и, точнее, ксилолами. Смешанные ксилолы относятся к смеси ксилолов и этилбензола . Все четыре соединения имеют идентичные молекулярные формулы. С 8 Ч 10 . Обычно эти четыре соединения производятся вместе различными методами каталитического риформинга и пиролиза . [ 4 ]
Возникновение и производство
[ редактировать ]Ксилолы являются важным нефтехимическим продуктом, производимым путем каталитического риформинга , а также карбонизации угля при производстве коксового топлива . Они также встречаются в сырой нефти в концентрациях около 0,5–1%, в зависимости от источника. Небольшие количества встречаются в бензине и авиационном топливе .
Ксилолы производятся в основном как часть ароматических соединений БТХ ( бензола , толуола и ксилолов), экстрагируемых из продукта каталитического риформинга, известного как риформинг .
Ежегодно производится несколько миллионов тонн. [ 3 ] В 2011 году глобальный консорциум начал строительство одного из крупнейших в мире заводов по производству ксилола в Сингапуре . [ 5 ]
История
[ редактировать ]Ксилол был впервые выделен и назван в 1850 году французским химиком Огюстом Кауром (1813–1891), поскольку он был обнаружен как составная часть древесной смолы . [ 6 ]
Промышленное производство
[ редактировать ]получают метилированием толуола бензола и Ксилолы . [ 3 ] [ 7 ] Производимый ксилол коммерческого или лабораторного качества обычно содержит около 40–65% м -ксилола и до 20% о -ксилола , п -ксилола и этилбензола . [ 8 ] [ 9 ] [ 10 ] Соотношение изомеров можно изменить в пользу ценного п- ксилола с помощью запатентованного UOP- Isomar. процесса [ 11 ] или путем трансалкилирования ксилола самим собой или триметилбензолом. Эти превращения катализируются цеолитами . [ 3 ]
ZSM-5 используется для облегчения некоторых реакций изомеризации, ведущих к массовому производству современных пластмасс.
Характеристики
[ редактировать ]Физические свойства изомеров ксилола различаются незначительно. Температура плавления колеблется от -47,87 °C (-54,17 °F) ( м -ксилол) до 13,26 °C (55,87 °F) ( п -ксилол) - как обычно, температура плавления пара-изомера намного выше, поскольку он упаковывает больше легко в кристаллической структуре. Температура кипения каждого изомера составляет около 140 ° C (284 ° F). Плотность каждого изомера составляет около 0,87 г/мл (7,3 фунта/галлон США; 8,7 фунта/имп-галлон) и, следовательно, менее плотна, чем вода . Запах ксилола можно обнаружить при концентрациях от 0,08 до 3,7 частей на миллион (частей ксилола на миллион частей воздуха), а вкус ксилола можно ощутить в воде при концентрации от 0,53 до 1,8 частей на миллион. [ 9 ]
| Изомеры ксилола | ||||
|---|---|---|---|---|
| Общий | ||||
| Общее имя | Ксилолы (смесь) |
о -ксилол | м -ксилол | п -ксилол |
| Систематическое название | Диметилбензол | 1,2-Диметилбензол | 1,3-Диметилбензол | 1,4-Диметилбензол |
| Другие имена | Ксилол | о -ксилол; ортоксилол |
м -ксилол; Метаксилен |
п -ксилол; Параксилол |
| Молекулярная формула | С 8:10 утра | |||
| УЛЫБКИ | Cc1c(C)cccc1 | Cc1cc(C)ccc1 | Cc1ccc(C)cc1 | |
| Молярная масса | 106.16 g/mol | |||
| Появление | Прозрачная бесцветная жидкость | |||
| Номер CAS | [1330-20-7] | [95-47-6] | [108-38-3] | [106-42-3] |
| Характеристики | ||||
| Плотность и фаза | 0,864 г/мл, жидкость | 0,88 г/мл, жидкость | 0,86 г/мл, жидкость | 0,86 г/мл, жидкость |
| Растворимость в воде | Практически нерастворим | |||
| Растворим в неполярных растворителях, таких как ароматические углеводороды. | ||||
| Температура плавления | -47,4 ° C (-53,3 ° F; 226 К) | -25 ° C (-13 ° F; 248 К) | -48 ° C (-54 ° F; 225 К) | 13 ° C (55 ° F; 286 К) |
| Точка кипения | 138,5 ° С (281,3 ° F; 412 К) | 144 ° С (291 ° F; 417 К) | 139 ° С (282 ° F; 412 К) | 138 ° C (280 ° F; 411 К) |
| Вязкость | 0,812 сП при 20 ° C (68 ° F) | 0,62 сП при 20 °C (68 °F) | 0,34 сП при 30 °C (86 °F) | |
| Опасности | ||||
| Паспорт безопасности | Ксилолы | о -ксилол | м -ксилол | п -ксилол |
| Пиктограммы ЕС |   
| |||
| НФПА 704 | ||||
| точка возгорания | 30 ° С (86 ° F) | 17 ° С (63 ° F) | 25 ° С (77 ° F) | 25 ° С (77 ° F) |
| H & P Фразы | Х225 , Х226 , Х304 , Х312 , Х315 , Х319 , Х332 , Х335 , Х412 P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P273 , P280 , P301+P310 , P302+P352 , P303+P361+P353 , P304+P312 , P304+P340 , P305+P351+P338 , P312 , P321 , P322 , P331 , P332+P313 , P337+P313 , P362 , P363 , P370+P378 , P403+P233 , P403+P235 , П405 , П501 | |||
| РТЭКС номер | ZE2450000 | ZE2275000 | ZE2625000 | |
| Родственные соединения | ||||
| Родственные ароматические углеводороды |
Толуол , мезитилен , бензол , этилбензол | |||
| Родственные соединения | Ксиленолы - виды фенолов | |||
| Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °С, 100 кПа). Отказ от ответственности в информационном окне и ссылки | ||||
Ксилолы образуют азеотропы с водой и различными спиртами. Азеотроп с водой состоит на 60% из ксилолов и кипит при 94,5 °С. [ 3 ] Как и многие алкилбензольные соединения, ксилолы образуют комплексы с различными галогенуглеродами . [ 12 ] Комплексы разных изомеров часто имеют резко отличающиеся друг от друга свойства. [ 13 ]
Приложения
[ редактировать ]Терефталевая кислота и родственные производные
[ редактировать ]п -Ксилол является основным предшественником терефталевой кислоты и диметилтерефталата , мономеров , используемых в производстве из полиэтилентерефталата (ПЭТ) пластиковых бутылок и полиэфирной одежды. 98% производимого п -ксилола и половина всех производимых ксилолов. Таким образом потребляется [ 10 ] [ 14 ] о -Ксилол является важным предшественником фталевого ангидрида . Спрос на изофталевую кислоту относительно невелик, поэтому м -ксилол ищут редко (а отсюда и полезность его превращения в о- и п -изомеры).
Применение растворителей и промышленные цели
[ редактировать ]Ксилолы используются в качестве растворителя в полиграфической , резиновой и кожевенной промышленности. Это обычный компонент чернил, резины и клеев . [ 15 ] При разбавлении красок и лаков его можно заменить толуолом , если требуется более медленное высыхание, и поэтому его используют реставраторы предметов искусства при тестировании растворимости. [ 16 ] Точно так же это чистящее средство , например, для стали , кремниевых пластин и интегральных схем . В стоматологии ксилол можно использовать для растворения гуттаперчи — материала, используемого в эндодонтии (лечении корневых каналов). В нефтяной промышленности ксилол также является частым компонентом растворителей парафина, используемых, когда трубы забиваются парафином.
Лабораторное использование
[ редактировать ]Ксилол используется в лаборатории для приготовления ванн с сухим льдом для охлаждения реакционных сосудов. [ 17 ] и в качестве растворителя для удаления синтетического иммерсионного масла микроскопа с объектива в световой микроскопии . [ 18 ] В гистологии ксилол является наиболее широко используемым очищающим средством. [ 19 ] Ксилол используется для удаления парафина с высушенных предметных стекол перед окрашиванием. После окрашивания предметные стекла помещают в ксилол перед установкой покровного стекла.
Прекурсор других соединений
[ редактировать ]В одном крупномасштабном применении пара-ксилол преобразуется в терефталевую кислоту . Основное применение ортоксилола — в качестве предшественника эфиров фталевой кислоты , используемых в качестве пластификатора . Мета-ксилол превращается в производные изофталевой кислоты , которые входят в состав алкидных смол . [ 3 ]
Химические свойства
[ редактировать ]Обычно с ксилолами происходят реакции двух типов: с участием метильных групп и с участием связей C–H в кольце. Будучи бензильными и, следовательно, ослабленными, связи C–H метильных групп подвержены свободнорадикальным реакциям, включая галогенирование до соответствующих дихлоридов ксилола (бис(хлорметил)бензолов), тогда как монобромирование дает ксилилбромид , слезоточивого газа. агент . Окисление и аммоксидирование также воздействуют на метильные группы, образуя дикарбоновые кислоты и динитрилы. Электрофилы атакуют ароматическое кольцо, приводя к хлор- и нитроксиленам. [ 3 ]
Здоровье и безопасность
[ редактировать ]Ксилол легковоспламеняем, но имеет умеренную острую токсичность: ЛД 50 колеблется от 200 до 5000 мг/кг для животных. Пероральная LD 50 для крыс составляет 4300 мг/кг. Основным механизмом детоксикации является окисление до метилбензойной кислоты и гидроксилирование до гидроксилена. [ 3 ]
Основным эффектом вдыхания паров ксилола является угнетение центральной нервной системы (ЦНС) с такими симптомами, как головная боль, головокружение, тошнота и рвота. При воздействии 100 ppm можно испытывать тошноту или головную боль. При воздействии от 200 до 500 частей на миллион симптомы могут включать чувство «кайфа», головокружение, слабость, раздражительность, рвоту и замедление реакции. [ 20 ] [ 21 ]
Побочные эффекты воздействия низких концентраций ксилола ( < 200 ppm ) обратимы и не вызывают необратимых повреждений. Длительное воздействие может привести к головным болям, раздражительности, депрессии, бессоннице, возбуждению, крайней усталости, тремору, потере слуха, нарушению концентрации и кратковременной потере памяти. [ 22 ] [ нужны разъяснения ] Состояние, называемое хронической энцефалопатией, вызванной растворителями , широко известное как «синдром органических растворителей», связано с воздействием ксилола. Имеется очень мало информации о том, как изолировать ксилол от воздействия других растворителей при изучении этих эффектов. [ 20 ]
Нарушения слуха также были связаны с воздействием ксилола, как показали исследования на экспериментальных животных, [ 23 ] [ 24 ] а также клинические исследования. [ 25 ] [ 26 ] [ 27 ]
Ксилол также раздражает кожу и лишает ее кожного сала, делая ее более проницаемой для других химикатов. Во избежание проблем с профессиональным здоровьем, связанных с воздействием ксилола, рекомендуется использовать непроницаемые перчатки и маски, а также, при необходимости, респираторы. [ 20 ]
Ксилолы метаболизируются до метилгиппуровых кислот . [ 28 ] [ 29 ] Присутствие метилгиппуровой кислоты можно использовать в качестве биомаркера для определения воздействия ксилола. [ 29 ] [ 30 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ξύλον . Лидделл, Генри Джордж ; Скотт, Роберт ; Греко-английский лексикон в проекте «Персей» .
- ^ Харпер, Дуглас. «ксилол» . Интернет-словарь этимологии .
- ^ Jump up to: а б с д и ж г час Фабри, Йорг; Грезер, Ульрих; Симо, Томас А. (2000). «Ксилолы». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a28_433 . ISBN 978-3527306732 .
- ^ Каннелла, Уильям Дж. (2000). «Ксилолы и этилбензол». Энциклопедия химической технологии Кирка-Отмера . дои : 10.1002/0471238961.2425120503011414.a01 . ISBN 0471238961 .
- ^ Трамбле, Жан-Франсуа (2011). «Производство ароматических веществ в Сингапуре». Архив новостей химической и инженерной промышленности . 89 (38): 18–19. doi : 10.1021/cen-v089n038.p018 .
- ^ Каур, Огюст (1850) «Recherches sur les huiles légéres obtenues dans la distillation du bois» (Исследования легких масел, полученных перегонкой древесины), Compte rendus , 30 : 319-323; см. особенно стр. 321. Со с. 321: «Je le désignerai sous le nomme xylène ». (Я обозначу его именем ксилола .) Примечание. Эмпирическая формула Каура для ксилола неверна, поскольку химики того времени использовали неправильную атомную массу углерода (6 вместо 12).
- ^ Мартиндейл, Дэвид К. и Кучар, Пол Дж., Производство ксилолов из легких алифатических углеводородов посредством дегидроциклодимеризации и метилирования , Патент США № 5043502, 1991-8-27. Доступ 28 апреля 2012 г.
- ^ «Ксилол (смешанные изомеры), сводная информация о токсичности воздуха» . Агентство по охране окружающей среды США . Проверено 8 февраля 2015 г.
- ^ Jump up to: а б Кандьяла, Рина; Рагхавендра, Сумант Пхани К.; Раджасекхаран, Сарасвати Т. (2010). «Ксилол: обзор опасности для здоровья и меры профилактики» . J Оральный челюстно-лицевой патол . 14 (1): 1–5. дои : 10.4103/0973-029X.64299 . ПМК 2996004 . ПМИД 21180450 .
- ^ Jump up to: а б Ксилол ( архивировано 11 августа 2011 г., в Wayback Machine ), Шведское химическое агентство, apps.kemi.se, 2010 г. По состоянию на 28 апреля 2012 г.
- ^ «Использование возможностей для пара производства -ксилола» . ЮОП, компания Honeywell . Проверено 8 февраля 2015 г.
- ^ Кларк Дж.Э.; Люти, Р.В. (1955). «Выделение ксилолов». Индийский англ. Хим . 47 (2): 250–253. дои : 10.1021/ie50542a028 .
- ^ Стивенсон, Шерил Д.; МакЭлхени, Дэниел Дж.; Кейдж, Дэвид Э.; Чишевски, Джеймс Т.; Райтер, Ричард К. (1998). «Разделение близкокипящих изомеров и одинаково кипящих изотопомеров посредством экстракции с переносом электрона». Аналитическая химия . 70 (18): 3880. doi : 10.1021/ac980221b .
- ^ ICIS, параксилол-ортоксилен | Цены, новости и анализ рынка , icis.com, 2012 г. По состоянию на 28 апреля 2012 г.
- ^ Bostik, Паспорт безопасности Blu-Tack ( архивировано 11 сентября 2011 г., в Wayback Machine ), № 13135, Bostik Corp., июнь 2007 г. По состоянию на 28 апреля 2012 г.
- ^ Самет, Венди, (комп.), Приложение I, Каталог консервации картин , Американский институт консервации исторических и художественных произведений, Conservation-wiki.com, сентябрь 1997 г. По состоянию на 28 апреля 2012 г.
- ^ «Охлаждающие ванны» . Wiki Калифорнийского университета в Дэвисе. 2013-10-02. Архивировано из оригинала 8 февраля 2015 г. Проверено 8 февраля 2015 г.
- ^ Каргилл, Джон (1985) [1964], «Иммерсионное масло и микроскоп» , Ежегодник Нью-Йоркского микроскопического общества , заархивировано из оригинала 11 сентября 2011 г. , получено 10 марта 2011 г.
- ^ Карсон, Фрида; Хладик, Криста (2009). Гистотехнология: текст для самообучения (3-е изд.). Американское общество клинической патологии Press. п. 35. ISBN 9780891895817 .
- ^ Jump up to: а б с Кандьяла, Рина; Рагхавендра, Сумант Пхани К.; Раджасекхаран, Сарасвати Т. (1 января 2010 г.). «Ксилол: обзор опасности для здоровья и меры профилактики» . Журнал патологии полости рта и челюстно-лицевой области . 14 (1): 1–5. дои : 10.4103/0973-029X.64299 . ISSN 0973-029X . ПМК 2996004 . ПМИД 21180450 .
- ^ «ОБЗОР ОСТРОЙ ТОКСИЧНОСТИ: КСИЛОЛЫ» (PDF) . Архивировано из оригинала (PDF) 22 октября 2015 г.
- ^ «Ксилолы (EHC 190, 1997)» .
- ^ Ганьер, Ф.; Мариньяк, Б.; Лангле, К.; Бонне, П. (июль 2001 г.). «Ототоксичность у крыс, подвергшихся воздействию паров орто-, мета- и пара-ксилола в течение 13 недель». Фармакология и токсикология . 89 (1): 6–14. doi : 10.1034/j.1600-0773.2001.d01-129.x (неактивен 9 июля 2024 г.). ISSN 0901-9928 . ПМИД 11484912 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на июль 2024 г. ( ссылка ) - ^ Ганьер, Ф.; Мариньяк, Б.; Блашер, В.; Гроссманн, С.; Лангле, К. (07 марта 2007 г.). «Роль токсикокинетики в ототоксичности, вызванной ксилолом, у крыс и морских свинок». Токсикология . 231 (2–3): 147–158. дои : 10.1016/j.tox.2006.11.075 . ISSN 0300-483X . ПМИД 17210216 .
- ^ Фуэнте, Адриан; Макферсон, Брэдли; Кардемиль, Фелипе (сентябрь 2013 г.). «Слуховая дисфункция у человека, вызванная ксилолом». Ухо и слух . 34 (5): 651–660. дои : 10.1097/AUD.0b013e31828d27d7 . hdl : 10533/134303 . ISSN 1538-4667 . ПМИД 23598724 . S2CID 45206975 .
- ^ Дрейпер, THJ; Бамиу, Д.-Э. (апрель 2009 г.). «Слуховая нейропатия у пациента, подвергшегося воздействию ксилола: отчет о случае» (PDF) . Журнал ларингологии и отологии . 123 (4): 462–465. дои : 10.1017/S0022215108002399 . ISSN 1748-5460 . ПМИД 18439334 . Архивировано (PDF) из оригинала 9 августа 2017 г.
- ^ Фуэнте, Адриан; Макферсон, Брэдли; Худ, Линда Дж. (ноябрь 2012 г.). «Потеря слуха, связанная с воздействием ксилола у лабораторного работника». Журнал Американской академии аудиологии . 23 (10): 824–830. дои : 10.3766/jaaa.23.10.7 . hdl : 10533/137495 . ISSN 1050-0545 . ПМИД 23169198 .
- ^ «ГИППУРОВАЯ И МЕТИЛГИППУРОВАЯ КИСЛОТЫ в моче» (PDF) . Руководство NIOSH по аналитическим методам (NMAM) (Четвертое изд.).
- ^ Jump up to: а б Иноуэ, О.; Сейджи, К.; Каваи, Т.; Ватанабэ, Т.; Джин, К.; Кай, SX; Чен, З.; Цюй, QS; Чжан, Т.; Икеда, М. (1993). «Выделение метилгиппуровой кислоты с мочой у рабочих, подвергшихся воздействию смеси ксилола: сравнение трех изомеров ксилола и толуола». Международные архивы гигиены труда и окружающей среды . 64 (7): 533–539. дои : 10.1007/bf00381104 . ПМИД 8482596 . S2CID 21534640 .
- ^ Кира С. (1977). «Измерение газовой хроматографией гиппуровой кислоты и метилгиппуровой кислоты в моче как показателей воздействия толуола и ксилола» . Профессиональная и экологическая медицина . 34 (305–309): 305–309. дои : 10.1136/oem.34.4.305 . ПМЦ 1008281 . ПМИД 588486 .
Внешние ссылки
[ редактировать ]- Чисхолм, Хью , изд. (1911). . Британская энциклопедия (11-е изд.). Издательство Кембриджского университета.
- Карманный справочник NIOSH по химическим опасностям ( о -ксилол)
- Карманный справочник NIOSH по химическим опасностям ( м -ксилол)
- Карманный справочник NIOSH по химическим опасностям ( п -ксилол)
- Ксилол, сводка опасностей (EPA) (смешанные изомеры)
- Ушные яды , Синергист , Американская ассоциация промышленной гигиены , ноябрь 2018 г.
