Морские вирусы
Морские вирусы определяются их средой обитания как вирусы , которые обнаруживаются в морской среде , то есть в соленой воде морей или океанов или в солоноватой воде прибрежных эстуариев . Вирусы — это небольшие инфекционные агенты , которые могут реплицироваться только внутри живых клеток организма- , хозяина поскольку для этого им необходим механизм репликации хозяина. [4] Они могут инфицировать все виды форм жизни , от животных и растений до микроорганизмов , включая бактерии и археи . [5]
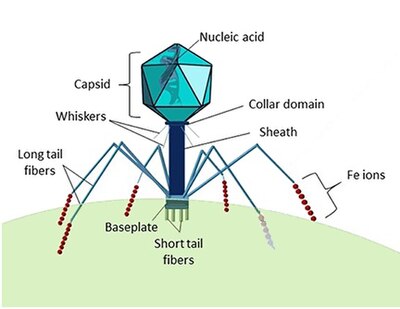
Находясь вне клетки или в процессе заражения клетки, вирусы существуют в форме независимых частиц, называемых вирионами . Вирион содержит геном (длинную молекулу , несущую генетическую информацию в форме ДНК или РНК ), окруженный капсидом ( белковой оболочкой, защищающей генетический материал). Формы этих вирусных частиц варьируются от простых спиральных и икосаэдрических форм для некоторых видов вирусов до более сложных структур для других. Большинство видов вирусов имеют вирионы, которые слишком малы, чтобы их можно было увидеть в оптический микроскоп . Средний вирион составляет примерно одну сотую линейного размера средней бактерии .
Чайная ложка морской воды обычно содержит около пятидесяти миллионов вирусов. [6] Большинство этих вирусов представляют собой бактериофаги , которые заражают и уничтожают морские бактерии и контролируют рост фитопланктона в основе морской пищевой сети . Бактериофаги безвредны для растений и животных, но необходимы для регуляции морских экосистем. Они обеспечивают ключевые механизмы переработки океанского углерода и питательных веществ . В процессе, известном как вирусный шунт , органические молекулы, высвобождаемые из мертвых бактериальных клеток, стимулируют рост новых бактерий и водорослей. разрушение бактерий вирусами ( лизис В частности, было показано, что ) усиливает круговорот азота и стимулирует рост фитопланктона. Вирусная активность также влияет на биологический насос — процесс, который улавливает углерод в глубинах океана. Увеличивая интенсивность дыхания в океанах, вирусы косвенно ответственны за сокращение количества углекислого газа в атмосфере примерно на 3 гигатонны углерода в год.
Морские микроорганизмы составляют около 70% всей морской биомассы . По оценкам, морские вирусы убивают 20% биомассы микроорганизмов каждый день. Вирусы являются основными агентами, ответственными за быстрое уничтожение вредоносного цветения водорослей , которое часто убивает других морских обитателей . Число вирусов в океанах уменьшается по мере удаления от берега и глубже в воду, где меньше организмов-хозяев. Вирусы являются важным естественным средством передачи генов между различными видами, что увеличивает генетическое разнообразие и стимулирует эволюцию. Считается, что вирусы играли центральную роль в ранней эволюции до диверсификации бактерий, архей и эукариот, во времена последнего универсального общего предка жизни на Земле. Вирусы по-прежнему остаются одной из крупнейших областей неисследованного генетического разнообразия на Земле.
| Часть серии обзоров по |
| Морская жизнь |
|---|
 |
Фон
[ редактировать ]| Часть серии о |
| Планктон |
|---|
 |
Сегодня вирусы признаны древними и имеют происхождение, предшествовавшее расколу жизни на три домена . [7] Они встречаются везде, где есть жизнь, и, вероятно, существовали с момента появления живых клеток. [8] Происхождение вирусов в эволюционной истории жизни неясно, поскольку они не образуют окаменелостей. Молекулярные методы используются для сравнения ДНК или РНК вирусов и являются полезным средством изучения того, как они возникли. [9] Некоторые вирусы, возможно, произошли от плазмид — фрагментов ДНК, которые могут перемещаться между клетками, — в то время как другие, возможно, произошли от бактерий. В эволюции вирусы являются важным средством горизонтального переноса генов , увеличивающего генетическое разнообразие . [10]
Мнения относительно того, являются ли вирусы формой жизни или органическими структурами, взаимодействующими с живыми организмами, расходятся. [11] Некоторые считают их формой жизни, поскольку они несут генетический материал, размножаются, создавая множество своих копий посредством самосборки, и развиваются посредством естественного отбора . Однако им не хватает ключевых характеристик, таких как клеточная структура, которая обычно считается необходимой для того, чтобы считаться жизнью. Поскольку вирусы обладают некоторыми, но не всеми такими качествами, их называют репликаторами. [12] и как «организмы на грани жизни». [13]
Существование вирусов в океане было обнаружено с помощью электронной микроскопии и эпифлуоресцентной микроскопии экологических проб воды, а затем с помощью метагеномного отбора некультивируемых вирусных образцов. [14] [15] Морские вирусы, хотя и микроскопические и до недавнего времени практически незамеченные учеными , являются наиболее многочисленными и разнообразными биологическими объектами в океане. Численность вирусов оценивается в 10 30 в океане или между 10 6 и 10 11 вирусов на миллилитр . [4] Количественное определение морских вирусов первоначально проводилось с использованием трансмиссионной электронной микроскопии, но затем было заменено эпифлуоресценцией или проточной цитометрией . [16]
Бактериофаги
[ редактировать ]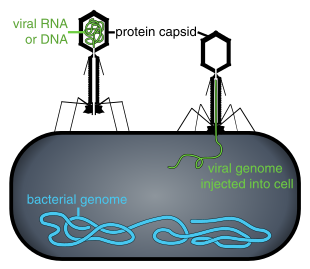
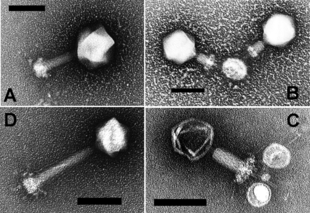
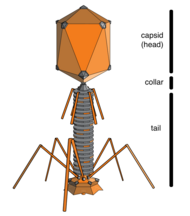
Бактериофаги , часто связанные с фагами , представляют собой вирусы, паразитирующие на бактериях для репликации. Как удачно названо, морские фаги паразитируют на морских бактериях , таких как цианобактерии . [17] Это разнообразная группа вирусов, которые являются наиболее распространенным биологическим объектом в морской среде, поскольку их хозяева, бактерии, обычно являются численно доминирующей клеточной жизнью в море. В океанах фагов в десять раз больше, чем бактерий. [18] достигнув уровня 250 миллионов бактериофагов на миллилитр морской воды. [19] Эти вирусы заражают определенные бактерии, связываясь с поверхностными молекулами рецепторов , а затем проникая в клетку. В течение короткого времени, в некоторых случаях всего за несколько минут, бактериальная полимераза начинает транслировать вирусную мРНК в белок. Эти белки впоследствии становятся либо новыми вирионами внутри клетки, либо белками-помощниками, которые помогают сборке новых вирионов, либо белками, участвующими в лизисе клеток. Вирусные ферменты способствуют разрушению клеточной мембраны, и существуют фаги, которые могут воспроизводить триста фагов через двадцать минут после инъекции. [20]

взаимодействие с морской бактерией Prochromococcus MED4
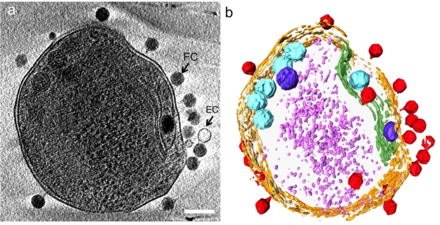
(б) то же изображение, визуализированное путем выделения клеточной стенки оранжевым цветом, плазматической мембраны светло-желтым, тилакоидной мембраны зеленым, карбоксисом голубым, полифосфатного тела синим, адсорбированных фагов по бокам или сверху клетки красным, и цитоплазматические гранулы (вероятно, в основном рибосомы) светло-фиолетового цвета. [21]
Бактерии защищаются от бактериофагов, производя ферменты, разрушающие чужеродную ДНК. Эти ферменты, называемые эндонуклеазами рестрикции , разрезают вирусную ДНК, которую бактериофаги вводят в бактериальные клетки. [22] Бактерии также содержат систему, которая использует последовательности CRISPR для сохранения фрагментов геномов вирусов, с которыми бактерии контактировали в прошлом, что позволяет им блокировать репликацию вируса посредством формы РНК-интерференции . [23] [24] Эта генетическая система обеспечивает бактериям приобретенный иммунитет к инфекции. [25]
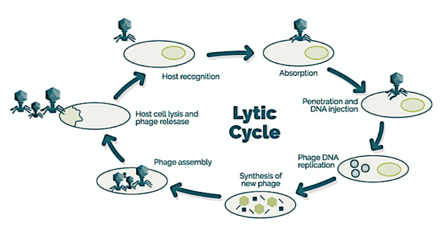
→ прикрепление: фаг прикрепляется к поверхности клетки-хозяина
→ проникновение: фаг вводит свою ДНК через клеточную мембрану
→ транскрипция: ДНК клетки-хозяина разрушается, и метаболизм клетки направлен на инициацию биосинтеза фага.
→ биосинтез: ДНК фага реплицируется внутри клетки
→ созревание: реплицированный материал собирается в полностью сформированные вирусные фаги.
→ лизис : вновь образованные фаги высвобождаются из инфицированной клетки (которая сама разрушается в процессе) для поиска новых клеток-хозяев. [26]
Микробы управляют трансформацией питательных веществ, которые поддерживают экосистемы Земли. [27] а вирусы, которые заражают эти микробы, модулируют как размер, так и разнообразие микробной популяции. [28] [21] Цианобактерия на Земле, вносит существенный вклад в глобальное производство первичного углерода и Prochromococcus , самый распространенный оксигенный фототроф часто достигает плотности более 100 000 клеток на миллилитр в олиготрофных и умеренных океанах. [29] Следовательно, вирусная (цианофаговая) инфекция и лизис прохлорококка представляют собой важный компонент глобального углеродного цикла . Помимо своей экологической роли в индукции смертности хозяев, цианофаги влияют на метаболизм и эволюцию своих хозяев путем кооптации и обмена генами, включая основные гены фотосинтеза. [21]

Долгое время хвостатые фаги отряда Caudovirales, казалось, доминировали в морских экосистемах по численности и разнообразию организмов. [17] Однако в результате недавних исследований бесхвостые вирусы, по-видимому, доминируют на многих глубинах и в океанических регионах. [31] Эти бесхвостые фаги также инфицируют морские бактерии и включают семейства Corticoviridae . [32] иновирусиды , [33] Микровирусиды [34] и автоликивирусиды . [35] [36] [37] [38]
По состоянию на сентябрь 2023 года фаг Halomonas vB HmeY H4907 является первым вирусом, выделенным из самой глубокой части океана. [39]
Архейные вирусы
[ редактировать ]
Архейные вирусы размножаются внутри архей : это вирусы с двухцепочечной ДНК необычной, а иногда и уникальной формы. [40] [41] Наиболее подробно эти вирусы изучены на термофильных археях, в частности на порядках Sulfolobales и Thermoproteales . [42] Защита от этих вирусов включает вмешательство РНК из повторяющихся последовательностей ДНК в геномах архей, которые связаны с генами вирусов. [43] [44] Большинство архей имеют системы CRISPR-Cas в качестве адаптивной защиты от вирусов. Это позволяет археям сохранять участки вирусной ДНК, которые затем используются для нацеливания и устранения последующих заражений вирусом, используя процесс, аналогичный РНК-интерференции. [45]
Грибковые вирусы
[ редактировать ]Миковирусы , также известные как микофаги, представляют собой вирусы, поражающие грибы . Заражение грибковых клеток отличается от заражения клеток животных. Грибы имеют жесткую клеточную стенку, состоящую из хитина, поэтому большинство вирусов могут проникнуть внутрь этих клеток только после травмы клеточной стенки. [46]
- См. Нерва Л., Чуффо М., Валлино М., Маргария П., Варезе Г., Гнави Г., Турина М. (2016). «Множественные подходы к обнаружению и характеристике вирусных и плазмидных симбионтов из коллекции морских грибов». Вирусные исследования . 219 : 22–38. doi : 10.1016/j.virusres.2015.10.028 . hdl : 2318/1527617 . ПМИД 26546154 . S2CID 53417720 .
Эукариотные вирусы
[ редактировать ]
Морские протисты
[ редактировать ]К 2015 году было выделено и исследовано около 40 вирусов, поражающих морских простейших , большинство из которых — вирусы микроводорослей. [47] Геномы этих морских протистских вирусов весьма разнообразны. [48] [49] Морские водоросли могут быть заражены вирусами семейства Phycodnaviridae . Это крупные (100–560 т.п.н.) двухцепочечные ДНК-вирусы с капсидами икосаэдрической формы. К 2014 году в семействе было идентифицировано 33 вида, разделенных на шесть родов. [50] [51] который принадлежит к супергруппе крупных вирусов, известных как нуклеоцитоплазматические большие ДНК-вирусы . В 2014 году были опубликованы данные, свидетельствующие о том, что некоторые штаммы Phycodnaviridae могут заражать людей, а не только виды водорослей, как считалось ранее. [52] Большинство родов этого семейства проникают в клетку-хозяина путем эндоцитоза клеточных рецепторов и реплицируются в ядре.

Фикоднавирусы играют важную экологическую роль, регулируя рост и продуктивность своих водорослей-хозяев. Виды водорослей, такие как Heterosigma akashiwo и род Chrysochromulina, могут образовывать густое цветение, что может нанести ущерб рыболовству и привести к потерям в аквакультуре. [53] Вирус Heterosigma akashiwo (HaV) был предложен для использования в качестве микробного агента для предотвращения повторения токсичных красных приливов, вызываемых этим видом водорослей. [54] Вирус кокколитовируса Emiliania Emiliania huxleyi 86 , гигантский вирус с двухцепочечной ДНК , заражает вездесущий кокколитофор huxleyi . [50] [51] Этот вирус имеет один из крупнейших известных геномов среди морских вирусов. [55] Фикоднавирусы вызывают гибель и лизис пресноводных и морских видов водорослей, выделяя в воду органический углерод, азот и фосфор, обеспечивая питательные вещества для микробного цикла. [56]
Соотношение вирусов и прокариотов, VPR, часто используется как индикатор взаимоотношений между вирусами и хозяевами. В исследованиях VPR использовался для косвенного вывода о влиянии вируса на продуктивность морских микробов, смертность и биогеохимический цикл. [57] Однако, делая эти приближения, ученые предполагают, что VPR составляет 10:1, средний наблюдаемый VPR на поверхности океана. [57] [18] Фактический VPR сильно варьируется в зависимости от местоположения, поэтому VPR может не быть точным показателем вирусной активности или численности после лечения. [57] [58]
Морские беспозвоночные
[ редактировать ]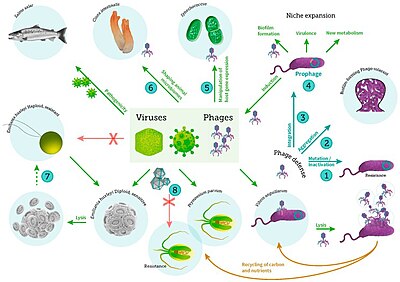
в том числе вирусное заражение бактерий, фитопланктона и рыб [59]
Морские беспозвоночные восприимчивы к вирусным заболеваниям. [60] [61] [62] Истощение морских звезд — заболевание морских звезд и некоторых других иглокожих, которое проявляется спорадически и вызывает массовую смертность заболевших. [63] Этой болезнью поражено около 40 различных видов морских звезд. В 2014 году было высказано предположение, что заболевание связано с одноцепочечным ДНК-вирусом, ныне известным как денсовирус, ассоциированный с морской звездой (SSaDV); однако истощение морских звезд до конца не изучено. [64]
Морские позвоночные
[ редактировать ]Рыбы особенно склонны к заражению рабдовирусами , которые отличаются от вируса бешенства, но родственны ему. По меньшей мере девять типов рабдовируса вызывают экономически важные заболевания у таких видов, как лосось, щука, окунь, морской окунь, карп и треска. Симптомы включают анемию, кровотечение, вялость и уровень смертности, на который влияет температура воды. В инкубаториях заболевания часто контролируют путем повышения температуры до 15–18 °C (59–64 °F). [65] : 442–443 Как и все позвоночные, рыбы болеют вирусами герпеса . Эти древние вирусы эволюционировали вместе со своими хозяевами и обладают высокой видоспецифичностью. [65] : 324 У рыб они вызывают раковые опухоли и нераковые новообразования, называемые гиперплазией . [65] : 325
В 1984 году инфекционная анемия лосося (ISAv) была обнаружена в Норвегии на заводе по выращиванию атлантического лосося . Восемьдесят процентов рыбы во время вспышки погибли. ISAv, вирусное заболевание, в настоящее время представляет собой серьезную угрозу жизнеспособности разведения атлантического лосося. [66] Как следует из названия, он вызывает тяжелую анемию у зараженных рыб . В отличие от млекопитающих, эритроциты рыб имеют ДНК и могут инфицироваться вирусами. Стратегии управления включают разработку вакцины и повышение генетической устойчивости к этой болезни. [67]
Морские млекопитающие также восприимчивы к морским вирусным инфекциям. В 1988 и 2002 годах тысячи тюленей погибли в Европе от вируса чумы чумы . [68] Многие другие вирусы, в том числе калицивирусы , герпесвирусы , аденовирусы и парвовирусы , циркулируют в популяциях морских млекопитающих. [69]
Гигантские морские вирусы
[ редактировать ]Длина большинства вирусов варьируется от 20 до 300 нанометров. Это можно сравнить с длиной бактерий, которая начинается примерно с 400 нанометров. Существуют также гигантские вирусы , часто называемые гирусами , обычно длиной около 1000 нанометров (один микрон). Все гигантские вирусы относятся к типу Nucleocytoviricota (NCLDV) вместе с поксвирусами .Самый крупный известный из них — Тупанвирус . Этот род гигантских вирусов был обнаружен в 2018 году в глубоком океане, а также в содовом озере, и его общая длина может достигать 2,3 микрона. [70]
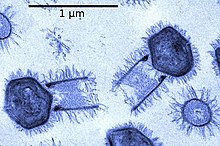
- Гигантский мимивирус
Открытие и последующая характеристика гигантских вирусов вызвали споры относительно их эволюционного происхождения. Две основные гипотезы их происхождения заключаются в том, что либо они произошли от небольших вирусов, перехвативших ДНК от организмов-хозяев, либо они эволюционировали из очень сложных организмов в современную форму, которая не является самодостаточной для размножения. [72] От какого сложного организма могли отделиться гигантские вирусы, также является предметом споров. Одно из предположений состоит в том, что точка происхождения на самом деле представляет собой четвертую область жизни, [73] [74] но это было в значительной степени обесценено. [75] [76]
Вирофаги
[ редактировать ]Вирофаги — это небольшие вирусы с двухцепочечной ДНК, которые возникают в результате совместной инфекции с гигантскими вирусами . Для собственной репликации вирофаги полагаются на фабрику вирусной репликации коинфицирующего гигантского вируса. Одной из характеристик вирофагов является то, что они имеют паразитные отношения с коинфицирующим вирусом. Их зависимость от гигантского вируса для репликации часто приводит к дезактивации гигантских вирусов. Вирофаг может улучшить восстановление и выживаемость организма хозяина. В отличие от других сателлитных вирусов , вирофаги оказывают паразитарное действие на вирус, который их одновременно инфицирует. Было замечено, что вирофаги делают гигантский вирус неактивным и тем самым улучшают состояние организма хозяина.
Все известные вирофаги объединены в семейство Lavidaviridae (от «большие вирусозависимые или ассоциированные» + -viridae ). [77] Первый вирофаг был обнаружен в градирне в Париже в 2008 году. Он был обнаружен вместе с коинфицирующим его гигантским вирусом Acanthamoeba castellanii mamavirus (ACMV). Вирофаг получил название «Спутник» , и его репликация полностью зависела от совместной инфекции ACMV и его цитоплазматического механизма репликации. Также было обнаружено, что «Спутник» оказывает ингибирующее действие на ACMV и улучшает выживаемость хозяина. Другие охарактеризованные вирофаги включают Спутник 2, Спутник 3, Замилон и Мавирус . [78] [79]
Большинство этих вирофагов были обнаружены путем анализа наборов метагеномных данных. В метагеномном анализе последовательности ДНК проходят через множество биоинформатических алгоритмов, которые выявляют определенные важные закономерности и характеристики. В этих наборах данных присутствуют гигантские вирусы и вирофаги. Их разделяют путем поиска последовательностей длиной от 17 до 20 т.п.н. , которые имеют сходство с уже секвенированными вирофагами. Эти вирофаги могут иметь линейные или кольцевые геномы двухцепочечной ДНК. [80] Вирофаги в культуре имеют икосаэдрические частицы капсида длиной от 40 до 80 нанометров. [81] Частицы вирофагов настолько малы, что для их просмотра необходимо использовать электронную микроскопию. Анализ метагеномных последовательностей был использован для предсказания около 57 полных и частичных геномов вирофагов. [82] а в декабре 2019 года — идентифицировать 328 высококачественных (полных или почти полных) геномов из различных сред обитания, включая кишечник человека, ризосферу растений и недра Земли, из 27 различных таксономических клад. [83]
Гигантский морской вирус CroV заражает и вызывает гибель Cafeteria морских зоофлагеллят roenbergensis . [85] Это влияет на прибрежную экологию, поскольку Cafeteria roenbergensis питается бактериями, обитающими в воде. низкая Когда численность Cafeteria roenbergensis из-за обширной инфекции CroV, популяция бактерий увеличивается в геометрической прогрессии. [86] Влияние CroV на естественные популяции C. roenbergensis остается неизвестным; однако было обнаружено, что вирус очень специфичен для хозяина и не заражает другие близкородственные организмы. [87] Cafeteria roenbergensis также заражается вторым вирусом, вирофагом Mavirus , при коинфекции CroV. [78] Этот вирус препятствует репликации CroV, что приводит к выживанию клеток C. roenbergensis . Мавирус способен интегрироваться в геном клеток C. roenbergensis и тем самым придавать популяции иммунитет. [79]
Роль морских вирусов
[ редактировать ]Хотя морские вирусы стали широко изучаться лишь недавно, уже известно, что они играют решающую роль во многих функциях и циклах экосистем. [88] Морские вирусы оказывают ряд важных экосистемных услуг и играют важную роль в регулировании морских экосистем. [3] Морские бактериофаги и другие вирусы, по-видимому, влияют на биогеохимические циклы во всем мире, обеспечивают и регулируют микробное биоразнообразие , обеспечивают круговорот углерода через морские пищевые сети и играют важную роль в предотвращении взрывного роста популяций бактерий . [89]
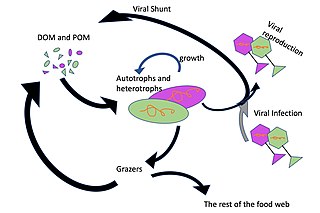
Вирусный шунт
[ редактировать ]
Доминирующими хозяевами вирусов в океане являются морские микроорганизмы, например бактерии. [14] Бактериофаги безвредны для растений и животных и необходимы для регуляции морских и пресноводных экосистем. [91] являются важными агентами смертности фитопланктона , основы пищевой цепи в водной среде. [92] Они заражают и уничтожают бактерии в водных микробных сообществах и являются одним из наиболее важных механизмов переработки углерода и круговорота питательных веществ в морской среде. Органические молекулы, высвобождаемые из мертвых бактериальных клеток, стимулируют рост новых бактерий и водорослей в процессе, известном как вирусный шунт . [93]
Таким образом, считается, что морские вирусы играют важную роль в круговороте питательных веществ, повышая эффективность биологического насоса . Вирусы вызывают лизис живых клеток, то есть разрушают клеточные мембраны. При этом высвобождаются такие соединения, как аминокислоты и нуклеиновые кислоты , которые имеют тенденцию перерабатываться у поверхности.
Вирусная активность также усиливает способность биологического насоса улавливать углерод в глубинах океана. [69] Лизис выделяет больше неперевариваемого богатого углеродом материала, подобного тому, который содержится в клеточных стенках, который, вероятно, экспортируется в более глубокие воды. Таким образом, материал, который экспортируется в более глубокие воды с помощью вирусного шунта, вероятно, более богат углеродом, чем материал, из которого он был получен. [94] [95] Увеличивая интенсивность дыхания в океанах, вирусы косвенно ответственны за сокращение количества углекислого газа в атмосфере примерно на три гигатонны углерода в год. [69] Было показано, что лизис бактерий вирусами также усиливает круговорот азота и стимулирует рост фитопланктона. [96]
Вирусный шунтирующий путь — это механизм, который предотвращает ( прокариотические и эукариотические ) морские микробные частицы органического вещества (ПОМ) от миграции вверх по трофическим уровням путем их переработки в растворенное органическое вещество (РОВ), которое может быть легко поглощено микроорганизмами. Вирусное шунтирование помогает поддерживать разнообразие микробной экосистемы, не позволяя одному виду морских микробов доминировать в микросреде. [97] МОВ, перерабатываемый вирусным шунтирующим путем, сопоставим с количеством, вырабатываемым другими основными источниками морского РОВ. [98]

Вирусы являются наиболее распространенным биологическим объектом в морской среде. [5] В среднем их около десяти миллионов в одном миллилитре морской воды. [100] Большинство из этих вирусов представляют собой бактериофаги, инфицирующие гетеротрофные бактерии, и цианофаги, инфицирующие цианобактерии. Вирусы легко заражают микроорганизмы в микробной петле из-за их относительной численности по сравнению с микробами. [101] Смертность прокариот и эукариот способствует рециркуляции углеродных питательных веществ посредством лизиса клеток . Имеются также свидетельства регенерации азота (особенно аммония). Такая рециркуляция питательных веществ помогает стимулировать рост микробов. [102] До 25% первичной продукции фитопланктона в мировом океане может быть переработано в микробном цикле посредством вирусного шунтирования. [103]
Ограничение цветения водорослей
[ редактировать ]Микроорганизмы составляют около 70% морской биомассы. [104] По оценкам, вирусы убивают 20% биомассы микроорганизмов каждый день, а в океанах вирусов в 15 раз больше, чем бактерий и архей. Вирусы являются основными агентами, ответственными за быстрое уничтожение вредоносного цветения водорослей . [105] которые часто убивают других морских обитателей. [106] Ученые изучают потенциал морских цианофагов для предотвращения или обращения вспять эвтрофикации . Число вирусов в океанах уменьшается по мере удаления от берега и глубже в воду, где меньше организмов-хозяев. [107]
Перенос генов
[ редактировать ]Морские бактериофаги часто содержат вспомогательные метаболические гены , гены, полученные от хозяина, которые, как считается, поддерживают репликацию вируса, дополняя метаболизм хозяина во время вирусной инфекции. [108] Эти гены могут влиять на многочисленные биогеохимические циклы, включая углерод, фосфор, серу и азот. [109] [110] [111] [112]
Вирусы являются важным естественным средством передачи генов между различными видами, что увеличивает генетическое разнообразие и стимулирует эволюцию. [10] Считается, что вирусы играли центральную роль в ранней эволюции, до того, как бактерии, археи и эукариоты диверсифицировались, во времена последнего универсального общего предка жизни на Земле. [113] Вирусы по-прежнему являются одним из крупнейших резервуаров неизведанного генетического разнообразия на Земле. [107]
Морская среда обитания
[ редактировать ]Вдоль побережья
[ редактировать ]Морские прибрежные среды обитания находятся на границе суши и океана. Вполне вероятно, что РНК-вирусы играют значительную роль в этих средах. [114]
На поверхности океана
[ редактировать ]
Морские поверхностные среды обитания находятся на границе между атмосферой и океаном. на Среда обитания , похожая на биопленку, поверхности океана содержит обитающие на поверхности микроорганизмы, обычно называемые нейстоном . Вирусы в микрослое, так называемые вирионеустоны , недавно стали интересовать исследователей как загадочные биологические объекты в пограничных поверхностных слоях с потенциально важными экологическими последствиями. Учитывая, что эта обширная граница раздела воздух-вода находится на пересечении основных процессов воздухообмена и воды, охватывающих более 70% площади мировой поверхности, это, вероятно, будет иметь глубокие последствия для морских биогеохимических циклов , микробного цикла и газообмена, поскольку а также структуру морской пищевой сети , глобальное распространение переносимых по воздуху вирусов, происходящих из микрослоя морской поверхности , и здоровье человека. [115]
В толще воды
[ редактировать ]Морская вирусная активность представляет собой потенциальное объяснение парадокса планктона, предложенного Джорджем Хатчинсоном в 1961 году. [116] Парадокс планктона заключается в том, что многие виды планктона были обнаружены в небольших регионах океана, где ограниченные ресурсы должны создавать конкурентное исключение , ограничивающее количество сосуществующих видов. [116] Морские вирусы могут сыграть роль в этом эффекте, поскольку вирусная инфекция увеличивается по мере увеличения потенциального контакта с хозяевами. [4] Таким образом, вирусы могут контролировать популяции видов планктона, которые становятся слишком многочисленными, позволяя сосуществовать широкому разнообразию видов. [4]
В отложениях
[ редактировать ]Морские бактериофаги играют важную роль в глубоководных экосистемах . Есть между 5x10 12 и 1x10 13 фагов на квадратный метр в глубоководных отложениях, и их численность тесно коррелирует с количеством прокариот, обнаруженных в отложениях. Они ответственны за гибель 80% прокариот, обнаруженных в отложениях, и почти все эти смерти вызваны лизисом (лопанием) клеток. Это позволяет азоту, углероду и фосфору из живых клеток превращаться в растворенные органические вещества и детрит, способствуя высокой скорости круговорота питательных веществ в глубоководных отложениях. Из-за важности глубоководных отложений в биогеохимических циклах морские бактериофаги влияют на циклы углерода , азота и фосфора. Для более точного выяснения этих влияний необходимо провести дополнительные исследования. [117]
В гидротермальных источниках
[ редактировать ]Вирусы являются частью микробного сообщества гидротермальных источников , и их влияние на микробную экологию в этих экосистемах является развивающейся областью исследований. [118] Вирусы — самая распространенная форма жизни в океане, таящая в себе величайший резервуар генетического разнообразия. [105] Поскольку их инфекции часто приводят к летальному исходу, они представляют собой значительный источник смертности и, таким образом, оказывают широкое влияние на биологические океанографические процессы, эволюцию и биогеохимический цикл в океане. [107] Однако были обнаружены доказательства того, что вирусы, обнаруженные в жерловых средах обитания, приняли более мутуалистическую , чем паразитическую эволюционную стратегию, чтобы выжить в экстремальной и нестабильной среде, в которой они существуют. [119] Было обнаружено, что глубоководные гидротермальные источники содержат большое количество вирусов, что указывает на высокую вирусную продукцию. [120] Как и в других морских средах, глубоководные гидротермальные вирусы влияют на численность и разнообразие прокариот и, следовательно, влияют на микробный биогеохимический цикл, лизис своих хозяев для репликации. [121] Однако, в отличие от своей роли источника смертности и контроля над популяцией, предполагается, что вирусы также повышают выживаемость прокариот в экстремальных условиях, выступая в качестве резервуаров генетической информации. Таким образом, считается, что взаимодействие виросферы с микроорганизмами в условиях стресса окружающей среды способствует выживанию микроорганизмов за счет распространения генов хозяина посредством горизонтального переноса генов . [122]
Полярные регионы
[ редактировать ]Помимо разнообразной топографии и, несмотря на чрезвычайно холодный климат, полярные водные регионы изобилуют микробной жизнью . Даже в подледниковых регионах клеточная жизнь адаптировалась к этим экстремальным условиям, где, возможно, есть следы ранних микробов на Земле. Поскольку в большинстве этих полярных регионов выпас макрофауны ограничен, вирусы признаются в качестве важных факторов смертности, тем самым влияя на биогеохимический круговорот питательных веществ , которые, в свою очередь, влияют на динамику сообществ в сезонном и пространственном масштабах. [123] Для полярных регионов характерны усеченные пищевые сети, и роль вирусов в функционировании экосистемы, вероятно, будет даже больше, чем где-либо еще в морской пищевой сети , однако их разнообразие все еще относительно недостаточно изучено, а то, как они влияют на полярные регионы, характеризуется усеченными пищевыми цепями. сообщества не совсем понятны, [124] особенно в круговороте питательных веществ. [125] [126] [127] [123]
Распределение
[ редактировать ]Вирусы очень специфичны для хозяина. [128] Морской вирус с большей вероятностью заразит сопутствующие организмы, то есть те, которые живут в том же регионе, где обитает вирус. [129] Следовательно, биогеография является важным фактором способности вириона заражать.
Знание об этих различиях в вирусных популяциях в пространственно-временных и других градиентах окружающей среды подтверждается морфологией вируса, определенной с помощью трансмиссионной электронной микроскопии (ТЕМ). Бесхвостые вирусы, по-видимому, доминируют на многих глубинах и в океанических регионах, за ними следуют миовирусы Caudovirales , подовирусы и сифовирусы. [31] Однако вирусы, принадлежащие к семействам Corticoviridae , [130] Иновириды [131] и микровирусы [132] Также известно, что они заражают разнообразные морские бактерии. Метагеномные данные свидетельствуют о том, что микровирусы (икосаэдрические фаги оцДНК) особенно распространены в морской среде обитания. [132]
Метагеномные подходы к оценке вирусного разнообразия часто ограничены отсутствием эталонных последовательностей, в результате чего многие последовательности остаются неаннотированными. [133] Однако вирусные контиги создаются путем прямого секвенирования вирусной фракции, обычно образующейся после фильтрации образца морской воды с размером пор 0,02 мкм, или с помощью биоинформатических подходов для идентификации вирусных контигов или вирусных геномов из микробного метагенома. Новые инструменты для выявления предполагаемых вирусных контигов, такие как VirSorter. [134] и ВирФиндер, [135] позволяют оценить закономерности численности вирусов, круг хозяев и функциональное содержание морского бактериофага. [136] [137]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Боннэн С., Брейтбарт М., Бак К. (2016). «Гипотеза ферроянского коня: взаимодействие железа и вируса в океане» . Границы морской науки . 3 : 82. дои : 10.3389/fmars.2016.00082 . S2CID 2917222 .
- ↑ Эти крошечные организмы имеют действительно странную форму , National Geographic , 12 ноября 2016 г.
- ^ Перейти обратно: а б Шорс Т (2008). Понимание вирусов . Издательство Джонс и Бартлетт. п. 5. ISBN 978-0-7637-2932-5 .
- ^ Перейти обратно: а б с д Бруссаард КП, Боду АС, Родригес-Валера Ф (2016). Сталь ЖЖ, Кретойу М.С. (ред.). Морские вирусы . Международное издательство Спрингер . стр. 155–183. дои : 10.1007/978-3-319-33000-6_5 . ISBN 9783319329987 .
{{cite book}}:|work=игнорируется ( помогите ) - ^ Перейти обратно: а б с д Кунин Е.В., Сенкевич Т.Г., Доля В.В. (2006). «Древний мир вирусов и эволюция клеток» . Биология Директ . 1:29 . дои : 10.1186/1745-6150-1-29 . ПМЦ 1594570 . ПМИД 16984643 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 2.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 2.0 . - ^ Саттл С. (2005). «Вирусы в море». Природа . 437 (7057): 356–361. Бибкод : 2005Natur.437..356S . дои : 10.1038/nature04160 . ПМИД 16163346 . S2CID 4370363 .
- ^ Махи У.Дж., Ван Регенмортель MHV, ред. (2009). Настольная энциклопедия общей вирусологии . Оксфорд: Академическая пресса. п. 28. ISBN 978-0-12-375146-1 .
- ^ Айер Л.М., Баладжи С., Кунин Е.В., Аравинд Л. (2006). «Эволюционная геномика ядерно-цитоплазматических крупных ДНК-вирусов» . Вирусные исследования . 117 (1): 156–84. doi : 10.1016/j.virusres.2006.01.009 . ПМИД 16494962 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Санхуан Р., Небот М.Р., Кирико Н., Мански Л.М., Белшоу Р. (октябрь 2010 г.). «Темпы вирусных мутаций» . Журнал вирусологии . 84 (19): 9733–48. дои : 10.1128/JVI.00694-10 . ПМЦ 2937809 . ПМИД 20660197 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б Канчая С., Фурнус Г., Чибани-Шеннуфи С., Диллманн М.Л., Брюссов Х. (2003). «Фаг как агент латерального переноса генов». Современное мнение в микробиологии . 6 (4): 417–24. дои : 10.1016/S1369-5274(03)00086-9 . ПМИД 12941415 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Кунин Е.В., Старокадомский П (2016). «Живы ли вирусы? Парадигма репликатора проливает решающий свет на старый, но ошибочный вопрос» . Исследования по истории и философии биологических и биомедицинских наук . 59 : 125–134. дои : 10.1016/j.shpsc.2016.02.016 . ПМК 5406846 . ПМИД 26965225 .
- ^ Кунин Е.В., Старокадомский П (7 марта 2016 г.). «Живы ли вирусы? Парадигма репликатора проливает решающий свет на старый, но ошибочный вопрос» . Исследования по истории и философии биологических и биомедицинских наук . 59 : 125–34. дои : 10.1016/j.shpsc.2016.02.016 . ПМК 5406846 . ПМИД 26965225 .
- ^ Рыбицкий, Е.П. (1990). «Классификация организмов на пороге жизни, или Проблемы вирусной систематики». Южноафриканский научный журнал . 86 : 182–186.
- ^ Перейти обратно: а б Манн, Нью-Хэмпшир (май 2005 г.). «Третья эра фага» . ПЛОС Биология . 3 (5): е182. doi : 10.1371/journal.pbio.0030182 . ПМК 1110918 . ПМИД 15884981 .
- ^ Уоммак К.Е., Хилл Р.Т., Мюллер Т.А., Колвелл Р.Р. (апрель 1996 г.). «Влияние солнечного света на жизнеспособность и структуру бактериофагов» . Прикладная и экологическая микробиология . 62 (4): 1336–41. Бибкод : 1996ApEnM..62.1336W . дои : 10.1128/АЕМ.62.4.1336-1341.1996 . ПМК 167899 . ПМИД 8919794 .
- ^ Мари Д., Брюссаард К.П., Тирхауг Р., Братбак Г., Воло Д. (январь 1999 г.). «Подсчет морских вирусов в культурных и природных образцах методом проточной цитометрии» . Прикладная и экологическая микробиология . 65 (1): 45–52. Бибкод : 1999ApEnM..65...45M . дои : 10.1128/АЕМ.65.1.45-52.1999 . ПМК 90981 . ПМИД 9872758 .
- ^ Перейти обратно: а б Манн, Нью-Хэмпшир (17 мая 2005 г.). «Третья эпоха фагов» . ПЛОС Биология . 3 (5): 753–755. doi : 10.1371/journal.pbio.0030182 . ПМК 1110918 . ПМИД 15884981 .
- ^ Перейти обратно: а б Уоммак К.Е., Колвелл Р.Р. (март 2000 г.). «Вириопланктон: вирусы в водных экосистемах» . Обзоры микробиологии и молекулярной биологии . 64 (1): 69–114. дои : 10.1128/ММБР.64.1.69-114.2000 . ПМК 98987 . ПМИД 10704475 .
- ^ Берг О., Борсхайм К.Ю., Братбак Г., Хелдал М. (август 1989 г.). «Высокое количество вирусов обнаружено в водной среде». Природа . 340 (6233): 467–68. Бибкод : 1989Natur.340..467B . дои : 10.1038/340467a0 . ПМИД 2755508 . S2CID 4271861 .
- ↑ Шорс, стр. 595–97.
- ^ Перейти обратно: а б с д Мурата К., Чжан К., Галаз-Монтойя Дж., Фу С., Коулман М., Осберн М., Шмид М., Салливан М., Чисхолм С., Чиу В. (2017). «Визуализация адсорбции цианофага P-SSP7 на морском прохлорококке » . Научные отчеты . 7 : 44176. Бибкод : 2017NatSR...744176M . дои : 10.1038/srep44176 . ПМК 5345008 . ПМИД 28281671 .
- ^ Бикл Т.А., Крюгер Д.Х. (июнь 1993 г.). «Биология рестрикции ДНК» . Микробиологические обзоры . 57 (2): 434–50. дои : 10.1128/MMBR.57.2.434-450.1993 . ПМК 372918 . ПМИД 8336674 .
- ^ Баррангу Р., Фремо С., Дево Х., Ричардс М., Бояваль П., Муано С., Ромеро Д.А., Хорват П. (март 2007 г.). «CRISPR обеспечивает приобретенную устойчивость прокариот к вирусам». Наука . 315 (5819): 1709–12. Бибкод : 2007Sci...315.1709B . дои : 10.1126/science.1138140 . hdl : 20.500.11794/38902 . ПМИД 17379808 . S2CID 3888761 .
- ^ Браунс С.Дж., Джор М.М., Лундгрен М., Вестра Э.Р., Слейкхейс Р.Дж., Снейдерс А.П., Дикман М.Дж., Макарова К.С., Кунин Е.В., ван дер Оост Дж. (август 2008 г.). «Маленькие РНК CRISPR обеспечивают противовирусную защиту прокариот» . Наука . 321 (5891): 960–64. Стартовый код : 2008Sci...321..960B . дои : 10.1126/science.1159689 . ПМЦ 5898235 . ПМИД 18703739 .
- ^ Мохика Ф.Д., Родригес-Валера Ф. (сентябрь 2016 г.). «Открытие CRISPR у архей и бактерий». Журнал ФЭБС . 283 (17): 3162–69. дои : 10.1111/февраль 13766 . hdl : 10045/57676 . ПМИД 27234458 . S2CID 42827598 .
- ^ Как размножаются бактериофаги? Университет Барселоны. Проверено 12 июля 2020 г.
- ^ Фальковски П., Фенчел Т., Делонг Э. (2008). «Микробные двигатели, управляющие биогеохимическими циклами Земли». Наука . 320 (5879): 1034–1039. Бибкод : 2008Sci...320.1034F . дои : 10.1126/science.1153213 . ПМИД 18497287 . S2CID 2844984 .
- ^ Брам Дж., Салливан М. (2015). «Принимая вызов: ускоренные темпы открытий меняют морскую вирусологию». Обзоры природы Микробиология . 13 (3): 147–159. дои : 10.1038/nrmicro3404 . ПМИД 25639680 . S2CID 32998525 .
- ^ Бауман Х, Уллоа О, Сканлан Д, Цвирглмайер К, Ли В, Платт Т, Стюарт В, Барлоу Р, Лет О, Клементсон Л, Лутц В (2006). «Океанографические основы глобального поверхностного распространения экотипов Prochromococcus ». Наука . 312 (5775): 918–921. Бибкод : 2006Sci...312..918B . дои : 10.1126/science.1122692 . ПМИД 16690867 . S2CID 20738145 .
- ^ Гонсалес-Серрано Р., Данн М., Росселли Р., Мартин-Куадрадо А.Б., Гросбуйо В., Зинсли Л.В., Рода-Гарсия Дж.Дж., Лесснер М.Дж., Родригес-Валера Ф (2020). «Alteromonas Myovirus V22 представляет новый род морских бактериофагов, требующий шаперона хвостового волокна для распознавания хозяина» . mSystems . 5 (3). дои : 10.1128/mSystems.00217-20 . ПМЦ 7289586 . ПМИД 32518192 .
- ^ Перейти обратно: а б Брум-младший, Шенк Р.О., Салливан М.Б. (сентябрь 2013 г.). «Глобальный морфологический анализ морских вирусов показывает минимальную региональную изменчивость и доминирование бесхвостых вирусов» . Журнал ISME . 7 (9): 1738–51. Бибкод : 2013ISMEJ...7.1738B . дои : 10.1038/ismej.2013.67 . ПМЦ 3749506 . ПМИД 23635867 .
- ^ Крупович М., Бэмфорд Д.Х. (2007). «Предположительные профаги, родственные литическому бесхвостому морскому фагу дцДНК PM2, широко распространены в геномах водных бактерий» . БМК Геномика . 8 : 236. дои : 10.1186/1471-2164-8-236 . ЧВК 1950889 . ПМИД 17634101 .
- ^ Сюэ Х, Сюй Ю, Буше Ю, Полц МФ (2012). «Высокая частота появления нового нитчатого фага, VCYφ, в популяции холерного вибриона окружающей среды» . Прикладная и экологическая микробиология . 78 (1): 28–33. Бибкод : 2012ApEnM..78...28X . дои : 10.1128/АЕМ.06297-11 . ПМЦ 3255608 . ПМИД 22020507 .
- ^ Ру С., Крупович М., Пуле А., Деброа Д., Эно Ф. (2012). «Эволюция и разнообразие вирусного семейства Microviridae посредством коллекции из 81 нового полного генома, собранного из считываний вирома» . ПЛОС ОДИН . 7 (7): е40418. Бибкод : 2012PLoSO...740418R . дои : 10.1371/journal.pone.0040418 . ПМЦ 3394797 . ПМИД 22808158 .
- ^ Кауфман К.М., Хусейн Ф.А., Ян Дж., Аревало П., Браун Дж.М., Чанг В.К., Ванинсберг Д., Эльшербини Дж., Шарма Р.С., Катлер М.Б., Келли Л., Польц М.Ф. (2018). «Основная линия бесхвостых вирусов дцДНК как непризнанных убийц морских бактерий». Природа . 554 (7690): 118–122. Бибкод : 2018Natur.554..118K . дои : 10.1038/nature25474 . ПМИД 29364876 . S2CID 4462007 .
- ↑ Ученые обнаружили в Мировом океане новый тип вируса: Autolykiviridae , на: научные новости, 25 января 2018 г.
- ^ Никогда ранее не встречавшиеся вирусы со странной ДНК были только что обнаружены в океане , на: наука тревога , 25 января 2018 г.
- ^ NCBI: Autolykiviridae (семейство) - неклассифицированные вирусы дцДНК.
- ^ Су Ю, Чжан В, Лян Ю, Ван Х, Лю Ю, Чжэн К, Лю З, Ю Х, Рен Л, Шао Х, Сун Ю, Мок В.Дж., Вонг Л.Л., Чжан Ю.З., МакМинн А. (20 сентября 2023 г.). Чао Д.Ю. (ред.). «Идентификация и геномный анализ умеренного бактериофага Halomonas vB_HmeY_H4907 из поверхностных отложений Марианской впадины на глубине 8900 м» . Микробиологический спектр . 11 (5): e0191223. дои : 10.1128/spectrum.01912-23 . ISSN 2165-0497 . ПМЦ 10580944 . ПМИД 37728551 .
- ^ Лоуренс СМ, Менон С., Эйлерс Б.Дж., Ботнер Б., Хаят Р., Дуглас Т., Янг М.Дж. (2009). «Структурно-функциональные исследования архейных вирусов» . Журнал биологической химии . 284 (19): 12599–603. дои : 10.1074/jbc.R800078200 . ПМК 2675988 . ПМИД 19158076 .
- ^ Прангишвили Д., Фортер П., Гаррет Р.А. (2006). «Вирусы архей: объединяющий взгляд». Обзоры природы Микробиология . 4 (11): 837–48. дои : 10.1038/nrmicro1527 . ПМИД 17041631 . S2CID 9915859 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Прангишвили Д., Гаррет Р.А. (2004). «Исключительно разнообразные морфотипы и геномы кренархейных гипертермофильных вирусов» (PDF) . Труды Биохимического общества . 32 (Часть 2): 204–8. дои : 10.1042/BST0320204 . ПМИД 15046572 . S2CID 20018642 .
- ^ Мохика Ф.Х., Диес-Вильясеньор К., Гарсиа-Мартинес Х., Сория Э. (февраль 2005 г.). «Промежуточные последовательности прокариотических повторов с регулярными интервалами происходят от чужеродных генетических элементов». Журнал молекулярной эволюции . 60 (2): 174–82. Бибкод : 2005JMolE..60..174M . дои : 10.1007/s00239-004-0046-3 . ПМИД 15791728 . S2CID 27481111 .
- ^ Макарова К.С., Гришин Н.В., Шабалина С.А., Вольф Ю.И., Кунин Е.В. (март 2006 г.). «Предполагаемая иммунная система прокариот, основанная на РНК-интерференции: вычислительный анализ предсказанного ферментативного механизма, функциональные аналогии с эукариотическими РНКи и гипотетические механизмы действия» . Биология Директ . 1 :7. дои : 10.1186/1745-6150-1-7 . ПМК 1462988 . ПМИД 16545108 .
- ^ ван дер Оост Дж., Вестра Э.Р., Джексон Р.Н., Виденхефт Б. (июль 2014 г.). «Раскрытие структурной и механистической основы систем CRISPR-Cas» . Обзоры природы Микробиология . 12 (7): 479–92. дои : 10.1038/nrmicro3279 . ПМЦ 4225775 . ПМИД 24909109 .
- ^ Диммок, Нью-Джерси, Истон А.Дж., Леппард К. (2007). Введение в современную вирусологию (Шестое изд.). Издательство Блэквелл. п. 70 . ISBN 978-1-4051-3645-7 .
- ^ Томару И., Кимура К. и Нагасаки К. (2015) «Морские вирусы протистов» . В: Оцука С., Сузаки Т., Хоригучи Т., Сузуки Н., Not F (ред.) Морские Протисты, страницы 501–517. Спрингер, Токио. дои : 10.1007/978-4-431-55130-0_20 . ISBN 978-4-431-55130-0 .
- ^ Хайман П., Абедон С.Т. (2012). «Маленькие блохи: вирусы микроорганизмов» . Научка . 2012 : 1–23. дои : 10.6064/2012/734023 . ПМК 3820453 . ПМИД 24278736 . .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 . - ^ Короткометражка S (2012). «Экология вирусов, поражающих эукариотические водоросли». Экологическая микробиология . 14 (9): 2253–2271. Бибкод : 2012EnvMi..14.2253S . дои : 10.1111/j.1462-2920.2012.02706.x . ПМИД 22360532 .
- ^ Перейти обратно: а б «Вирусная зона» . ЭксПАСи . Проверено 15 июня 2015 г.
- ^ Перейти обратно: а б ICTV. «Таксономия вирусов: выпуск 2014 г.» . Проверено 15 июня 2015 г.
- ^ Йолкен Р.Х. и др. (2014). «Хлоровирус ATCV-1 является частью орофарингеального вирома человека и связан с изменениями когнитивных функций у людей и мышей» . Proc Natl Acad Sci США . 111 (45): 16106–16111. Бибкод : 2014PNAS..11116106Y . дои : 10.1073/pnas.1418895111 . ПМЦ 4234575 . ПМИД 25349393 .
- ^ Томару Ю, Шираи Ю, Нагасаки К (1 августа 2008 г.). «Экология, физиология и генетика фикоднавируса, поражающего ядовитый цветущий рафидофит Heterosigma akashiwo ». Рыболовная наука . 74 (4): 701–711. Бибкод : 2008FisSc..74..701T . дои : 10.1111/j.1444-2906.2008.01580.x . S2CID 23152411 .
- ^ Нагасаки К., Тарутани К., Ямагути М. (1 марта 1999 г.). «Характеристики роста вируса Heterosigma akashiwo и его возможное использование в качестве микробиологического агента для борьбы с красным приливом» . Прикладная и экологическая микробиология . 65 (3): 898–902. Бибкод : 1999ApEnM..65..898N . дои : 10.1128/АЕМ.65.3.898-902.1999 . ПМК 91120 . ПМИД 10049839 .
- ^ Крупнейшие известные вирусные геномы Giantviruses.org . Доступ: 11 июня 2020 г.
- ^ Сиги Д. (27 сентября 2005 г.). Пресноводная микробиология: биоразнообразие и динамические взаимодействия микроорганизмов в водной среде . Джон Уайли и сыновья. ISBN 9780470026472 .
- ^ Перейти обратно: а б с Вигингтон CH, Зондереггер Д.Л., Брюссаард CP, Бьюкен А., Финке Дж.Ф., Фурман Дж., Леннон Дж.Т., Мидделбо М., Саттл Калифорния, Сток C, Уилсон WH (26 августа 2015 г.). «Пересмотр взаимосвязи между численностью вирусов и микробных клеток в мировом океане» . bioRxiv : 025544. bioRxiv 10.1101/025544 . дои : 10.1101/025544 .
- ^ Парикка К.Дж., Ле Романсер М., Вотерс Н., Жаке С. (май 2017 г.). «Расшифровка соотношения вирусов и прокариотов (VPR): понимание взаимоотношений вирус-хозяин в различных экосистемах». Биологические обзоры Кембриджского философского общества . 92 (2): 1081–1100. дои : 10.1111/brv.12271 . ПМИД 27113012 . S2CID 3463306 .
- ^ Мидделбо М., Брюссаард К. (2017). «Морские вирусы: ключевые игроки морских экосистем» . Вирусы . 9 (10): 302. дои : 10.3390/v9100302 . ПМЦ 5691653 . ПМИД 29057790 .
- ^ ТДжонсон П. (1984). «Вирусные болезни морских беспозвоночных» . Морские исследования Гельголанда . 37 (1–4): 65–98. Бибкод : 1984HM.....37...65J . дои : 10.1007/BF01989296 . S2CID 30161955 .
- ^ Renault T (2011) «Вирусы, заражающие морских моллюсков» В: Hurst CJ (Ed) Исследования в области вирусной экологии , Том 2: Системы-хозяева животных, John Wiley & Sons. ISBN 9781118024584 .
- ^ Арзул И, Корбей С, Морга Б, Рено Т (2017). «Вирусы, поражающие морских моллюсков» (PDF) . Журнал патологии беспозвоночных . 147 : 118–135. дои : 10.1016/j.jip.2017.01.009 . ПМИД 28189502 .
- ^ Даусони, Соластер. «Виды морских звезд, страдающие синдромом истощения». Pacificrockyintertidal.org Seastarwasting.org (без даты): n. стр. Экология и эволюционная биология . Веб.
- ^ «Синдром истощения морских звезд | МОРСКОЙ» . eeb.ucsc.edu . Проверено 3 июня 2018 г.
- ^ Перейти обратно: а б с Мерфи, Ф.А., Гиббс, EPJ, Хорзинек, MC, Стаддарт MJ (1999). Ветеринарная вирусология . Бостон: Академическая пресса. ISBN 978-0-12-511340-3 .
- ^ Нью-Брансуик поможет Чили победить болезнь. Информация и услуги по рыбе.
- ^ Информационный бюллетень - Исследования в области аквакультуры атлантического лосося. Архивировано 29 декабря 2010 г. в Wayback Machine Fisheries and Oceans Canada . Проверено 12 мая 2009 г.
- ^ Холл А.Дж., Джепсон П.Д., Гудман С.Дж., Харконен Т. (2006). «Вирус чумки чумы в Северном и Европейском морях – данные и модели, природа и воспитание». Биологическая консервация . 131 (2): 221–29. Бибкод : 2006BCons.131..221H . doi : 10.1016/j.biocon.2006.04.008 .
- ^ Перейти обратно: а б с Саттл, Калифорния (октябрь 2007 г.). «Морские вирусы – основные игроки глобальной экосистемы». Обзоры природы Микробиология . 5 (10): 801–12. дои : 10.1038/nrmicro1750 . ПМИД 17853907 . S2CID 4658457 .
- ^ Абраао Х, Силва Л., Силва Л.С., Халил Дж.Ю., Родригес Р., Арантес Т., Ассис Ф., Боратто П., Андраде М., Крун Э.Г., Рибейро Б., Бержье И., Селигманн Х., Гиго Е., Колсон П., Левассер А., Кремер Г. , Рауль Д., Скола Б.Л. (27 февраля 2018 г.). «Хвостатый гигантский Тупанвирус обладает наиболее полным трансляционным аппаратом из известных виросфере» . Природные коммуникации . 9 (1): 749. Бибкод : 2018NatCo...9..749A . дои : 10.1038/s41467-018-03168-1 . ПМЦ 5829246 . ПМИД 29487281 .
- ^ Сяо С, Фишер М, Болотауло Д, Уллоа-Рондо Н, Авила Г, Саттл С (2017). «Крио-ЭМ-реконструкция капсида вируса Cafeteria roenbergensis предполагает новый путь сборки гигантских вирусов» . Научные отчеты . 7 (1): 5484. Бибкод : 2017NatSR...7.5484X . doi : 10.1038/s41598-017-05824-w . ПМК 5511168 . ПМИД 28710447 .
- ^ Бичелл Р.Э. «Гены гигантских вирусов намекают на их загадочное происхождение» . Все учтено .
- ^ Ван Эттен Дж.Л. (июль – август 2011 г.). «Гигантские вирусы» . Американский учёный . 99 (4): 304–311. дои : 10.1511/2011.91.304 .
- ^ Лежандр М., Арслан Д., Абергель С., Клавери Дж.М. (январь 2012 г.). «Геномика мегавируса и неуловимая четвертая область жизни» . Коммуникативная и интегративная биология . 5 (1): 102–6. дои : 10.4161/cib.18624 . ПМК 3291303 . ПМИД 22482024 .
- ^ Шульц Ф., Ютин Н., Иванова Н.Н., Ортега Д.Р., Ли Т.К., Вирхейлиг Дж., Даймс Х., Хорн М., Вагнер М., Йенсен Г.Дж., Кирпидес Н.К., Кунин Е.В., Войк Т. (апрель 2017 г.). «Гигантские вирусы с расширенным набором компонентов системы трансляции» (PDF) . Наука . 356 (6333): 82–85. Бибкод : 2017Sci...356...82S . дои : 10.1126/science.aal4657 . ПМИД 28386012 . S2CID 206655792 .
- ^ Бэкстрем Д., Ютин Н., Йоргенсен С.Л., Дхарамши Дж., Хома Ф., Заремба-Недведска К., Спанг А., Вольф Ю.И., Кунин Е.В., Эттема Т.Дж. (март 2019 г.). «Вирусные геномы из глубоководных отложений расширяют мегавиром океана и поддерживают независимое происхождение вирусного гигантизма» . мБио . 10 (2): e02497-02418. дои : 10.1128/mBio.02497-18 . ПМК 6401483 . ПМИД 30837339 .
- ^ Дюпоншель С., Фишер М.Г. (март 2019 г.). «Вива лавидавирусы! Пять особенностей вирофагов, паразитирующих на гигантских ДНК-вирусах» . ПЛОС Патогены . 15 (3): e1007592. дои : 10.1371/journal.ppat.1007592 . ПМЦ 6428243 . ПМИД 30897185 .
- ^ Перейти обратно: а б Фишер М.Г., Саттл, Калифорния (апрель 2011 г.). «Вирофаг – источник больших ДНК-транспозонов». Наука . 332 (6026): 231–4. Бибкод : 2011Sci...332..231F . дои : 10.1126/science.1199412 . ПМИД 21385722 . S2CID 206530677 .
- ^ Перейти обратно: а б Фишер М.Г., Хакл (декабрь 2016 г.). «Интеграция генома хозяина и индуцированная гигантским вирусом реактивация мавируса вирофага». Природа . 540 (7632): 288–91. Бибкод : 2016Natur.540..288F . дои : 10.1038/nature20593 . ПМИД 27929021 . S2CID 4458402 .
- ^ Кацуракис А., Асвад А. (2014). «Происхождение гигантских вирусов, вирофагов и их родственников в геномах хозяев» . БМК Биология . 12 : 2–3. дои : 10.1186/s12915-014-0051-y . ПМК 4096385 . ПМИД 25184667 .
- ^ Крупович М., Кун Дж., Фишер М. (осень 2015 г.). «Система классификации вирофагов и сателлитных вирусов» (PDF) . Архив вирусологии . 161 (1): 233–247. дои : 10.1007/s00705-015-2622-9 . ПМИД 26446887 . S2CID 14196910 – через Springer.
- ^ Ру С., Чан Л.К., Иган Р., Мальмстрем Р.Р., МакМахон К.Д., Салливан М.Б. (2017). «Экогеномика вирофагов и их гигантских вирусных хозяев, оцененная с помощью метагеномики временных рядов» . Природные коммуникации . 8 (1): 858. Бибкод : 2017NatCo...8..858R . дои : 10.1038/s41467-017-01086-2 . ISSN 2041-1723 . ПМЦ 5636890 . ПМИД 29021524 .
- ^ Паес-Эспино Д., Чжоу Дж., Ру С., Найфач С., Павлопулос Г.А., Шульц Ф., МакМахон К.Д., Уолш Д., Войк Т., Иванова Н.Н., Элоэ-Фадрош Э.А., Тринге С.Г., Кирпидес Н.К. (10 декабря 2019 г.). «Разнообразие, эволюция и классификация вирофагов, обнаруженные с помощью глобальной метагеномики» . Микробиом . 7 (1): 157. дои : 10.1186/s40168-019-0768-5 . ПМК 6905037 . ПМИД 31823797 .
- ^ Дюпоншель С., Фишер М.Г. (2019). «Вива лавидавирусы! Пять особенностей вирофагов, паразитирующих на гигантских ДНК-вирусах» . ПЛОС Патогены . 15 (3): e1007592. дои : 10.1371/journal.ppat.1007592 . ПМЦ 6428243 . ПМИД 30897185 . .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 . - ^ Фишер, М.Г., Аллен, М.Дж., Уилсон, У.Х., Саттл, Калифорния (2010). «Гигантский вирус с замечательным набором генов заражает морской зоопланктон» (PDF) . Труды Национальной академии наук . 107 (45): 19508–19513. Бибкод : 2010PNAS..10719508F . дои : 10.1073/pnas.1007615107 . ПМЦ 2984142 . ПМИД 20974979 .
- ^ Матиас Г. Фишер, Майкл Дж. Аллен, Уильям Х. Уилсон, Кертис А. Саттл (2010). «Гигантский вирус с замечательным набором генов заражает морской зоопланктон» (PDF) . Труды Национальной академии наук . 107 (45): 19508–19513. Бибкод : 2010PNAS..10719508F . дои : 10.1073/pnas.1007615107 . ПМЦ 2984142 . ПМИД 20974979 .
- ^ Массана, Рамон, Хавьер Дель Кампо, Кристиан Динтер, Рубен Соммаруга (2007). «Гибель популяции морских гетеротрофных жгутиконосцев Cafeteria roenbergensis из-за вирусной инфекции». Экологическая микробиология . 9 (11): 2660–2669. Бибкод : 2007EnvMi...9.2660M . дои : 10.1111/j.1462-2920.2007.01378.x . ПМИД 17922751 . S2CID 30191542 .
- ^ Херндл Г., Бриан Ф., ред. (2003). Экология морских вирусов. Монография семинара CIESM 21 [1]
- ^ Уолдор М.К., Фридман Д.И., Адья С.Л., ред. (2005). Фаги: их роль в бактериальном патогенезе и биотехнологии . Вашингтон, округ Колумбия: ASM Press. стр. 450 . ISBN 978-1-55581-307-9 .
- ^ Кезе Л., Гойер Дж.К. (2018). «Реакция фитопланктона на изменение морского климата – введение». YOUMARES 8 – Океаны через границы: учимся друг у друга . стр. 55–71. дои : 10.1007/978-3-319-93284-2_5 . ISBN 978-3-319-93283-5 . S2CID 134263396 .
- ^ Вайц Дж.С., Вильгельм С.В. (2013). «Океан вирусов» . Ученый . 27 (7): 35–39.
- ^ Саттл, Калифорния (сентябрь 2005 г.). «Вирусы в море». Природа . 437 (7057): 356–61. Бибкод : 2005Natur.437..356S . дои : 10.1038/nature04160 . ПМИД 16163346 . S2CID 4370363 .
- ^ Вильгельм С.В., Саттл, Калифорния (1999). «Вирусы и циклы питательных веществ в море: вирусы играют решающую роль в структуре и функциях водных пищевых сетей» . Бионаука . 49 (10): 781–88. дои : 10.2307/1313569 . JSTOR 1313569 .
- ^ Саттл, Калифорния (октябрь 2007 г.). «Морские вирусы — основные игроки глобальной экосистемы». Обзоры природы Микробиология . 5 (10): 801–12. дои : 10.1038/nrmicro1750 . ПМИД 17853907 . S2CID 4658457 .
- ^ Саттл, Калифорния (сентябрь 2005 г.). «Вирусы в море». Природа . 437 (7057): 356–61. Бибкод : 2005Natur.437..356S . дои : 10.1038/nature04160 . ПМИД 16163346 . S2CID 4370363 .
- ^ Шелфорд Э.Дж., Саттл, Калифорния (2018). «Вирус-опосредованный перенос азота от гетеротрофных бактерий к фитопланктону» . Биогеонауки . 15 (3): 809–15. Бибкод : 2018BGeo...15..809S . дои : 10.5194/bg-15-809-2018 .
- ^ Вайнбауэр М.Г. и др. (2007). «Синергетическое и антагонистическое воздействие вирусного лизиса и выпаса протистана на бактериальную биомассу, производство и разнообразие». Экологическая микробиология . 9 (3): 777–788. Бибкод : 2007EnvMi...9..777W . дои : 10.1111/j.1462-2920.2006.01200.x . ПМИД 17298376 .
- ^ Робинсон, Кэрол и Нагаппа Рамайя. «Скорость микробного гетеротрофного метаболизма ограничивает микробный углеродный насос». Американская ассоциация содействия развитию науки, 2011 г.
- ^ Генрихс, М.Э., Мори, К. и Длугош, Л. (2020) «Сложные взаимодействия между водными организмами и их химической средой, выясненные с разных точек зрения». В: YOUMARES 9-Океаны: наши исследования, наше будущее , страницы 279–297. Спрингер. дои : 10.1007/978-3-030-20389-4_15 .
- ^ Давила-Рамос С., Кастелан-Санчес Х.Г., Мартинес-Авила Л., Санчес-Карбенте М.Д., Перальта Р., Эрнандес-Мендоса А., Добсон А.Д., Гонсалес Р.А., Пастор Н., Батиста-Гарсия Р.А. (2019). «Обзор вирусной метагеномики в экстремальных условиях» . Границы микробиологии . 10 : 2403. дои : 10.3389/fmicb.2019.02403 . ПМК 6842933 . ПМИД 31749771 .
- ^ Фурман Дж.А. (1999). «Морские вирусы и их биогеохимические и экологические эффекты». Природа . 399 (6736): 541–548. Бибкод : 1999Natur.399..541F . дои : 10.1038/21119 . ISSN 0028-0836 . ПМИД 10376593 . S2CID 1260399 .
- ^ Цай, Ань-И, Гво-Цзин Гун и Ю-Вэнь Хуан. «Важность вирусного шунта в круговороте азота у Synechococcus Spp. Рост в субтропических прибрежных водах западной части Тихого океана». Науки о Земле, атмосфере и океане 25.6 (2014).
- ^ Вильгельм С.В., Саттл, Калифорния (1999). «Вирусы и циклы питательных веществ в море: вирусы играют решающую роль в структуре и функциях водных пищевых сетей» . Бионаука . 49 (10): 781–788. дои : 10.2307/1313569 . JSTOR 1313569 .
- ^ Бар-Он Ю.М., Филлипс Р., Майло Р. (2018). «Распределение биомассы на Земле» . ПНАС . 115 (25): 6506–6511. Бибкод : 2018PNAS..115.6506B . дои : 10.1073/pnas.1711842115 . ПМК 6016768 . ПМИД 29784790 .
- ^ Перейти обратно: а б Саттл, Калифорния (2005). «Вирусы в море». Природа . 437 (7057): 356–361. Бибкод : 2005Natur.437..356S . дои : 10.1038/nature04160 . ISSN 0028-0836 . ПМИД 16163346 . S2CID 4370363 .
- ^ «Вредное цветение водорослей: Красный прилив: Дом | CDC HSB» . www.cdc.gov . Проверено 19 декабря 2014 г.
- ^ Перейти обратно: а б с Саттл, Калифорния (октябрь 2007 г.). «Морские вирусы — основные игроки глобальной экосистемы». Обзоры природы Микробиология . 5 (10): 801–812. дои : 10.1038/nrmicro1750 . ISSN 1740-1526 . ПМИД 17853907 . S2CID 4658457 .
- ^ Брейтбарт М., Томпсон Л., Саттл С., Салливан М. (1 июня 2007 г.). «Изучение огромного разнообразия морских вирусов» (PDF) . Океанография . 20 (2): 135–139. дои : 10.5670/oceanog.2007.58 .
- ^ Гурвиц Б.Л., У'Рен Дж.М. (июнь 2016 г.). «Вирусное метаболическое перепрограммирование в морских экосистемах». Современное мнение в микробиологии . 31 : 161–168. дои : 10.1016/j.mib.2016.04.002 . ПМИД 27088500 .
- ^ Гурвиц Б.Л., Халлам С.Дж., Салливан М.Б. (ноябрь 2013 г.). «Метаболическое перепрограммирование вирусами в солнечном и темном океане» . Геномная биология . 14 (11): 123 р. дои : 10.1186/gb-2013-14-11-r123 . ПМК 4053976 . ПМИД 24200126 .
- ^ Анантараман К., Дюэйм М.Б., Брейер Дж.А., Вендт К.А., Тонер Б.М., Дик Г.Дж. (май 2014 г.). «Гены окисления серы в различных глубоководных вирусах». Наука . 344 (6185): 757–60. Бибкод : 2014Sci...344..757A . дои : 10.1126/science.1252229 . HDL : 1912/6700 . ПМИД 24789974 . S2CID 692770 .
- ^ Ру С., Хоули А.К., Торрес Бельтран М., Скофилд М., Швинтек П., Степанаускас Р., Войк Т., Халлам С.Дж., Салливан М.Б. (август 2014 г.). «Экология и эволюция вирусов, заражающих некультивируемые бактерии SUP05, по данным одноклеточной и метагеномики» . электронная жизнь . 3 : e03125. дои : 10.7554/elife.03125 . ПМК 4164917 . ПМИД 25171894 .
- ^ Фортер П., Филипп Х (1999). «Последний универсальный общий предок (LUCA), простой или сложный?». Биологический вестник . 196 (3): 373–5, обсуждение 375–7. дои : 10.2307/1542973 . JSTOR 1542973 . ПМИД 11536914 .
- ^ Калли А., Ланг А., Саттл С. (2006). «Метагеномный анализ прибрежных сообществ РНК-вирусов». Наука . 312 (5781): 1795–1798. Бибкод : 2006Sci...312.1795C . дои : 10.1126/science.1127404 . ПМИД 16794078 . S2CID 20194876 .
- ^ Перейти обратно: а б Ральф Дж (2019). «Вирионеустон: обзор вирусно-бактериальных ассоциаций на границе раздела воздух-вода» . Вирусы . 11 (2): 191. дои : 10.3390/v11020191 . ПМК 6410083 . ПМИД 30813345 . .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 . - ^ Перейти обратно: а б Хатчинсон Дж. Э. (1961). «Парадокс планктона». Американский натуралист . 95 (882): 137–145. дои : 10.1086/282171 . JSTOR 2458386 . S2CID 86353285 .
- ^ Дановаро Р., Делл'Анно А., Коринальдези С., Маганьини М., Нобл Р., Тамбурини С., Вайнбауэр М. (август 2008 г.). «Основное вирусное воздействие на функционирование донных глубоководных экосистем». Природа . 454 (7208): 1084–7. Бибкод : 2008Natur.454.1084D . дои : 10.1038/nature07268 . ПМИД 18756250 . S2CID 4331430 .
- ^ Андерсон Р.Э., Бразелтон В.Дж., Баросс Дж.А. (2011). «Затронут ли вирусы генетический ландшафт глубокой подповерхностной биосферы?» . Границы микробиологии . 2 : 219. дои : 10.3389/fmicb.2011.00219 . ISSN 1664-302X . ПМК 3211056 . ПМИД 22084639 .
- ^ Андерсон Р.Э., Согин М.Л., Баросс Дж.А. (3 октября 2014 г.). «Эволюционные стратегии вирусов, бактерий и архей в экосистемах гидротермальных источников, выявленные с помощью метагеномики» . ПЛОС ОДИН . 9 (10): e109696. Бибкод : 2014PLoSO...9j9696A . дои : 10.1371/journal.pone.0109696 . ISSN 1932-6203 . ПМЦ 4184897 . ПМИД 25279954 .
- ^ Ортманн AC, Саттл, Калифорния (август 2005 г.). «Высокое содержание вирусов в глубоководной гидротермальной системе указывает на вирусно-опосредованную смертность микробов». Глубоководные исследования. Часть I: Статьи океанографических исследований . 52 (8): 1515–1527. Бибкод : 2005DSRI...52.1515O . дои : 10.1016/j.dsr.2005.04.002 . ISSN 0967-0637 .
- ^ Брейтбарт М (15 января 2012 г.). «Морские вирусы: правда или действие». Ежегодный обзор морской науки . 4 (1): 425–448. Бибкод : 2012ARMS....4..425B . doi : 10.1146/annurev-marine-120709-142805 . ISSN 1941-1405 . ПМИД 22457982 .
- ^ Гольденфельд Н., Везе С. (январь 2007 г.). «Следующая революция биологии». Природа . 445 (7126): 369. arXiv : q-bio/0702015 . Бибкод : 2007Natur.445..369G . дои : 10.1038/445369а . ISSN 0028-0836 . ПМИД 17251963 . S2CID 10737747 .
- ^ Перейти обратно: а б Яу С., Сет-Пасрича М. (2019). «Вирусы полярных водных сред» . Вирусы . 11 (2): 189. дои : 10.3390/v11020189 . ПМК 6410135 . ПМИД 30813316 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 . - ^ Анесио AM, Беллас CM (2011). «Являются ли низкотемпературные места обитания горячими точками микробной эволюции, вызванными вирусами?». Тенденции в микробиологии . 19 (2): 52–57. дои : 10.1016/j.tim.2010.11.002 . ПМИД 21130655 .
- ^ Лейборн-Пэрри Дж. (2009). «Нет места, где слишком холодно». Наука . 324 (5934): 1521–1522. Бибкод : 2009Sci...324.1521L . дои : 10.1126/science.1173645 . ПМИД 19541982 . S2CID 33598792 .
- ^ Лопес-Буэно А., Тамамес Х., Веласкес Д., Моя А., Кесада А., Альками А. (2009). «Высокое разнообразие вирусного сообщества антарктического озера». Наука . 326 (5954): 858–861. Бибкод : 2009Sci...326..858L . дои : 10.1126/science.1179287 . ПМИД 19892985 . S2CID 32607904 .
- ^ Севстрем С., Лайл Дж., Анесио А.М., Приску Дж.К., Лэйборн-Пэрри Дж. (2008). «Бактериофаг в полярных внутренних водах» . Экстремофилы . 12 (2): 167–175. дои : 10.1007/s00792-007-0134-6 . ПМИД 18188502 . S2CID 2927907 .
- ^ Леггетт ХК, Баклинг А, Лонг GH, Бутс М (октябрь 2013 г.). «Генерализм и эволюция вирулентности паразитов». Тенденции в экологии и эволюции . 28 (10): 592–6. дои : 10.1016/j.tree.2013.07.002 . ПМИД 23968968 .
- ^ Флорес Ко, Вальверде С, Вайц Дж.С. (март 2013 г.). «Многомасштабная структура и географические факторы перекрестной инфекции среди морских бактерий и фагов» . Журнал ISME . 7 (3): 520–32. Бибкод : 2013ISMEJ...7..520F . дои : 10.1038/ismej.2012.135 . ПМЦ 3578562 . ПМИД 23178671 .
- ^ Крупович М., Бэмфорд Д.Х. (июль 2007 г.). «Предположительные профаги, родственные литическому бесхвостому морскому фагу дцДНК PM2, широко распространены в геномах водных бактерий» . БМК Геномика . 8 : 236. дои : 10.1186/1471-2164-8-236 . ЧВК 1950889 . ПМИД 17634101 .
- ^ Сюэ Х, Сюй Ю, Буше Ю, Полц МФ (январь 2012 г.). «Высокая частота появления нового нитчатого фага VCY φ в окружающей популяции холерного вибриона» . Прикладная и экологическая микробиология . 78 (1): 28–33. Бибкод : 2012ApEnM..78...28X . дои : 10.1128/АЕМ.06297-11 . ПМЦ 3255608 . ПМИД 22020507 .
- ^ Перейти обратно: а б Ру С., Крупович М., Пуле А., Деброа Д., Эно Ф. (2012). «Эволюция и разнообразие вирусного семейства Microviridae посредством коллекции из 81 нового полного генома, собранного из считываний вирома» . ПЛОС ОДИН . 7 (7): е40418. Бибкод : 2012PLoSO...740418R . дои : 10.1371/journal.pone.0040418 . ПМЦ 3394797 . ПМИД 22808158 .
- ^ Гурвиц Б.Л., Салливан М.Б. (2013). «Виром Тихого океана (POV): набор метагеномных данных морских вирусов и связанные с ним белковые кластеры для количественной вирусной экологии» . ПЛОС ОДИН . 8 (2): e57355. Бибкод : 2013PLoSO...857355H . дои : 10.1371/journal.pone.0057355 . ПМЦ 3585363 . ПМИД 23468974 .
- ^ Ру С., Эно Ф., Гурвиц Б.Л., Салливан М.Б. (28 мая 2015 г.). «VirSorter: извлечение вирусного сигнала из микробных геномных данных» . ПерДж . 3 : е985. дои : 10.7717/peerj.985 . ПМК 4451026 . ПМИД 26038737 .
- ^ Рен Дж., Альгрен Н.А., Лу Й.Ю., Фурман Дж.А., Сан Ф. (июль 2017 г.). «VirFinder: новый инструмент на основе k-меров для идентификации вирусных последовательностей на основе собранных метагеномных данных» . Микробиом . 5 (1): 69. дои : 10.1186/s40168-017-0283-5 . ПМК 5501583 . ПМИД 28683828 .
- ^ Паес-Эспино Д., Элое-Фадрош Е.А., Павлопулос Г.А., Томас А.Д., Хантеманн М., Михайлова Н., Рубин Е., Иванова Н.Н., Кирпидес Н.К. (август 2016 г.). «Открытие земного вирома » Природа 536 (7617): 425–30. Бибкод : 2016Nature.536..425P . дои : 10.1038/nature19094 . ПМИД 27533034 . S2CID 4466854 .
- ^ Коутиньо ФХ, Силвейра CB, Грегораччи ГБ, Томпсон СС, Эдвардс РА, Бруссаард КП, Дутил БЕ, Томпсон ФЛ (июль 2017 г.). «Морские вирусы, обнаруженные с помощью метагеномики, проливают свет на вирусные стратегии в океанах» . Природные коммуникации . 8 : 15955. Бибкод : 2017NatCo...815955C . дои : 10.1038/ncomms15955 . ПМЦ 5504273 . ПМИД 28677677 .

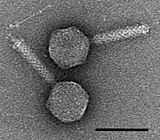
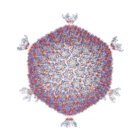

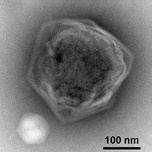
![Криоэлектронная микрофотография гигантского вируса CroV [71], шкала = 0,2 мкм.](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/CroV_TEM_%28cropped%29.jpg/270px-CroV_TEM_%28cropped%29.jpg)