Фторорганическая химия

Б: изофлюран
C: ХФУ
D: ГФУ
E: трифликовая кислота
Ф: Тефлон
Г: ПФОС
H: фторурацил
Я: флуоксетин
Фторорганическая химия описывает химию фторорганических соединений , органических соединений , содержащих связь углерод-фтор . Фторорганические соединения находят разнообразное применение: от нефте- и водоотталкивающих средств до фармацевтических препаратов , хладагентов и реагентов для катализа . Помимо этих применений, некоторые фторорганические соединения являются загрязнителями из-за их вклада в разрушение озонового слоя , глобальное потепление , биоаккумуляцию и токсичность . Область фторорганической химии часто требует специальных методов, связанных с обращением с фторирующими агентами.
Связь углерод-фтор
[ редактировать ]Фтор имеет ряд отличительных отличий от всех других заместителей, встречающихся в органических молекулах. В результате физические и химические свойства фторорганических соединений могут отличаться от других галогенорганических соединений .
- Связь углерод-фтор — одна из самых прочных в органической химии (средняя энергия связи около 480 кДж/моль). [ 1 ] ). Это значительно прочнее, чем связи углерода с другими галогенами (средняя энергия связи, например, связи C-Cl составляет около 320 кДж/моль). [ 1 ] ) и является одной из причин, почему фторорганические соединения обладают высокой термической и химической стабильностью.
- Связь углерод-фтор относительно короткая (около 1,4 Å). [ 1 ] ).
- Ван -дер-Ваальсовый радиус фтористого заместителя составляет всего 1,47 Å, [ 1 ] который короче, чем у любого другого заместителя, и близок к таковому у водорода (1,2 Å). Это, наряду с короткой длиной связи, является причиной отсутствия стерической деформации в полифторированных соединениях. Это еще одна причина их высокой термостабильности. Кроме того, фтористые заместители в полифторированных соединениях эффективно защищают углеродный скелет от возможных агрессивных реагентов. Это еще одна причина высокой химической стабильности полифторированных соединений.
- Фтор имеет самую высокую электроотрицательность из всех элементов: 3,98. [ 1 ] Это обуславливает высокий дипольный момент связи CF (1,41 Д [ 1 ] ).
- У фтора самая низкая поляризуемость из всех атомов: 0,56. 10 −24 см 3 . [ 1 ] Это вызывает очень слабые дисперсионные силы между полифторированными молекулами и является причиной часто наблюдаемого снижения температуры кипения при фторировании, а также одновременной гидрофобности и липофобности полифторированных соединений, тогда как другие пергалогенированные соединения более липофильны .
По сравнению с арилхлоридами и бромидами арилфториды лишь неохотно образуют реактивы Гриньяра . [ нужна ссылка ] С другой стороны, арилфториды, например фторанилины и фторфенолы , часто эффективно подвергаются нуклеофильному замещению. [ 2 ]
Виды фторорганических соединений
[ редактировать ]Фторуглероды
[ редактировать ]Формально фторуглероды содержат только углерод и фтор. Иногда их называют перфторуглеродами. Это могут быть газы, жидкости, воски или твердые вещества, в зависимости от их молекулярной массы. Простейшим фторуглеродом является газ тетрафторметан (CF 4 ). Жидкости включают перфтороктан и перфтордекалин. Хотя фторуглероды с одинарными связями стабильны, ненасыщенные фторуглероды более реакционноспособны, особенно с тройными связями. Фторуглероды более химически и термически стабильны, чем углеводороды, что отражает относительную инертность связи CF. Они также относительно липофобны . Из-за уменьшения межмолекулярных ван-дер-ваальсовых взаимодействий соединения на основе фторуглеродов иногда используются в качестве смазок или обладают высокой летучестью. Фторуглеродные жидкости находят медицинское применение в качестве переносчиков кислорода. [ нужна ссылка ]
Строение фторорганических соединений может быть различным. Как показано ниже, перфторированные алифатические соединения имеют тенденцию к сегрегации от углеводородов. Этот эффект «подобное растворяется подобное» связан с полезностью фторсодержащих фаз и использованием ПФОК при переработке фторполимеров. В отличие от алифатических производных, перфторароматические производные имеют тенденцию образовывать смешанные фазы с нефторированными ароматическими соединениями в результате донорно-акцепторных взаимодействий между пи-системами.

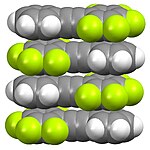
Фторполимеры
[ редактировать ]Полимерные фторорганические соединения многочисленны и имеют коммерческое значение. Они варьируются от полностью фторированных, например, ПТФЭ, до частично фторированных, например, поливинилиденфторида ([CH 2 CF 2 ] n ) и полихлортрифторэтилена ([CFClCF 2 ] n ). Фторполимер политетрафторэтилен (ПТФЭ/тефлон) представляет собой твердое вещество. [ нужна ссылка ]
Гидрофторуглероды
[ редактировать ]Гидрофторуглероды (ГФУ), органические соединения, содержащие атомы фтора и водорода, являются наиболее распространенным типом фторорганических соединений. Они обычно используются в системах кондиционирования воздуха и в качестве хладагентов. [ 5 ] вместо более старых хлорфторуглеродов, таких как R-12 , и гидрохлорфторуглеродов, таких как R-21 . Они не наносят такого вреда озоновому слою, как соединения, которые они заменяют; однако они действительно способствуют глобальному потеплению . Их концентрация в атмосфере и вклад в антропогенные выбросы парниковых газов быстро растут, вызывая обеспокоенность международного сообщества по поводу их радиационного воздействия .
Фторуглероды с небольшим количеством связей CF ведут себя аналогично исходным углеводородам, но их реакционная способность может быть значительно изменена. Например, и урацил , и 5-фторурацил представляют собой бесцветные, тугоплавкие кристаллические вещества, но последний является мощным противораковым препаратом. Использование связи CF в фармацевтических препаратах основано на этой измененной реакционной способности. [ 6 ] Некоторые лекарственные препараты и агрохимикаты содержат только один фтористый центр или одну трифторметильную группу.
В отличие от других парниковых газов, включенных в Парижское соглашение , по гидрофторуглеродам ведутся другие международные переговоры. [ 7 ]
В сентябре 2016 года так называемая Нью-Йоркская декларация призвала к глобальному сокращению использования ГФУ. [ 8 ] 15 октября 2016 года из-за вклада этих химических веществ в изменение климата переговорщики из 197 стран встретились на саммите Программы Организации Объединенных Наций по окружающей среде в Кигали, Руанда, достигли юридически обязывающего соглашения о поэтапном отказе от гидрофторуглеродов (ГФУ) в поправке к Монреальский протокол . [ 9 ] [ 10 ] [ 11 ]
Фторкарбены
[ редактировать ]Как указано в этой статье, фторзаместители приводят к реакционной способности, которая сильно отличается от классической органической химии. Ярким примером является дифторкарбен CF 2 , который является синглетным , тогда как карбен (CH 2 ) имеет триплетное основное состояние. [ 12 ] Эта разница существенна, поскольку дифторкарбен является предшественником тетрафторэтилена .
Перфторированные соединения
[ редактировать ]Перфторированные соединения являются производными фторуглеродов, поскольку по своей структуре они тесно связаны с фторуглеродами. Однако они также обладают новыми атомами, такими как азот , йод или ионные группы, такие как перфторированные карбоновые кислоты .
Методы получения связей C–F
[ редактировать ]Фторорганические соединения получают различными способами в зависимости от степени и региохимии искомого фторирования и природы предшественников. Прямое фторирование углеводородов F 2 , часто разбавленным N 2 , полезно для получения сильнофторированных соединений:
- Р
3 СН + Ф
2 → Р
3 ЦФ + ВЧ
Однако такие реакции часто неселективны и требуют осторожности, поскольку углеводороды могут бесконтрольно «гореть» в F.
2 , аналогично горению углеводорода в O
2 . По этой причине были разработаны альтернативные методики фторирования. Обычно такие методы делятся на два класса.
Электрофильное фторирование
[ редактировать ]Электрофильное фторирование основано на источниках «F». + «. Часто такие реагенты содержат связи NF, например F-TEDA-BF 4 . Асимметричное фторирование, при котором только один из двух возможных энантиомерных продуктов образуется из прохирального субстрата, основано на электрофильных реагентах фторирования. [ 13 ] Иллюстрацией этого подхода является получение предшественника противовоспалительных средств: [ 14 ]
Электросинтетические методы
[ редактировать ]Специализированный, но важный метод электрофильного фторирования включает электросинтез . Этот метод в основном используется для перфторирования, т.е. замены всех связей C–H на связи C–F. Углеводород растворяют или суспендируют в жидком HF и смесь подвергают электролизу при напряжении 5–6 В с использованием никелевых анодов . [ 15 ] Впервые метод был продемонстрирован на препарате перфторпиридина ( C
5 Ф
5 N ) из пиридина ( C
55Ч
5 Н ). Описано несколько вариантов этого метода, включая использование расплавленного бифторида калия или органических растворителей .
Нуклеофильное фторирование
[ редактировать ]Основной альтернативой электрофильному фторированию является нуклеофильное фторирование с использованием реагентов, являющихся источниками «F». − «Для нуклеофильного замещения, как правило, хлорида и бромида. метатезиса Реакции с использованием фторидов щелочных металлов являются самыми простыми. [ 16 ] Для алифатических соединений это иногда называют реакцией Финкельштейна , а для ароматических соединений — процессом Халекса .
- Р
3 CCl + МФ → Р
3 CF + MCl (M = Na, K, Cs)
Алкилмонофториды можно получить из спиртов и реагента Олаха (фторида пиридиния) или других фторирующих агентов.
Разложение тетрафторборатов арилдиазония в реакции Зандмейера. [ 17 ] или реакции Шимана используют фторбораты как F − источники.
- АрН
22БФ
4 → АрФ + Н
2 + лучший друг
3
Хотя фторид водорода может показаться маловероятным нуклеофилом, он является наиболее распространенным источником фторида при синтезе фторорганических соединений. Такие реакции часто катализируются фторидами металлов, такими как трифторид хрома. 1,1,1,2-Тетрафторэтан , заменитель ХФУ, получают в промышленности с использованием следующего подхода: [ 18 ]
- Cl 2 C=CClH + 4 HF → F 3 CCFH 2 + 3 HCl
Обратите внимание, что это превращение влечет за собой два типа реакции: метатезис (замена Cl − от Ф − ) и гидрофторирование алкена .
Деоксофторирование
[ редактировать ]Деоксофторирование превращает различные кислородсодержащие группы во фториды. Обычный реактив — тетрафторид серы :
- РКО 2 Н + СФ 4 → РЦФ 3 + ТАК 2 + ВЧ
Более удобной альтернативой SF 4 является трифторид диэтиламиносеры , который представляет собой жидкость, тогда как SF 4 является коррозионным газом: [ 19 ] [ 20 ]
- C 6 H 5 CHO + R 2 NSF 3 → C 6 H 5 CHF 2 + «R 2 NSOF»
Помимо DAST, существует широкий спектр подобных реагентов, включая, помимо прочего, 2-пиридинсульфонилфторид (PyFluor) и N -тозил-4-хлорбензолсульфонимидоилфторид (SulfoxFluor). [ 21 ] Многие из них демонстрируют улучшенные свойства, такие как лучший профиль безопасности, более высокая термодинамическая стабильность, простота обращения, высокая энантиоселективность и селективность в отношении устранения побочных реакций. [ 22 ] [ 23 ]
Из фторированных строительных блоков
[ редактировать ]Многие фторорганические соединения образуются из реагентов, доставляющих перфторалкильные и перфторарильные группы. (Трифторметил)триметилсилан, CF 3 Si(CH 3 ) 3 в качестве источника трифторметильной группы. , используется , например, [ 24 ] Среди доступных фторированных строительных блоков можно назвать CF 3 X (X = Br, I), C 6 F 5 Br и C 3 F 7 I. Эти соединения образуют реактивы Гриньяра , которые затем можно обрабатывать различными электрофилами . Развитие фтористых технологий (см. ниже, раздел «Растворители») приводит к разработке реагентов для введения «фтористых хвостов».
Особым, но важным применением подхода, основанного на использовании фторированных строительных блоков, является синтез тетрафторэтилена , который производится в промышленных масштабах с использованием дифторкарбена. Процесс начинается с термического (600-800°С) дегидрохлорирования хлордифторметана : [ 6 ]
- CHClF 2 → CF 2 + HCl
- 2 КФ 2 → С 2 Ж 4
Фтордихлорацетат натрия (CAS# 2837-90-3) используется для получения хлорфторкарбена для циклопропанирования.
18 F-методы доставки
[ редактировать ]Полезность фторсодержащих радиофармпрепаратов в 18 F- позитронно-эмиссионная томография стимулировала разработку новых методов образования связей C–F. Из-за короткого периода полураспада 18 F, эти синтезы должны быть высокоэффективными, быстрыми и простыми. [ 25 ] Показательным методом является получение фторид-модифицированной глюкозы путем замещения трифлата меченым фторидным нуклеофилом:
Биологическая роль
[ редактировать ]Биологически синтезированные фторорганические соединения были обнаружены у микроорганизмов и растений, но не у животных. [ 26 ] Наиболее распространенным примером является фторацетат , который используется как защита растений от травоядных животных как минимум на 40 растениях в Австралии, Бразилии и Африке. [ 27 ] Другие биологически синтезируемые фторорганические соединения включают ω-фтор жирные кислоты , фторацетон и 2-фторцитрат , которые, как полагают, биосинтезируются биохимическими путями из промежуточного фторацетальдегида. [ 26 ] Аденозилфторидсинтаза — фермент, способный биологически синтезировать связь углерод-фтор. [ 28 ]
Приложения
[ редактировать ]Фторорганическая химия влияет на многие области повседневной жизни и технологий. Связь CF встречается, в фармацевтических препаратах , агрохимикатах , фторполимерах , хладагентах , поверхностно-активных веществах , анестетиках , маслоотталкивающих средствах , катализе и водоотталкивающих средствах среди прочего, .
Фармацевтика и агрохимия
[ редактировать ]Связь углерод-фтор обычно встречается в фармацевтических и агрохимических препаратах, поскольку она обычно метаболически стабильна, а фтор действует как биоизостер атома водорода . По оценкам, 1/5 фармацевтических препаратов содержат фтор, в том числе некоторые из лучших лекарств. [ 29 ] [ 30 ] Примеры включают 5-фторурацил , флунитразепам (рогипнол), флуоксетин (прозак), пароксетин (паксил), ципрофлоксацин (ципро), мефлохин и флуконазол . Введение связи углерод-фтор в органические соединения является основной задачей для химиков-медиков, использующих фторорганическую химию, поскольку связь углерод-фтор увеличивает вероятность создания успешного лекарства примерно в десять раз. [ 30 ]
Пропеллент для ингаляторов
[ редактировать ]Фторуглероды также используются в качестве пропеллента в дозированных ингаляторах, используемых для введения некоторых лекарств от астмы. Текущее поколение пропеллентов состоит из гидрофторалканов (HFA), которые заменили CFC ингаляторы на основе . Ингаляторы CFC были запрещены с 2008 года. [update] в рамках Монреальского протокола [ 31 ] из-за экологических проблем с озоновым слоем. По состоянию на октябрь 2014 года генерические версии ингаляторов-пропеллентов с HFA, таких как FloVent и ProAir ( Сальбутамол ), отсутствуют.
Фторповерхностно-активные вещества
[ редактировать ]Фторповерхностно-активные вещества, имеющие полифторированный «хвост» и гидрофильную «головку», служат поверхностно-активными веществами концентрируются на границе раздела жидкость-воздух , поскольку из-за своей липофобности . Фторповерхностно-активные вещества имеют низкую поверхностную энергию и значительно более низкое поверхностное натяжение. Фторсодержащие поверхностно-активные вещества перфтороктансульфоновая кислота (ПФОС) и перфтороктановая кислота (ПФОК) являются двумя наиболее изученными из-за их повсеместного распространения, токсичности и длительного времени пребывания в организме человека и дикой природы.
Растворители
[ редактировать ]Фторированные соединения часто проявляют различные свойства растворимости. Дихлордифторметан и хлордифторметан когда-то были широко используемыми хладагентами. ХФУ обладают мощным потенциалом разрушения озона из-за гомолитического разрыва связей углерод-хлор; их использование в значительной степени запрещено Монреальским протоколом . Гидрофторуглероды (ГФУ), такие как тетрафторэтан , служат заменой ХФУ, поскольку они не катализируют разрушение озона.
Кислород проявляет высокую растворимость в перфторуглеродных соединениях, что отражается на их липофильности. Перфтордекалин был продемонстрирован как кровезаменитель, транспортирующий кислород в легкие. Фторзамещенные эфиры являются летучими анестетиками , включая коммерческие продукты метоксифлуран , энфлюран , изофлюран , севофлуран и десфлюран . Фторуглеродные анестетики снижают опасность воспламенения диэтилового эфира и циклопропана . Перфторированные алканы используются в качестве кровезаменителей .
Растворитель 1,1,1,2-тетрафторэтан использовался для экстракции натуральных продуктов, таких как таксол , масло вечерней примулы и ванилин . 2,2,2-трифторэтанол — устойчивый к окислению полярный растворитель. [ 32 ]
Фторорганические реагенты
[ редактировать ]Развитие фторорганической химии дало возможность создать множество ценных реагентов, выходящих за рамки фторорганической химии. Трифликовая кислота (CF 3 SO 3 H) и трифторуксусная кислота (CF 3 CO 2 H) используются в органическом синтезе . Их сильная кислотность объясняется электроотрицательностью трифторметильной группы , которая стабилизирует отрицательный заряд. Трифлатная группа (сопряженное основание трифликовой кислоты) является хорошей уходящей группой в реакциях замещения.
Фтористые фазы
[ редактировать ]Высокофторированные заместители, например перфторгексил (C 6 F 13 ), придают молекулам особые свойства растворимости, что облегчает очистку продуктов органического синтеза . [ 33 ] [ 34 ] В этой области, называемой « химией фтора », используется концепция подобного-растворяется-подобного в том смысле, что богатые фтором соединения растворяются преимущественно в растворителях, богатых фтором. Из-за относительной инертности связи CF такие фтористые фазы совместимы с агрессивными реагентами. Эта тема породила методы «маркировки фтором и защиты фтором ». Показательным примером фторсодержащей технологии является использование фторалкилзамещенных гидридов олова для восстановления, при этом продукты легко отделяются от отработанного оловянного реагента путем экстракции с использованием фторированных растворителей. [ 35 ]
Гидрофобные фторированные ионные жидкости , такие как органические соли бистрифлимида или гексафторфосфата , могут образовывать фазы, нерастворимые как в воде, так и в органических растворителях, образуя многофазные жидкости .
Фторорганические лиганды в координационной химии
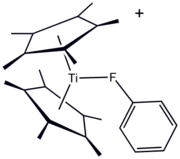
[ редактировать ]Фторорганические лиганды уже давно используются в металлоорганической и координационной химии . Одним из преимуществ F-содержащих лигандов является удобство 19 F ЯМР-спектроскопия для мониторинга реакций. Фторорганические соединения могут служить «сигма-донорным лигандом», примером чего является производное титана(III) [(C 5 Me 5 ) 2 Ti(FC 6 H 5 )]BPh 4 . используют фторуглеродные заместители Однако чаще всего для повышения льюисовской кислотности металлоцентров . Ярким примером является « Юфод », координационный комплекс европия(III), который содержит модифицированный перфторгептил ацетилацетонатный лиганд . Этот и родственные виды полезны в органическом синтезе и в качестве «реагентов сдвига» в ЯМР-спектроскопии .
В области, где координационная химия и материаловедение пересекаются, фторирование органических лигандов используется для настройки свойств составляющих молекул. Например, степень и региохимия фторирования металлированных 2-фенилпиридиновых лигандов в комплексах платины(II) существенно изменяют эмиссионные свойства комплексов. [ 36 ]
В координационной химии фторорганических лигандов также используются фтористые технологии. Например, трифенилфосфин был модифицирован путем присоединения перфторалкильных заместителей, которые придают ему растворимость в перфторгексане, а также в сверхкритическом диоксиде углерода . В качестве конкретного примера, [(C 8 F 17 C 3 H 6 -4-C 6 H 4 ) 3 P. [ 37 ]
Некоторые металлокомплексы расщепляют связи CF. Эти реакции представляют интерес с точки зрения органического синтеза и восстановления ксенохимикатов. [ 38 ] Активация связи CF классифицируется следующим образом: «(i) окислительное присоединение фторуглерода, (ii) образование связи M–C с отщеплением HF, (iii) образование связи M–C с отщеплением фторсилана, (iv) гидродефторирование фторуглерода с помощью M– Образование F-связи, (v) нуклеофильная атака фторуглерода и (vi) дефторирование фторуглерода». Показательной реакцией активации CF, опосредованной металлами, является дефторирование фторгексана дигидридом цирконоцена :
- (C 5 (CH 3 ) 5 ) 2 ZrH 2 + FC 6 H 13 → (C 5 (CH 3 ) 5 ) 2 ZrH(F) + C 6 H 14
Фторсодержащие соединения часто относятся к некоординирующим или слабокоординационным анионам. Оба тетракис(пентафторфенил)бората, B(C 6 F 5 ) 4 − и родственный тетракис[3,5-бис(трифторметил)фенил]борат полезны в катализе Циглера-Натта и связанных с ним методологиях полимеризации алкенов. Фторированные заместители делают анионы слабоосновными и повышают растворимость в слабоосновных растворителях, совместимых с сильными кислотами Льюиса.
Материаловедение
[ редактировать ]Фторорганические соединения находят множество нишевых применений в материаловедении . Обладая низким коэффициентом трения , жидкие фторполимеры используются в качестве специальных смазок. Смазки на основе фторуглеродов используются в сложных условиях. Типичные продукты включают Fomblin и Krytox , произведенные Solvay Solexis и DuPont соответственно. Некоторые смазочные материалы для огнестрельного оружия, такие как «Tetra Gun», содержат фторуглероды. Благодаря своей негорючести фторуглероды используются в пенах для пожаротушения. Фторорганические соединения входят в состав жидкокристаллических дисплеев . Полимерный аналог трифликовой кислоты, нафион, представляет собой твердую кислоту, которая используется в качестве мембраны в большинстве низкотемпературных топливных элементов . Бифункциональный мономер 4,4'-дифторбензофенон является предшественником полимеров класса PEEK .
Биосинтез фторорганических соединений
[ редактировать ]В отличие от многих встречающихся в природе органических соединений, содержащих более тяжелые галогениды , хлорид, бромид и йодид, известно лишь несколько биологически синтезированных связей углерод-фтор. [ 39 ] Наиболее распространенной природной разновидностью фторорганических соединений является фторацетат , токсин, обнаруженный в нескольких видах растений. Другие включают фторолеиновую кислоту, фторацетон , нуклеоцидин (4'-фтор-5'-O-сульфамоиладенозин), фтортреонин и 2-фторцитрат . Некоторые из этих видов, вероятно, биосинтезируются из фторацетальдегида . Фермент фториназа (см . катализирует синтез 5'-дезокси-5'-фтораденозина схему справа).
История
[ редактировать ]Фторорганическая химия началась в 1800-х годах с развитием органической химии. [ 18 ] [ 40 ] Первые фторорганические соединения были получены с использованием трифторида сурьмы в качестве F. − источник. Негорючесть и нетоксичность хлорфторуглеродов CCl 3 F и CCl 2 F 2 привлекли внимание промышленности в 1920-х годах. 6 апреля 1938 года Рой Дж. Планкетт, молодой химик-исследователь, работавший в DuPont лаборатории Джексона компании в Дипуотере, штат Нью-Джерси , случайно обнаружил политетрафторэтилен (ПТФЭ). [ 41 ] [ 42 ] [ 43 ] Последующие крупные разработки, особенно в США, опирались на опыт, накопленный в производстве гексафторида урана. [ 6 ] Начиная с конца 1940-х годов, был представлен ряд методик электрофильного фторирования, начиная с CoF 3 . об электрохимическом фторировании (« электрофторирование Было объявлено »), которое Джозеф Х. Саймонс разработал в 1930-х годах для получения высокостабильных перфторированных материалов, совместимых с гексафторидом урана . [ 15 ] Эти новые методологии позволили синтезировать связи CF без использования элементарного фтора и без использования метатетических методов. [ нужна ссылка ]
В 1957 г. была описана противораковая активность 5-фторурацила. В этом отчете представлен один из первых примеров рационального проектирования лекарств. [ 44 ] Это открытие вызвало всплеск интереса к фторированным фармацевтическим препаратам и агрохимикатам. Открытие соединений благородных газов , например, XeF 4 , с начала 1960-х годов привело к появлению множества новых реагентов. В 1970-х годах фтордезоксиглюкоза была признана полезным реагентом в 18 F- позитронно-эмиссионная томография . В работе, получившей Нобелевскую премию, было показано, что ХФУ способствуют истощению атмосферного озона. Это открытие предупредило мир о негативных последствиях фторорганических соединений и послужило стимулом для разработки новых путей получения фторорганических соединений. В 2002 году было сообщено о первом ферменте, образующем связи CF, фториназе . [ 45 ]
Проблемы окружающей среды и здоровья
[ редактировать ]Лишь немногие фторорганические соединения обладают высокой биоактивностью и высокой токсичностью, например фторацетат и перфторизобутен . [ нужна ссылка ]
Некоторые фторорганические соединения представляют значительный риск и опасность для здоровья и окружающей среды. ХФУ и ГХФУ ( гидрохлорфторуглероды ) разрушают озоновый слой и являются мощными парниковыми газами . ГФУ являются мощными парниковыми газами и сталкиваются с призывами к более строгому международному регулированию и графикам поэтапного отказа в качестве быстродействующей меры по сокращению выбросов парниковых газов, как и перфторуглероды (ПФУ) и гексафторид серы (SF 6 ). [ нужна ссылка ]
Из-за воздействия этого соединения на климат крупнейшие экономики «Большой двадцатки» договорились в 2013 году поддержать инициативы по поэтапному отказу от использования ГХФУ. Они подтвердили роль Монреальского протокола и Рамочной конвенции Организации Объединенных Наций об изменении климата в глобальном учете и сокращении ГХФУ. США и Китай одновременно объявили о двустороннем соглашении аналогичного эффекта. [ 46 ]
Стойкость и биоаккумуляция
[ редактировать ]Из-за прочности связи углерод-фтор многие синтетические фторуглероды и соединения на их основе устойчивы в окружающей среде. Фторсодержащие поверхностно-активные вещества, такие как ПФОС и ПФОК , являются стойкими глобальными загрязнителями. ХФУ на основе фторуглеродов и тетрафторметан были обнаружены в магматических и метаморфических породах . [ 26 ] ПФОС является стойким органическим загрязнителем и может нанести вред здоровью дикой природы; потенциальное воздействие ПФОК на здоровье человека исследуется научной группой C8.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Кирш П. (2004). Современная фторорганическая химия: синтез, реакционная способность, применение . Вайли-ВЧ.
- ^ Уоррен С., Вятт П. (2008). Органический синтез: подход к отключению (2-е изд.). Уайли. стр. 12–13.
- ^ Лапассе Дж., Море Дж., Мелас М., Колле А., Вигье М., Бланку Х. (1996). «Кристаллическая структура 12,12,13,13,14,14,15,15,16,16,17,17,17-тридекафторгептадекан-1-ола, C 17 H 23 F 13 O». З. Кристаллогр. 211 (12): 945–946. Бибкод : 1996ЗК....211..945Л . дои : 10.1524/zkri.1996.211.12.945 . Запись в ЦД TULQOG.
- ^ Смит С.Э., Смит П.С., Томас Р.Л., Робинс Э.Г., Коллингс Дж.К., Дай С. и др. (2004). «Взаимодействия арен-перфтораренов в кристаллотехнике: структурные предпочтения в полифторированных толанах». Дж. Матер. хим. 14 (3): 413–420. дои : 10.1039/b314094f . Запись в ЦД ASIJIV.
- ^ Мильман О. (22 сентября 2016 г.). «100 стран настаивают на поэтапном отказе от потенциально катастрофических парниковых газов» . Хранитель . Лондон, Великобритания . Проверено 22 сентября 2016 г.
- ^ Jump up to: а б с Зигемунд Г., Швертфегер В., Фейринг А., Смарт Б., Бер Ф., Фогель Х. и др. (2005). «Соединения фтора органические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a11_349 . ISBN 978-3-527-30385-4 .
- ^ Давенпорт С (23 июля 2016 г.). «Продолжение Парижского соглашения по климату обретает форму в Вене» . Нью-Йорк Таймс . Проверено 17 августа 2016 г.
- ^ «Нью-Йоркская декларация коалиции по обеспечению амбициозной поправки к HFC» . Вашингтон, округ Колумбия: Государственный департамент США. 22 сентября 2016 г. Проверено 22 сентября 2016 г.
- ^ Джонстон С., Милман О., Видал Дж. (15 октября 2016 г.). «Изменение климата: достигнуто глобальное соглашение по ограничению использования гидрофторуглеродов» . Хранитель .
- ^ МакГрат М. (15 октября 2016 г.). «Изменение климата: «монументальное» соглашение по сокращению выбросов ГФУ, наиболее быстро растущих парниковых газов» . Новости Би-би-си . Проверено 15 октября 2016 г.
- ^ «Народы, борющиеся с мощным хладагентом, согревающим планету, достигают знаковой сделки» . Нью-Йорк Таймс . 15 октября 2016 года . Проверено 15 октября 2016 г.
- ^ Брамс Д.Л., Дейли В.П. (август 1996 г.). «Фторированные карбены». Химические обзоры . 96 (5): 1585–1632. дои : 10.1021/cr941141k . ПМИД 11848805 .
- ^ Брюне В.А., О'Хаган Д. (2008). «Каталитическое асимметричное фторирование достигает совершеннолетия». Ангеванде Хеми . 47 (7): 1179–1182. дои : 10.1002/anie.200704700 . ПМИД 18161722 .
- ^ Кэрон С., Даггер Р.В., Руджери С.Г., Рэган Дж.А., Рипин Д.Х. (июль 2006 г.). «Крупномасштабное окисление в фармацевтической промышленности». Химические обзоры . 106 (7): 2943–2989. дои : 10.1021/cr040679f . ПМИД 16836305 .
- ^ Jump up to: а б Саймонс Дж. Х. (1949). «Электрохимический процесс производства фторуглеродов». Журнал Электрохимического общества . 95 (2): 47–66. дои : 10.1149/1.2776733 .
- ^ Фогель А.И., Лестер Дж., Мейси В.А. «Н-гексилфторид» . Органические синтезы ; Сборник томов , т. 4, с. 525 .
- ^ Наводнение ДТ. «Фторбензол» . Органические синтезы ; Сборник томов , т. 2, с. 295 .
- ^ Jump up to: а б Долбье-младший WR (2005). «Химия фтора в тысячелетии». Журнал химии фтора . 126 (2): 157–163. Бибкод : 2005JFluC.126..157D . дои : 10.1016/j.jfluchem.2004.09.033 .
- ^ Смит, Майкл Б., Марч, Джерри (2007), Передовая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 1299, ISBN 978-0-471-72091-1
- ^ Ван CJ (1985). «Фторирование тетрафторидом серы». Органические реакции . стр. 319–400. дои : 10.1002/0471264180.или034.02 . ISBN 978-0-471-26418-7 .
- ^ Аггарвал Т., Верма АК (2021). «Достижения в области фторирования с использованием различных реагентов посредством реакции дезоксифторирования». Границы органической химии . 8 (22): 6452–6468. дои : 10.1039/D1QO00952D .
- ^ Нильсен М.К., Угаз Ч.Р., Ли В., Дойл А.Г. (август 2015 г.). «PyFluor: недорогой, стабильный и селективный реагент для дезоксифторирования» . Журнал Американского химического общества . 137 (30): 9571–9574. дои : 10.1021/jacs.5b06307 . ПМИД 26177230 .
- ^ Го Дж, Куанг С, Ронг Дж, Ли Л, Ни С, Ху Дж (май 2019 г.). «Быстрое дезоксифторирование спиртов N-тозил-4-хлорбензолсульфонимидоилфторидом (SulfoxFluor) при комнатной температуре». Химия . 25 (30): 7259–7264. дои : 10.1002/chem.201901176 . ПМИД 30869818 .
- ^ Рамайя П., Кришнамурти Р., Сурья Пракаш Г.К. (1998). «1-трифторметил)-1-циклогексанол» . Органические синтезы : 232 .
- ^ Ле Барс Д (2006). «Фтор-18 и медицинская визуализация: радиофармацевтические препараты для позитронно-эмиссионной томографии». Журнал химии фтора . 127 (11): 1488–1493. Бибкод : 2006JFluC.127.1488L . дои : 10.1016/j.jfluchem.2006.09.015 .
- ^ Jump up to: а б с Мерфи С.Д., Шаффрат С., О'Хаган Д.: «Фторированные натуральные продукты: биосинтез фторацетата и 4-фтортреонина в Streptomyces Cattleya » Хемосфера. Июль 2003 г.;52(2):455-61.
- ^ Праудфут А.Т., Брэдберри С.М., Вейл Дж.А. (2006). «Отравление фторацетатом натрия». Токсикологические обзоры . 25 (4): 213–219. дои : 10.2165/00139709-200625040-00002 . ПМИД 17288493 . S2CID 29189551 .
- ^ О'Хаган Д., Шаффрат С., Кобб С.Л., Гамильтон Дж.Т., Мерфи CD (март 2002 г.). «Биохимия: биосинтез фторорганической молекулы» . Природа . 416 (6878): 279. Бибкод : 2002Natur.416..279O . дои : 10.1038/416279а . ПМИД 11907567 . S2CID 4415511 .
- ^ Иноуэ М., Сумии Ю., Сибата Н. (май 2020 г.). «Вклад фторорганических соединений в фармацевтику» . АСУ Омега . 5 (19): 10633–10640. дои : 10.1021/acsomega.0c00830 . ПМК 7240833 . ПМИД 32455181 .
- ^ Jump up to: а б Тайер А.М. (5 июня 2006 г.). «Сказочный фтор» . Новости химии и техники . 84 (23): 15–24. doi : 10.1021/cen-v084n023.p015 .
- ^ «Поэтапный отказ от дозированных ингаляторов с ХФУ» . Управление по контролю за продуктами и лекарствами США . Проверено 10 сентября 2017 г.
- ^ Равикумар К.С., Кесаван В., Крусс Б., Бонне-Дельпон Д., Беге Ж.П. (2003). «Мягкое и селективное окисление соединений серы в трифторэтаноле: дифенилдисульфид и метилфенилсульфоксид» . Органические синтезы . 80 :184 .
- ^ Гладыш Я.А., Курран Д.П. , Хорват И.Т., ред. (2004). Справочник по фтористой химии . Вайнхайм: Wiley-VCH. ISBN 978-3-527-30617-6 .
- ^ Хоуп Э.Г., Эбботт А.П., Дэвис Д.Л., Солан Г.А., Стюарт А.М. (2007). «Зеленая металлоорганическая химия». Комплексная металлоорганическая химия III . Том. 12. С. 837–864. дои : 10.1016/B0-08-045047-4/00182-5 . ISBN 978-0-08-045047-6 .
- ^ Кромби А., Ким С.Ю., Хадида С., Карран Д.П. «Синтез гидрида трис (2-перфторгексилэтил) олова: высокофторированного гидрида олова с преимуществами легкой очистки» . Органические синтезы ; Сборник томов , т. 10, с. 712 .
- ^ Томпсон М.Е., Джурович П.Е., Барлоу С., Мардер С. (2007). «Металлоорганические комплексы для оптоэлектроники». Комплексная металлоорганическая химия III . Том. 12. С. 101–194. дои : 10.1016/B0-08-045047-4/00169-2 . ISBN 978-0-08-045047-6 .
- ^ Питерс Дж.С., Томас Дж.К. (2007). «Лиганды, реагенты и методы металлоорганического синтеза». Комплексная металлоорганическая химия III . Том. 1. С. 59–92. дои : 10.1016/B0-08-045047-4/00002-9 . ISBN 978-0-08-045047-6 .
- ^ Перуц Р.Н., Браун Т. (2007). «Активация связи C – F, опосредованная переходными металлами». Комплексная металлоорганическая химия III . Том. 1. С. 725–758. дои : 10.1016/B0-08-045047-4/00028-5 . ISBN 978-0-08-045047-6 .
- ^ О'Хаган Д., Харпер Б. (1999). «Фторсодержащие натуральные продукты». Журнал химии фтора . 100 (1–2): 127–133. Бибкод : 1999JFluC.100..127O . дои : 10.1016/S0022-1139(99)00201-8 .
- ^ Оказо Т. (2009). «Обзор истории фторорганической химии с точки зрения материальной промышленности» . Труды Японской академии. Серия Б, Физические и биологические науки . 85 (8): 276–289. Бибкод : 2009PJAB...85..276O . дои : 10.2183/pjab.85.276 . ПМЦ 3621566 . ПМИД 19838009 .
- ^ «Доктор Рой Дж. Планкетт: первооткрыватель фторполимеров» (PDF) . Информационный бюллетень Отдела фторполимеров (лето): 1–2. 1994. Архивировано из оригинала (PDF) 9 июля 2003 г.
- ^ «Рой Дж. Планкетт» . Институт истории науки . Июнь 2016 года . Проверено 21 февраля 2018 г.
- ^ Центр устной истории. «Рой Дж. Планкетт» . Институт истории науки . Проверено 21 февраля 2018 г.
- ^ Гейдельбергер С., Чаудхури Н.К., Даннеберг П., Мурен Д., Грисбах Л., Душинский Р. и др. (март 1957 г.). «Фторированные пиримидины, новый класс соединений, ингибирующих опухоли». Природа . 179 (4561): 663–666. Бибкод : 1957Natur.179..663H . дои : 10.1038/179663a0 . ПМИД 13418758 . S2CID 4296069 .
- ^ О'Хаган Д., Шаффрат С., Кобб С.Л., Гамильтон Дж.Т., Мерфи CD (март 2002 г.). «Биохимия: биосинтез фторорганической молекулы» . Природа . 416 (6878): 279. Бибкод : 2002Natur.416..279O . дои : 10.1038/416279а . ПМИД 11907567 . S2CID 4415511 .
- ^ Пресс-секретарь Белого дома США (6 сентября 2013 г.). «Соединенные Штаты, Китай и лидеры стран «Большой двадцатки» объявляют об историческом прогрессе на пути к глобальному отказу от ГФУ» . whitehouse.gov (пресс-релиз) . Проверено 16 сентября 2013 г. - из Национального архива .



