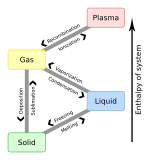
Энтальпия испарения
Эта статья включает список общих ссылок , но в ней отсутствуют достаточные соответствующие встроенные цитаты . ( Март 2016 г. ) |

В термодинамике энтальпия парообразования (обозначение ∆ H vap ), также известная как ( скрытая ) теплота парообразования или теплота испарения , представляет собой количество энергии ( энтальпии ), которую необходимо присоединить к жидкому веществу, чтобы превратить некоторое количество это вещество в газ . Энтальпия парообразования является функцией давления превращение ( испарение или испарение и температуры, при которых происходит ).
Энтальпию испарения часто называют нормальной температурой кипения вещества. Хотя табличные значения обычно корректируются до 298 К , эта поправка часто меньше, чем неопределенность измеренного значения.
Теплота парообразования зависит от температуры, хотя можно предположить постоянную теплоту парообразования для небольших интервалов температур и при пониженной температуре T r ≪ 1 . Теплота парообразования уменьшается с повышением температуры и полностью исчезает в определенной точке, называемой температурой ( Tr критической = 1 ). Выше критической температуры жидкая и паровая фазы неразличимы, и вещество называется сверхкритической жидкостью .
Единицы
[ редактировать ]Значения обычно указываются в Дж / моль или кДж/моль (молярная энтальпия испарения), хотя кДж/кг или Дж/г (удельная теплота испарения) и более старые единицы, такие как ккал /моль, кал/г и БТЕ / lb иногда до сих пор используются среди других.
Энтальпия конденсации
[ редактировать ]Энтальпия конденсации (или теплота конденсации ) по определению равна энтальпии испарения с противоположным знаком: изменения энтальпии испарения всегда положительны (тепло поглощается веществом), тогда как изменения энтальпии конденсации всегда отрицательны (теплообразование выделяется веществом).
Термодинамический фон
[ редактировать ]
Энтальпию испарения можно записать как
Она равна увеличенной внутренней энергии паровой фазы по сравнению с жидкой фазой плюс работа, совершаемая против давления окружающей среды. Увеличение внутренней энергии можно рассматривать как энергию, необходимую для преодоления межмолекулярных взаимодействий в жидкости (или твердом теле, в случае сублимации ). Следовательно, гелий имеет особенно низкую энтальпию испарения, 0,0845 кДж/моль, поскольку силы Ван-дер-Ваальса между атомами гелия особенно слабы. С другой стороны, молекулы в жидкой воде удерживаются вместе относительно прочными водородными связями , а ее энтальпия испарения, 40,65 кДж/моль, более чем в пять раз превышает энергию, необходимую для нагрева того же количества воды от 0 °C до 100 °С ( = ср 75,3 Дж/К·моль). Однако необходимо соблюдать осторожность при использовании энтальпии испарения для измерения силы межмолекулярных сил, поскольку эти силы могут в некоторой степени сохраняться в газовой фазе (как в случае с фтористым водородом ), и поэтому расчетное значение связи сила будет слишком низкой. Особенно это касается металлов, которые часто образуют ковалентно связанные молекулы в газовой фазе: в этих случаях энтальпию атомизации необходимо использовать для получения истинного значения энергии связи .
Альтернативное описание состоит в том, чтобы рассматривать энтальпию конденсации как тепло, которое должно быть передано в окружающую среду, чтобы компенсировать падение энтропии , когда газ конденсируется в жидкость. Поскольку жидкость и газ находятся в равновесии при температуре кипения ( T b ), Δ v G = 0, что приводит к:
Поскольку ни энтропия, ни энтальпия сильно не изменяются в зависимости от температуры, нормально использовать табличные стандартные значения без какой-либо поправки на разницу температур от 298 К. Поправку необходимо внести, если давление отличается от 100 кПа , поскольку энтропия газа пропорциональна его давлению (или, точнее, его летучести ): энтропия жидкостей мало меняется с давлением, так как сжимаемость жидкости мала.
Эти два определения эквивалентны: точка кипения — это температура, при которой возросшая энтропия газовой фазы преодолевает межмолекулярные силы. Поскольку данное количество вещества всегда имеет более высокую энтропию в газовой фазе, чем в конденсированной фазе ( всегда положительна), а из
- ,
падает Изменение свободной энергии Гиббса с ростом температуры: газы предпочтительнее при более высоких температурах, как это наблюдается на практике.
Энтальпия испарения растворов электролитов
[ редактировать ]Оценку энтальпии испарения растворов электролитов можно просто провести с помощью уравнений, основанных на химико-термодинамических моделях, таких как модель Питцера. [1] или модель TCPC. [2]
Выбранные значения
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( сентябрь 2018 г. ) |
Элементы
[ редактировать ]| Энтальпии испарения элементов | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||
| Группа → | ||||||||||||||||||||
| ↓ Период | ||||||||||||||||||||
| 1 | Н 0,90 | Он 0,08 | ||||||||||||||||||
| 2 | Ли 136 | Будь 292 | Б508 508 | С 715 | Н 5,57 | О 6.82 | Ф 6,62 | Это было 1,71 | ||||||||||||
| 3 | На 97,4 | Мг 128 | Ал 284 | Си 359 | Пт 12.4 | С 45 | кл 20.4 | Ар 6,53 | ||||||||||||
| 4 | К 76,9 | Около 155 | СК 333 | Ти 425 | В444 444 | Кр 339 | Мн 221 | Фе 340 | Ко 377 | Ни 379 | Cu 300 | Цин 115 | Га 256 | Ге 334 | Как 32,4 | Се 95,5 | руб. 30,0 | кр 9,08 . | ||
| 5 | руб. 75,8 | Ср 141 | Д 390 | Зр 573 | № 690 | Мо 617 | ТК 585 | Ру 619 | рэнда 494 | ПД 358 | Аг 254 | КД 99,9 | В 232 | Сн 296 | Сб 193 | Те 114 | я 41,6 | Хе 12,6 | ||
| 6 | Cs 63,9 | Ба 140 | Лу 414 | Хф 648 | Та 733 | Вт 807 | Ре 704 | ОС 678 | Ир 564 | Пт 510 | Ау 342 | рт. ст. 59,1 | турецких лир 165 . | Пб 179 | Би 179 | По 103 | В 54,4 | Рн 18.1 | ||
| 7 | франков 65 | Ра 113 | Лр н/д | РФ н/д | БД н/д | Сг н/д | Бх н/д | Хс н/д | Гора н/д | Дс н/д | Рг н/д | Сп н/д | № н/д | Флорида н/д | Мак н/д | Уровень н/д | Ц н/д | Ога н/д | ||
| Ла 400 | Се 398 | Пр 331 | 289 № | Вечер 289 | см 172 | ЕС 176 | Б-г 301 | ТБ 391 | Дом 280 | Хо 251 | Эр 280 | Тм 191 | Ыб 129 | |||||||
| Ак 400 | ч 514 | К 481 году | Ю 417 | Нп 336 | Пу 333 | Я н/д | См н/д | См . н/д | См. н/д | Это н/д | FM н/д | Мэриленд н/д | Нет н/д | |||||||
| Энтальпия в кДж/моль, измеренная при соответствующих нормальных температурах кипения. | ||||||||||||||||||||
| 0–10 кДж/моль | 10–100 кДж/моль | 100–300 кДж/моль | >300 кДж/моль | |||||||||||||||||
Испарение металлов является ключевым этапом синтеза паров металлов , в котором используется повышенная реакционная способность атомов металлов или мелких частиц по сравнению с объемными элементами.
Другие распространенные вещества
[ редактировать ]Энтальпии испарения обычных веществ, измеренные при их соответствующих стандартных температурах кипения:
| Сложный | Температура кипения, при нормальном давлении | Теплота испарения | |||
|---|---|---|---|---|---|
| (К) | (°С) | (°Ф) | ( кДж/моль ) | (Дж/г) | |
| Ацетон | 329 | 56 | 133 | 31.300 | 538.9 |
| Алюминий | 2792 | 2519 | 4566 | 294.0 | 10500 |
| Аммиак | 240 | −33.34 | −28 | 23.35 | 1371 |
| Бутан | 272–274 | −1 | 30–34 | 21.0 | 320 |
| Диэтиловый эфир | 307.8 | 34.6 | 94.3 | 26.17 | 353.1 |
| Этанол | 352 | 78.37 | 173 | 38.6 | 841 |
| Водород ( параводород ) | 20.271 | −252.879 | −423.182 | 0.8992 | 446.1 |
| Железо | 3134 | 2862 | 5182 | 340 | 6090 |
| Изопропиловый спирт | 356 | 82.6 | 181 | 44 | 732.2 |
| Метан | 112 | −161 | −259 | 8.170 | 480.6 |
| Метанол | 338 | 64.7 | 148 | 35.2 [3] | 1104 |
| Пропан | 231 | −42 | −44 | 15.7 | 356 |
| Фосфин | 185 | −87.7 | −126 | 14.6 | 429.4 |
| Вода | 373.15 | 100 | 212 | 40.66 | 2257 |
См. также
[ редактировать ]- Отношение Клаузиуса – Клапейрона
- Уравнение Шиманского , описывает температурную зависимость теплоты парообразования
- Энтальпия плавления , удельная теплота плавления
- Энтальпия сублимации
- Метод Джобака , оценка теплоты испарения при нормальной температуре кипения по молекулярным структурам.
- Скрытое тепло
Ссылки
[ редактировать ]- ^ Ге, Синьлэй; Ван, Сидун (20 мая 2009 г.). «Оценка снижения температуры замерзания, повышения температуры кипения и энтальпии испарения растворов электролитов» . Исследования в области промышленной и инженерной химии . 48 (10): 5123. дои : 10.1021/ie900434h .
- ^ Ге, Синьлэй; Ван, Сидун (2009). «Расчеты понижения температуры замерзания, повышения температуры кипения, давления пара и энтальпии испарения растворов электролитов с помощью модифицированной корреляционной модели треххарактеристических параметров». Журнал химии растворов . 38 (9): 1097–1117. дои : 10.1007/s10953-009-9433-0 . ISSN 0095-9782 . S2CID 96186176 .
- ^ НИСТ
- Ключевые значения CODATA для термодинамики
- Гмелин, Леопольд (1985). Справочник Гмелина по неорганической химии / 08 а (8-е, полностью переработанное издание изд.). Берлин [среди прочих]: Springer. стр. 116–117. ISBN 978-3-540-93516-2 .
- Интернет-книга NIST по химии
- Янг, Фрэнсис В. Сирс, Марк В. Земански, Хью Д. (1982). Университетская физика (6-е изд.). Ридинг, Массачусетс: Аддисон-Уэсли. ISBN 978-0-201-07199-3 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )