Эпоксид

В органической химии эпоксидом : является циклическим эфиром , где эфир образует трехатомическое кольцо два атома углерода и один атом кислорода . Эта треугольная структура имеет существенный деформация кольца , что делает эпоксиды очень реактивными , больше, чем другие эфиры. Они производятся в больших масштабах для многих приложений. В целом, эпоксиды с низкой молекулярной массой являются бесцветными и неполярными и часто летучими . [ 1 ]
Номенклатура
[ редактировать ]Соединение, содержащее функциональную группу эпоксидной , можно назвать эпоксидной, эпоксидной, оксиранной и этоксиновой. Простые эпоксиды часто называют оксидами. Таким образом, эпоксидом этилена (C 2 H 4 ) представляет собой этиленоксид (C 2 H 4 O). У многих соединений есть тривиальные названия; Например, этиленоксид называется «оксиран». Некоторые имена подчеркивают наличие функциональной группы эпоксидной , как в соединении 1,2-эпоксигептана , который также можно назвать оксидом 1,2-хаптена .
Полимер , образованный из предшественников эпоксид, называется эпоксидной смолой . Однако немногие, если какая -либо из эпоксидной группы в смоле переживает процесс отверждения .
Синтез
[ редактировать ]Доминирующими эпоксидами в промышленности являются этиленоксид и оксид пропилена , которые производятся соответственно по масштабам приблизительно 15 и 3 миллионов тонн/год. [ 2 ]
Помимо оксида этилена, большинство эпоксидов генерируются, когда пероксидизированные реагенты пожертвовают один атом кислорода в алкен . Соображения безопасности взвешивают эти реакции, потому что органические пероксиды подвержены спонтанному разложению или даже сгоранию.
В качестве источников кислорода во время окисления пропилена можно использовать как Т-бутилгидропероксид , так и этилбензол гидропероксид (хотя вместо этого требуется катализатор, а также большинство промышленных производителей используют дегидрохлорирование). [ 3 ]
Этилен окисление
[ редактировать ]Промышленность этиленоксида генерирует свой продукт от реакции этилена и кислорода . Модифицированные гетерогенные серебряные катализаторы обычно используются. [ 4 ] Согласно механизму реакции, предложенным в 1974 году [ 5 ] По крайней мере, одна молекула этилена полностью окисляется на каждые шесть, которые преобразуются в этилен -оксид:
Только этилен производит эпоксид во время неполного сгорания . Другие алкены не могут отреагировать полезно, даже пропилен , хотя TS-1, поддерживаемые Au катализаторами, могут избирательно эпоксидизировать пропилен. [ 6 ]
Органические пероксиды и металлические катализаторы
[ редактировать ]Комплексы металлов являются полезными катализаторами для эпоксидаций, включающих перекись водорода и алкилдропероксиды. Катализируемые металлом эпоксидации сначала исследовали с использованием трет-бутилгидропероксида (TBHP). [ 7 ] Ассоциация TBHP с металлом (M) генерирует комплекс Active Metal Peroxy, содержащий группу Moor, который затем передает A -центр в алкен. [ 8 ]
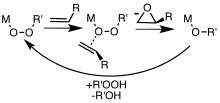
Упрощенный механизм для катализируемого металлом эпоксидирования алкенов с реагентами пероксида (ROOH)
Ванадий (II) оксид катализирует эпоксидирование в специально менее замещенных алкенах. [ 9 ]
Нуклеофильное эпоксидирование
[ редактировать ]Электронные дефицитные олефины, такие как эноны и акрил-производные, могут быть эпоксидированы с использованием нуклеофильных кислородных соединений, таких как пероксиды. Реакция представляет собой двухэтапный механизм. Сначала кислород выполняет нуклеофильное соединение конъюгата, чтобы дать стабилизированный карбанион. Затем этот Карбанион атакует тот же атом кислорода, вытесняя из нее уходную группу, чтобы закрыть эпоксидное кольцо.
Переносить из пероксикарбоновых кислот
[ редактировать ]Пероксикарбоновые кислоты, которые являются более электрофильными, чем другие пероксиды, преобразуют алкены в эпоксиды без вмешательства металлических катализаторов. В специализированных приложениях диоксирана реагенты (например, DiMethylDioxirane ) работают аналогично , но более взрывные.
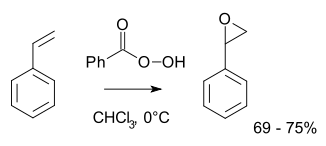
Типичные лабораторные операции используют реакцию Прилецхаева . [ 10 ] [ 11 ] Этот подход включает в себя окисление алкена пероксицидкой, такой как M CPBA . Иллюстративным является эпоксидирование стирола с пербензойной кислотой на оксид стирола : [ 12 ]
Стереохимия реакции довольно чувствительна. В зависимости от механизма реакции и геометрии начального материала алкена цис и/или транс -эпоксид диастереомеры могут быть образованы . Кроме того, если в стартовом материале присутствуют другие стереоцентеры, они могут влиять на стереохимию эпоксидации.
Реакция проходит через то, что обычно известно как «механизм бабочки». [ 13 ] Пероксид рассматривается как электрофил , а алкен - нуклеофил . Реакция считается согласованной. Механизм бабочки позволяет идеально расположить O -O Sigma Star Orbital для C - C π -электроны для атаки. [ 14 ] Поскольку две связи разбиваются и образуются с кислородом эпоксида, это формально пример переходного состояния коарктата .
Асимметричные эпоксидации
[ редактировать ]Хиральные эпоксиды часто можно получить энантиоселективно из прочеральных алкенов. Многие металлические комплексы дают активные катализаторы, но наиболее важные включают титановый , ванадий и молибден . [ 15 ] [ 16 ]
Гидропероксиды также используются в каталитических энантиоселективных эпоксидах, таких как эпоксидирование Sharpless и эпоксидирование Jacobsen . Вместе с эпоксидией SHI эти реакции полезны для энантиоселективного синтеза хиральных эпоксидов. Реагенты оксазиридина также могут использоваться для генерации эпоксидов из алкенов.
Реакция эпоксидации Sharpless является одной из главных энантиоселективных химических реакций . Он используется для приготовления 2,3-эпоксиалкохол из первичных и вторичных аллиловых спиртов . [ 17 ] [ 18 ]

Дегидрогалогенация и другие γ -элинами
[ редактировать ]
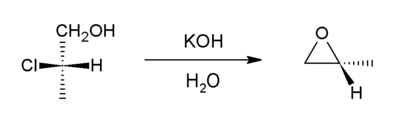
Галогидрины реагируют с основанием, чтобы получить эпоксиды. [ 20 ] Реакция является спонтанной, потому что энергетическая стоимость введения деформации кольца (13 ккал/моль) компенсируется более широкой энтальпией связи недавно введенной связи CO (по сравнению с расщепленной C-галогеновой связью).
Предсказано, что образование эпоксидов из вторичных галогидринов происходит быстрее, чем у первичных галогидринов из -за повышенного энтропийного эффекта во вторичном галогидрине, а третичные галогидрины реагируют (если вообще) очень медленно из -за стерической толпы. [ 21 ]
Начиная с пропиленхлоргидрина большая часть мирового поставки пропиленасида . , по этому пути возникает [ 3 ]
Внутримолекулярная реакция образования эпоксида является одним из ключевых этапов реакции Дарзенса .
В реакционных эпоксидах Джонсона -Корея -Чейковского генерируются карбонильные группы и сульфония . В этой реакции сульфон - это уходная группа вместо хлорида.
Биосинтез
[ редактировать ]Эпоксиды редки в природе. Они обычно возникают посредством оксигенации алкенов путем действия цитохрома P450 . [ 22 ] (Но см. Также короткоживущие эпоксиикосатриеновые кислоты , которые действуют как сигнальные молекулы. [ 23 ] и аналогичные эпоксидокозапентановые кислоты и эпоксиикозатетраеновые кислоты .)
Оксиды Арен являются промежуточными звенами при окислении арены цитохромом P450 . Для прочеральных арены ( нафталин , толуол , бензоаты , бензопирен ) эпоксиды часто получают при высокой энантиоселективности.
Реакция
[ редактировать ]Реакции раскрытия кольца доминируют в реакционной способности эпоксидов.
Гидролиз и добавление нуклеофилов
[ редактировать ]Эпоксиды реагируют с широким спектром нуклеофилов, например, спиртами, водой, аминами, тиолами и даже галогенками. С двумя часто новыми эквивалентными участками атаки эпоксиды иллюстрируют «субстраты амбидентов». [ 24 ] раскрытия кольца Региоселективность в асимметричных эпоксидах обычно следует за шаблоном атаки S N 2 при наименьшей замещенной углероде, [ 25 ] но может повлиять на стабильность карбоката в кислых условиях. [ 26 ] Этот класс реакций является основой эпоксидных клеев и производства гликолей. [ 19 ]
Гидрад лития алюминия или гидрид алюминия оба уменьшают эпоксиды за счет простого нуклеофильного добавления гидрида (h − ); Они производят соответствующий алкоголь . [ 27 ]
Полимеризация и олигомеризация
[ редактировать ]Полимеризация эпоксидов дает полиэфиры . Например, этиленоксид полимеризуется с получением полиэтиленгликоля , также известного как полиэтиленоксид. Реакция спирта или фенола с оксидом этилена, этоксилирования широко используется для получения поверхностно -активных веществ: [ 28 ]
- Roh + n c 2 h 4 ч 4 ч 4 ч 4 ч 4 ) или ОН
С ангидридами эпоксиды дают полиэфиры. [ 29 ]
Металлирование и дезоксигенация
[ редактировать ]Литиация расщепляет кольцо к β-литиолкоксидам. [ 30 ]
Эпоксиды могут быть дезоксигенированы с использованием оксофильных реагентов с потерей или удержанием конфигурации. [ 31 ] Комбинация вольфрамового гексахлорида и n -бутиллития дает алкен . [ 32 ] [ 33 ]
При лечении Thiurea , эпоксиды превращаются в эпизоклид (Thiiranes).
Другие реакции
[ редактировать ]- Эпоксиды подвергаются реакциям расширения кольца, иллюстрируемые вставкой углекислого газа с получением циклических карбонатов .
- Эпоксид, примыкающий к алкоголю, может подвергаться перестройке Пейна в базе.
Использование
[ редактировать ]-
Бисфенол Диглицидиловый эфир является компонентом в общей домашней «эпоксидной смоле».
-
Химическая структура эпоксидного глицидола , общего химического промежутка.
-
Эпотилоны являются естественными эпоксидами.
-
3,4-эпоксициклогексилметил-3 ', 4'-эпоксициклогексан карбоксилат , предшественник покрытий. [ 34 ]
-
Эпоксидизированный линолейин , основной компонент эпоксидированного соевого масла (ESBO), коммерчески важного пластификатора .
-
Оксид бензола существует в равновесии с изомером кислорода.
Этиленоксид широко используется для генерации моющих средств и поверхностно -активных веществ с помощью этоксилирования . Его гидролиз дает этиленгликоль . Он также используется для стерилизации медицинских инструментов и материалов.
Реакция эпоксидов с аминами является основой для образования эпоксидных клеев и структурных материалов. Типичным амин-хардиенером является триэтилентетрамин (TETA).
Безопасность
[ редактировать ]Эпоксиды являются алкилирующими агентами , что делает многих из них очень токсичными. [ 35 ]
Смотрите также
[ редактировать ]Дальнейшее чтение
[ редактировать ]- Massingill, JL; Бауэр, Р.С. (2000-01-01). «Эпоксидные смолы» . В Craver, Clara D.; Carraher, Charles E. (Eds.). Прикладная полимерная наука: 21 век . Оксфорд: Пергамон. С. 393–424. doi : 10.1016/b978-008043417-9/50023-4 . ISBN 978-0-08-043417-9 Полем Получено 2023-12-20 .
Ссылки
[ редактировать ]- ^ Guenter Sienel; Роберт Риет; Кеннет Т. Роуботтом. «Эпоксиды». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. doi : 10.1002/14356007.a09_531 . ISBN 978-3527306732 .
- ^ Зигфрид Ребсат; Дитер Майер. «Этиленоксид». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. doi : 10.1002/14356007.a10_117 . ISBN 978-3527306732 .
- ^ Jump up to: а беременный Dietmar Kahlich, Uwe Wiechern, Jörg Lindner "пропилен-оксид" в энциклопедии Ullmann of Industrial Chemistry, 2002 Wiley-VCH, Вайнхайм. Два : 10.1002/14356007.A22_239
- ^ Sajkowski, DJ; Budart, M. (1987). «Чувствительность структуры каталитического окисления этеной серебром». Обзоры катализа . 29 (4): 325–360. doi : 10.1080/01614948708078611 .
- ^ Килти Па; Sachtler WMH (1974). «Механизм селективного окисления этилена в этиленоксид». Обзоры катализа: наука и инженерия . 10 : 1–16. doi : 10.1080/01614947408079624 .
- ^ Nijhuis, T. Alexander; Макки, Михиэль; Мулиджн, Джейкоб А.; Weckhuysen, Bert M. (1 мая 2006 г.). «Производство оксида пропена: каталитические процессы и последние разработки». Исследования промышленной и инженерной химии . 45 (10): 3447–3459. doi : 10.1021/IE0513090 . HDL : 1874/20149 . S2CID 94240406 .
- ^ Индикатор Н., Брилл В.Ф. (1965). «Металлический ацетилацетонат катализируется эпоксидирование олефинов с Т-бутилгидропероксидом». J. Org. Химический 30 (6): 2074. DOI : 10.1021/JO01017A520 .
- ^ Тиль В.Р. (1997). «Металл катализировал окисление. Часть 5. Каталитическое эпоксидирование олефина с семикоординатными комплексами молибдена из оксобиспероксо: механистическое исследование». Журнал молекулярного катализа A: Химический . 117 : 449–454. doi : 10.1016/s1381-1169 (96) 00291-9 .
- ^ Табер, Дуглас (25 сентября 2006 г.). «Селективные реакции алкенов» . Органическая химия .
- ^ Март, Джерри. 1985. Усовершенствованная органическая химия, реакции, механизмы и структура . 3 -е изд. Джон Уайли и сыновья. ISBN 0-471-85472-7 .
- ^ Николаус Прилешайв (1909). «Окисление ненасыщенных соединений с использованием органического супероксида» [окисление ненасыщенных соединений с помощью органических пероксидов]. Сообщения о немецком химическом обществе (на немецком языке). 42 (4): 4811–4815. Doi : 10.1002/cber.190904204100 .
- ^ Гарольд Хибберт и Полин Берт (1941). «Оксид стирола» . Органические синтезы ; Собранные объемы , вып. 1, с. 494 .
- ^ Пол Д. Бартлетт (1950). «Недавняя работа по механизмам пероксидных реакций». Запись химического прогресса . 11 : 47–51.
- ^ Джон О. Эдвардс (1962). Механизмы реакции пероксид . Межсциуна, Нью -Йорк. С. 67–106.
- ^ Беррисфорд, диджей; Болм, C.; Sharpless, KB (2003). «Ускоренный лиганд катализ». Angew. Химический Инт. Редакция Энтузиазм 95 (10): 1059–1070. doi : 10.1002/anie.199510591 .
- ^ Шелдон Р.А. (1980). «Синтетические и механистические аспекты эпоксидаций, катализируемых на металлах, с гидропероксидами». Журнал молекулярного катализа . 1 : 107–206. doi : 10.1016/0304-5102 (80) 85010-3 .
- ^ Кацуки, Т.; Sharpless, KB (1980). «Первый практический метод асимметричного эпоксидации». J. Am. Химический Соц 102 (18): 5974–5976. doi : 10.1021/ja00538a077 .
- ^ Хилл, JG; Sharpless, KB ; Экзон, CM; Regenye, R. Org. Синтезатор , Coll. Тол. 7, с. 461 (1990); Тол. 63, с. 66 (1985). ( Статья архивирована 2013-09-27 на The Wayback Machine )
- ^ Jump up to: а беременный Pham, Ha Q.; Marks, Maurice J. (2005). «Эпоксидные смолы». Энциклопедия промышленной химии Уллмана . Wiley-Vch. doi : 10.1002/14356007.a09_547.pub2 . ISBN 978-3527306732 .
- ^ Koppenhoefer, B.; Шуриг В. (1993). «(R) -алкилоксираны высокой энантиомерной чистоты из (s) -2-хлоролкановых кислот через (s) -2-хлор-1-алканолы: (r) -метилоксиран» . Органические синтезы ; Собранные объемы , вып. 8, с. 434 .
- ^ Сильва, PJ (2023). «Вычислительное понимание спонтанности формирования эпоксида из галогидринов и других механистических деталей синтеза эфира Уильямсона» . Химический J. плесень . 18 (2): 87–95. doi : 10.19261/cjm.2023.1083 .
- ^ Thibodeaux CJ (2012). «Ферментативная химия циклопропана, эпоксида и биосинтеза азиридина» . Химический Преподобный 112 (3): 1681–1709. doi : 10.1021/cr200073d . PMC 3288687 . PMID 22017381 .
- ^ Boron WF (2003). Медицинская физиология: клеточный и молекулярный подход . Elsevier/Saunders. п. 108. ISBN 978-1-4160-2328-9 .
- ^ Смит, Майкл Б.; Март, Джерри (2007), Advanced Organic Chemistry: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, p. 517, ISBN 978-0-471-72091-1
- ^ Уоррен, Стюарт; Уайетт, Пол (2008). Органический синтез: подход отключения (2 -е изд.). Уайли. п. 39
- ^ Рзепа, Генри (28 апреля 2013 г.). «Как предсказать региоселективность открытия эпоксидного кольца» . Химия с изюминкой .
- ^ Брюс Рикборн и Уоллес Э. Ламке (1967). «Снижение эпоксидов. II. Гидрад лития алюминия и смешанное снижение гидрида 3-метилциклогексенового оксида». J. Org. Химический 32 (3): 537–539. doi : 10.1021/jo01278a005 .
- ^ Коссхив, Курт (2002). "Surfactorts" В Эльверсе, Барбара; тр. (ред.). Энциклопедия Вайнхайм, Гер: Wiley-VCH. doi : 10.1002/14366007.a25_747 . ISBN 978-3527306732 .
- ^ Джули М. Лонго; Мария Дж. Сэнфорд; Джеффри В. Коутс (2016). «Сополимеризация эпоксидов и циклических ангидридов с помощью дискретных металлических комплексов: отношения структуры и деятельности». Химический Преподобный 116 (24): 15167–15197. doi : 10.1021/acs.chemrev.6b00553 . PMID 27936619 .
- ^ Б. Мудрик; Т. Коэн (1995). «1,3-диолы из β-литий-лития β-литиолкоксидами, полученные в результате восстановительного литирования эпоксидов: 2,5-диметил-2,4-гександиол». Орг Синтезатор 72 : 173. doi : 10.15227/orgsyn.072.0173 .
- ^ Такуя Накагри; Вырезать Масахито; Казухико Такай (2015). «Стереоспецифическая дезоксигенация алифатических эпоксидов к алкенам в катализе Rhenium. орг Летт 17 (13): 3346–9 Doi : 10.1021/ acs.orglett.5b0 26065934PMID
- ^ К. Барри Шарплесс , Марта А. Умбрейт (1981). «Дезоксигенация эпоксидов с более низкими валентными галогенидами вольфрама: транс -циклододекен». Орг Синтезатор 60 : 29. doi : 10.15227/orgsyn.060.0029 .
- ^ К. Барри Шарплесс ; Марта А. Умбрейт; Марджори Т. Них; Томас С. Фол (1972). «Нижняя валентная вольфрама галогенидов. Новый класс реагентов для дезоксигенации органических молекул». J. Am. Химический Соц 94 (18): 6538–6540. doi : 10.1021/ja00773a045 .
- ^ Сасаки, Хироши (февраль 2007 г.). «Выклятые свойства циклоалифатических эпоксидных производных». Прогресс в органических покрытиях . 58 (2–3): 227–230. doi : 10.1016/j.porgcoat.2006.09.030 .
- ^ Нидерер, Кристиан; Бедра, Рената; Сложнее, Анжела; Schwarzenbach, René P.; Эшер, Бит И. (2004). «Механистические подходы для оценки токсичности реактивных органохлоринов и эпоксидов в зеленых водорослях». Экологическая токсикология и химия . 23 (3): 697–704. doi : 10.1897/03-83 . PMID 15285364 . S2CID 847639 .







![3,4-эпоксициклогексилметил-3 ', 4'-эпоксициклогексан карбоксилат, предшественник покрытий. [34]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0e/Diepoxyester.svg/175px-Diepoxyester.svg.png)

