Интеграза
| Интеграза цинк-связывающий домен | |||
|---|---|---|---|
 Структура раствора n-концевого zn-связывающего домена интегразы ВИЧ-1 (е-форма), ЯМР, 38 структур | |||
| Идентификаторы | |||
| Символ | Интеграза_Zn | ||
| Пфам | PF02022 | ||
| ИнтерПро | ИПР003308 | ||
| СКОП2 | 1wjb / SCOPe / СУПФАМ | ||
| |||
| Основной домен интеграции | |||
|---|---|---|---|
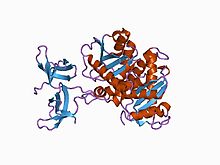 Кристаллическая структура двухдоменной интегразы RSV. | |||
| Идентификаторы | |||
| Символ | ехать | ||
| Пфам | PF00665 | ||
| Пфам Клан | CL0219 | ||
| ИнтерПро | ИПР001584 | ||
| СКОП2 | 2итг / СКОПе / СУПФАМ | ||
| |||
| ДНК-связывающий домен интегразы | |||
|---|---|---|---|
 Кристаллическая структура двухдоменной интегразы RSV. | |||
| Идентификаторы | |||
| Символ | IN_DBD_C | ||
| Пфам | PF00552 | ||
| ИнтерПро | IPR001037 | ||
| СКОП2 | 1ihw / SCOPe / СУПФАМ | ||
| |||
Ретровирусная интеграза ( ИН ) — это фермент, продуцируемый ретровирусом ( таким как ВИЧ ), который интегрирует (формирует ковалентные связи) свою генетическую информацию с информацией клетки- хозяина, которую он заражает. [1] Ретровирусные ИН не следует путать с фаговыми интегразами ( рекомбиназами ), используемыми в биотехнологии , такими как фаговая интеграза λ, как обсуждается в разделе сайт-специфической рекомбинации .
Макромолекулярный комплекс ИН макромолекулы , связанной с концами концов вирусной ДНК, получил название интасомы ; ИН является ключевым компонентом этого комплекса, а также ретровирусного преинтеграционного комплекса . [2]
Структура
[ редактировать ]Все ретровирусные белки IN содержат три канонических домена, соединенных гибкими линкерами: [3] [4]
- цинксвязывающий N-концевой домен HH-CC (трехспиральный пучок, стабилизированный координацией катиона Zn(II)),
- каталитический основной домен (складка РНКазы H),
- С -концевой ДНК-связывающий домен ( складка SH3 ).
кристаллических и ЯМР-структурах отдельных доменов и двухдоменных конструкциях интеграз ВИЧ-1, ВИЧ-2, SIV и вируса саркомы Рауса (RSV), причем первые структуры были определены в 1994 году. Сообщалось о [5] [6] Биохимические и структурные данные позволяют предположить, что ретровирусная ИН функционирует как тетрамер (димер из димеров), причем все три домена важны для мультимеризации и связывания вирусной ДНК. [7] Кроме того, было показано, что несколько клеточных белков хозяина взаимодействуют с ИН, облегчая процесс интеграции: например, фактор хозяина, человеческий хроматин-ассоциированный белок LEDGF , прочно связывает ИН ВИЧ и направляет преинтеграционный комплекс ВИЧ к высокоэкспрессируемым генам для интеграция. [8]
Пенистый вирус человека (HFV), агент, безвредный для человека, имеет интегразу, аналогичную ВИЧ-ИН, и поэтому является моделью функции ВИЧ-ИН; Определена кристаллическая структура 2010 интегразы HFV, собранной на концах вирусной ДНК. [6]
Функция и механизм
[ редактировать ]Интеграция происходит после образования двухцепочечной линейной вирусной ДНК обратной транскриптазой вирусной РНК/ДНК-зависимой ДНК-полимеразы . [9]
Основная функция ИН — вставка вирусной ДНК в хромосомную ДНК хозяина, что является важным этапом репликации ВИЧ . Интеграция – это «точка невозврата» для клетки, которая становится постоянным носителем вирусного генома (провируса). Интеграция частично ответственна за сохранение ретровирусных инфекций. [10] После интеграции экспрессия вирусного гена и образование частиц могут произойти немедленно или в какой-то момент в будущем, время зависит от активности хромосомного локуса, в котором находится провирус. [4]
Ретровирусные ИН катализируют две реакции: [4]
- 3'-процессинг, при котором два или три нуклеотида удаляются с одного или обоих 3'-концов вирусной ДНК, чтобы обнажить инвариантный динуклеотид СА.
- реакция переноса цепи, при которой процессированные 3'-концы вирусной ДНК ковалентно лигируются с хромосомной ДНК хозяина.
Обе реакции катализируются в одном и том же активном центре и включают переэтерификацию без участия ковалентного промежуточного соединения белок-ДНК (в отличие от реакций, катализируемых рекомбиназой Ser/Tyr) . [4]
ВИЧ
[ редактировать ]
ВИЧ- интеграза представляет собой вирусный белок массой 32 кДа, состоящий из трех доменов: N-конца , каталитического ядерного домена и С-конца, каждый из которых имеет различные свойства и функции, способствующие эффективности ВИЧ-интегразы. [3]
N-конец состоит из 50 аминокислотных остатков, которые содержат консервативную последовательность гистидина, гистидина, цитозина, цитозина, которая хелатирует ионы цинка, дополнительно усиливая ферментативную активность каталитического ядерного домена. [3] Поскольку хелатирование металлов имеет жизненно важное значение для эффективности интегразы, оно является целью разработки ретровирусной терапии. [3]
Каталитический основной домен, как и N-конец, содержит высококонсервативные аминокислотные остатки -Asp64, Asp116, Glu152-, поскольку консервативный мотив DDE (Asp-Asp-Glu) способствует эндонуклеазным и полинуклеотидтрансферазным функциям интегразы. Мутации в этих регионах инактивируют интегразу и препятствуют интеграции генома. [3]
С-концевой домен неспецифично связывается с ДНК хозяина и стабилизирует интеграционный комплекс. [3]
Механизм интеграции
[ редактировать ]После синтеза генома двухцепочечной ДНК ВИЧ интеграза связывается с длинными тандемными повторами, фланкирующими геном на обоих концах. Используя свою эндонуклеолитическую активность, интеграза отщепляет ди- или тринуклеотид с обоих 3'-концов генома в процессе, известном как 3'-процессинг. [11] Специфичность расщепления улучшается за счет использования кофакторов, таких как Mn. 2+ и мг 2+ которые взаимодействуют с мотивом DDE каталитического основного домена, действуя как кофакторы функции интегразы. [11]
ДНК хозяина Вновь созданные 3'OH-группы разрушают фосфодиэфирные связи посредством нуклеофильной атаки типа SN2. [6] 3'-концы ковалентно связаны с целевой ДНК. Затем 5'-концы вирусного генома расщепляются с помощью ферментов репарации хозяина; считается, что эти же ферменты ответственны за интеграцию 5'-конца в геном хозяина, образуя провирус. [6] [11]
Антиретровирусная терапия
[ редактировать ]В ноябре 2005 года данные фазы 2 исследования исследуемого ингибитора ВИЧ- МК интегразы -0518 продемонстрировали, что это соединение обладает мощной противовирусной активностью. 12 октября 2007 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (США) одобрило ингибитор интегразы Ралтегравир (МК-0518, торговая марка Isentress). Второй ингибитор интегразы, элвитегравир , был одобрен в США в августе 2012 года.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Бек Б.Дж., Фрейденрайх О., Уорт Дж.Л. (2010). «Пациенты с инфекцией вируса иммунодефицита человека и синдромом приобретенного иммунодефицита». Справочник больницы общего профиля Массачусетса по психиатрии больниц общего профиля . Эльзевир. стр. 353–370. дои : 10.1016/b978-1-4377-1927-7.00026-1 . ISBN 9781437719277 .
- ^ Масуда Т. (2011). «Неферментативные функции ретровирусной интегразы: следующая цель разработки новых лекарств против ВИЧ» . Границы микробиологии . 2 : 210. дои : 10.3389/fmicb.2011.00210 . ПМК 3192317 . ПМИД 22016749 .
- ^ Перейти обратно: а б с д и ж Йожвик И.К., Пассос Д.О., Люмкис Д. (сентябрь 2020 г.). «Структурная биология ингибиторов переноса цепи интегразы ВИЧ» . Тенденции в фармакологических науках . 41 (9): 611–626. дои : 10.1016/j.tips.2020.06.003 . ПМЦ 7429322 . ПМИД 32624197 .
- ^ Перейти обратно: а б с д Делелис О, Карайон К, Саиб А, Депре Э, Мусаде Ж.Ф. (декабрь 2008 г.). «Интеграза и интеграция: биохимическая активность интегразы ВИЧ-1» . Ретровирусология . 5 (1): 114. дои : 10.1186/1742-4690-5-114 . ПМК 2615046 . ПМИД 19091057 .
- ^ Лоди П.Дж., Эрнст Дж.А., Кушевски Дж., Хикман А.Б., Энгельман А., Крейги Р. и др. (август 1995 г.). «Структура раствора ДНК-связывающего домена интегразы ВИЧ-1». Биохимия . 34 (31): 9826–9833. дои : 10.1021/bi00031a002 . ПМИД 7632683 .
- ^ Перейти обратно: а б с д Чой Э., Малларедди-младший, Лу Д., Коллуру С. (октябрь 2018 г.). «Последние достижения в открытии низкомолекулярных ингибиторов интегразы ВИЧ-1» . Наука будущего О.А. 4 (9): ФСО338. дои : 10.4155/fsoa-2018-0060 . ПМК 6222271 . ПМИД 30416746 .
- ^ Заяц С., Ди Нунцио Ф., Лабежа А., Ван Дж., Энгельман А., Черепанов П. (июль 2009 г.). Любан Дж. (ред.). «Структурные основы функциональной тетрамеризации лентивирусной интегразы» . ПЛОС Патогены . 5 (7): e1000515. дои : 10.1371/journal.ppat.1000515 . ПМК 2705190 . ПМИД 19609359 .
- ^ Крейги Р., Бушман FD (июль 2012 г.). «Интеграция ДНК ВИЧ» . Перспективы Колд-Спринг-Харбора в медицине . 2 (7): а006890. doi : 10.1101/cshperspect.a006890 . ПМЦ 3385939 . ПМИД 22762018 .
- ^ Бердик Р.К., Патак В.К. (январь 2021 г.). «Эффективная обратная транскрипция ВИЧ-1 in vitro: необходима оптимальная стабильность капсида» . Сигнальная трансдукция и таргетная терапия . 6 (1): 13. дои : 10.1038/s41392-020-00458-3 . ПМК 7804106 . ПМИД 33436564 .
- ^ Мальдарелли Ф (февраль 2016 г.). «Роль интеграции ВИЧ в персистенции вируса: больше не надо свистеть мимо провирусного кладбища» . Журнал клинических исследований . 126 (2): 438–447. дои : 10.1172/JCI80564 . ПМЦ 4731194 . ПМИД 26829624 .
- ^ Перейти обратно: а б с Махбуби-Раббани М, Аббаси М, Хаджимахди З, Зарги А (2021). «Двойные ингибиторы обратной транскриптазы/интегразы ВИЧ-1: обзор последних достижений и исследований взаимосвязи структура-активность» . Иранский журнал фармацевтических исследований . 20 (2): 333–369. дои : 10.22037/ijpr.2021.115446.15370 . ПМЦ 8457747 . ПМИД 34567166 .
Дальнейшее чтение
[ редактировать ]- Мартенс Г.Н., Энгельман А.Н., Черепанов П. (январь 2022 г.). «Структура и функции ретровирусной интегразы» . Обзоры природы. Микробиология . 20 (1): 20–34. дои : 10.1038/s41579-021-00586-9 . ПМЦ 8671357 . ПМИД 34244677 . S2CID 235787691 .
Внешние ссылки
[ редактировать ]- PDB-101 Молекула месяца: 135 ВИЧ-интеграза
- Интегразы Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)