Метициллин
 | |
 | |
| Клинические данные | |
|---|---|
| Маршруты администрация | IV |
| код АТС | |
| Фармакокинетические данные | |
| Биодоступность | Не всасывается перорально |
| Метаболизм | печеночный, 20–40% |
| Период полувыведения | 25–60 минут |
| Экскреция | почечный |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.000.460 |
| Химические и физические данные | |
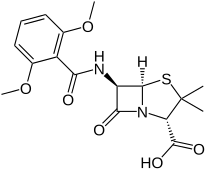
| Формула | С 17 Н 20 Н 2 О 6 С |
| Молярная масса | 380.42 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Метициллин ( USAN ), также известный как метициллин ( INN ), представляет собой узкого спектра действия β-лактамный антибиотик класса пенициллинов .
Метициллин был открыт в 1960 году. [1]
Медицинское использование
[ редактировать ]По сравнению с другими пенициллинами, которые сталкиваются с устойчивостью к противомикробным препаратам из-за β-лактамаз , он менее активен, может вводиться только парентерально и имеет более высокую частоту интерстициального нефрита , что в других отношениях является редким побочным эффектом пенициллинов. Однако выбор метициллина зависел от результатов тестирования на чувствительность отобранной инфекции, и, поскольку он больше не производится, его регулярное тестирование также больше не проводится. Он также использовался в лаборатории для определения чувствительности Staphylococcus aureus к антибиотикам к другим пенициллинам, устойчивым к β-лактамам; эта роль теперь передана другим пенициллинам, а именно клоксациллину , а также генетическому тестированию на наличие mecA гена с помощью ПЦР . [ нужна ссылка ]
Спектр деятельности
[ редактировать ]Одно время метициллин использовался для лечения инфекций, вызванных некоторыми грамположительными бактериями, включая Staphylococcus aureus , Staphylococcus epidermidis , Streptococcus pyogenes и Streptococcus pneumoniae . Метициллин эффективен против золотистого стафилококка только в 50% случаев.
Устойчивость к метициллину обеспечивается активацией нового гена бактериального пенициллинсвязывающего белка (PBP) mecA . Он кодирует белок PBP2a. PBP2a действует аналогично другим PBP, но он связывает β-лактамы с очень низким сродством, что означает, что они не конкурируют эффективно с естественным субстратом фермента и не ингибируют биосинтез клеточной стенки. Экспрессия PBPA2 обеспечивает устойчивость ко всем β-лактамам. [ нужна ссылка ]
Эти данные о чувствительности приведены для нескольких значимых с медицинской точки зрения бактерий:
- Золотистый стафилококк : 0,125 – >100 мкг/мл
- Метициллинрезистентный золотистый стафилококк (MRSA): 15,6 – >1000 мкг/мл
- Streptococcus pneumoniae : 0,39 мкг/мл [2]
Механизм действия
[ редактировать ]Как и другие бета-лактамные антибиотики, метициллин действует путем ингибирования синтеза клеточных стенок бактерий . Он ингибирует перекрестные связи между линейными полимерными цепями пептидогликана , которые составляют основной компонент клеточной стенки грамположительных бактерий. Он делает это путем связывания и конкурентного ингибирования фермента транспептидазы (также известного как пенициллин-связывающие белки (PBP)). Эти PBP сшивают гликопептиды ( D -аланилаланин ), образуя клеточную стенку пептидогликана. Метициллин и другие β-лактамные антибиотики являются структурными аналогами D -аланилаланина, а ферменты транспептидазы, которые с ними связываются, иногда называют пенициллинсвязывающими белками (PBP). [3]
Метициллин на самом деле является β-лактамным антибиотиком, устойчивым к пенициллиназе . Пенициллиназа — это бактериальный фермент, вырабатываемый бактериями, устойчивыми к другим β-лактамным антибиотикам, который гидролизует антибиотик, делая его нефункциональным. Метициллин не связывается и не гидролизуется пенициллиназой, а это означает, что он может убивать бактерии, даже если этот фермент присутствует.
Медицинская химия
[ редактировать ]Метициллин устойчив к бета-лактамазам — ферментам, секретируемым многими бактериями, устойчивыми к бета-лактамным антибиотикам. Присутствие орто -диметоксифенильной группы , непосредственно присоединенной к карбонильной группе боковой цепи ядра пенициллина, облегчает устойчивость к β-лактамазам, поскольку эти ферменты относительно нетерпимы к стерическим препятствиям боковой цепи . Таким образом, он способен связываться с PBP и ингибировать сшивание пептидогликана , но не связывается и не инактивируется β-лактамазами. [ нужна ссылка ]
История
[ редактировать ]Метициллин был разработан компанией Beecham в 1959 году. [4] Ранее его использовали для лечения инфекций, вызванных чувствительными грамположительными бактериями, в частности микроорганизмами, продуцирующими пенициллиназу, такими как Staphylococcus aureus , которые в противном случае были бы устойчивы к большинству пенициллинов.
Его роль в терапии в значительной степени заменена оксациллином (используемым для клинического тестирования чувствительности к противомикробным препаратам), флуклоксациллином и диклоксациллином , но термин метициллин-резистентный золотистый стафилококк (MRSA) продолжает использоваться для описания штаммов S. aureus, устойчивых ко всем пенициллинам. [5]
Ссылки
[ редактировать ]- ^ Уокер С.Р. (2012). Тенденции и изменения в исследованиях и разработках лекарственных средств . Springer Science & Business Media. п. 109. ИСБН 9789400926592 .
- ^ «Данные о чувствительности и концентрации натрия к метициллину (MIC)» (PDF) . ТОКУ-Э .
- ^ Гладвин М., Трэтлер Б. (2004). Клиническая микробиология стала до смешного простой (3-е изд.). Майами: MedMaster, Inc.
- ^ Датфилд Дж. (30 июля 2009 г.). Права интеллектуальной собственности и отрасли медико-биологических наук: прошлое, настоящее и будущее . Всемирная научная. стр. 140–. ISBN 978-981-283-227-6 . Проверено 18 ноября 2010 г.
- ^ Ньюсом SW (ноябрь 2004 г.). «MRSA — прошлое, настоящее, будущее» . Журнал Королевского медицинского общества . 97 (11): 509–10. дои : 10.1177/014107680409701101 . ПМЦ 1079642 . ПМИД 15520143 .