Металлоцен

Металлоцен циклопентадиенильных представляет собой соединение, обычно состоящее из двух анионов ( C
55Ч −
5 , сокращенно Cp), связанный с металлическим центром (М) в степени окисления II, с полученной в результате общей формулой (C 5 H 5 ) 2 M. Близкими родственниками металлоценов являются производные металлоценов, например дихлорид титаноцена или дихлорид ванадоцена . Некоторые металлоцены и их производные проявляют каталитические свойства, хотя металлоцены редко используются в промышленности. Катионные производные металлоценов 4-й группы, родственные [Cp 2 ZrCH 3 ] + катализируют полимеризацию олефинов .
Некоторые металлоцены состоят из металла плюс двух циклооктатетраенид-анионов ( C
88Ч 2−
8 , сокращенная детская кроватка 2− ), а именно лантаноцены и актиноцены ( ураноцен и др.).
Металлоцены представляют собой подмножество более широкого класса соединений, называемых сэндвич-соединениями . [ 1 ] В структуре, показанной справа, два пятиугольника представляют собой циклопентадиенильные анионы с кружками внутри, указывающими на то, что они ароматически стабилизированы. Здесь они показаны в шахматном порядке .
История
[ редактировать ]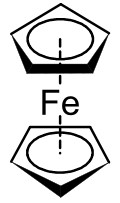
Первым классифицированным металлоценом был ферроцен , который был открыт одновременно в 1951 году Кили и Паусоном. [ 2 ] и Миллер и др. [ 3 ] Кили и Паусон пытались синтезировать фульвален окислением циклопентадиенильной соли безводным FeCl 3 , но вместо этого получили вещество C 10 H 10 Fe. [ 2 ] В то же время Миллер и др. сообщили о том же продукте железа в результате реакции циклопентадиена с железом в присутствии оксидов алюминия, калия или молибдена. [ 3 ] Структура «C 10 H 10 Fe» была определена Джеффри Уилкинсоном и др. [ 1 ] и Эрнст Отто Фишер и др. [ 4 ] Эти двое были удостоены Нобелевской премии по химии в 1973 году за работу над сэндвич-соединениями, включая структурное определение ферроцена. [ 1 ] Они определили, что атомы углерода циклопентадиенильного (Cp) лиганда вносят равный вклад в связь и что связь происходит за счет d-орбиталей металла и π- электронов на p-орбиталях лигандов Cp. Этот комплекс теперь известен как ферроцен, а группа дициклопентадиенильных соединений переходных металлов известна как металлоцены. Металлоцены имеют общую формулу [( η 5 -С 5 Н 5 ) 2 М]. Фишер и др. впервые получил производные ферроцена с участием Co и Ni. часто получают из замещенных производных циклопентадиенида . Металлоцены многих элементов [ 5 ]
Одним из первых коммерческих производителей металлоценов была компания Arapahoe Chemicals в Боулдере, штат Колорадо. [ 6 ]
Определение
[ редактировать ]
Общее название металлоцен происходит от ферроцена , (C 5 H 5 ) 2 Fe или Cp 2 Fe, систематически называемого бис( η 5 - циклопентадиенил )железо(II). Согласно определению Международного союза теоретической и прикладной химии , металлоцен содержит переходный металл и два циклопентадиенильных лиганда, координированных в сэндвич-структуре, то есть два циклопентадиенильных аниона находятся в параллельных плоскостях с одинаковой связей длиной и силой . Используя номенклатуру « гаптичности », эквивалентная связь всех 5 атомов углерода циклопентадиенильного кольца обозначается как η. 5 , произносится как «пентагапто». Есть исключения, такие как ураноцен , который имеет два циклооктатетраеновых кольца, окруженных атомом урана .
В названиях металлоценов приставка перед окончанием -оцен указывает, какой металлический элемент находится между группами Cp. Например, в ферроцене присутствует железо(II), двухвалентное железо.
В отличие от более строгого определения, предложенного Международным союзом теоретической и прикладной химии, которое требует d-блочного металла и сэндвич-структуры, термин металлоцен и, следовательно, обозначение -оцен применяется в химической литературе также к непереходным соединениям. соединения металлов, такие как бароцен (Cp 2 Ba), или структуры, в которых ароматические кольца не параллельны, например, обнаруженные в дихлориде манганоцена или титаноцена (Cp 2 TiCl 2 ).
некоторых металлоценовых комплексах актинидов , в которых имеется три циклопентадиенильных лиганда монометаллического комплекса, все три из которых связаны η Сообщалось о 5 . [ 7 ]
Классификация
[ редактировать ]Их много ( η 5 -C 5 H 5 ) – металлокомплексы и их можно классифицировать по следующим формулам: [ 8 ]
| Формула | Описание |
|---|---|
| [( час 5 -С 5 Н 5 ) 2 М] | Симметричная классическая структура «сэндвич» |
| [( час 5 -C 5 H 5 ) 2 МЛ х ] | Изогнутые или наклоненные Cp-кольца с дополнительными лигандами, L |
| [( час 5 -C 5 H 5 )ML x ] | Только один лиганд Cp с дополнительными лигандами L (структура «табуретки»). |
Комплексы на основе ЦП также можно классифицировать по типу: [ 8 ]
- Параллельно
- Многоэтажный
- Полусэндвич-комплекс
- Изогнутый металлоцен или наклонный
- Более двух лигандов Cp
Синтез
[ редактировать ]При образовании соединений такого типа обычно используются три основных пути: [ 8 ]
Использование соли металла и циклопентадиенильных реагентов.
[ редактировать ]Циклопентадиенид натрия (NaCp) является предпочтительным реагентом для реакций такого типа. Его легче всего получить реакцией расплавленного натрия и дициклопентадиена. [ 9 ] Традиционно отправной точкой является крекинг дициклопентадиена , димера циклопентадиена. Циклопентадиен депротонируется сильными основаниями или щелочными металлами.
- MCl 2 + 2 NaC 5 H 5 → (C 5 H 5 ) 2 M + 2 NaCl (M = V, Cr, Mn, Fe, Co; растворитель = ТГФ, ДМЭ NH ,
- CrCl 3 + 3 NaC 5 H 5 → [(C 5 H 5 ) 2 Cr] + 1 ⁄ 2 " С 10 Н 10 " + 3 NaCl
NaCp действует в этой реакции как восстановитель и лиганд.
Использование металла и циклопентадиена
[ редактировать ]Этот метод предусматривает использование атомов металла в газовой фазе, а не в твердом металле. Высокореактивные атомы или молекулы генерируются при высокой температуре в вакууме и соединяются с выбранными реагентами на холодной поверхности.
- М + Ц 5 Ч 6 → МС 5 Ч 5 + 1 ⁄ 2 Ч 2 (М = Li, Na, К)
- М + 2 С 5 Н 6 → [(С 5 Н 5 ) 2 М] + Н 2 (М = Mg, Fe)
Использование циклопентадиенильных реагентов
[ редактировать ]Разработано множество реагентов, переносящих Цп в металлы. Когда-то популярным был циклопентадиенид таллия . Он реагирует с галогенидами металлов с образованием хлорида таллия, который плохо растворим, и циклопентадиенильного комплекса . триалкилолова Производные Cp − также использовались.
Было разработано множество других методов. Хромоцен можно получить из гексакарбонила хрома прямой реакцией с циклопентадиеном в присутствии диэтиламина ; в этом случае за формальным депротонированием циклопентадиена следует восстановление полученных протонов до газообразного водорода , что способствует окислению металлического центра. [ 10 ]
- Cr(CO) 6 + 2 C 5 H 6 → Cr(C 5 H 5 ) 2 + 6 CO + H 2
Металлоцены обычно обладают высокой термической стабильностью. Ферроцен можно сублимировать на воздухе при температуре более 100 ° C без разложения; Металлоцены обычно очищают в лаборатории методом вакуумной сублимации . В промышленности сублимация нецелесообразна, поэтому металлоцены выделяют путем кристаллизации или производят как часть углеводородного раствора. Для металлоценов группы IV донорные растворители, такие как эфир или ТГФ, явно нежелательны для катализа полиолефинов. Зарядно-нейтральные металлоцены растворимы в обычных органических растворителях. Алкильное замещение металлоцена увеличивает растворимость в углеводородных растворителях.
Структура
[ редактировать ]Структурная тенденция серии MCp 2 связана с изменением связей MC, которые удлиняются по мере отклонения числа валентных электронов от 18. [ 11 ]
| М(С 5 Н 5 ) 2 | р М–С (вечером) | Количество валентных электронов |
|---|---|---|
| Фе | 203.3 | 18 |
| Ко | 209.6 | 19 |
| Кр | 215.1 | 16 |
| В | 218.5 | 20 |
| V | 226 | 15 |
В металлоценах типа (C 5 R 5 ) 2 M циклопентадиенильные кольца вращаются с очень низкими барьерами. исследования монокристаллов Рентгеновские обнаруживают как затменные , так и шахматные ротамеры. Для незамещенных металлоценов разница в энергии между шахматной и затменной конформациями составляет всего несколько кДж/моль . Кристаллы ферроцена и осмоцена при низких температурах проявляют затменные конформации, тогда как в родственных бис(пентаметилциклопентадиенильных) комплексах кольца обычно кристаллизуются в шахматном порядке, по-видимому, для минимизации стерических затруднений между метильными группами .
Спектроскопические свойства [ 8 ]
[ редактировать ]Колебательная (инфракрасная и рамановская) спектроскопия металлоценов
[ редактировать ]Инфракрасная и рамановская спектроскопия оказались важными при анализе сэндвич-типов циклических полиенильных металлов, особенно при выяснении ковалентных или ионных связей М-кольца и различении центральных и координированных колец. Некоторые типичные спектральные полосы и отнесение металлоценов группы железа показаны в следующей таблице: [ 8 ]
| Ферроцен (см −1 ) | Рутеноцен (см −1 ) | Осмоцен (см −1 ) | |
|---|---|---|---|
| C – H растяжение | 3085 | 3100 | 3095 |
| C–C растяжение | 1411 | 1413 | 1405 |
| Деформация кольца | 1108 | 1103 | 1096 |
| C – H деформация | 1002 | 1002 | 995 |
| C – H внеплоскостной изгиб | 811 | 806 | 819 |
| Наклон кольца | 492 | 528 | 428 |
| М-кольцо растягивается | 478 | 446 | 353 |
| М-кольцевой изгиб | 170 | 185 | – |
ЯМР ( 1 Рука 13 В) спектроскопия металлоценов
[ редактировать ]Ядерный магнитный резонанс (ЯМР) является наиболее применяемым инструментом при изучении сэндвич-соединений металлов и металлоорганических соединений, дающим информацию о ядерных структурах в растворах, жидкостях, газах и твердом состоянии. 1 Химические сдвиги ЯМР H для парамагнитных соединений переходных металлов обычно наблюдаются в диапазоне от 25 до 40 м.д., но этот диапазон гораздо более узок для диамагнитных металлоценовых комплексов, при этом химические сдвиги обычно наблюдаются в диапазоне от 3 до 7 м.д. [ 8 ]
Масс-спектрометрия металлоценов
[ редактировать ]Масс-спектрометрия металлоценовых комплексов очень хорошо изучена, и влиянию металла на фрагментацию органического фрагмента уделяется значительное внимание, а идентификация металлсодержащих фрагментов часто облегчается по изотопному распределению металла. Три основных фрагмента, наблюдаемые при масс-спектрометрии, представляют собой пик молекулярного иона [C 10 H 10 M]. + и фрагментные ионы, [C 5 H 5 M] + и М + .
Производные
[ редактировать ]После открытия ферроцена интерес исследователей привлек синтез и характеристика производных металлоцена и других сэндвич-соединений.
Металлоценофаны
[ редактировать ]Металлоценофаны характеризуются связыванием циклопентадиенильных или полиаренильных колец путем введения одного или нескольких гетерокольцевых мостиков. Некоторые из этих соединений подвергаются термической полимеризации с раскрытием кольца с образованием растворимых высокомолекулярных полимеров с переходными металлами в основной цепи полимера. Анса-металлоцены представляют собой производные металлоценов с внутримолекулярным мостиком между двумя циклопентадиенильными кольцами.
Полиядерные и гетеробиметаллические металлоцены
[ редактировать ]- Производные ферроцена: биферроценофаны были изучены на предмет их свойств смешанной валентности . При одноэлектронном окислении соединения с двумя и более эквивалентными ферроценовыми фрагментами электронная вакансия может быть локализована на одном ферроценовом звене или полностью делокализована .
- Производные рутеноцена : в твердом состоянии бирутеноцен разупорядочен и принимает трансоидную конформацию с взаимной ориентацией колец Cp, зависящей от межмолекулярных взаимодействий.
- Производные ванадоцена и родоцена : комплексы ванадоцена использовались в качестве исходных материалов для синтеза гетеробиметаллических комплексов. 18 ионов валентных электронов [Cp 2 Rh] + очень стабильны, в отличие от нейтральных мономеров Cp 2 Rh, которые димеризуются сразу при комнатной температуре и наблюдались при матричной изоляции .
Многоярусные сэндвич-комплексы
[ редактировать ]
Трехдекерные комплексы состоят из трех анионов Cp и двух катионов металлов, расположенных в чередующемся порядке. Первый трехэтажный сэндвич-комплекс, [Ни 2 КП 3 ] + было сообщено в 1972 году. [ 12 ] Впоследствии было описано множество примеров, часто с борсодержащими кольцами . [ 13 ]
Ионы металлоцения
[ редактировать ]Самый известный пример — ферроцений . [Fe(C 5 H 5 ) 2 ] + , комплекс синего железа (III), полученный в результате окисления ферроцена оранжевого железа (II). Литоценовый анион, [Li(C 5 H 5 ) 2 ] – , [ 14 ] является наиболее документированным примером металлоценового аниона; в остальном такие ионы малоизвестны.
Приложения
[ редактировать ]Многие производные металлоценов ранних металлов являются активными катализаторами полимеризации олефинов . В отличие от традиционных и до сих пор доминирующих гетерогенных катализаторов Циглера-Натта , металлоценовые катализаторы гомогенны. [ 8 ] Производные ранних металлоценов, например , реактив Теббе , реактив Петасиса и реактив Шварца , полезны в специализированных операциях органического синтеза.
Возможные применения
[ редактировать ]ферроцен/ ферроцений биосенсор Обсуждался для определения уровней глюкозы в образце электрохимически посредством серии связанных окислительно-восстановительных циклов. [ 8 ]
Металлоценовые дигалогениды [Cp 2 MX 2 ] (M = Ti, Mo, Nb) проявляют противоопухолевые свойства, хотя ни один из них не продвинулся далеко в клинических испытаниях. [ 15 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Уилкинсон, Г .; Розенблюм, М.; Уайтинг, MC; Вудворд, РБ (1952). «Структура бис-циклопентадиенила железа». Дж. Ам. хим. Соц. 74 (8): 2125–2126. дои : 10.1021/ja01128a527 .
- ^ Jump up to: а б Кили, Ти Джей; Паусон, Польша (1951). «Новый тип железоорганических соединений». Природа . 168 (4285): 1039. Бибкод : 1951Natur.168.1039K . дои : 10.1038/1681039b0 . S2CID 4181383 .
- ^ Jump up to: а б Миллер, ЮАР; Теббот, Дж.А.; Тремейн, Дж. Ф. (1952). «114. Дициклопентадиенилирон». Дж. Хим. Соц. 1952 : 632–635. дои : 10.1039/JR9520000632 .
- ^ Фишер, EO ; Пфаб, В. (1952). «О кристаллическом строении дициклопентадиенильных соединений двухвалентного железа, кобальта и никеля » . З. естествоиспытатель. Б. 7 (7): 377–379. дои : 10.1515/znb-1952-0701 .
- ^ Чирик, Пол Дж. (2010). «Сэндвич-комплексы переходных металлов группы 4: все еще свежи спустя почти 60 лет». Металлоорганические соединения . 29 (7): 1500–1517. дои : 10.1021/om100016p .
- ^ . АРАПАХО КЕМИКАЛС, ИНК (11 ноября 1962 г.). «Арапахо Кемикалс, Инк». Аналитическая химия . 34 (12): 122А. дои : 10.1021/ac60192a828 . ISSN 0003-2700 .
- ^ Бреннан, Дж.Г.; Андерсен, РА; Залкин, А. (1986). «Химия металлоценов трехвалентного урана: Реакции переноса электрона. Синтез и характеристика [(MeC 5 H 4 ) 3 U] 2 E (E= S, Se, Te) и кристаллических структур гексакис(метилциклопентадиенил)сульфидодиурана и трис( метилциклопентадиенил)(трифенилфосфиноксид)уран». Неорг. хим. 25 (11): 1761–1765. дои : 10.1021/ic00231a008 .
- ^ Jump up to: а б с д и ж г час Лонг, Нью-Джерси (1998). Металлоцены: введение в сэндвич-комплексы . Лондон: Уайли-Блэквелл . ISBN 978-0632041626 .
- ^ Панда, ТК; Геймер, Монтана; Роски, PW (2003). «Улучшенный синтез циклопентадиенида натрия и калия». Металлоорганические соединения . 22 (4): 877. doi : 10.1021/om0207865 .
- ^ Фишер, Э.О .; Хафнер, В. (1955). «Циклопентадиенил-хром-трикарбонил-Вассерстофф» [трикарбонилгидрид циклопентадиенилхрома]. З. Натурфорш. Б (на немецком языке). 10 (3): 140–143. дои : 10.1515/znb-1955-0303 . S2CID 209650632 .
- ^ Цветок, КР; Хичкок, П.Б. (1996). «Кристаллическая и молекулярная структура хромоцена ( η 5 -C 5 H 5 ) 2 Cr". J. Organomet. Chem. 507 (1–2): 275–277. doi : 10.1016/0022-328X(95)05747-D . Обсуждаются все металлоценовые структуры, доступные на тот момент.
- ^ Вернер, Гельмут; Зальцер, Альбрехт (1 января 1972 г.). «Синтез первого двойного сэндвич-комплекса: трициклопентадиенильный катион диникеля». Синтез и реакционная способность в неорганической и металлоорганической химии . 2 (3): 239–248. дои : 10.1080/00945717208069606 . ISSN 0094-5714 .
- ^ Граймс, Р.Н. (2004). «Кластеры бора достигают совершеннолетия» . Дж. Хим. Образование. 81 (5): 657–672. Бибкод : 2004ЖЧЭд..81..657Г . дои : 10.1021/ed081p657 .
- ^ Хардер, Сьерд; Просенк, Марк Генрих (16 сентября 1994 г.). «Простейший металлоценовый сэндвич: литоценовый анион». Angewandte Chemie International Edition на английском языке . 33 (17): 1744–1746. дои : 10.1002/anie.199417441 .
- ^ Куо, Л.Ю.; Канацидис, М.Г.; Сабат, М.; Маркс, Ти Джей; Маркс, Тобин Дж. (1991). «Металлоценовые противоопухолевые средства. Химия координации молибденоцена в растворе и твердом состоянии компонентов ДНК». Дж. Ам. хим. Соц. 113 (24): 9027–9045. дои : 10.1021/ja00024a002 .
Дополнительные ссылки
[ редактировать ]- Зальцер, А. (1999). «Номенклатура металлоорганических соединений переходных элементов» . Чистое приложение. хим. 71 (8): 1557–1585. дои : 10.1351/pac199971081557 . S2CID 14367196 .
- Крэбтри, Роберт Х. (2005). Металлоорганическая химия переходных металлов (4-е изд.). Уайли-Интерсайенс. ISBN 0470257628
- Мисслер, Гэри Л.; Тарр, Дональд А. (2004). Неорганическая химия . Река Аппер-Седл, Нью-Джерси: Pearson Education. ISBN 978-0-13-035471-6 .
- Коттон, Флорида ; Уилкинсон, Г. (1988). Неорганическая химия (5-е изд.). Уайли. стр. 626–7. [ ISBN отсутствует ]
- Тони, А.; Халтерман, Р.Л. (1998). Металлоцены . Вайли-ВЧ. [ ISBN отсутствует ]