Анилин
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Анилин [1] | |||
| Систематическое название ИЮПАК Бензенамин | |||
| Другие имена Фениламин Аминобензол Бензамин | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 3DMeet | |||
| 605631 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.000.491 | ||
| Номер ЕС |
| ||
| 2796 | |||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ |
| ||
| Число | 1547 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 6 Н 5 NH 2 | |||
| Молярная масса | 93.129 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Плотность | 1,0297 г/мл | ||
| Температура плавления | -6,30 ° C (20,66 ° F; 266,85 К) | ||
| Точка кипения | 184,13 ° С (363,43 ° F; 457,28 К) | ||
| 3,6 г/(100 мл) при 20 °C | |||
| Давление пара | 0,6 мм рт.ст. (20 °С) [2] | ||
| Кислотность ( pKa ) |
| ||
| −62.95·10 −6 см 3 /моль | |||
Показатель преломления ( n D ) | 1.58364 | ||
| Вязкость | 3,71 сП (3,71 мПа·с при 25 °C) | ||
| Термохимия | |||
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | −3394 кДж/моль | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | потенциальный профессиональный канцероген | ||
| СГС Маркировка : | |||
     | |||
| Опасность | |||
| Х301 , Х311 , Х317 , Х318 , Х331 , Х341 , Х351 , Х372 , Х400 | |||
| P201 , P202 , P260 , P261 , P264 , P270 , P271 , P272 , P273 , P280 , P281 , P301+P310 , P302+P352 , P304+P340 , P305+P351+P338 , P308+P31 3 , П310 , П311 , П312 , P314 , P321 , P322 , P330 , P333+P313 , P361 , P363 , P391 , P403+P233 , P405 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 70 ° C (158 ° F; 343 К) | ||
| 770 ° C (1420 ° F; 1040 К) | |||
| Взрывоопасные пределы | 1.3–11% [2] | ||
| Летальная доза или концентрация (LD, LC): | |||
LD Lo ( самый низкий опубликованный ) | 195 мг/кг (собаки, перорально) 250 мг/кг (крыса, перорально) 464 мг/кг (мышь, перорально) 440 мг/кг (крыса, перорально) 400 мг/кг (морская свинка, перорально) [4] | ||
ЛК 50 ( средняя концентрация ) | 175 частей на миллион (мышь, 7 ч) [4] | ||
LC Lo ( самый низкий из опубликованных ) | 250 частей на миллион (крыса, 4 ч) 180 частей на миллион (кошка, 8 ч) [4] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | СВВ 5 частей на миллион (19 мг/м 3 ) [кожа] [2] | ||
РЕЛ (рекомендуется) | Ca [потенциальный профессиональный канцероген] [2] | ||
IDLH (Непосредственная опасность) | 100 частей на миллион [2] | ||
| Родственные соединения | |||
Родственные ароматические амины | 1-нафтиламин 2-нафтиламин | ||
Родственные соединения | Фенилгидразин Нитрозобензол Нитробензол | ||
| Страница дополнительных данных | |||
| Анилин (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Анилин (от португальского anil «кустарник индиго» и -ine , обозначающего производное вещество) [6] представляет собой соединение формулы органическое С 6 Н 5 NH 2 . Состоит из фенильной группы ( -C 6 H 5 ), присоединенный к аминогруппе ( −NH 2 ), анилин — простейший ароматический амин . Это промышленно значимое химическое вещество , а также универсальный исходный материал для тонкого химического синтеза. Его основное применение — производство прекурсоров полиуретана , красителей и других промышленных химикатов. Как и большинство летучих аминов, он имеет запах тухлой рыбы . Он легко воспламеняется , горя дымным пламенем, свойственным ароматическим соединениям. [7] Он токсичен для человека.
По сравнению с бензолом он богат электронами. Таким образом, он быстрее участвует в реакциях электрофильного ароматического замещения . Кроме того, он также склонен к окислению : хотя свежеочищенный анилин представляет собой почти бесцветное масло, воздействие воздуха приводит к постепенному потемнению до желтого или красного цвета из-за образования сильно окрашенных окисленных примесей. Анилин можно диазотировать с образованием соли диазония , которая затем может подвергаться различным реакциям нуклеофильного замещения.
Как и другие амины, анилин является одновременно основанием (p K aH = 4,6) и нуклеофилом , хотя и в меньшей степени, чем структурно сходные алифатические амины.
Поскольку ранним источником бензола, из которого они получены, была каменноугольная смола , анилиновые красители также называют красителями каменноугольной смолы .
Структура
[ редактировать ]
Расстояния Арил-Н
[ редактировать ]В анилине длина связи C-N составляет 1,41 Å , [8] по сравнению с длиной связи C-N 1,47 Å для циклогексиламина , [9] что указывает на частичную π-связь между C(арилом) и N. [10] Длина химической связи C( арил )-NH 2 в анилинах весьма чувствителен к эффектам заместителей . Длина связи C-N составляет 1,34 Å в 2,4,6-тринитроанилине против 1,44 Å в 3-метиланилине . [11]
Пирамидализация
[ редактировать ]Аминная группа в анилинах представляет собой слегка пирамидальную молекулу с гибридизацией азота где-то между sp 3 и сп 2 . Азот описывается как имеющий высокий p-характер. Аминогруппа в анилине более плоская (т.е. представляет собой «более мелкую пирамиду»), чем в алифатическом амине, из-за сопряжения неподеленной пары с арильным заместителем. Наблюдаемая геометрия отражает компромисс между двумя конкурирующими факторами: 1) стабилизация неподеленной N-пары на орбитали со значительным s-характером благоприятствует пирамидализации (орбитали с s-характером имеют меньшую энергию), а 2) делокализация неподеленной N-пары в арильное кольцо предпочитает планарность (неподеленная пара на чистой p-орбитали дает лучшее перекрытие с орбиталями π-системы бензольного кольца). [12] [13]
В соответствии с этими факторами замещенные анилины с электронодонорными группами более пирамидальны, тогда как анилины с электроноакцепторными группами более плоские. В исходном анилине неподеленная пара составляет примерно 12% s-символа, что соответствует sp 7.3 гибридизация. [12] [ нужны разъяснения ] (Для сравнения: алкиламины обычно имеют неподеленные пары на орбиталях, близких к sp 3 .)
Угол пирамидализации между связью C–N и биссектрисой угла H–N–H составляет 142,5°. [14] Для сравнения, у более сильно пирамидальной аминной группы в метиламине эта величина составляет ~125°, тогда как у аминной группы в формамиде угол составляет 180°.
Производство
[ редактировать ]Промышленное производство анилина включает два этапа. Сначала бензол нитруют при температуре от концентрированной смесью азотной и серной кислот 50 до 60 °C с получением нитробензола . Затем нитробензол гидрируют (обычно при 200–300 ° C) в присутствии металлических катализаторов : [15] Ежегодно производится около 4 млрд кг. [16]
Восстановление нитробензола до анилина впервые осуществил Николай Зинин в 1842 году с помощью сульфидных солей ( реакция Зинина ). Восстановление нитробензола до анилина было также выполнено в рамках восстановления Антуаном Бешаном в 1854 году с использованием железа в качестве восстановителя ( восстановление Бешана ). Эти стехиометрические пути остаются полезными для специальных анилинов. [17]
Альтернативно анилин можно получить из аммиака и фенола, полученных кумоловым способом . [7]
В торговле различают три марки анилина: анилиновое масло для синего, представляющее собой чистый анилин; анилиновое масло красного цвета, смесь эквимолекулярных количеств анилина и орто- и пара-толуидинов ; и анилиновое масло для сафранина , которое содержит анилин и ортотолуидин и получается из дистиллята (échappés) плавленного фуксина . [18]
Родственные производные анилина
[ редактировать ]множество аналогов и производных Известно анилина, в которых фенильная группа дополнительно замещена. К ним относятся толуидины , ксилидины , хлоранилины , аминобензойные кислоты , нитроанилины и многие другие. Их также обычно получают нитрованием замещенных ароматических соединений с последующим восстановлением. Например, этот подход используется для превращения толуола в толуидины и хлорбензола в 4-хлоранилин . [7] Альтернативно, используя подходы сочетания Бухвальда-Хартвига или реакции Ульмана, арилгалогениды можно аминировать водным или газообразным аммиаком. [19]
Реакции
[ редактировать ]Химический состав анилина богат, поскольку это соединение уже много лет доступно по низкой цене. Ниже приведены некоторые классы его реакций.
Окисление
[ редактировать ]
Окисление анилина было тщательно исследовано и может приводить к реакциям, локализованным у азота, или, что чаще всего, к образованию новых связей CN. В щелочном растворе образуется азобензол , а мышьяковая кислота образует вещество фиолетового цвета — виоланилин. Хромовая кислота превращает его в хинон , тогда как хлораты в присутствии некоторых солей металлов (особенно ванадия ) дают анилиновую чернь . Соляная кислота и хлорат калия дают хлоранил . Перманганат калия в нейтральном растворе окисляет его до нитробензола ; в щелочном растворе к азобензолу , аммиаку и щавелевой кислоте ; в растворе кислоты до анилиновой черной. Хлорноватистая кислота дает 4-аминофенол парааминодифениламин и . [18] Окисление персульфатом дает различные полианилины . Эти полимеры обладают богатыми окислительно-восстановительными и кислотно-основными свойствами.

Электрофильные реакции в орто- и пара-положениях
[ редактировать ]Подобно фенолам , производные анилина весьма восприимчивы к реакциям электрофильного замещения . Его высокая реакционная способность отражает то, что это енамин , который усиливает электронодонорную способность кольца. Например, реакция анилина с серной кислотой при 180°С дает сульфаниловую кислоту . H 2 NC 6 H 4 SO 3 H .
При добавлении бромной воды к анилину бромная вода обесцвечивается и белый осадок 2,4,6 -триброманилина образуется . Для получения монозамещенного продукта необходима защита ацетилхлоридом:
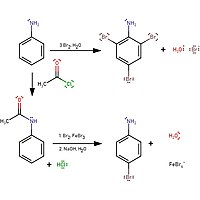
Реакция образования 4-броманилина заключается в защите амина с помощью ацетилхлорида, а затем обратном гидролизе с образованием анилина.
Крупнейшая промышленная реакция анилина включает его алкилирование формальдегидом . Показано идеализированное уравнение:
- 2 C 6 H 5 NH 2 + CH 2 O → CH 2 (C 6 H 4 NH 2 ) 2 + H 2 O
Полученный диамин является предшественником 4,4'-МДИ и родственных диизоцианатов.
Реакции на азот
[ редактировать ]Основность
[ редактировать ]Анилин является слабым основанием . Ароматические амины , такие как анилин, обычно являются гораздо более слабыми основаниями, чем алифатические амины. Анилин реагирует с сильными кислотами с образованием иона анилиния (или фениламмония) ( С 6 ЧАС 5 -NH + 3 ). [20]
Традиционно слабую основность анилина объясняют сочетанием индуктивного эффекта более электроотрицательных sp. 2 углеродный и резонансный эффекты, поскольку неподеленная пара азота частично делокализована в пи-систему бензольного кольца. (см. картинку ниже):

В таком анализе отсутствует учет сольватации . Анилин, например, более щелочной, чем аммиак в газовой фазе, но в десять тысяч раз менее щелочной в водном растворе. [21]
Ацилирование
[ редактировать ]Анилин реагирует с ацилхлоридами, такими как ацетилхлорид, с образованием амидов . Амиды, образующиеся из анилина, иногда называют анилидами , например CH 3 -C(=O)-NH-C 6 H 5 представляет собой ацетанилид . При высоких температурах анилин и карбоновые кислоты реагируют с образованием анилидов. [22]
N -Алкилирование
[ редактировать ]N -Метилирование анилина метанолом при повышенных температурах над кислотными катализаторами дает N -метиланилин и N , N -диметиланилин :
- C 6 H 5 NH 2 + 2 CH 3 OH → C 6 H 5 N(CH 3 ) 2 + 2H 2 O
N -Метиланилин и N , N -диметиланилин — бесцветные жидкости с температурами кипения 193–195 °С и 192 °С соответственно. Эти производные имеют важное значение в цветной промышленности.
Производные сероуглерода
[ редактировать ]При кипячении с сероуглеродом получается сульфокарбанилид (дифенилтиомочевина ) ( S=C(-NH-C 6 H 5 ) 2 ), который может разлагаться до фенилизотиоцианата ( C 6 H 5 -N=C=S ) и трифенилгуанидин ( C 6 ЧАС 5 -N=C(-NH-C 6 ЧАС 5 ) 2 ). [18]
Диазотирование
[ редактировать ]Анилин и его замещенные по кольцу производные реагируют с азотистой кислотой с образованием солей диазония . Одним из примеров является тетрафторборат бензолдиазония . Через эти промежуточные соединения аминогруппа может быть преобразована в гидроксил ( −OH ), цианид ( −CN ), или галогенидная группа ( −X , где X – галоген ) посредством реакций Зандмейера . Эта соль диазония также может вступать в реакцию с NaNO 2 и фенол для получения красителя , известного как бензолазофенол , в процессе, называемом сочетанием .Реакция превращения первичного ароматического амина в соль диазония называется диазотированием.В этой реакции первичный ароматический амин вступает в реакцию с нитритом натрия и 2 молями HCl , которая известна как «ледяная смесь», поскольку температура реакции составляла всего 0,5 °C. Бензол-диазониевая соль образуется в качестве основного продукта наряду с побочными продуктами - водой и хлоридом натрия .
Другие реакции
[ редактировать ]Он реагирует с нитробензолом с образованием феназина в реакции Воля-Ауэ . Гидрирование дает циклогексиламин .
Будучи стандартным реагентом в лабораториях, анилин используется во многих нишевых реакциях. Его ацетат используется в анилинацетатном тесте на углеводы, определяя пентозы путем преобразования в фурфурол . Он используется для окрашивания нейронной РНК в синий цвет при окраске по Нисслю . [ нужна ссылка ]
Кроме того, анилин является исходным компонентом при производстве диглицидиланилина . [23] Эпихлоргидрин является другим основным ингредиентом. [23] [24]
Использование
[ редактировать ]Анилин преимущественно используется для получения метилендианилина и родственных соединений конденсацией с формальдегидом. Диамины конденсируются с фосгеном с образованием метилендифенилдиизоцианата , предшественника уретановых полимеров. [7]

Большая часть анилина потребляется при производстве метилендианилина , предшественника полиуретанов.
Другие области применения включают резины химикаты для переработки (9%), гербициды (2%), а также красители и пигменты (2%). [25] В качестве добавок к каучуку производные анилина, такие как фенилендиамины и дифениламин , являются антиоксидантами. Показательными препаратами, приготовленными из анилина, является парацетамол (ацетаминофен, тайленол ). Анилин в основном используется в красильной промышленности как предшественник индиго , синего цвета синих джинсов . [7]

Анилиновое масло также используется для идентификации грибов.Agaricus of North America P45 Керриган, 2016 г.: (Ссылаясь на реакцию Шаффера) «На самом деле я рекомендую перейти к следующему модифицированному тесту. Франк (1988) разработал альтернативную формулу, в которой анилиновое масло сочетается с ледяной уксусной кислотой (GAA, по сути, дистиллированный уксус). ) в растворе 50:50. GAA является гораздо более безопасной и менее реакционноспособной кислотой. Этот отдельный комбинированный реагент относительно стабилен во времени. По моему опыту, новый состав работает. так же, как и у Шаффера, но при этом он безопаснее и удобнее». [26]
История
[ редактировать ]Анилин был впервые выделен в 1826 году Унвердорбеном путем деструктивной перегонки индиго Отто . [27] Он назвал его Кристаллином . В 1834 году Фридлиб Рунге вещество выделил из каменноугольной смолы приобретало красивый синий цвет , которое при обработке хлорной известью . Он назвал его кианол или цианол . [28] В 1840 году Карл Юлиус Фриче (1808–1871) обработал индиго едким поташем и получил масло, которое он назвал анилин , в честь растения, дающего индиго, анила ( Indigofera suffruticosa ). [29] [30] В 1842 году Николай Николаевич Зинин восстановил нитробензол и получил основание, которое назвал бензидамом . [31] В 1843 году Август Вильгельм фон Гофман показал, что это все одно и то же вещество, известное впоследствии как фениламин или анилин . [32]
Производство синтетических красителей
[ редактировать ]В 1856 году, пытаясь синтезировать хинин , фон Гофмана ученик Уильям Генри Перкин открыл мовеин . Мовен быстро стал коммерческим красителем. Затем последовали другие синтетические красители, такие как фуксин , сафранин и индилин . На момент открытия мовена анилин был дорогим. Вскоре после этого, применив метод, описанный в 1854 году Антуаном Бешаном , [33] его готовили «тоннами». [34] способствовало Сокращение производства в Бешане развитию крупной красильной промышленности в Германии. Сегодня название BASF , первоначально Badische Anilin- und Soda-Fabrik (англ. Baden Aniline and Soda Factory), ныне крупнейшего поставщика химической продукции, перекликается с наследием индустрии синтетических красителей, построенной на анилиновых красителях и расширенной за счет родственных азокрасителей. красители . Первым азокрасителем был анилиновый желтый . [35]
Развитие медицины
[ редактировать ]В конце 19-го века производные анилина, такие как ацетанилид и фенацетин, появились в качестве обезболивающих препаратов, а их побочные эффекты, подавляющие деятельность сердца, часто компенсировались кофеином . [36] В течение первого десятилетия 20-го века, пытаясь модифицировать синтетические красители для лечения африканской сонной болезни , Пауль Эрлих , который придумал термин «химиотерапия» своего волшебного подхода к медицине, потерпел неудачу и переключился на модификацию Бешана атоксила для , первого органический препарат мышьяка и по счастливой случайности получил лекарство от сифилиса — сальварсан — первый успешный химиотерапевтический агент. Целевой микроорганизм Сальварсана , еще не признанный бактерией, все еще считался паразитом, и медицинские бактериологи, полагая, что бактерии невосприимчивы к химиотерапевтическому подходу, проигнорировали отчет Александра Флеминга 1928 года о воздействии пенициллина . [37]
В 1932 году компания Bayer начала искать применение своих красителей в медицинских целях. Герхард Домагк идентифицировал как антибактериальное средство красный азокраситель, представленный в 1935 году как первый антибактериальный препарат, пронтозил , который вскоре был обнаружен в Институте Пастера как пролекарство , разлагающееся in vivo до сульфаниламида – бесцветного промежуточного продукта для многих очень стойких к цвету азокрасителей – уже с патент с истекшим сроком действия, синтезированный в 1908 году в Вене исследователем Паулем Гельмо для его докторского исследования. [37] К 1940-м годам более 500 родственных сульфаниламидных препаратов . было произведено [37] Лекарства, пользовавшиеся большим спросом во время Второй мировой войны (1939–1945 гг.), эти первые чудодейственные лекарства , химиотерапия широкой эффективности, дали толчок развитию американской фармацевтической промышленности. [38] В 1939 году в Оксфордском университете в поисках альтернативы сульфаниламидным препаратам Говард Флори разработал пенициллин Флеминга и превратил его в первый системный антибиотик – пенициллин G. ( Грамицидин , разработанный Рене Дюбо в Институте Рокфеллера в 1939 году, был первым антибиотиком, однако его токсичность ограничивала его местное применение.) После Второй мировой войны Корнелиус П. Роудс представил химиотерапевтический подход к лечению рака. [39]
Ракетное топливо
[ редактировать ]Некоторые ранние американские ракеты, такие как Aerobee и WAC Corporal смесь анилина и фурфурилового спирта , использовали в качестве топлива с азотной кислотой в качестве окислителя. Комбинация является гиперголической и воспламеняется при контакте топлива и окислителя. Он также плотный и может храниться в течение длительного времени. Позднее анилин был заменен гидразином . [40]
Токсикология и тестирование
[ редактировать ]Анилин токсичен при вдыхании паров, проглатывании или чрескожном всасывании. [41] [42] МАИР ( относит его к Группе 2А вероятно канцерогенно для человека ), и оно конкретно связано с раком мочевого пузыря. [43] Анилин считается одной из возможных причин вымирания лесов . [44]
Существует множество методов обнаружения анилина. [45]
Окислительное повреждение ДНК
[ редактировать ]Воздействие анилина на крыс может вызвать токсичную для селезенки реакцию , включая онкогенную реакцию. [46] У крыс, подвергшихся воздействию анилина в питьевой воде, наблюдалось значительное увеличение окислительного повреждения ДНК селезенки, что определялось как 2,8-кратное увеличение содержания 8-гидрокси-2'-дезоксигуанозина (8-OHdG) в их ДНК . [46] Хотя путь эксцизионной репарации оснований также был активирован, его активности было недостаточно для предотвращения накопления 8-OHdG. Накопление окислительных повреждений ДНК в селезенке после воздействия анилина может усилить мутагенные явления, лежащие в основе онкогенеза.
Примечания
[ редактировать ]- ^ Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. 416, 668. doi : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
Анилин, обозначающий C 6 H 5 -NH 2 , является единственным названием первичного амина, сохранившимся в качестве предпочтительного названия IUPAC, для которого разрешено полное замещение в кольце и атоме азота. Это сохраненное название типа 2а; правила замены см. в П-15.1.8.2. Замещение ограничивается группами заместителей, указанными в качестве префиксов в соответствии со старшинством функциональных групп, явно выраженным или подразумеваемым в названии функционального исходного соединения. Название бензонамин может использоваться в общей номенклатуре.
- ^ Jump up to: а б с д и Карманный справочник NIOSH по химическим опасностям. «#0033» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Воллхардт, П.; Шор, Нил (2018). Органическая химия (8-е изд.). У. Х. Фриман. п. 1031. ИСБН 9781319079451 .
- ^ Jump up to: а б с «Анилин» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Анилин» . www.cameochemicals.noaa.gov . Управление реагирования и восстановления НОАА США . Проверено 16 июня 2016 г.
- ^ «анилин | Этимология, происхождение и значение анилина по этимонлину» . www.etymonline.com . Проверено 15 февраля 2022 г.
- ^ Jump up to: а б с д и Каль, Томас; Шредер, К.В.; Лоуренс, Франция; Элверс, Барбара; Хёке, Хартмут; Пфефферкорн, Р.; Маршалл, WJ (2007). «Анилин». В Ульманне, Фриц (ред.). Энциклопедия промышленной химии Ульмана . Уайли: Нью-Йорк. дои : 10.1002/14356007.a02_303 . ISBN 978-3-527-20138-9 . ОСЛК 11469727 .
- ^ Чжан, Хуайюй; Цзян, Сяоюй; Ву, Вэй; Мо, Йиронг (28 апреля 2016 г.). «Сопряжение электронов против π-π-отталкивания в замещенных бензолах: почему связь углерод-азот в нитробензоле длиннее, чем в анилине» . Физическая химия Химическая физика . 18 (17): 11821–11828. Бибкод : 2016PCCP...1811821Z . дои : 10.1039/c6cp00471g . ISSN 1463-9084 . ПМИД 26852720 .
- ^ Рачиньска, Ева Д.; Холлман, Маргарет; Кольчинская, Катажина; Стемпневский, Томаш М. (12 июля 2010 г.). «О модели гармонического осциллятора индекса делокализации электронов (HOMED) и ее применении к гетероатомным π-электронным системам» . Симметрия . 2 (3): 1485–1509. Бибкод : 2010Symm....2.1485R . дои : 10.3390/sym2031485 . ISSN 2073-8994 .
- ^ Г. М. Войчик «Структурная химия анилинов» в анилинах (Химия функциональных групп Патаи), С. Патай, Эд. 2007, Wiley-VCH, Вайнхайм. два : 10.1002/9780470682531.pat0385 .
- ^ Соррисо, С. (1982). «Структурная химия». Амино-, нитроско- и нитросоединения и их производные: Vol. 1 (1982) . стр. 1–51. дои : 10.1002/9780470771662.ch1 . ISBN 9780470771662 .
- ^ Jump up to: а б Алабугин, Игорь В. (2016). Стереоэлектронные эффекты: мост между структурой и реактивностью . Чичестер, Великобритания. ISBN 978-1-118-90637-8 . OCLC 957525299 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Алабугин IV; Манохаран, М.; Бак, М.; Кларк, Р.Дж. Замещенные анилины: перетягивание каната между пирамидализацией и резонансом внутри и снаружи кристаллических полостей. ТЕОХИМ, 2007, 813, 21-27. http://dx.doi.org/10.1016/j.theochem.2007.02.016 .
- ^ Кэри, Фрэнсис А. (2008). Органическая химия (7-е изд.). Бостон: Высшее образование Макгроу-Хилла. ISBN 9780073047874 . OCLC 71790138 .
- ^ US3136818A , Генрих, Спербер; Гюнтер, Полер и Иоахим, Пистор Ханс и др., «Производство анилина», выпущено 9 июня 1964 г.
- ^ Вестерхаус, Феликс А.; Джагадиш, Радженахалли В.; Винхёфер, Геррит; Пол, Марга Мартина; Радник, Йорг; Суркус, Аннет-Энрика; Рабеа, Джабор; Боже, Кэтрин; Боже, Хенрик; Нильсен, Мартин; Брюкнер, Анжелика; Беллер, Матиас (2013). «Гетерогенизированные катализаторы на основе оксида кобальта для восстановления нитроарена пиролизом молекулярно определенных комплексов». Природная химия . 5 (6): 537–543. Бибкод : 2013NatCh...5..537W . дои : 10.1038/nchem.1645 . ПМИД 23695637 . S2CID 3273484 .
- ^ Портер, Гонконг (2011), «Восстановление нитроаренов зинином» , Organic Reactions , John Wiley & Sons, Ltd, стр. 455–481, doi : 10.1002/0471264180.or020.04 , ISBN 978-0-471-26418-7 , получено 1 февраля 2022 г.
- ^ Jump up to: а б с Чисхолм 1911 , с. 48.
- ^ «Синтез анилина аминированием (арилированием)» .
- ^ Макмерри, Джон Э. (1992), Органическая химия (3-е изд.), Бельмонт: Уодсворт, ISBN 0-534-16218-5
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Карл Н. Уэбб (1941). «Бензанилид» . Органические синтезы ; Сборник томов , т. 1, с. 82 .
- ^ Jump up to: а б Панда, доктор Х. (2019). Справочник по технологиям эпоксидных смол (процесс производства, синтез, клеи на основе эпоксидных смол и эпоксидные покрытия (2-е изд.). Asia Pacific Business Press Inc., стр. 38. ISBN 978-8178331829 .
- ^ Юнг, У Хёк; Ха, Ын-Джу; Чанг, Иль ду; Ли, Чан-У (01 августа 2008 г.). «Синтез азополимеров на основе анилина для рельефных решеток» . Макромолекулярные исследования . 16 (6): 532–538. дои : 10.1007/BF03218555 . ISSN 2092-7673 . S2CID 94372490 .
- ^ «Анилин» . Репортер химического рынка. Архивировано из оригинала 19 февраля 2002 г. Проверено 21 декабря 2007 г.
- ^ Керриган, Ричард (2016). Агарикус Северной Америки. Нью-Йорк Пресс. п. 45. ISBN 978-0-89327-536-5.
- ^ Отто Унвердорбен (1826 г.). «О поведении органических веществ при высоких температурах» . Анналы физики и химии . 8 (11): 397–410. Бибкод : 1826АнП....84..397У . дои : 10.1002/andp.18260841109 .
- ^ Ф. Ф. Рунге (1834) «О некоторых продуктах перегонки угля», Анналы физики и химии , 31 : 65–77 (см. стр. 65), 513–524 ; и 32 : 308–332 (см. стр. 331).
- ^ Дж. Фриче (1840) «Ueber das Anilin, ein neues Zersetzungsproduct des Indigo» (Об анилине, новом продукте разложения индиго), Научный вестник [изданный Императорской академией наук Санкт-Петербурга], 7 (12): 161–165. Перепечатано в:
- Дж. Фриче (1840) «Об анилине, новом продукте разложения индиго», Юстус Либигс Анналы химии , 36 (1): 84–90.
- Дж. Фриче (1840) «Об анилине, новом продукте распада индиго » , Журнал практической химии , 20 : 453–457. В приписке к этой статье Эрдманн (один из редакторов журнала) утверждает, что анилин и «кристаллин», открытый Унвердорбеном в 1826 году, — одно и то же вещество; см . стр. 457–459 .
- ^ синоним I anil , в конечном итоге от санскритского «nīla», темно-синий.
- ^ Н. Зинин (1842). «Описание некоторых новых органических оснований, полученных действием сероводорода на соединения углеводородов и гипоазотной кислоты [H 2 N 2 O 3 ]), Bulletin Scientifique [publié par l'Académie Impériale des Sciences de Saint-Petersbourg], 10 (18): 272–285. Перепечатано в: Н. Зинин (1842) «Описание некоторых новых органических оснований, выражающихся в действии сероводорода на соединения углеводородов с гипоазотной кислотой» , Журнал практической химии , 27 (1): 140–153. Бензидам назван на странице 150.Фриче, коллега Зинина, вскоре понял, что «бензидам» на самом деле представляет собой анилин. См.: Fritzsche (1842) Bulletin Scientifique , 10 : 352. Перепечатано как приписка к статье Зинина в: J. Fritzsche (1842) « Комментарий к предыдущей статье г-на Зинина», Журнал практической химии , 27 (1): 153.
См. также: (Анон.) (1842) «Органические солевые основания, происходящие из нитронафталина и нитробензола через сероводород» , Annals of Chemistry and Pharmacie , 44 : 283–287. - ^ Август Вильгельм Хофманн (1843) «Химическое исследование органических оснований в каменноугольном масле» , Annals of Chemistry and Pharmacie , 47 : 37–87. На странице 48 Хофманн утверждает, что кристаллин, кианол, бензидам и анилин идентичны.
- ^ А. Бешан (1854) «De l'action des protosels defer sur la нитронафталин и нитробензин. Новый метод образования оснований органических искусственных веществ де Зинина» (О действии протосолей железа на нитронафталин и нитробензол. Новый метод образования Синтетические органические основания Зинина.), Annales de Chemie et de Physique , 3rd series, 42 : 186–196. (Примечание: в случае металла, имеющего два или более различных оксидов (например, железа), «протосоль» представляет собой устаревший термин для соли, получаемой из оксида, содержащего наименьшее соотношение кислорода к металлу, например, в случае железа, имеющего два оксида – оксид железа (II) (FeO) и оксид железа (III) (Fe 2); O 3 ) – FeO – это «закись», из которой можно получить протосоль. См.: Викисловарь: протосоль .)
- ^ Перкин, Уильям Генри. 08.06.1861. «Труды химических обществ: Химическое общество, четверг, 16 мая 1861 г.» . Химические новости и журнал промышленной науки . Проверено 24 сентября 2007 г.
- ^ Ауэрбах Г., «Азо- и нафтоловые красители», Текстильный колорист , май 1880 г.; 2 (17): 137-9, стр. 138 .
- ^ Уилкокс Р.В., «Лечение гриппа у взрослых», Medical News , 15 декабря 1900 г.; 77 ():931-2, стр. 932 .
- ^ Jump up to: а б с DJ Th Wagener, История онкологии (Houten: Springer, 2009), стр. 150–1 .
- ^ Джон Э. Леш, Первые чудодейственные лекарства: как сульфаниламидные препараты изменили медицину (Нью-Йорк: Oxford University Press, 2007), стр. 202–3 .
- ^ «Медицина: военные трофеи» . Время . 15 мая 1950 года. Архивировано из оригинала 24 июня 2013 года . Проверено 20 ноября 2020 г.
- ^ Брайан Бернелл. 2016. http://www.nuclear-weapons.info/cde.htm#Corporal SSM.
- ^ Мьюир, Г.Д. (ред.) 1971, Опасности в химической лаборатории , Королевский институт химии, Лондон.
- ^ Индекс Merck . 10-е изд. (1983), стр.96, Рэуэй: Merck & Co.
- ^ (2011 , Тошия , , Такудзи , Кодзи ; Кацухито Миядзава Танака . ; Куно )
- ^ Краль-Урбан, Б., Папке, Х.Э., Петерс, К. (1988) Упадок лесов: исследование причинно-следственных связей в Соединенных Штатах Северной Америки и Федеративной Республике Германии . Германия: Группа оценки биологии, экологии и энергетики Юлихского центра ядерных исследований.
- ^ Базовая аналитическая токсикология (1995), Р. Дж. Фланаган, С. С. Браун, Ф. А. де Вольф, Р. А. Брейтуэйт, Б. Виддоп: Всемирная организация здравоохранения
- ^ Jump up to: а б Ма, Хуасянь; Ван, Цзяньлин; Абдель-Рахман, Шериф З.; Бур, Пол Дж.; Хан, М. Фирозе (2008). «Окислительное повреждение ДНК и его восстановление в селезенке крыс после субхронического воздействия анилина» . Токсикология и прикладная фармакология . 233 (2): 247–253. дои : 10.1016/j.taap.2008.08.010 . ПМК 2614128 . ПМИД 18793663 .
Ссылки
[ редактировать ]- В эту статью включен текст из публикации, которая сейчас находится в свободном доступе : Чисхолм, Хью , изд. (1911), « Анилин », Британская энциклопедия , том. 2 (11-е изд.), Cambridge University Press, стр. 47–48.
Внешние ссылки
[ редактировать ]- Бэйнс, Т.С., изд. (1878), , Британская энциклопедия , том. 2 (9-е изд.), Нью-Йорк: Сыновья Чарльза Скрибнера, стр. 47–48, короткое = x
- Международная карта химической безопасности 0011
- CDC - Карманный справочник NIOSH по химическим опасностям
- Электрополимеризация анилина