Структурная биология
| Часть серии о |
| Биохимия |
|---|
 |
Структурная биология , по определению Журнала структурной биологии , занимается структурным анализом живого материала (сформированного, состоящего из живых клеток и/или поддерживаемого и усовершенствованного живыми клетками) на каждом уровне организации. [1]
Ранние структурные биологи на протяжении 19 и начала 20 веков в основном могли изучать структуры только до предела остроты зрения невооруженным глазом и с помощью увеличительных очков и световых микроскопов. В 20 веке было разработано множество экспериментальных методов для изучения трехмерных структур биологических молекул. Наиболее известные методы — рентгеновская кристаллография , ядерный магнитный резонанс и электронная микроскопия . Благодаря открытию рентгеновских лучей и их применению к кристаллам белков структурная биология произвела революцию, поскольку теперь ученые могли получать трехмерные структуры биологических молекул с точностью до атомов. [2] Аналогично, ЯМР-спектроскопия позволила получить информацию о структуре и динамике белка. [3] Наконец, в 21 веке в электронной микроскопии также произошла радикальная революция с разработкой более когерентных источников электронов, коррекции аберраций для электронных микроскопов и программного обеспечения для реконструкции, которое позволило успешно реализовать криоэлектронную микроскопию высокого разрешения, тем самым позволив изучать отдельные белки и молекулярные комплексы в трехмерном изображении с ангстремным разрешением.
С развитием этих трех методов область структурной биологии расширилась и стала также отраслью молекулярной биологии , биохимии и биофизики, занимающейся молекулярной структурой биологических макромолекул (особенно белков , состоящих из аминокислот , РНК или ДНК , состоящих из состоят из нуклеотидов и мембран , состоящих из липидов ), как они приобретают имеющиеся у них структуры и как изменения в их структурах влияют на их функции. [4] Этот предмет представляет большой интерес для биологов, поскольку макромолекулы выполняют большинство функций клеток , и только свертываясь в определенные трехмерные формы, они способны выполнять эти функции. Эта архитектура, « третичная структура » молекул, сложным образом зависит от основного состава каждой молекулы, или « первичной структуры ». При более низком разрешении такие инструменты, как томография FIB-SEM, позволили лучше понять клетки и их органеллы в трех измерениях, а также то, как каждый иерархический уровень различных внеклеточных матриц способствует функционированию (например, в кости). За последние несколько лет также стало возможным прогнозировать высокоточные физические молекулярные модели , дополняющие экспериментальное изучение биологических структур. [5] Вычислительные методы, такие как моделирование молекулярной динамики , могут использоваться в сочетании со стратегиями определения эмпирической структуры для расширения и изучения структуры, конформации и функции белка. [6]


История
[ редактировать ]В 1912 году Макс фон Лауэ направил рентгеновские лучи на кристаллизованный сульфат меди, создав дифракционную картину . [7] Эти эксперименты привели к развитию рентгеновской кристаллографии и ее использованию при исследовании биологических структур. [5] В 1951 году Розалинда Франклин и Морис Уилкинс использовали рентгенограммы, чтобы получить первое изображение дезоксирибонуклеиновой кислоты (ДНК). Фрэнсис Крик и Джеймс Уотсон смоделировали двойную спиральную структуру ДНК, используя тот же метод в 1953 году, и получили Нобелевскую премию по медицине вместе с Уилкинсом в 1962 году. [8]
Кристаллы пепсина были первыми белками, кристаллизованными для использования в дифракции рентгеновских лучей Теодором Сведбергом , получившим в 1962 году Нобелевскую премию по химии. [9] Первая третичная структура белка , миоглобина , была опубликована в 1958 году Джоном Кендрю . [10] За это время моделирование белковых структур проводилось с использованием моделей из пробкового дерева или проволоки . [11] С изобретением программного обеспечения для моделирования, такого как CCP4, в конце 1970-х гг. [12] моделирование теперь осуществляется с помощью компьютера. Последние разработки в этой области включают создание рентгеновских лазеров на свободных электронах , позволяющих анализировать динамику и движение биологических молекул. [13] и использование структурной биологии в помощь синтетической биологии . [14]
В конце 1930-х и начале 1940-х годов сочетание работ Исидора Раби , Феликса Блоха и Эдварда Миллса Перселла привело к развитию ядерного магнитного резонанса (ЯМР). В настоящее время ЯМР твердого тела широко используется в области структурной биологии для определения структуры и динамической природы белков ( ЯМР белков ). [15]
В 1990 году Ричард Хендерсон получил первое трехмерное изображение бактериородопсина с высоким разрешением с помощью криогенной электронной микроскопии (крио-ЭМ). [16] С тех пор криоЭМ становится все более популярным методом определения трехмерных структур биологических изображений с высоким разрешением. [17]
Совсем недавно были разработаны вычислительные методы для моделирования и изучения биологических структур. Например, молекулярная динамика (МД) обычно используется для анализа динамических движений биологических молекул. В 1975 году в журнале Nature было опубликовано первое моделирование процесса биологической складки с использованием МД. [18] Недавно предсказание структуры белка было значительно улучшено благодаря новому методу машинного обучения под названием AlphaFold. [19] Некоторые утверждают, что вычислительные подходы начинают лидировать в области исследований в области структурной биологии. [20]
Техники
[ редактировать ]Биомолекулы слишком малы, чтобы их можно было рассмотреть в деталях даже с помощью самых совершенных световых микроскопов . Методы, которые структурные биологи используют для определения их структуры, обычно включают измерения огромного количества идентичных молекул одновременно. Эти методы включают в себя:
- Масс-спектрометрия
- Макромолекулярная кристаллография
- Нейтронная дифракция
- Протеолиз
- Спектроскопия ядерно-магнитного резонанса белков (ЯМР)
- Электронный парамагнитный резонанс (ЭПР)
- Криогенная электронная микроскопия (криоЭМ)
- Электронная кристаллография и микрокристаллическая электронография
- Многоугольное рассеяние света
- Малый угол рассеяния
- Сверхбыстрая лазерная спектроскопия
- Анизотропная терагерцовая микроспектроскопия
- Двумерная инфракрасная спектроскопия
- Двухполяризационная интерферометрия и круговой дихроизм
Чаще всего исследователи используют их для изучения « родных состояний » макромолекул. Но вариации этих методов также используются для наблюдения за возникающими или денатурированными молекулами, принимающими или возвращающими свое исходное состояние. См. сворачивание белка .
Третий подход, который структурные биологи используют для понимания структуры, — это биоинформатика, позволяющая искать закономерности среди разнообразных последовательностей , которые приводят к определенным формам. Исследователи часто могут вывести аспекты структуры интегральных мембранных белков на основе топологии мембраны, предсказанной анализом гидрофобности . См. предсказание структуры белка .
Приложения
[ редактировать ]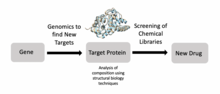
Структурные биологи внесли значительный вклад в понимание молекулярных компонентов и механизмов, лежащих в основе заболеваний человека. Например, криоЭМ и оцЯМР использовались для изучения агрегации амилоидных фибрилл, которые связаны с болезнью Альцгеймера , болезнью Паркинсона и диабетом II типа . [21] В дополнение к амилоидным белкам ученые использовали крио-ЭМ для создания моделей тау-нитей с высоким разрешением в мозгу пациентов с болезнью Альцгеймера, что может помочь в разработке более эффективных методов лечения в будущем. [22] Инструменты структурной биологии также можно использовать для объяснения взаимодействия между патогенами и хозяевами. Например, инструменты структурной биологии позволили вирусологам понять, как оболочка ВИЧ позволяет вирусу уклоняться от иммунных реакций человека. [23]
Структурная биология также является важным компонентом открытия лекарств . [24] Ученые могут идентифицировать цели с помощью геномики, изучать эти цели с помощью структурной биологии и разрабатывать лекарства, подходящие для этих целей. лигандов ЯМР , масс-спектрометрия и рентгеновская кристаллография В частности, в процессе открытия лекарств широко используются методы . Например, исследователи использовали структурную биологию, чтобы лучше понять Met , белок, кодируемый протоонкогеном, который является важной мишенью лекарств при раке . [25] Аналогичные исследования были проведены в отношении целей борьбы с ВИЧ для лечения людей со СПИДом . [24] Исследователи также разрабатывают новые противомикробные препараты для лечения микобактериальных инфекций, используя открытие лекарств, основанных на структуре. [24]
См. также
[ редактировать ]- Первичная структура
- Вторичная структура
- Третичная структура
- Четвертичная структура
- Структурная область
- Структурный мотив
- Белковая субъединица
- Молекулярная модель
- Кооперативность
- сопровождающий
- Структурная геномика
- Стереохимия
- Разрешение (электронная плотность)
- Proteopedia Совместная трехмерная энциклопедия белков и других молекул .
- Прогнозирование структуры белка
Ссылки
[ редактировать ]- ^ «Журнал структурной биологии | ScienceDirect.com от Elsevier» . 18 апреля 2024 г. Архивировано из оригинала 18 апреля 2024 г. Проверено 14 мая 2024 г.
{{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) - ^ Карри, Стивен (3 июля 2015 г.). «Структурная биология: столетнее путешествие в невидимый мир» . Междисциплинарные научные обзоры . 40 (3): 308–328. Бибкод : 2015ISRv...40..308C . дои : 10.1179/0308018815Z.000000000120 . ISSN 0308-0188 . ПМЦ 4697198 . ПМИД 26740732 .
- ^ Кэмпбелл, Иэн Д. (1 января 2013 г.). «Эволюция ЯМР белков» . Биомедицинская спектроскопия и визуализация . 2 (4): 245–264. дои : 10.3233/BSI-130055 . ISSN 2212-8794 .
- ^ Банашак ЖЖ (2000). Основы структурной биологии . Берлингтон: Эльзевир. ISBN 9780080521848 .
- ^ Перейти обратно: а б Джампер, Джон; Эванс, Ричард; Притцель, Александр; Грин, Тим; Фигурнов Михаил; Роннебергер, Олаф; Туньясувунакул, Кэтрин; Бейтс, Расс; Жидек, Августин; Потапенко, Анна; Бриджланд, Алекс; Мейер, Клеменс; Коль, Саймон А.А.; Баллард, Эндрю Дж.; Коуи, Эндрю (15 июля 2021 г.). «Высокоточное предсказание структуры белка с помощью AlphaFold» . Природа . 596 (7873): 583–589. Бибкод : 2021Natur.596..583J . дои : 10.1038/s41586-021-03819-2 . ISSN 1476-4687 . ПМЦ 8371605 . PMID 34265844 .
- ^ Карплюс М., Маккаммон Дж.А. (сентябрь 2002 г.). «Молекулярно-динамическое моделирование биомолекул». Структурная биология природы . 9 (9): 646–652. дои : 10.1038/nsb0902-646 . ПМИД 12198485 . S2CID 590640 .
- ^ Карри С. (июль 2015 г.). «Структурная биология: столетнее путешествие в невидимый мир» . Междисциплинарные научные обзоры . 40 (3): 308–328. Бибкод : 2015ISRv...40..308C . дои : 10.1179/0308018815z.000000000120 . ПМК 4697198 . ПМИД 26740732 .
- ^ «Нобелевская премия по физиологии и медицине 1962 года» . NobelPrize.org . Проверено 1 октября 2022 г.
- ^ Яскольски М., Даутер З., Влодавер А. (сентябрь 2014 г.). «Краткая история макромолекулярной кристаллографии, иллюстрированная генеалогическим древом и его Нобелевскими плодами» . Журнал ФЭБС . 281 (18): 3985–4009. дои : 10.1111/февраль 12796 . ПМК 6309182 . ПМИД 24698025 .
- ^ Кендрю Дж.К., Бодо Дж., Динцис Х.М., Пэрриш Р.Г., Вайкофф Х., Филлипс, округ Колумбия (март 1958 г.). «Трехмерная модель молекулы миоглобина, полученная методом рентгеноструктурного анализа». Природа . 181 (4610): 662–666. Бибкод : 1958Natur.181..662K . дои : 10.1038/181662a0 . ПМИД 13517261 . S2CID 4162786 .
- ^ Гарман Э.Ф. (март 2014 г.). «Разработки в области рентгеноструктурного определения структуры биологических макромолекул». Наука . 343 (6175): 1102–1108. Бибкод : 2014Sci...343.1102G . дои : 10.1126/science.1247829 . ПМИД 24604194 . S2CID 21067016 .
- ^ «О CCP4» . Legacy.ccp4.ac.uk . Проверено 2 апреля 2021 г.
- ^ Уолдроп М.М. (январь 2014 г.). «Рентгенология: большие пушки» . Природа . 505 (7485): 604–606. Бибкод : 2014Natur.505..604W . дои : 10.1038/505604a . ПМИД 24476872 .
- ^ Киль С., Серрано Л. (ноябрь 2012 г.). «Структурные данные в подходах синтетической биологии для изучения общих принципов проектирования сотовых сигнальных сетей» . Структура . 20 (11): 1806–1813. дои : 10.1016/j.str.2012.10.002 . hdl : 10230/23121 . ПМИД 23141693 .
- ^ Вютрих К. (ноябрь 2001 г.). «Путь к ЯМР-структурам белков». Структурная биология природы . 8 (11): 923–925. дои : 10.1038/nsb1101-923 . ПМИД 11685234 . S2CID 26153265 .
- ^ Хендерсон Р., Болдуин Дж. М., Ческа Т. А., Землян Ф., Бекманн Э., Даунинг К. Х. (июнь 1990 г.). «Модель структуры бактериородопсина на основе электронной криомикроскопии высокого разрешения». Журнал молекулярной биологии . 213 (4): 899–929. дои : 10.1016/S0022-2836(05)80271-2 . ПМИД 2359127 .
- ^ Каллауэй, Юэн (10 февраля 2020 г.). «Революционная крио-ЭМ захватывает структурную биологию» . Природа . 578 (7794): 201. Бибкод : 2020Natur.578..201C . дои : 10.1038/d41586-020-00341-9 . ПМИД 32047310 . S2CID 211081167 .
- ^ Левитт М., Варшел А. (февраль 1975 г.). «Компьютерное моделирование сворачивания белка». Природа . 253 (5494): 694–698. Бибкод : 1975Natur.253..694L . дои : 10.1038/253694a0 . ПМИД 1167625 . S2CID 4211714 .
- ^ Джампер Дж., Эванс Р., Притцель А., Грин Т., Фигурнов М., Роннебергер О. и др. (август 2021 г.). «Высокоточное предсказание структуры белка с помощью AlphaFold» . Природа . 596 (7873): 583–589. Бибкод : 2021Natur.596..583J . дои : 10.1038/s41586-021-03819-2 . ПМЦ 8371605 . PMID 34265844 .
- ^ Нусинов, Рут; Цай, Чунг-Юнг; Шеху, Амарда; Чан, Хёнбом (12 февраля 2019 г.). «Вычислительная структурная биология: успехи, будущие направления и проблемы» . Молекулы (Базель, Швейцария) . 24 (3): Е637. дои : 10.3390/molecules24030637 . ISSN 1420-3049 . ПМК 6384756 . ПМИД 30759724 .
- ^ Яданза М.Г., Джексон, член парламента, Хьюитт Э.В., Рэнсон Н.А., Рэдфорд С.Э. (декабрь 2018 г.). «Новая эра понимания амилоидных структур и заболеваний» . Обзоры природы. Молекулярно-клеточная биология . 19 (12): 755–773. дои : 10.1038/s41580-018-0060-8 . ПМИД 30237470 . S2CID 52307956 .
- ^ Фитцпатрик, Энтони В.П.; Сокол, Бенджамин; Он, Шаода; Мурзин Алексей Георгиевич; Муршудов, Гариб; Гарринджер, Холли Дж.; Кроутер, Р. Энтони; Гетти, Бернардино; Гедерт, Мишель; Шерес, Сьорс Х.В. (13 июля 2017 г.). «Крио-ЭМ структуры тау-нитей болезни Альцгеймера» . Природа . 547 (7662): 185–190. Бибкод : 2017Natur.547..185F . дои : 10.1038/nature23002 . ISSN 1476-4687 . ПМК 5552202 . ПМИД 28678775 .
- ^ Энгельман, Алан; Черепанов, Петр (16 марта 2012 г.). «Структурная биология ВИЧ-1: механизмы и терапевтические идеи» . Обзоры природы Микробиология . 10 (4): 279–290. дои : 10.1038/nrmicro2747 . ISSN 1740-1526 . ПМЦ 3588166 . ПМИД 22421880 . S2CID 14088805 .
- ^ Перейти обратно: а б с Томас С.Е., Мендес В., Ким С.Ю., Малхотра С., Очоа-Монтаньо Б., Блащик М., Бланделл Т.Л. (август 2017 г.). «Структурная биология и разработка новых терапевтических средств: от ВИЧ и рака до микобактериальных инфекций: статья, посвященная Джону Кендрю» . Журнал молекулярной биологии . Специальное издание, посвященное 100-летию Джона Кендрю. 429 (17): 2677–2693. дои : 10.1016/j.jmb.2017.06.014 . ПМИД 28648615 .
- ^ Вендт К.У., Вайс М.С., Крамер П., Хайнц Д.В. (февраль 2008 г.). «Структуры и болезни» . Структурная и молекулярная биология природы . 15 (2): 117–120. дои : 10.1038/nsmb0208-117 . ПМК 7097323 . ПМИД 18250627 .
