Рибосома
| Клеточная биология | |
|---|---|
| Диаграмма клеток животных | |
 Компоненты типичной животной клетки:
|
Рибосомы ( / ˈ r aɪ b ə z oʊ m , -s oʊ m / ( ) — это макромолекулярные машины обнаруженные во всех клетках , которые выполняют биологический синтез белка , трансляцию информационной РНК ). Рибосомы связывают аминокислоты вместе в порядке, заданном кодонами молекул информационной РНК, с образованием полипептидных цепей. Рибосомы состоят из двух основных компонентов: малой и большой рибосомальных субъединиц. Каждая субъединица состоит из одной или нескольких молекул рибосомальной РНК и множества рибосомальных белков ( r-белков ). [ 1 ] [ 2 ] [ 3 ] Рибосомы и связанные с ними молекулы также известны как аппарат трансляции .
Обзор
[ редактировать ]Последовательность ДНК , которая кодирует последовательность аминокислот в белке, транскрибируется в цепь информационной РНК (мРНК). Рибосомы связываются с информационными РНК и используют их последовательности. [ нужны разъяснения ] определить правильную последовательность аминокислот для образования данного белка. Аминокислоты отбираются и переносятся в рибосому с помощью молекул транспортной РНК (тРНК), которые входят в рибосому и связываются с цепью информационной РНК через петлю стебля антикодона . Для каждого кодирующего триплета ( кодона ) в информационной РНК существует уникальная транспортная РНК, которая должна иметь точное совпадение антикодона и нести правильную аминокислоту для включения в растущую полипептидную цепь. Как только белок будет произведен, он может сворачиваться , образуя функциональную трехмерную структуру.
Рибосома состоит из комплексов РНК и белков и, следовательно, представляет собой рибонуклеопротеиновый комплекс . У прокариот каждая рибосома состоит из малых (30 S ) и больших (50 S ) компонентов, называемых субъединицами, которые связаны друг с другом:
- (30S) выполняет в основном функцию декодирования, а также связан с мРНК.
- (50S) выполняет преимущественно каталитическую функцию, а также связан с аминоацилированными тРНК.
Синтез белков из их строительных блоков происходит в четыре фазы: инициация, элонгация, терминация и рециклинг. Старт-кодон во всех молекулах мРНК имеет последовательность AUG. Стоп-кодон представляет собой один из UAA, UAG или UGA; поскольку нет молекул тРНК, распознающих эти кодоны, рибосома распознает, что трансляция завершена. [ 4 ] Когда рибосома завершает считывание молекулы мРНК, две субъединицы разделяются и обычно распадаются, но могут быть использованы повторно. Рибосомы являются рибозимами , поскольку каталитическая пептидилтрансферазная активность, связывающая аминокислоты вместе, осуществляется рибосомальной РНК. [ 5 ]
Рибосомы часто связаны с внутриклеточными мембранами, образующими шероховатую эндоплазматическую сеть .
Рибосомы бактерий , архей и эукариот в трехдоменной системе в значительной степени похожи друг на друга, что свидетельствует об общем происхождении. Они различаются размером, последовательностью, структурой и соотношением белка и РНК. Различия в структуре позволяют некоторым антибиотикам убивать бактерии, ингибируя их рибосомы, не затрагивая рибосомы человека. У всех видов более одной рибосомы могут перемещаться по одной цепи мРНК одновременно (как полисома ), каждая из которых «считывает» определенную последовательность и производит соответствующую белковую молекулу.
Митохондриальные рибосомы эукариотических клеток функционально напоминают рибосомы бактерий, что отражает вероятное эволюционное происхождение митохондрий. [ 6 ] [ 7 ]
Открытие
[ редактировать ]Рибосомы были впервые обнаружены в середине 1950-х годов румынско-американским клеточным биологом Джорджем Эмилем Паладе с помощью электронного микроскопа в виде плотных частиц или гранул. [ 8 ] Первоначально их называли гранулами Палада из-за их зернистой структуры. Термин «рибосома» был предложен в 1958 году Говардом М. Динцисом: [ 9 ]
В ходе симпозиума стала очевидной смысловая трудность. Для некоторых участников «микросомы» означают рибонуклеопротеиновые частицы микросомальной фракции, загрязненные другим белковым и липидным материалом; для других микросомы состоят из белков и липидов, загрязненных частицами. Словосочетание «микросомальные частицы» не кажется адекватным, а «рибонуклеопротеиновые частицы микросомальной фракции» — слишком неуклюжим. В ходе встречи было предложено слово «рибосома», имеющее весьма удачное название и приятное звучание. Нынешняя путаница была бы устранена, если бы термином «рибосома» было принято обозначать рибонуклеопротеиновые частицы размером от 35 до 100S.
- Альберт Клод, Микросомальные частицы и синтез белка [ 10 ]
Альберт Клод , Кристиан де Дюв и Джордж Эмиль Палад были совместно удостоены Нобелевской премии по физиологии и медицине в 1974 году за открытие рибосомы. [ 11 ] Нобелевская премия по химии 2009 года была присуждена Венкатраману Рамакришнану , Томасу А. Стейцу и Аде Э. Йонат за определение детальной структуры и механизма рибосомы. [ 12 ]
Структура
[ редактировать ]

Рибосома — сложная клеточная машина. Он в основном состоит из специализированной РНК, известной как рибосомальная РНК (рРНК), а также десятков различных белков (точное количество незначительно варьируется у разных видов). Рибосомальные белки и рРНК организованы в две отдельные рибосомальные части разного размера, известные как большая и малая субъединицы рибосомы. Рибосомы состоят из двух субъединиц, которые соединяются вместе и работают как одна, переводя мРНК в полипептидную цепь во время синтеза белка. Поскольку они образованы из двух субъединиц неравного размера, на оси они несколько длиннее, чем в диаметре.
Прокариотические рибосомы
[ редактировать ]Прокариотические рибосомы имеют диаметр около 20 нм (200 Å ) и состоят на 65% из рРНК и на 35% из рибосомальных белков . [ 13 ] Эукариотические рибосомы имеют диаметр от 25 до 30 нм (250–300 Å) с соотношением рРНК к белку, близким к 1. [ 14 ] Кристаллографическая работа [ 15 ] показало, что вблизи места реакции синтеза полипептида нет рибосомальных белков. Это говорит о том, что белковые компоненты рибосом не принимают непосредственного участия в катализе образования пептидных связей, а скорее действуют как каркас, который может усиливать способность рРНК синтезировать белок (см.: Рибозим ).
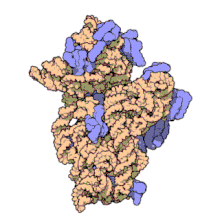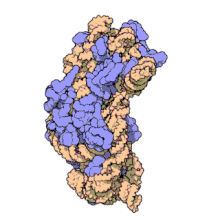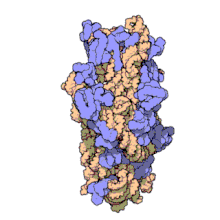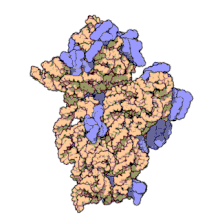
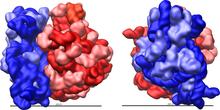
Рибосомальные субъединицы прокариот и эукариот очень похожи. [ 17 ]
Единицей измерения, используемой для описания субъединиц рибосом и фрагментов рРНК, является единица Сведберга , мера скорости седиментации при центрифугировании , а не размера. Это объясняет, почему имена фрагментов не складываются: например, бактериальные рибосомы 70S состоят из субъединиц 50S и 30S.
Прокариоты имеют 70 S- рибосом, каждая из которых состоит из малой ( 30S ) и большой ( 50S ) субъединиц. E. coli , например, имеет субъединицу РНК 16S (состоящую из 1540 нуклеотидов), которая связана с 21 белком. Большая субъединица состоит из субъединицы 5S РНК (120 нуклеотидов), субъединицы 23S РНК (2900 нуклеотидов) и 31 белка . [ 17 ]
Рибосома E. coli (бактерия) [ 18 ] : 962 рибосома субъединицы рРНК р-белки 70С 50С 23S (2904 нт ) 31 5S (120 нт) 30С 16S (1542 нт) 21
Аффинная метка сайтов связывания тРНК на рибосоме E. coli позволила идентифицировать белки сайтов A и P, наиболее вероятно связанные с активностью пептидилтрансферазы; [ 5 ] меченые белки: L27, L14, L15, L16, L2; по крайней мере L27 располагается на донорском участке, как показали Э. Коллатц и А. П. Черниловский. [ 19 ] [ 20 ] Дополнительные исследования показали, что белки S1 и S21 в сочетании с 3'-концом 16S рибосомальной РНК участвуют в инициации трансляции. [ 21 ]
Архейные рибосомы
[ редактировать ]Рибосомы архей имеют те же общие размеры, что и рибосомы бактерий: они представляют собой рибосому 70S, состоящую из большой субъединицы 50S и малой субъединицы 30S и содержащую три цепи рРНК. Однако на уровне последовательностей они гораздо ближе к эукариотическим, чем к бактериальным. Каждый дополнительный рибосомальный белок, который есть у архей по сравнению с бактериями, имеет эукариотический аналог, в то время как между архей и бактериями такая связь отсутствует. [ 22 ] [ 23 ] [ 24 ]
Эукариотические рибосомы
[ редактировать ]Эукариоты имеют 80S рибосомы, расположенные в цитозоле, каждая из которых состоит из малой (40S) и большой (60S) субъединиц . Их субъединица 40S содержит 18S РНК (1900 нуклеотидов) и 33 белка. [ 25 ] [ 26 ] Большая субъединица состоит из субъединиц 5S РНК (120 нуклеотидов), 28S РНК (4700 нуклеотидов), 5,8S РНК (160 нуклеотидов) и 49 белков. [ 17 ] [ 25 ] [ 27 ]
эукариотические цитозольные рибосомы ( R. norvegicus ) [ 18 ] : 65 рибосома субъединицы рРНК р-белки 80-е годы 60С 28S (4718 нт) 49 5,8S (160 нт) 5S (120 нт) 40С 18S (1874 нт) 33
В 1977 году Черниловский опубликовал исследование, в котором использовалось аффинное мечение для идентификации участков связывания тРНК на рибосомах печени крыс. Несколько белков, включая L32/33, L36, L21, L23, L28/29 и L13, были вовлечены в то, что они находились в центре пептидилтрансферазы или рядом с ним . [ 28 ]
Пласторибосомы и миторибосомы
[ редактировать ]У эукариот рибосомы присутствуют в митохондриях (иногда называемых миторибосомами ) и в пластидах, таких как хлоропласты (также называемые пласторибосомами). Они также состоят из больших и малых субъединиц, связанных между собой белками в одну 70S-частицу. [ 17 ] Эти рибосомы подобны рибосомам бактерий, и считается, что эти органеллы возникли как симбиотические бактерии . [ 17 ] Из этих двух хлорпластические рибосомы ближе к бактериальным, чем к митохондриальным. Многие участки рибосомальной РНК в митохондриях укорачиваются, а в случае 5S рРНК заменяются другими структурами у животных и грибов. [ 29 ] В частности, Leishmania tarentolae имеет минимизированный набор митохондриальных рРНК. [ 30 ] Напротив, миторибосомы растений имеют как расширенную рРНК, так и дополнительные по сравнению с бактериями белки, в частности, многие белки с пентатрикопетидными повторами. [ 31 ]
Криптомонады , и хлорарахниофитные водоросли могут содержать нуклеоморф напоминающий рудиментарное эукариотическое ядро. [ 32 ] Эукариотические 80S рибосомы могут присутствовать в компартменте, содержащем нуклеоморф. [ 33 ]
Использование различий
[ редактировать ]Различия между бактериальными и эукариотическими рибосомами используются химиками-фармацевтами для создания антибиотиков , способных уничтожить бактериальную инфекцию, не повреждая при этом клетки инфицированного человека. Из-за различий в своей структуре бактериальные 70S рибосомы уязвимы к этим антибиотикам, а эукариотические 80S рибосомы - нет. [ 34 ] Хотя митохондрии обладают рибосомами, сходными с бактериальными, эти антибиотики не влияют на митохондрии, поскольку они окружены двойной мембраной, которая с трудом пропускает эти антибиотики в органеллу . [ 35 ] Примечательным контрпримером является противоопухолевый антибиотик хлорамфеникол , который ингибирует бактериальные 50S и эукариотические митохондриальные 50S рибосомы. [ 36 ] Рибосомы в хлоропластах, однако, разные: устойчивость к антибиотикам в рибосомальных белках хлоропластов — это признак, который необходимо ввести в качестве маркера с помощью генной инженерии. [ 37 ]
Общие свойства
[ редактировать ]Различные рибосомы имеют общую структуру ядра, которая весьма схожа, несмотря на большие различия в размерах. Большая часть РНК высоко организована в различные третичные структурные мотивы , например псевдоузлы , которые демонстрируют коаксиальную укладку . Дополнительная РНК в более крупных рибосомах состоит из нескольких длинных непрерывных вставок. [ 38 ] так, что они образуют петли из основной структуры, не нарушая и не изменяя ее. [ 17 ] Вся каталитическая активность рибосомы осуществляется РНК ; белки располагаются на поверхности и, по-видимому, стабилизируют структуру. [ 17 ]
Структура высокого разрешения
[ редактировать ]
Общая молекулярная структура рибосомы известна с начала 1970-х годов. В начале 2000-х годов структура была получена при высоком разрешении, порядка нескольких ангстремов .
Первые статьи, дающие структуру рибосомы с атомным разрешением, были опубликованы почти одновременно в конце 2000 года. Субъединица 50S (большая прокариотическая) была определена у археи Haloarcula marismortui. [ 39 ] и бактерии Deinococcus radiodurans , а структуру 30S-субъединицы определяли по бактерии Thermus thermophilus . [ 16 ] [ 40 ] Эти структурные исследования были удостоены Нобелевской премии по химии в 2009 году. В мае 2001 года эти координаты были использованы для реконструкции всей частицы 70S T. thermophilus с разрешением 5,5 Å . [ 41 ]
В ноябре 2005 г. были опубликованы две статьи, посвященные структурам 70S рибосомы Escherichia coli . Структуру вакантной рибосомы определяли с 3,5 Å разрешением с помощью рентгеновской кристаллографии . [ 42 ] структура, основанная на криоэлектронной микроскопии . Затем, две недели спустя, была опубликована [ 43 ] на котором изображена рибосома с разрешением 11–15 Å в процессе прохождения вновь синтезированной белковой цепи в канал, проводящий белок.
Первые атомные структуры рибосомы в комплексе с молекулами тРНК и мРНК были решены с помощью рентгеновской кристаллографии двумя группами независимо, при 2,8 Å. [ 44 ] и при 3,7 Å . [ 45 ] Эти структуры позволяют увидеть детали взаимодействия рибосомы Thermus thermophilus с мРНК и тРНК, связанными в классических сайтах рибосомы. взаимодействия рибосомы с длинными мРНК, содержащими последовательности Шайна-Дальгарно, Вскоре после этого были визуализированы 4,5–5,5 Å . с разрешением [ 46 ]
В 2011 году методом кристаллографии была получена первая полная атомная структура эукариотической 80S рибосомы дрожжей Saccharomyces cerevisiae . [ 25 ] Модель раскрывает архитектуру специфичных для эукариот элементов и их взаимодействие с универсально консервативным ядром. В то же время была опубликована полная модель эукариотической структуры 40S рибосомы у Tetrahymena thermophila , в которой описана структура 40S субъединицы , а также многое о взаимодействии 40S субъединицы с eIF1 во время инициации трансляции . [ 26 ] эукариот Аналогично, структура 60S-субъединицы была также определена у Tetrahymena thermophila в комплексе с eIF6 . [ 27 ]
Функция
[ редактировать ]Рибосомы — это мельчайшие частицы, состоящие из РНК и связанных с ней белков, которые синтезируют белки. Белки необходимы для многих клеточных функций, таких как восстановление повреждений или управление химическими процессами. Рибосомы могут находиться в цитоплазме или прикреплены к эндоплазматической сети . Их основная функция — преобразование генетического кода в аминокислотную последовательность и построение белковых полимеров из мономеров аминокислот.
Рибосомы действуют как катализаторы в двух чрезвычайно важных биологических процессах, называемых переносом пептидила и гидролизом пептидила. [ 5 ] [ 47 ] «Центр PT отвечает за образование белковых связей во время элонгации белка». [ 47 ]
Таким образом, рибосомы выполняют две основные функции: декодирование сообщения и образование пептидных связей. Эти две функции присущи субъединицам рибосом. Каждая субъединица состоит из одной или нескольких рРНК и множества р-белков. Малая субъединица (30S у бактерий и архей, 40S у эукариот) выполняет функцию декодирования, тогда как большая субъединица (50S у бактерий и архей, 60S у эукариот) катализирует образование пептидных связей, называемое пептидилтрансферазной активностью. Малая субъединица бактерий (и архей) содержит 16S рРНК и 21 r-белок ( Escherichia coli ), тогда как малая субъединица эукариот содержит 18S рРНК и 32 r-белка (Saccharomyces cerevisiae, хотя их количество варьируется у разных видов). Большая бактериальная субъединица содержит 5S и 23S рРНК и 34 r-белка ( E. coli ), а эукариотическая большая субъединица содержит 5S, 5,8S и 25S/28S рРНК и 46 r-белков ( S. cerevisiae ; опять же, точные цифры варьируются в зависимости от вида). [ 48 ]
Перевод
[ редактировать ]Рибосомы являются местом биосинтеза белка , процесса перевода мРНК в белок . мРНК состоит из ряда кодонов , которые декодируются рибосомой для образования белка. Используя мРНК в качестве матрицы, рибосома проходит через каждый кодон (3 нуклеотида ) мРНК, соединяя его с соответствующей аминокислотой, представленной аминоацил-тРНК . Аминоацил-тРНК содержит комплементарный антикодон на одном конце и соответствующую аминокислоту на другом. Для быстрого и точного распознавания соответствующей тРНК рибосома использует большие конформационные изменения ( конформационная корректура ). [ 49 ] Малая субъединица рибосомы, обычно связанная с аминоацил-тРНК, содержащей первую аминокислоту метионин , связывается с кодоном AUG на мРНК и рекрутирует большую рибосомальную субъединицу. Рибосома содержит три сайта связывания РНК, обозначенные A, P и E. A-сайт связывает аминоацил-тРНК или факторы высвобождения терминации; [ 50 ] [ 51 ] P -сайт связывает пептидил-тРНК (тРНК, связанная с полипептидной цепью); а E-сайт (выход) связывает свободную тРНК. Синтез белка начинается со стартового кодона AUG вблизи 5'-конца мРНК. мРНК сначала связывается с P-сайтом рибосомы. Рибосома распознает стартовый кодон, используя Шайна-Дальгарно последовательность мРНК у прокариот и бокса Козака у эукариот.
Хотя в катализе пептидной связи C2 участвует гидроксил P-участка РНК аденозина в механизме протонного челнока, другие этапы синтеза белка (например, транслокация) вызываются изменениями конформации белка. Поскольку их каталитическое ядро состоит из РНК, рибосомы классифицируются как « рибозимы ». [ 52 ] и считается, что они могут быть остатками мира РНК . [ 53 ]

На рисунке 5 обе субъединицы рибосомы ( малая и большая ) собираются у стартового кодона (по направлению к 5'-концу мРНК ) . Рибосома использует тРНК , которая соответствует текущему кодону (триплету) мРНК, для присоединения аминокислоты к полипептидной цепи. Это делается для каждого триплета мРНК, при этом рибосома движется к 3'-концу мРНК. Обычно в бактериальных клетках несколько рибосом работают параллельно над одной мРНК, образуя так называемую полирибосому или полисому .
Котрансляционное сворачивание
[ редактировать ]Известно, что рибосома активно участвует в сворачивании белка . [ 54 ] [ 55 ] Структуры, полученные таким путем, обычно идентичны структурам, полученным при химическом рефолдинге белков; однако пути, ведущие к конечному продукту, могут быть разными. [ 56 ] [ 57 ] В некоторых случаях рибосома имеет решающее значение для получения функциональной формы белка. Например, один из возможных механизмов сворачивания глубоко завязанных белков основан на том, что рибосома проталкивает цепь через присоединенную петлю. [ 58 ]
Добавление независимых от трансляции аминокислот
[ редактировать ]Присутствие белка контроля качества рибосомы Rqc2 связано с мРНК-независимой элонгацией белка. [ 59 ] [ 60 ] Это удлинение является результатом добавления к рибосомам (посредством тРНК, принесенных с помощью Rqc2) - хвостов удлиняют С -конец остановившегося белка случайными, независимыми от трансляции последовательностями ланинов CAT и треонинов : рибосомы . [ 61 ] [ 62 ]
Расположение рибосом
[ редактировать ]Рибосомы классифицируются как «свободные» и «связанные с мембраной».

Свободные и мембраносвязанные рибосомы различаются только пространственным распределением; они идентичны по структуре. Существует ли рибосома в свободном или мембраносвязанном состоянии, зависит от наличия сигнальной последовательности, нацеленной на ЭР, на синтезируемом белке, поэтому отдельная рибосома может быть мембраносвязанной, когда она производит один белок, но свободной в цитозоле. когда он производит другой белок.
Рибосомы иногда называют органеллами , но использование термина «органелла» часто ограничивается описанием субклеточных компонентов, которые включают фосфолипидную мембрану, которой нет у рибосом, будучи полностью состоящими из частиц. По этой причине рибосомы иногда можно описать как «немембранные органеллы».
Свободные рибосомы
[ редактировать ]Свободные рибосомы могут перемещаться в любом месте цитозоля , но не попадают в ядро клетки и другие органеллы. Белки, образующиеся из свободных рибосом, высвобождаются в цитозоль и используются внутри клетки. Поскольку цитозоль содержит высокие концентрации глутатиона и, следовательно, является восстанавливающей средой , в нем не могут образовываться белки, содержащие дисульфидные связи , которые образуются из окисленных остатков цистеина.
Мембраносвязанные рибосомы
[ редактировать ]Когда рибосома начинает синтезировать белки, необходимые некоторым органеллам, рибосома, производящая этот белок, может стать «мембраносвязанной». В эукариотических клетках это происходит в области эндоплазматического ретикулума (ЭР), называемой «грубым ЭР». Вновь образующиеся полипептидные цепи вставляются непосредственно в ЭР с помощью рибосомы, осуществляющей векторный синтез , а затем транспортируются к местам назначения по секреторному пути . Связанные рибосомы обычно производят белки, которые используются внутри плазматической мембраны или выводятся из клетки посредством экзоцитоза . [ 63 ]
Биогенез
[ редактировать ]В бактериальных клетках рибосомы синтезируются в цитоплазме посредством транскрипции нескольких оперонов рибосомных генов . У эукариот этот процесс происходит как в цитоплазме клетки, так и в ядрышке , которое представляет собой область внутри ядра клетки . Процесс сборки включает в себя скоординированную функцию более 200 белков при синтезе и процессинге четырех рРНК, а также сборку этих рРНК с рибосомальными белками. [ 64 ]
Источник
[ редактировать ]Рибосома, возможно, первоначально возникла как проторибосома. [ 65 ] возможно, содержащий пептидилтрансферазный центр (ПТЦ) в мире РНК , проявляющийся как самовоспроизводящийся комплекс, который только позже развил способность синтезировать белки, когда аминокислоты . начали появляться [ 66 ] Исследования показывают, что древние рибосомы, построенные исключительно из рРНК, могли развить способность синтезировать пептидные связи . [ 67 ] [ 68 ] [ 69 ] [ 70 ] [ 71 ] Кроме того, данные убедительно указывают на то, что древние рибосомы представляли собой самовоспроизводящиеся комплексы, где рРНК в рибосомах имела информационные, структурные и каталитические цели, поскольку могла кодировать тРНК и белки, необходимые для саморепликации рибосом. [ 72 ] Гипотетические клеточные организмы с самореплицирующейся РНК, но без ДНК, называются рибоцитами (или рибоклетками). [ 73 ] [ 74 ]
Поскольку аминокислоты постепенно появлялись в мире РНК в пребиотических условиях, [ 75 ] [ 76 ] их взаимодействие с каталитической РНК увеличит как диапазон, так и эффективность функций каталитических молекул РНК. [ 66 ] Таким образом, движущей силой эволюции рибосомы из древней самовоспроизводящейся машины в ее нынешнюю форму как трансляционную машину, возможно, было селективное давление, направленное на включение белков в механизмы самовоспроизводства рибосомы, чтобы увеличить ее способность к самовоспроизведение. [ 72 ] [ 77 ] [ 78 ]
Гетерогенные рибосомы
[ редактировать ]Рибосомы по составу неоднородны между видами и даже внутри одной клетки, о чем свидетельствует существование цитоплазматических и митохондриальных рибосом внутри одних и тех же эукариотических клеток. Некоторые исследователи предположили, что гетерогенность в составе рибосомальных белков млекопитающих важна для регуляции генов, т. е . гипотеза специализированных рибосом. [ 79 ] [ 80 ] Однако эта гипотеза является спорной и является предметом продолжающихся исследований. [ 81 ] [ 82 ]
впервые предположили, что гетерогенность состава рибосом участвует в трансляционном контроле синтеза белка Винс Мауро и Джеральд Эдельман . [ 83 ] Они предложили гипотезу рибосомного фильтра, чтобы объяснить регуляторные функции рибосом. Имеющиеся данные свидетельствуют о том, что специализированные рибосомы, специфичные для разных популяций клеток, могут влиять на трансляцию генов. [ 84 ] Некоторые рибосомальные белки обмениваются из собранного комплекса с цитозольными копиями. [ 85 ] предполагая, что структуру рибосомы in vivo можно изменить без синтеза целой новой рибосомы.
Некоторые рибосомальные белки абсолютно необходимы для клеточной жизни, тогда как другие — нет. У почкующихся дрожжей 14/78 рибосомальных белков не являются необходимыми для роста, тогда как у человека это зависит от исследуемой клетки. [ 86 ] Другие формы гетерогенности включают посттрансляционные модификации рибосомальных белков, такие как ацетилирование, метилирование и фосфорилирование. [ 87 ] арабидопсис , [ 88 ] [ 89 ] [ 90 ] [ 91 ] Вирусные внутренние сайты входа в рибосомы (IRES) могут опосредовать трансляции с помощью рибосом, различающихся по составу. Например, 40S рибосомальные единицы без eS25 в клетках дрожжей и млекопитающих не способны рекрутировать CrPV IGR IRES . [ 92 ]
Гетерогенность модификаций рибосомальной РНК играет значительную роль в поддержании структуры и/или функции, и большинство модификаций мРНК обнаруживаются в высококонсервативных регионах. [ 93 ] [ 94 ] Наиболее распространенными модификациями рРНК являются псевдоуридилирование и 2'-О-метилирование рибозы. [ 95 ]
См. также
[ редактировать ]- Аминогликозиды
- Биологические машины
- Посттрансляционная модификация
- Динамика белка
- Рибосомно-ассоциированная везикула
- Третичная структура РНК
- Перевод (генетика)
- Колебание базовой пары
- Ада Йонат — израильский кристаллограф, известная своими новаторскими работами по структуре рибосомы, за которые она получила Нобелевскую премию .
Ссылки
[ редактировать ]- ^ Кониккат С (февраль 2016 г.). События динамического ремоделирования приводят к удалению спейсерной последовательности ITS2 во время сборки рибосомальных субъединиц 60S у S. cerevisiae (докторская диссертация). Университет Карнеги-Меллон. Архивировано из оригинала 3 августа 2017 года.
- ^ Вейлер Э.В., Новер Л. (2008). Общая и молекулярная ботаника (на немецком языке). Штутгарт: Георг Тиме Верлаг. п. 532. ИСБН 9783131527912 .
- ^ де ла Круз Дж., Карбштейн К., Вулфорд Дж.Л. (2015). «Функции рибосомальных белков при сборке эукариотических рибосом in vivo» . Ежегодный обзор биохимии . 84 : 93–129. doi : 10.1146/annurev-biochem-060614-033917 . ПМЦ 4772166 . ПМИД 25706898 .
- ^ «Срабатываемая по природе трансляция/трансляция РНК» .
- ^ Jump up to: а б с Тирумалай М.Р., Ривас М., Тран К., Фокс Дж.Э. (ноябрь 2021 г.). «Центр пептидилтрансферазы: окно в прошлое» . Микробиол Мол Биол Rev. 85 (4): e0010421. дои : 10.1128/MMBR.00104-21 . ПМЦ 8579967 . ПМИД 34756086 .
- ^ Бенне Р., Слоф П. (1987). «Эволюция механизма синтеза митохондриальных белков». Биосистемы . 21 (1): 51–68. Бибкод : 1987BiSys..21...51B . дои : 10.1016/0303-2647(87)90006-2 . ПМИД 2446672 .
- ^ «Рибосомы» . Архивировано из оригинала 20 марта 2009 г. Проверено 28 апреля 2011 г.
- ^ Паладе Г.Е. (январь 1955 г.). «Маленький дисперсный компонент цитоплазмы» . Журнал биофизической и биохимической цитологии . 1 (1): 59–68. дои : 10.1083/jcb.1.1.59 . ПМЦ 2223592 . ПМИД 14381428 .
- ^ Райнбергер, Ханс-Йорг (сентябрь 2022 г.). «Краткая история биосинтеза белка и исследования рибосом» . Встречи Нобелевских лауреатов в Линдау . Проверено 16 августа 2023 г.
- ^ Робертс Р.Б., изд. (1958). "Введение". Микросомальные частицы и синтез белка . Нью-Йорк: Pergamon Press, Inc.
- ^ «Нобелевская премия по физиологии и медицине 1974 года» . Нобелевская премия.org . Нобелевский фонд. Архивировано из оригинала 26 января 2013 года . Проверено 10 декабря 2012 г.
- ^ «Нобелевская премия по химии 2009 года» . Нобелевский фонд. Архивировано из оригинала 28 апреля 2012 года . Проверено 10 декабря 2012 г.
- ^ Курляндия К.Г. (1960). «Молекулярная характеристика рибонуклеиновой кислоты из рибосом Escherichia coli». Журнал молекулярной биологии . 2 (2): 83–91. дои : 10.1016/s0022-2836(60)80029-0 .
- ^ Уилсон Д.Н., Дудна Кейт Дж.Х. (май 2012 г.). «Строение и функции эукариотической рибосомы» . Перспективы Колд-Спринг-Харбор в биологии . 4 (5): а011536. doi : 10.1101/cshperspect.a011536 . ПМК 3331703 . ПМИД 22550233 .
- ^ Ниссен П., Хансен Дж., Бан Н., Мур П.Б., Стейц Т.А. (август 2000 г.). «Структурные основы активности рибосом при синтезе пептидных связей» (PDF) . Наука . 289 (5481): 920–30. Бибкод : 2000Sci...289..920N . дои : 10.1126/science.289.5481.920 . ПМИД 10937990 . S2CID 8370119 . Архивировано из оригинала (PDF) 30 ноября 2020 г.
- ^ Jump up to: а б Уимберли Б.Т., Бродерсен Д.Е., Клемонс В.М., Морган-Уоррен Р.Дж., Картер А.П., Фонрейн С., Хартч Т., Рамакришнан В. (сентябрь 2000 г.). «Структура рибосомальной субъединицы 30S». Природа . 407 (6802): 327–39. Бибкод : 2000Natur.407..327W . дои : 10.1038/35030006 . ПМИД 11014182 . S2CID 4419944 .
- ^ Jump up to: а б с д и ж г Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Мембраносвязанные рибосомы определяют грубый ЭР» . Молекулярная биология клетки (4-е изд.). Нью-Йорк: Garland Science. п. 342. ИСБН 978-0-8153-4072-0 .
- ^ Jump up to: а б Гарретт Р., Гришэм К.М. (2009). Биохимия (4-е изд.). Службы обучения Cengage. ISBN 978-0-495-11464-2 .
- ^ Коллатц Э., Кюхлер Э., Штеффлер Г., Черниловский А.П. (апрель 1976 г.). «Место реакции рибосомального белка L27 с производным аффинной метки тРНК Met f» . Письма ФЭБС . 63 (2): 283–6. дои : 10.1016/0014-5793(76)80112-3 . ПМИД 770196 .
- ^ Черниловский А.П., Коллатц Э.Э., Штеффлер Г., Кюхлер Э. (январь 1974 г.). «Белки в местах связывания тРНК рибосом Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 71 (1): 230–4. Бибкод : 1974PNAS...71..230C . дои : 10.1073/pnas.71.1.230 . ПМЦ 387971 . ПМИД 4589893 .
- ^ Черниловский А.П., Курланд К.Г., Штёффлер Г. (октябрь 1975 г.). «30S рибосомальные белки, связанные с 3'-концом 16S РНК» . Письма ФЭБС . 58 (1): 281–4. дои : 10.1016/0014-5793(75)80279-1 . ПМИД 1225593 .
- ^ Каллен К.Е. (2009). «Археальные рибосомы». Энциклопедия наук о жизни . Нью-Йорк: факты в архиве. стр. 1–5. дои : 10.1002/9780470015902.a0000293.pub3 . ISBN 9780470015902 . S2CID 243730576 .
- ^ Тирумалай М.Р., Анане-Бедиако Д., Раджеш Р., Фокс Дж.Э. (ноябрь 2021 г.). «Чистые заряды рибосомальных белков кластеров S10 и spc галофилов обратно пропорциональны степени галотолерантности» . Микробиол. Спектр . 9 (3): e0178221. дои : 10.1128/spectrum.01782-21 . ПМЦ 8672879 . ПМИД 34908470 .
- ^ Ван Дж., Дасгупта I, Fox GE (28 апреля 2009 г.). «Многие неуниверсальные рибосомальные белки архей обнаруживаются в консервативных кластерах генов» . Архея . 2 (4): 241–51. дои : 10.1155/2009/971494 . ПМК 2686390 . ПМИД 19478915 .
- ^ Jump up to: а б с Бен-Шем А., Гарро де Лубресс Н., Мельников С., Дженнер Л., Юсупова Г., Юсупов М. (декабрь 2011 г.). «Структура эукариотической рибосомы с разрешением 3,0 Å» . Наука 334 (6062): 1524–9. Бибкод : 2011Наука... 334.1524B дои : 10.1126/science.1212642 . ПМИД 22096102 . S2CID 9099683 .
- ^ Jump up to: а б Рабл Дж., Лейбундгут М., Атаиде С.Ф., Хааг А., Бан Н. (февраль 2011 г.). «Кристаллическая структура рибосомальной субъединицы 40S эукариот в комплексе с фактором инициации 1» (PDF) . Наука . 331 (6018): 730–6. Бибкод : 2011Sci...331..730R . дои : 10.1126/science.1198308 . hdl : 20.500.11850/153130 . ПМИД 21205638 . S2CID 24771575 .
- ^ Jump up to: а б Клинге С., Фойгтс-Хоффманн Ф., Лейбундгут М., Арпагаус С., Бан Н. (ноябрь 2011 г.). «Кристаллическая структура эукариотической рибосомальной субъединицы 60S в комплексе с фактором инициации 6». Наука . 334 (6058): 941–8. Бибкод : 2011Sci...334..941K . дои : 10.1126/science.1211204 . ПМИД 22052974 . S2CID 206536444 .
- ^ Фабижански С., Пеллегрини М. (1977). «Идентификация белков в месте связывания пептидил-тРНК рибосом печени крысы». Молекулярная и общая генетика . 184 (3): 551–6. дои : 10.1007/BF00431588 . ПМИД 6950200 . S2CID 9751945 .
- ^ Агравал Р.К., Шарма М.Р. (декабрь 2012 г.). «Структурные аспекты митохондриального трансляционного аппарата» . Современное мнение в области структурной биологии . 22 (6): 797–803. дои : 10.1016/j.sbi.2012.08.003 . ПМЦ 3513651 . ПМИД 22959417 .
- ^ Шарма М.Р., Бут Т.М., Симпсон Л., Маслов Д.А., Агравал Р.К. (июнь 2009 г.). «Структура митохондриальной рибосомы с минимальной РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (24): 9637–42. Бибкод : 2009PNAS..106.9637S . дои : 10.1073/pnas.0901631106 . ПМК 2700991 . ПМИД 19497863 .
- ^ Вальц Ф., Нгуен Т.Т., Арриве М., Бохлер А., Чичер Дж., Хамманн П., Кун Л., Куадрадо М., Миро Х., Хашем И., Жьеже П. (январь 2019 г.). «Маленькое значит большое в митохондриальной рибосоме Arabidopsis». Природные растения . 5 (1): 106–117. дои : 10.1038/s41477-018-0339-y . ПМИД 30626926 . S2CID 58004990 .
- ^ Арчибальд Дж. М., Лейн CE (2009). «Идет, идет, но не совсем ушел: нуклеоморфы как пример редукции ядерного генома» . Журнал наследственности . 100 (5): 582–90. дои : 10.1093/jhered/esp055 . ПМИД 19617523 .
- ^ «Специализированные внутренние структуры прокариот | Безграничная микробиология» . Courses.lumenlearning.com . Проверено 24 сентября 2021 г.
- ^ Рехт М.И., Даутвейт С., Пуглиси Дж.Д. (июнь 1999 г.). «Основы прокариотической специфичности действия аминогликозидных антибиотиков» . Журнал ЭМБО . 18 (11): 3133–8. дои : 10.1093/emboj/18.11.3133 . ПМЦ 1171394 . ПМИД 10357824 .
- ^ О'Брайен Т.В. (май 1971 г.). «Общее распространение 55 S-рибосом в митохондриях печени млекопитающих» . Журнал биологической химии . 246 (10): 3409–17. дои : 10.1016/S0021-9258(18)62239-2 . ПМИД 4930061 .
- ^ «Подавление костного мозга, вызванное хлорамфениколом» . ДЖАМА . 213 (7): 1183–1184. 17 августа 1970 г. дои : 10.1001/jama.1970.03170330063011 . ISSN 0098-7484 . ПМИД 5468266 .
- ^ Ньюман С.М., Бойнтон Дж.Э., Гиллхэм Н.В., Рэндольф-Андерсон Б.Л., Джонсон А.М., Харрис Э.Х. (декабрь 1990 г.). «Трансформация генов рибосомальной РНК хлоропластов у хламидомонады: молекулярная и генетическая характеристика событий интеграции» . Генетика . 126 (4): 875–88. дои : 10.1093/генетика/126.4.875 . ПМК 1204285 . ПМИД 1981764 .
- ^ Пенев П.И., Фахретаха-Аваль С., Патель В.Дж., Кэнноне Дж.Дж., Гутелл Р.Р., Петров А.С., Уильямс Л.Д., Гласс Дж.Б. (август 2020 г.). «Увеличенные сегменты расширения рибосомальной РНК у архей Асгарда» . Геномная биология и эволюция . 12 (10): 1694–1710. дои : 10.1093/gbe/evaa170 . ПМЦ 7594248 . ПМИД 32785681 .
- ^ Jump up to: а б Бан Н., Ниссен П., Хансен Дж., Мур П.Б., Стейц Т.А. (август 2000 г.). «Полная атомная структура большой субъединицы рибосомы с разрешением 2,4 А». Наука . 289 (5481): 905–20. Бибкод : 2000Sci...289..905B . CiteSeerX 10.1.1.58.2271 . дои : 10.1126/science.289.5481.905 . ПМИД 10937989 .
- ^ Шлуенцен Ф, Точил А, Заривач Р, Хармс Дж, Глюманн М, Джанелл Д, Башан А, Бартельс Х, Агмон И, Франчески Ф, Йонат А (сентябрь 2000 г.). «Структура функционально активированной малой рибосомальной субъединицы с разрешением 3,3 ангстрема» . Клетка . 102 (5): 615–23. дои : 10.1016/S0092-8674(00)00084-2 . ПМИД 11007480 . S2CID 1024446 .
- ^ Юсупов М.М., Юсупова Г.З., Бауком А., Либерман К., Эрнест Т.Н., Кейт Дж.Х., Ноллер Х.Ф. (май 2001 г.). «Кристаллическая структура рибосомы при разрешении 5,5 А» . Наука . 292 (5518): 883–96. Бибкод : 2001Sci...292..883Y . дои : 10.1126/science.1060089 . ПМИД 11283358 . S2CID 39505192 .
- ^ Шувирт Б.С., Боровинская М.А., Хау К.В., Чжан В., Вила-Санджурджо А., Холтон Дж.М., Кейт Дж.Х. (ноябрь 2005 г.). «Структуры бактериальной рибосомы при разрешении 3,5 А». Наука . 310 (5749): 827–34. Бибкод : 2005Sci...310..827S . дои : 10.1126/science.1117230 . ПМИД 16272117 . S2CID 37382005 .
- ^ Митра К., Шаффитцель С., Шейх Т., Тама Ф., Дженни С., Брукс К.Л., Бан Н., Фрэнк Дж. (ноябрь 2005 г.). «Структура белка-проводящего канала E. coli, связанного с транслирующей рибосомой» . Природа . 438 (7066): 318–24. Бибкод : 2005Natur.438..318M . дои : 10.1038/nature04133 . ПМЦ 1351281 . ПМИД 16292303 .
- ^ Селмер М., Данэм К.М., Мерфи Ф.В., Вейкслбаумер А., Петри С., Келли А.С., Вейр Дж.Р., Рамакришнан В. (сентябрь 2006 г.). «Структура рибосомы 70S в комплексе с мРНК и тРНК». Наука . 313 (5795): 1935–42. Бибкод : 2006Sci...313.1935S . дои : 10.1126/science.1131127 . ПМИД 16959973 . S2CID 9737925 .
- ^ Коростелев А, Траханов С, Лаурберг М, Ноллер Х.Ф. (сентябрь 2006 г.). «Кристаллическая структура комплекса 70S рибосома-тРНК обнаруживает функциональные взаимодействия и перестройки» . Клетка . 126 (6): 1065–77. дои : 10.1016/j.cell.2006.08.032 . ПМИД 16962654 . S2CID 13452915 .
- ^ Юсупова Г., Дженнер Л., Рис Б., Морас Д., Юсупов М. (ноябрь 2006 г.). «Структурная основа движения информационной РНК по рибосоме». Природа . 444 (7117): 391–4. Бибкод : 2006Natur.444..391Y . дои : 10.1038/nature05281 . ПМИД 17051149 . S2CID 4419198 .
- ^ Jump up to: а б «Специализированные внутренние структуры прокариот» . Courses.lumenlearning.com . Безграничная микробиология . Проверено 27 сентября 2018 г.
- ^ Лафонтен, Д.; Толлерви, Д. (2001). «Функция и синтез рибосом». Nat Rev Mol Cell Biol . 2 (7): 514–520. дои : 10.1038/35080045 . hdl : 1842/729 . ПМИД 11433365 . S2CID 2637106 .
- ^ Савир Ю., Тлусти Т. (апрель 2013 г.). «Рибосома как оптимальный декодер: урок молекулярного распознавания» . Клетка . 153 (2): 471–479. Бибкод : 2013APS..MARY46006T . дои : 10.1016/j.cell.2013.03.032 . ПМИД 23582332 .
- ^ Коркмаз Г., Саньял С. (сентябрь 2017 г.). « Эшерихия коли » . Журнал биологической химии . 292 (36): 15134–15142. дои : 10.1074/jbc.M117.785238 . ПМК 5592688 . ПМИД 28743745 .
- ^ Коневега А.Л., Соболева Н.Г., Махно В.И., Семенков Ю.П., Винтермейер В., Роднина М.В., Катунин В.И. (январь 2004 г.). «Пуриновые основания в положении 37 тРНК стабилизируют взаимодействие кодон-антикодон в сайте рибосомы А за счет стэкинга и Mg 2+ -зависимые взаимодействия» . РНК . 10 (1): 90–101. doi : /rna.5142404 . PMC 1370521. . PMID 14681588 10.1261
- ^ Роднина М.В., Берингер М., Винтермейер В. (январь 2007 г.). «Как рибосомы образуют пептидные связи». Тенденции биохимических наук . 32 (1): 20–26. дои : 10.1016/j.tibs.2006.11.007 . ПМИД 17157507 .
- ^ Чех, ТР (август 2000 г.). «Структурная биология. Рибосома — это рибозим». Наука . 289 (5481): 878–879. дои : 10.1126/science.289.5481.878 . ПМИД 10960319 . S2CID 24172338 .
- ^ Банерджи Д., Саньял С. (октябрь 2014 г.). «Активность сворачивания белка рибосомы (PFAR) – мишень для антиприонных соединений» . Вирусы . 6 (10): 3907–3924. дои : 10.3390/v6103907 . ПМЦ 4213570 . ПМИД 25341659 .
- ^ Федоров А.Н., Болдуин Т.О. (декабрь 1997 г.). «Котрансляционное сворачивание белка» . Журнал биологической химии . 272 (52): 32715–32718. дои : 10.1074/jbc.272.52.32715 . ПМИД 9407040 .
- ^ Болдуин Р.Л. (июнь 1975 г.). «Промежуточные соединения в реакциях сворачивания белков и механизм сворачивания белков». Ежегодный обзор биохимии . 44 (1): 453–475. дои : 10.1146/annurev.bi.44.070175.002321 . ПМИД 1094916 .
- ^ Дас Д., Дас А., Саманта Д., Гош Дж., Дасгупта С., Бхаттачарья А., Басу А., Саньял С., Дас Гупта С. (август 2008 г.). «Роль рибосомы в сворачивании белка» (PDF) . Биотехнологический журнал . 3 (8): 999–1009. дои : 10.1002/biot.200800098 . ПМИД 18702035 .
- ^ Домбровский-Тумански П., Пейко М., Невецчерзал С., Стасяк А., Сулковска Дж.И. (декабрь 2018 г.). «Связывание белков путем активного пронизывания возникающей полипептидной цепи, выходящей из выходного канала рибосомы». Журнал физической химии Б. 122 (49): 11616–11625. doi : 10.1021/acs.jpcb.8b07634 . ПМИД 30198720 . S2CID 52176392 .
- ^ Брандман О, Стюарт-Орнштейн Дж, Вонг Д, Ларсон А, Уильямс CC, Ли Г.В., Чжоу С, Кинг Д, Шен П.С., Вайбезан Дж., Данн Дж.Г., Рускин С., Инада Т., Фрост А., Вайсман Дж.С. (ноябрь 2012 г.) . «Комплекс контроля качества, связанный с рибосомами, запускает деградацию возникающих пептидов и сигнализирует о стрессе трансляции» . Клетка . 151 (5): 1042–1054. дои : 10.1016/j.cell.2012.10.044 . ПМЦ 3534965 . ПМИД 23178123 .
- ^ Дефенуйер К., Яо Й., Муайкель Дж., Намане А., Галопиер А., Декурти Л., Дуайен А., Малабат С., Савану С., Жакье А., Фромон-Расин М. (март 2013 г.). «Связанный с Cdc48 комплекс, связанный с частицами 60S, необходим для выведения аберрантных продуктов трансляции» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (13): 5046–5051. Бибкод : 2013PNAS..110.5046D . дои : 10.1073/pnas.1221724110 . ПМЦ 3612664 . ПМИД 23479637 .
- ^ Шен П.С., Пак Дж., Цинь Ю., Ли Х, Парсавар К., Ларсон М.Х., Кокс Дж., Ченг Ю., Ламбовиц А.М., Вайсман Дж.С., Брандман О., Фрост А. (январь 2015 г.). «Синтез белка. Рибосомальные субъединицы Rqc2p и 60S опосредуют мРНК-независимое удлинение возникающих цепей» . Наука . 347 (6217): 75–78. Бибкод : 2015Sci...347...75S . дои : 10.1126/science.1259724 . ПМЦ 4451101 . ПМИД 25554787 .
- ^ Кили, Дж.; Гутников Р. (2 января 2015 г.). «Исследования рибосом открывают новый механизм синтеза белка» (Пресс-релиз). Медицинский институт Говарда Хьюза . Архивировано из оригинала 12 января 2015 года . Проверено 16 января 2015 г.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Мембраносвязанные рибосомы определяют грубый ЭР» . Молекулярная биология клетки (4-е изд.). Нью-Йорк: Garland Science. ISBN 978-0-8153-4072-0 .
- ^ Кресслер, Дитер; Больно, Эд; Баблер, Йохен (2009). «Управление сборкой рибосом» (PDF) . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1803 (6): 673–683. дои : 10.1016/j.bbamcr.2009.10.009 . ПМИД 19879902 .
- ^ Танец, Эмбер (28 февраля 2023 г.). «Как зародилась жизнь? Становится понятен один ключевой ингредиент: команда учёного, лауреата Нобелевской премии, сделала большой шаг вперёд в своём стремлении реконструировать раннюю земную РНК, способную строить белки» . Природа . 615 (7950): 22–25. дои : 10.1038/d41586-023-00574-4 . ПМИД 36854922 .
- ^ Jump up to: а б Ноллер HF (апрель 2012 г.). «Эволюция синтеза белков из мира РНК» . Перспективы Колд-Спринг-Харбор в биологии . 4 (4): а003681. doi : 10.1101/cshperspect.a003681 . ПМЦ 3312679 . ПМИД 20610545 .
- ^ Даббс Э.Р. (1986). Мутантные исследования прокариотической рибосомы . Нью-Йорк: Springer-Verlag.
- ^ Ноллер Х.Ф., Хоффарт В., Зимняк Л. (июнь 1992 г.). «Необычная устойчивость пептидилтрансферазы к процедурам экстракции белка». Наука . 256 (5062): 1416–9. Бибкод : 1992Sci...256.1416N . дои : 10.1126/science.1604315 . ПМИД 1604315 .
- ^ Номура М., Мидзушима С., Одзаки М., Трауб П., Лоури К.В. (1969). «Структура и функции рибосом и их молекулярных компонентов». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 34 : 49–61. дои : 10.1101/sqb.1969.034.01.009 . ПМИД 4909519 .
- ^ Крупкин М., Мацов Д., Тан Х., Мец М., Калаора Р., Белоусов М.Дж., Циммерман Е., Башан А., Йонат А. (октябрь 2011 г.). «Внутри современной рибосомы функционирует остатки пребиотической связывающей машины» . Фил. Пер. Р. Сок. Б. 366 (1580): 2972–8. дои : 10.1098/rstb.2011.0146 . ПМК 3158926 . ПМИД 21930590 .
- ^ Бозе Т., Фридкин Г., Давидович С., Крупкин М., Дингер Н., Фалькович А.Х., Пелег Ю., Агмон И., Башан А., Йонат А. (февраль 2022 г.). «Происхождение жизни: проторибосома образует пептидные связи и связывает миры, в которых доминируют РНК и белки» . Нуклеиновые кислоты Рез . 50 (4): 1815–1828. дои : 10.1093/nar/gkac052 . ПМЦ 8886871 . ПМИД 35137169 .
- ^ Jump up to: а б Рут-Бернштейн М., Рут-Бернштейн Р. (февраль 2015 г.). «Рибосома как недостающее звено в эволюции жизни» . Журнал теоретической биологии . 367 : 130–158. дои : 10.1016/j.jtbi.2014.11.025 . ПМИД 25500179 .
- ^ Ярус М (2002). «Изначальная генетика: фенотип рибоцита». Ежегодный обзор генетики . 36 : 125–51. дои : 10.1146/annurev.genet.36.031902.105056 . ПМИД 12429689 .
- ^ Фортер П., Крупович М. (2012). «Происхождение вирионов и вироклеток: пересмотр гипотезы побега». Вирусы: незаменимые агенты жизни . стр. 43–60. дои : 10.1007/978-94-007-4899-6_3 . ISBN 978-94-007-4898-9 .
- ^ Каэтано-Аноллес Дж., Сойфферхельд MJ (2013). «Коэволюционные корни биохимии и клеточной организации бросают вызов мировой парадигме РНК». Журнал молекулярной микробиологии и биотехнологии . 23 (1–2): 152–77. дои : 10.1159/000346551 . ПМИД 23615203 . S2CID 41725226 .
- ^ Саладино Р., Ботта Дж., Пино С., Костанцо Дж., Ди Мауро Э. (август 2012 г.). «Сначала генетика или сначала метаболизм? Ключ к формамиду». Обзоры химического общества . 41 (16): 5526–65. дои : 10.1039/c2cs35066a . hdl : 11573/494138 . ПМИД 22684046 .
- ^ Fox GE (сентябрь 2010 г.). «Происхождение и эволюция рибосомы» . Колд Спринг Харб Перспектива Биол . 2 (9): а003483. doi : 10.1101/cshperspect.a003483 . ПМЦ 2926754 . ПМИД 20534711 .
- ^ Фокс Дж.Э. (2016). «Происхождение и ранняя эволюция рибосомы». В Эрнандесе Дж., Ягусе Р. (ред.). Эволюция механизма синтеза белка и его регуляция . Швейцария: Springer, Cham. стр. 31–60. дои : 10.1007/978-3-319-39468-8 . ISBN 978-3-319-39468-8 . S2CID 27493054 .
- ^ Ши З, Фуджи К., Ковари К.М., Генут Н.Р., Рёст Х.Л., Теруэль М.Н., Барна М. (июль 2017 г.). «Гетерогенные рибосомы преимущественно транслируют различные субпулы мРНК по всему геному» . Молекулярная клетка . 67 (1). Эльзевир Б.В.: 71–83.e7. doi : 10.1016/j.molcel.2017.05.021 . ПМК 5548184 . ПМИД 28625553 .
- ^ Сюэ С., Барна М. (май 2012 г.). «Специализированные рибосомы: новый рубеж в регуляции генов и биологии организма» . Обзоры природы. Молекулярно-клеточная биология . 13 (6). ООО «Спрингер Сайенс энд Бизнес Медиа»: 355–369. дои : 10.1038/nrm3359 . ПМК 4039366 . ПМИД 22617470 .
- ^ Ферретти М.Б., Карбштейн К. (май 2019 г.). «Действительно ли существует функциональная специализация рибосом?» . РНК . 25 (5). Лаборатория Колд-Спринг-Харбор: 521–538. дои : 10.1261/rna.069823.118 . ПМК 6467006 . ПМИД 30733326 .
- ^ Фарли-Барнс К.И., Огава Л.М., Басерга С.Дж. (октябрь 2019 г.). «Рибосомопатии: старые концепции, новые противоречия» . Тенденции в генетике . 35 (10). Эльзевир Б.В.: 754–767. дои : 10.1016/j.tig.2019.07.004 . ПМЦ 6852887 . ПМИД 31376929 .
- ^ Мауро, вице-президент, генеральный директор Edelman (сентябрь 2002 г.). «Гипотеза рибосомного фильтра» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (19): 12031–6. Бибкод : 2002PNAS...9912031M . дои : 10.1073/pnas.192442499 . ПМК 129393 . ПМИД 12221294 .
- ^ Сюэ С., Барна М. (май 2012 г.). «Специализированные рибосомы: новый рубеж в регуляции генов и биологии организма» . Обзоры природы. Молекулярно-клеточная биология . 13 (6): 355–69. дои : 10.1038/nrm3359 . ПМК 4039366 . ПМИД 22617470 .
- ^ Матис А.Д., Нейлор Б.К., Карсон Р.Х., Эванс Э., Харвелл Дж., Кнехт Дж., Хексем Э., Пилор Ф.Ф., Миллер Б.Ф., Гамильтон К.Л., Transtrum MK, Бикман Б.Т., Прайс Дж.К. (февраль 2017 г.). «Механизмы изменения содержания рибосом in vivo в ответ на сигналы питательных веществ» . Молекулярная и клеточная протеомика . 16 (2): 243–254. дои : 10.1074/mcp.M116.063255 . ПМК 5294211 . ПМИД 27932527 .
- ^ Стеффен К.К., Маккормик М.А., Фам К.М., Маккей В.Л., Делани Дж.Р., Мураками С.Дж. и др. (май 2012 г.). «Дефицит рибосом защищает от стресса ЭР у Saccharomyces cerevisiae» . Генетика . 191 (1). Американское генетическое общество: 107–118. дои : 10.1534/genetics.111.136549 . ПМЦ 3338253 . ПМИД 22377630 .
- ^ Ли С.В., Бергер С.Дж., Мартинович С., Паса-Толич Л., Андерсон Г.А., Шен Ю. и др. (апрель 2002 г.). «Прямой масс-спектрометрический анализ интактных белков большой рибосомальной субъединицы дрожжей с использованием капиллярной ЖХ/FTICR» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (9): 5942–5947. Бибкод : 2002PNAS...99.5942L . дои : 10.1073/pnas.082119899 . ПМК 122881 . ПМИД 11983894 .
- ^ Кэрролл А.Дж., Хизлвуд Дж.Л., Ито Дж., Миллар А.Х. (февраль 2008 г.). «Анализ протеома цитозольных рибосом арабидопсиса дает детальное представление о его компонентах и их посттрансляционных модификациях» . Молекулярная и клеточная протеомика . 7 (2): 347–369. дои : 10.1074/mcp.m700052-mcp200 . ПМИД 17934214 .
- ^ Одинцова Т.И., Мюллер ЕС, Иванов А.В., Егоров Т.А., Бинерт Р., Владимиров С.Н. и др. (апрель 2003 г.). «Характеристика и анализ посттрансляционных модификаций белков субъединиц больших цитоплазматических рибосом человека с помощью масс-спектрометрии и секвенирования Эдмана». Журнал белковой химии . 22 (3): 249–258. дои : 10.1023/а:1025068419698 . ПМИД 12962325 . S2CID 10710245 .
- ^ Ю Ю, Джи Х, Дудна Дж. А., Лири Дж. А. (июнь 2005 г.). «Масс-спектрометрический анализ 40S рибосомальной субъединицы человека: нативные и IRES-связанные комплексы ВГС» . Белковая наука . 14 (6): 1438–1446. дои : 10.1110/ps.041293005 . ПМЦ 2253395 . ПМИД 15883184 .
- ^ Зейдан К., Ван З., Де Майо А., Харт Г.В. (июнь 2010 г.). «Циклирующие ферменты O-GlcNAc связываются с механизмом трансляции и модифицируют основные рибосомальные белки» . Молекулярная биология клетки . 21 (12): 1922–1936. дои : 10.1091/mbc.e09-11-0941 . ПМЦ 2883937 . ПМИД 20410138 .
- ^ Лэндри Д.М., Герц М.И., Томпсон С.Р. (декабрь 2009 г.). «RPS25 необходим для инициации трансляции IRES дицистовирусов и вируса гепатита С» . Гены и развитие . 23 (23): 2753–2764. дои : 10.1101/gad.1832209 . ПМЦ 2788332 . ПМИД 19952110 .
- ^ Декейтер В.А., Фурнье М.Дж. (июль 2002 г.). «Модификации рРНК и функция рибосомы». Тенденции биохимических наук . 27 (7): 344–51. дои : 10.1016/s0968-0004(02)02109-6 . ПМИД 12114023 .
- ^ Натчиар С.К., Мясников А.Г., Кратцат Х., Хаземанн И., Клахольц Б.П. (ноябрь 2017 г.). «Визуализация химических модификаций в структуре 80S рибосомы человека». Природа . 551 (7681): 472–477. Бибкод : 2017Natur.551..472N . дои : 10.1038/nature24482 . ПМИД 29143818 . S2CID 4465175 .
- ^ Го Х (август 2018 г.). «Специализированные рибосомы и контроль трансляции». Труды Биохимического общества . 46 (4): 855–869. дои : 10.1042/BST20160426 . ПМИД 29986937 . S2CID 51609077 .
Внешние ссылки
[ редактировать ]- Лабораторный компьютер имитирует движение рибосомы
- Роль рибосомы , Гвен В. Чайлдс, скопировано здесь
- Рибосома в Proteopedia — Бесплатная совместная трехмерная энциклопедия белков и других молекул.
- Семейства рибосомальных белков в ExPASy. Архивировано 30 апреля 2011 г. в Wayback Machine.
- Молекула месяца. Архивировано 27 октября 2009 г. в Wayback Machine © RCSB Protein Data Bank :
- Рибосома. Архивировано 14 ноября 2010 г. в Wayback Machine.
- Факторы удлинения. Архивировано 16 марта 2011 г. в Wayback Machine.
- Паладес
- 3D-структуры рибосом электронной микроскопии в Банке данных EM (EMDB)
 В этой статье использованы общедоступные материалы из Научный букварь . НКБИ . Архивировано из оригинала 8 декабря 2009 г.
В этой статье использованы общедоступные материалы из Научный букварь . НКБИ . Архивировано из оригинала 8 декабря 2009 г.