Хлорид олова(II)

| |||
| |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена
Хлорид олова(II)
Дихлорид олова | |||
Другие имена
| |||
| Идентификаторы | |||
| |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.028.971 | ||
| Номер ЕС |
| ||
| номер Е | Е512 (регуляторы кислотности,...) | ||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ |
| ||
| Число | 3260 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| SnCl 2 | |||
| Молярная масса | 189,60 г/моль (безводный) 225,63 г/моль (дигидрат) | ||
| Появление | Белое кристаллическое твердое вещество | ||
| Запах | без запаха | ||
| Плотность | 3,95 г/см 3 (безводный) 2,71 г/см 3 (дигидрат) | ||
| Температура плавления | 247 ° C (477 ° F, 520 К) (безводный) 37,7 ° C (дигидрат) | ||
| Точка кипения | 623 ° C (1153 ° F, 896 К) (разлагается) | ||
| 83,9 г/100 мл (0 °С) Гидролизуется в горячей воде | |||
| Растворимость | растворим в этаноле , ацетоне , эфире , тетрагидрофуране нерастворим в ксилоле | ||
| −69.0·10 −6 см 3 /моль | |||
| Структура | |||
| Структура слоев (цепочки групп SnCl 3 ) | |||
| Тригонально-пирамидальный (безводный) Дигидрат также трехкоординатный | |||
| Бент (газовая фаза) | |||
| Термохимия | |||
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
−325 кДж/моль | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности
|
Раздражает, опасен для водных организмов. | ||
| СГС Маркировка : [ 2 ] | |||
  
| |||
| Опасность | |||
| Х290 , Х302+Х332 , Х314 , Х317 , Х335 , Х373 , Х412 | |||
| P260 , P273 , P280 , P303+P361+P353 , P304+P340+P312 , P305+P351+P338+P310 | |||
| NFPA 704 (огненный алмаз) | |||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза )
|
700 мг/кг (крыса, перорально) 10 000 мг/кг (кролик, перорально) 250 мг/кг (мыши, перорально) [ 1 ] | ||
| Паспорт безопасности (SDS) | ICSC 0955 (безводный) ICSC 0738 (дигидрат) | ||
| Родственные соединения | |||
Другие анионы
|
фторид олова(II) Бромид олова(II) Йодид олова(II) | ||
Другие катионы
|
дихлорид германия Хлорид олова(IV) Хлорид свинца(II) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Хлорид олова(II) , также известный как хлорид олова , представляет собой белое кристаллическое твердое вещество с формулой Sn Cl 2 . Он образует стабильный дигидрат , но водные растворы имеют тенденцию подвергаться гидролизу , особенно если они горячие. SnCl 2 широко применяется в качестве восстановителя (в растворах кислот), а также в электролитических ваннах при лужении . Хлорид олова (II) не следует путать с другим хлоридом олова; хлорид олова(IV) или хлорид олова (SnCl 4 ).
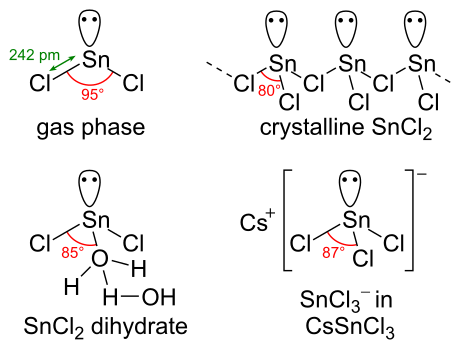
Химическая структура
[ редактировать ]SnCl 2 имеет неподеленную пару электронов . , поэтому молекула в газовой фазе изогнута В твердом состоянии кристаллический SnCl 2 образует цепи, связанные хлоридными мостиками, как показано. У дигидрата также есть три координаты: одна вода на банке, а другая вода на первой. Основная часть молекулы укладывается в двойные слои кристаллической решетки , между которыми находится «вторая» вода.

Химические свойства
[ редактировать ]Хлорид олова(II) может растворяться в воде, меньшей его собственной массы, без видимого разложения, но по мере разбавления раствора происходит гидролиз с образованием нерастворимой основной соли:
- SnCl 2 (водн.) + H 2 O (ж) ⇌ Sn(OH)Cl (тв) + HCl (водн.)
Следовательно, если необходимо использовать прозрачные растворы хлорида олова (II), его необходимо растворить в соляной кислоте (обычно той же или большей молярности, что и хлорид олова) для поддержания равновесия в левой части (используя формулу Ле Шателье) . принцип ). Растворы SnCl 2 также неустойчивы к окислению воздухом:
- 6 SnCl 2 (водн.) + O 2 (г) + 2 H 2 O (ж) → 2 SnCl 4 (водн.) + 4 Sn(OH)Cl (тв)
Этого можно избежать, храня раствор над кусками металлического олова. [ 4 ]
Существует множество таких случаев, когда хлорид олова(II) действует как восстановитель, восстанавливая соли серебра и золота до металла, а соли железа(III) до железа(II), например:
- SnCl 2 (водный) + 2 FeCl 3 (водный) → SnCl 4 (водный) + 2 FeCl 2 (водный)
Он также восстанавливает медь(II) до меди(I).
Растворы хлорида олова(II) могут служить и просто источником Sn. 2+ ионы, которые могут образовывать другие соединения олова (II) в результате осаждения реакций . Например, реакция с сульфидом натрия дает коричнево-черный сульфид олова (II) :
- SnCl 2 (водн.) + Na 2 S (водн.) → SnS (тв) + 2 NaCl (водн.)
Если добавить щелочь к раствору SnCl 2 белый осадок гидратированного оксида олова(II) , сначала образуется ; затем он растворяется в избытке основания с образованием станнитной соли, такой как станнит натрия:
- SnCl 2 (водный) + 2 NaOH (водный) → SnO·H 2 O (тв) + 2 NaCl (водный)
- SnO·H 2 O(т) + NaOH (водн.) → NaSn(OH) 3 (водн.)
Безводный SnCl 2 можно использовать для получения множества интересных соединений олова(II) в неводных растворителях. Например, литиевая соль 4- метил -2,6-ди-трет-бутилфенола реагирует с SnCl 2 в ТГФ с образованием желтого линейного двухкоординационного соединения Sn(OAr) 2 (Ar = арил ). [ 5 ]
Хлорид олова(II) также ведет себя как кислота Льюиса , образуя комплексы с такими лигандами , как хлорид- ион, например:
- SnCl 2 (водный) + CsCl (водный) → CsSnCl 3 (водный)
Большинство этих комплексов имеют пирамидальную форму , и поскольку такие комплексы, как SnCl −
3 имеют полный октет , тенденция к добавлению более одного лиганда невелика. Однако неподеленная пара электронов в таких комплексах доступна для связывания, и поэтому сам комплекс может действовать как основание или лиганд Льюиса . Это наблюдается в связанном с ферроценом продукте следующей реакции:
- SnCl 2 + Fe(η 5 -C 5 H 5 )(CO) 2 HgCl → Fe(n 5 -C 5 H 5 )(CO) 2 SnCl 3 + Hg
SnCl 2 можно использовать для получения множества таких соединений, содержащих связи металл-металл. Например, реакция с октакарбонилом дикобальта :
- SnCl 2 + Co 2 (CO) 8 → (CO) 4 Co-(SnCl 2 )-Co(CO) 4
Подготовка
[ редактировать ]Безводный SnCl 2 получают действием сухого газообразного хлористого водорода на металлическое олово . Дигидрат получают аналогичной реакцией с использованием соляной кислоты :
- Sn(s) + 2 HCl (водн.) → SnCl 2 (водн.) + Н 2 (г)
Затем воду осторожно выпаривают из кислого раствора с образованием кристаллов SnCl 2 ·2H 2 O. Этот дигидрат можно дегидратировать до ангидратации с помощью уксусного ангидрида . [ 6 ]
Использование
[ редактировать ]Раствор хлорида олова(II), содержащий небольшое количество соляной кислоты, применяется для лужения стали и изготовления консервных банок . Прикладывается электрический потенциал, и металлическое олово образуется на катоде посредством электролиза .
Хлорид олова(II) используется в качестве протравы тканей при крашении , поскольку он дает более яркие цвета с некоторыми красителями, например, с кошенилью . Эту протраву также использовали отдельно для увеличения веса шелка.
В последние годы все большее число брендов зубных паст добавляют в свою формулу хлорид олова(II) для защиты от эрозии эмали, например Oral-B или Elmex .
Он используется в качестве катализатора в производстве пластиковой полимолочной кислоты (PLA).
Он также находит применение в качестве катализатора между ацетоном и перекисью водорода с образованием тетрамерной формы пероксида ацетона .
Хлорид олова(II) также находит широкое применение в качестве восстановителя . Это видно по его использованию для серебрения зеркал, когда серебро на стекло наносится металлическое :
- Сн 2+ (вода) + 2 Ag + → Сн 4+ (водн.) + 2 Ag(s)
Соответствующее сокращение традиционно использовалось в качестве аналитического теста для ртуть 2+ (акв) . Например, если SnCl 2 добавить по каплям в раствор хлорида ртути(II) белый осадок хлорида ртути(I) , сначала образуется ; при добавлении большего количества SnCl 2 он становится черным, поскольку образуется металлическая ртуть.
Хлорид олова также используется многими любителями и профессионалами в области очистки драгоценных металлов для проверки наличия солей золота . [ 7 ] Когда SnCl 2 вступает в контакт с соединениями золота, особенно солями хлораурата , он образует ярко-фиолетовый коллоид, известный как пурпур Кассия . [ 8 ] Аналогичная реакция происходит с солями платины и палладия , которые становятся зелеными и коричневыми соответственно. [ 9 ]
При анализе ртути с помощью атомно-абсорбционной спектроскопии необходимо использовать метод холодного пара, а в качестве восстановителя обычно используется хлорид олова (II).
В органической химии SnCl 2 в основном используется при восстановлении по Стивену , при котором нитрил восстанавливается (через имидоилхлоридную соль) до имина , который легко гидролизуется до альдегида . [ 10 ]
Реакция обычно лучше всего протекает с ароматическими нитрилами Aryl -CN. Родственная реакция (называемая методом Зонна-Мюллера) начинается с амида, который обрабатывается PCl 5 с образованием имидоилхлоридной соли.

Восстановление Стивена сегодня используется реже, поскольку оно в основном заменено восстановлением диизобутилалюминийгидридом .
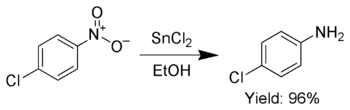
Кроме того, SnCl 2 используется для селективного восстановления ароматических нитрогрупп до анилинов . [ 11 ]
SnCl 2 также восстанавливает хиноны до гидрохинонов .
Хлорид олова также добавляется в качестве пищевой добавки с номером E E512 в некоторые консервированные и бутилированные продукты, где он служит агентом, сохраняющим цвет, и антиоксидантом .
SnCl 2 используется в радионуклидной ангиографии для снижения содержания радиоактивного вещества технеция -99m- пертехнетата , помогающего связываться с клетками крови.
Расплавленный SnCl 2 может быть окислен с образованием высококристаллических наноструктур SnO 2 . [ 12 ] [ 13 ]
Примечания
[ редактировать ]- Н. Н. Гринвуд, А. Эрншоу, Химия элементов , 2-е изд., Баттерворт-Хайнеманн, Оксфорд, Великобритания, 1997.
- Справочник по химии и физике , 71-е издание, CRC Press, Анн-Арбор, Мичиган, 1990.
- Индекс Merck , 7-е издание, Merck & Co, Рэуэй, Нью-Джерси, США, 1960 г.
- А.Ф. Уэллс, « Структурная неорганическая химия» , 5-е изд., Oxford University Press, Оксфорд, Великобритания, 1984.
- Дж. Марч, Передовая органическая химия , 4-е изд., с. 723, Уайли, Нью-Йорк, 1992 год.
Ссылки
[ редактировать ]- ^ «Олово (неорганические соединения, например Sn)» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Запись в базе данных веществ GESTIS Института охраны труда.
- ^ Ж. М. Леже; Дж. Хейнс; А. Атуф (1996). «Поведение котуннитной и посткотуннитовой фаз PbCl 2 и SnCl 2 при высоком давлении ». Дж. Физ. хим. Твердые тела . 57 (1): 7–16. Бибкод : 1996JPCS...57....7L . дои : 10.1016/0022-3697(95)00060-7 .
- ^ Х. Нечамкин (1968). Химия элементов . Нью-Йорк: МакГроу-Хилл.
- ^ Цетинкайя, Б.; Гумрукчу, И.; Лапперт, МФ; и др. (1 марта 1980 г.). «2,6-ди-трет-бутилфеноксиды двухвалентного германия, олова и свинца, а также кристаллическая и молекулярная структура M(OC6H2Me-4-But2-2,6)2 (M = Ge или Sn)» . Журнал Американского химического общества . 102 (6): 2088–2089. дои : 10.1021/ja00526a054 . ISSN 0002-7863 .
- ^ Армарего, ВЛФ; Чай, CLL (2009). Очистка лабораторных химикатов . Берлингтон: Эльзевир , Баттервот-Хайнеманн. дои : 10.1016/B978-1-85617-567-8.50009-3 . ISBN 978-0-08-087824-9 . Проверено 3 февраля 2022 г.
- ^ Как получить хлорид олова для тестирования растворов золота , получено 10 февраля 2023 г.
- ^ Финк, Колин; Патнэм, Гарт (1 июня 1942 г.). «Определение малых количеств золота хлоридом олова» . Аналитическое издание по промышленной и технической химии . 14 (6): 468–470. дои : 10.1021/i560106a008 . ISSN 0096-4484 .
- ^ Сэм (11 июля 2020 г.). «Хлорид олова – тест на наличие золота, платины и палладия» . Золото-Н-лом . Проверено 5 мая 2024 г.
- ^ Уильямс, JW (1955). «β-Нафтальдегид» . Органические синтезы ; Сборник томов , т. 3, с. 626 .
- ^ Ф.Д. Беллами и К. Оу (1984). «Селективное восстановление ароматических нитросоединений хлоридом олова в некислой и неводной среде». Буквы тетраэдра . 25 (8): 839–842. дои : 10.1016/S0040-4039(01)80041-1 .
- ^ Камали, Али; Дивитини, Реза; Дукати, Джорджио; Фрай, Катерина; Дж, Дерек (2014). «Превращение расплавленного SnCl2 в наномонокристаллы SnO2» . CERI Керамика Интернэшнл . 40 (6): 8533–8538. doi : 10.1016/j.ceramint.2014.01.067 . ISSN 0272-8842 . OCLC 5902254906 .
- ^ Камали, Али Реза (2014). «Термокинетическая характеристика хлорида олова (II)» . Журнал термического анализа и калориметрии . 118 (1): 99–104. дои : 10.1007/s10973-014-4004-z . ISSN 1388-6150 . OCLC 5690448892 . S2CID 98207611 .


