Интерферон-альфа/бета-рецептор
| Интерферон (альфа, бета и омега) рецептор 1 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Ifnar1 | ||
| Альт. символы | ИФНАР | ||
| Ген NCBI | 3454 | ||
| HGNC | 5432 | ||
| Омим | 107450 | ||
| Refseq | NM_000629 | ||
| Uniprot | P17181 | ||
| Другие данные | |||
| Локус | Хр. 21 Q22.1 | ||
| |||
| Интерферон (альфа, бета и омега) рецептор 2 | |||
|---|---|---|---|
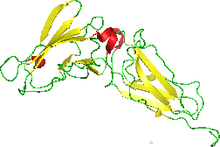 ЯМР-структура интерферон-связывающего эктодомена человеческого рецептора интерферона. [ 1 ] | |||
| Идентификаторы | |||
| Символ | Ifnar2 | ||
| Альт. символы | IFNABR | ||
| Ген NCBI | 3455 | ||
| HGNC | 5433 | ||
| Омим | 602376 | ||
| Refseq | NM_207585 | ||
| Uniprot | P48551 | ||
| Другие данные | |||
| Локус | Хр. 21 Q22.1 | ||
| |||
Рецептор интерферона-α/β (IFNAR) является практически повсеместным мембранным рецептором, который связывает эндогенный интерферон типа I (IFN). Эндогенные IFN человека типа I включают в себя много подтипов, таких как интерфероны -α, -β, -ε, -κ, -ω и -ζ. [ 2 ]
Функция
[ редактировать ]Активация различных врожденных иммунных сигнальных путей ( TLR3 , TLR4 , TLR7 , TLR8 , TLR9 , CGAS , RIG-I , MDA-5 ) приводит к быстрой индукции IFN типа I из-за их (в основном) структуры генов. [ 3 ] [ 4 ] Регуляторные элементы выше генов IFN типа I различаются, позволяя дифференциальной транскрипции IFN типа I в ответ на стимулы. [ 5 ] В частности, IFNβ содержит регуляторный сайт κB, тогда как подтипы IFNα не делают. Производство IFN конкретного типа I обычно ограничено небольшим количеством подтипов IFN типа I. [ 5 ] После секретировки IFN -типа IFNs сигнализируют ифнар паракрином и аутокринным образом. [ 6 ]
IFNAR - это рецептор гетеромерной клеточной поверхности, состоящий из двух субъединиц, называемый субъединицей с низкой аффинностью, IFNAR1 и субъединицей с высокой аффинностью IFNAR2 . [ 7 ] [ 8 ] После связывания интерферонов типа I IFNAR активирует сигнальный путь JAK-Stat , а также MAKK , PI3K и AKT . сигнальные пути [ 2 ] Агонизм IFNAR приводит к изменениям транскрипции с потенциалом увеличения или подавления транскрипции более 2000 различных генов. [ 9 ] Например, IFN типа I индуцируют экспрессию гена-стимулированного интерферона ( ISG ), классически приводящей к надежному антивирусному иммунному ответу. Кроме того, IFN в значительной степени влияют на здоровье и жизнеспособность клеток, с влиянием на апоптоз , аутофагию , дифференцировку клеток и пролиферацию. [ 10 ] Разнообразные эффекты IFN типа I, вероятно, зависят от клеточного и экологического контекста. [ 8 ]
Различные ответы, например, антивирусные против антипролиферативных ответов на подтипы IFN типа I, и проксимальная передача сигналов, такая как фосфорилирование STAT , не коррелирует с результатом. Кроме того, в то время как дифференциальные эффекты проявляются после нескольких дней хронической стимуляции, изменения в структуре рецептора, ориентации или стехиометрии не выяснили причину дифференциальной передачи сигналов через различные подтипы IFN типа I. [ 8 ] [ 11 ] Текущие гипотезы для дифференциальной передачи сигналов включают специфичные для лиганд различия в стабильности или сроке жизни тройного комплекса, [ 12 ] Индуцированные лигандом изменения в интернализации и обороте рецептора [ 8 ] и в настоящее время недооцененные различия в структуре лиганд-рецептор. [ 12 ]
Структура
[ редактировать ]Рецептор IFN типа I образует тройной комплекс, состоящий из двух его субъединиц IFNAR1 и IFNAR2, и лиганда IFN типа I. Связывание лиганда с любой субъединицей требуется для димеризации и активации рецептора и активации. Каждая субъединица IFNAR содержит N-концевой домен связывающего лиганда (с двумя или четырьмя субдоминами типа II типа фибронектина, для IFNAR2 и IFNAR1, соответственно), трансмембранного (TM) домена и цитоплазматического домена. [ 7 ] Каждый IFN -лиганд типа I содержит «горячую точку» или последовательность консервативных аминокислот, которые участвуют в связывании с рецептором, в частности, рецептор с высокой аффинностью, который определяет сродство каждого лиганда к рецептору. [ 11 ]
Структурный анализ рецептора IFN типа I с различными подтипами IFN IFN типа I выявил аналогичный сайт связывания для разных агонистов. [ 8 ] Исследования мутагенеза IFN типа I, IFNAR1 и IFNAR2 продемонстрировали важные остатки связывания, то есть «горячие точки», на подтипах IFN типа I, которые влияли на его способность связываться с IFNAR2. Связывание IFN типа I с IFNAR1 было менее сильно воздействовано мутированием отдельных аминокислот с аланином. [ 9 ] Важно отметить, что структурные исследования не выявили различий в тройных сложных структурах с IFNAR и различными подтипами IFN I типа, несмотря на различия в сродстве лиганда. [ 8 ] Эволюционное сохранение подтипов IFN типа I, связывающего один и тот же рецептор ифнара на одном и том же сайте с различным сродством, предполагает, что IFN типа I не избывают и потенциально регулируют различные клеточные ответы. [ 2 ] [ 11 ] Усилия по разработке более мощного IFNα2 вызвали клеточный ответ, аналогичный IFNβ, что позволяет предположить, что сродство IFN типа I к IFNAR играет важную роль в регулировании отклика нижнего течения. [ 9 ]
Субъединицы
[ редактировать ]Человеческие гены IFNAR1 и IFNAR2 расположены на хромосоме 21q22.1. [ 13 ] [ 14 ]
Ifnar1
[ редактировать ]IFNAR1 является субъединицей с низкой аффинностью, первоначально клонированной в 1990 году и состоит из четырех поддоменов фибронектина типа II (FNII-подобных), называемых SD1-4. [ 7 ] [ 15 ] IFN типа I связывают SD1-3 с типичной аффинностью связывания между 0,5–5 мкм; IFNα1 и IFNβ являются исключениями с связывающим сродством 220 нм и 100 нм соответственно. [ 7 ] IFN типа I имеет скорость связывания 5x10 5 M/S с переменной скоростью диссоциации, которая определяет аффинность IFN IFN типа I к IFNAR1. [ 2 ]
Цитоплазматический домен IFNAR1 ассоциируется с TYK2 , а TYK2 требуется для мембранной экспрессии IFNAR1. [ 2 ] В отсутствие TYK2 цитоплазматический мотив IFNAR1 фосфорилируется, индуцируя интернализацию рецептора. [ 9 ] IFNAR1 затем локализуется в перинуклеарном эндосомальном компартменте и деградируется. [ 8 ] Нулевые клетки TYK2 сохраняют некоторую отзывчивость к IFNβ. Тем не менее, реагирование на IFNα поднимается, вероятно, из -за сниженной экспрессии мембраны IFNAR1. [ 8 ] Связывание IFNAR1 с лигандами с низкой аффинностью, таких как подтипы IFNα, было предложено, чтобы быть ограничивающим скорость стадию в формировании тройного комплекса. [ 8 ] Следовательно, если мембранные уровни IFNAR1 слишком низки, бинарный комплекс IFNα-IFNAR2 не сможет рекрутировать его для индуцированной передачи сигналов. Эта гипотеза подтверждается наблюдениями, что клеточные линии с низкой экспрессией IFNAR1 реагируют на IFNβ, но не IFNα. [ 8 ]
Ifnar2
[ редактировать ]IFNAR2 является субъединицей с высокой аффинностью, первоначально клонированной в 1994 году, состоящей из двух FNII-подобных поддоменов, называемых D1 и D2. [ 7 ] [ 15 ] IFN типа I -IFN связывают D1 и D2 с типичной аффинностью связывания между 0,4–5 нм; IFNβ связывается с немного более низким аффинностью (0,1 нм). [ 7 ] IFN типа I имеет скорость связывания 10 −6 –10 −7 M/S с переменной скоростью диссоциации, которая определяет аффинность IFN IFN типа I к IFNAR2. [ 7 ]
IFNAR2 экспрессируется в виде трех изоформ из -за альтернативного сплайсинга, пропуска экзона и множественных сайтов полиаденилирования; IFNAR2A (растворимая форма, отсутствующая домен TM), IFNAR2B (растворимая форма, в которой отсутствует цитоплазматический домен) и IFNAR2C (граница мембраны, сигнальная компетентная форма). [ 2 ] Цитоплазматический домен IFNAR2C ассоциируется с JAK1 . [ 2 ]
Сигнализация
[ редактировать ]IFN типа I привязывается к IFNAR1 или IFNAR2, образуя бинарный комплекс. [ 9 ] Бинарный комплекс дополнительно набирает оставшуюся субъединицу IFNAR, завершая тройной комплекс и активируя передачу сигналов JAK/Stat . [ 9 ] IFN -лигирование в IFNAR приносит киназы, связанные с рецептором, JAK1 и TYK2, в непосредственную близость, что приводит к трансфосфорилированию киназы и последующему фосфорилированию тирозинов на IFNAR1 и IFNAR2. [ 5 ] [ 7 ] Остатки фосфотирозина на IFNAR1 и IFNAR2 рекрутируют статистики белки [ 7 ] (Классически STAT1 , STAT2 или STAT3 , хотя STAT4 , STAT5 и STAT6 могут играть роль в определенных типах ячеек [ 16 ] ) через их домены SH2 . После набора белки статистики фосфорилируются, которые индуцируют их гомо- или гетеродимеризацию. [ 17 ] Эти димеры транслоцируются в ядро, стимулированные элементы ответа связывания интерферона (ISRE) и гамма-активирующие последовательности (газ), способствуя транскрипции генов. [ 7 ] [ 17 ]
Регулирование
[ редактировать ]В нормальных условиях уровни IFN типа I Гомеостатически регулируются, чтобы сбалансировать преимущества защиты от вирусной инфекции с другими клеточными эффектами, связанными с передачей сигналов IFN I типа, такими как апоптоз, остановка клеточного цикла и иммунная модуляция. [ 9 ] Строгое регулирование передачи сигналов IFN типа I предполагает важность времени и местоположения. [ 5 ] Сигнализация IFN типа I контролируется с помощью различных механизмов, включая дифференциальную экспрессию сигнальных компонентов, [ 18 ] дифференциальная передача сигналов после взаимодействия с ифнаром, [ 9 ] Эндоцитоз и подавление рецепторов. [ 2 ] [ 9 ] [ 15 ] и механизмы отрицательной обратной связи [ 9 ]
Дифференциальное выражение
[ редактировать ]Отзывчивость на IFN типа I требует экспрессии компонентов сигнализации в данной целевой ячейке, включая IFNAR и статистику. Уровни экспрессии и посттрансляционные модификации на IFNAR и статистика могут изменять реакцию клеток. [ 18 ] Важно отметить, что на передачу сигналов влияют различные уровни экспрессии белка статистики и активация гетеродимеров статистики и гомодимеров статистики; Снижение уровней экспрессии статистики изменяет антивирусные, антипролиферативные и воспалительные реакции на ИФН типа I. [ 18 ] И наоборот, повышенная экспрессия STAT1 и IRF9 поддерживает экспрессию ISG, даже в отсутствие постоянной передачи сигналов рецептора цитокинов, тем самым усиливая передачу сигналов IFNAR. [ 18 ] Поскольку передача сигналов IFN типа I модулирует белки, участвующие в трансляции белка, она также может косвенно изменять уровни белка индуцированных генов и белков, участвующих в передаче сигналов пути. [ 18 ]
Подтипы IFN типа I, от 30–70% гомологии, все связывают один и тот же рецептор. [ 9 ] Предвзятый агонизм был изучен, чтобы лучше понять, как один рецептор по -разному реагирует на множественные родственные лиганды, кульминацией которых является разрозненные результаты.
Эндоцитоз и подавление
[ редактировать ]IFNAR1 и IFNAR2 могут быть интернализованы с помощью эндоцитоза в ответ на агонизм через клатрин-зависимые и клатрин-независимые механизмы. [ 2 ] Субъединицы IFNAR могут дифференциально подавлять после стимуляции IFN. Например, мембрана IFNAR1 снижается в ответ на IFNα, но уровни поверхности IFNAR1 и IFNAR2 подавляются в ответ на связывание IFNβ. [ 8 ] В соответствии с этими наблюдениями, интернализация ифнара часто связана со способностью соответствующего агониста вызывать антипролиферативный эффект. [ 7 ]
Интернализация субъединицы IFNAR также наблюдается в базальных условиях, при большей базальной обороте IFNAR1, чем IFNAR2. [ 2 ] IFNAR1 содержит дегрон или мотив убиквитинирования, который допускает его интернализацию и деградацию. [ 2 ] TYK2 может блокировать этот дегрон, предотвращая его интернализацию. [ 8 ]
Клатрин-зависимый эндоцитоз
[ редактировать ]После рецепторного агонизма С-конце IFNAR фосфорилируется, за которым следует его убиквитинирование и интернализация. [ 8 ] [ 15 ] Экспрессия поверхности IFNAR поддерживается в присутствии стимуляции, когда клатрин-зависимый путь эндоцитоза ингибируется с нокдауном миРНК клатрина или с использованием небольшого ингибитора молекулы GTPase динамина . [ 15 ] Интернализация может привести к деградации рецептора, тем самым снижая экспрессию мембраны, [ 15 ] Или это может привести к переработке рецептора без расширенного воздействия на уровни мембранных рецепторов. [ 2 ] Тем не менее, клатрин-опосредованный эндоцитоз также может служить для концентрации рецепторов IFNAR и сигнальных компонентов, тем самым усиливая передачу сигналов. [ 15 ] Эксперименты с электронной микроскопией показывают рецепторы IFNAR, концентрированные в ямах с клатрином, а ингибирование клатрин-опосредованного эндоцитоза привело к снижению фосфорилирования JAK1, TYK2, статистики и снижения транслокации ядерного ядерного ядер. [ 9 ] [ 15 ]
Негативные механизмы обратной связи
[ редактировать ]Отрицательные регуляторы передачи сигналов IFN типа I, такой как супрессор передачи сигналов 1 (SOCS1) и убиквитин-специфической пептидазы 18 ( USP18 ), индуцируются через 4 часа. [ 9 ] SOCS1 ингибирует передачу сигналов IFN типа, ингибируя JAKS и связывающий фосфорилированный TYK2. [ 9 ] USP18 связывается с C -конце IFNAR2. [ 9 ] USP18 может регулировать передачу сигналов IFN типа I, вмешиваясь в формирование тройного комплекса, а не с помощью его пептидазы. [ 7 ] Потеря USP18 приводит к воспалительной интерферонной заболеванию ЦНС. [ 3 ]
Клинические последствия
[ редактировать ]IFN типа I может обеспечить как полезные, так и вредные эффекты при различных заболеваниях. Считается, что IFN типа I является драйвером при множестве аутоиммунных заболеваний и может играть роль в хронической инфекции. [ 18 ] И наоборот, IFN типа I также назначаются в качестве терапии в других показателях заболевания. [ 18 ]
В частности, IFN типа I участвуют в патогенезе следующих аутоиммунных заболеваний: системная волчанка (SLE), синдром Шегрена , системный склероз , ревматоидный артрит (RA) и миозит . [ 18 ] Считается, что повышенные уровни внутримозговой IFNα играют вредную роль в синдроме Айкарди-Гутьер (AGS), ВИЧ-ассоциированной деменции и волчанке CNS. [ 12 ] В то время как IFN типа I являются одним из классических цитокинов, необходимых для противовирусного ответа эффекта, более высокие уровни IFN I типа связаны с ухудшением заболевания при бактериальных инфекциях, такими как туберкулез и прокатная проказа . [ 18 ] IFN типа I также исследуется на предмет потенциальной роли в нейродегенерации; Потеря экспрессии ифнара продлевала выживаемость в мышиных моделях амиотрофического бокового склероза (ALS). [ 12 ]
IFNα также использовался в клинике для лечения чувствительных к гематологическим злокачественным новообразованиям I IFN типа, таких как хронический миелогенный лейкоз (CML), множественная миелома и лейкоз волосатых клеток . [ 16 ] Важно отметить, что устойчивые к IFN-резистенту типа рак имеет низкое или отсутствующее выражение IFNAR. [ 16 ] Кроме того, IFNα также был предоставлен терапевтически для лечения некоторых потенциально хронических вирусных инфекций, таких как гепатит В и гепатит C. Как это ни парадоксально, IFNβ была первой линией лечения для центрального аутоиммунного заболевания, рассеянного склероза (MS), хотя механизм действия для IFNβ в MS не был окончательно продемонстрирован. [ 12 ] [ 16 ] [ 19 ]
Ссылки
[ редактировать ]- ^ PDB : 1N6U ; Chill JH, Quadt SR, Levy R, Schreiber G, Anglister J (июль 2003 г.). «Рецептор интерферона I -типа I -типа: Структура ЯМР выявляет молекулярную основу связывания лиганда» . Структура 11 (7): 791–802. doi : 10.1016/s0969-2126 (03) 00120-5 . PMID 12842042 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л de Weerd NA, Nguyen T (май 2012 г.). «Интерфероны и их рецепторы - распределение и регулирование» . Иммунология и клеточная биология . 90 (5): 483–91. doi : 10.1038/icb.2012.9 . PMC 7165917 . PMID 22410872 .
- ^ Jump up to: а беременный МакГлассон С., Жюри А., Джексон А., Охота Д. (сентябрь 2015). «Дисгуляция интерферона типа I и неврологические заболевания». Природные обзоры. Неврология . 11 (9): 515–23. doi : 10.1038/nrneurol.2015.143 . PMID 26303851 . S2CID 9640903 .
- ^ Nallar SC, Kalvakolanu DV (август 2014 г.). «Интерфероны, пути трансдукции сигнала и центральная нервная система» . Журнал интерферонов и цитокиновых исследований . 34 (8): 559–76. doi : 10.1089/jir.2014.0021 . PMC 4118707 . PMID 25084173 .
- ^ Jump up to: а беременный в дюймовый Hertzog PJ, Williams BR (июнь 2013 г.). «Прекрасная настройка типа I отвечает интерферона». Обзоры цитокинов и факторов роста . 24 (3): 217–25. doi : 10.1016/j.cytogfr.2013.04.002 . PMID 23711406 .
- ^ Coccia EM, Battistini A (март 2015 г.). «Ранний ответ IFN типа I: обучение на стратегиях уклонения от микробных препаратов» . Семинары по иммунологии . 27 (2): 85–101. doi : 10.1016/j.smim.2015.03.005 . PMC 7129383 . PMID 25869307 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не Piehler J, Thomas C, Garcia KC, Schreiber G (ноябрь 2012 г.). «Структурные и динамические детерминанты сборки рецептора интерферона I типа и их функциональной интерпретации» . Иммунологические обзоры . 250 (1): 317–34. doi : 10.1111/imr.12001 . PMC 3986811 . PMID 23046138 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м Uzé G, Schreiber G, Piehler J, Pellegrini S (2007). «Рецептор семейства интерферонов типа I». Интерферон: 50 -летие . Текущие темы в области микробиологии и иммунологии. Тол. 316. С. 71–95. doi : 10.1007/978-3-540-71329-6_5 . ISBN 978-3-540-71328-9 Полем PMID 17969444 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий Schreiber G, Piehler J (март 2015 г.). «Молекулярная основа для функциональной пластичности в передаче сигналов интерферона I типа». Тенденции в иммунологии . 36 (3): 139–49. doi : 10.1016/j.it.2015.01.002 . PMID 25687684 .
- ^ Trinchieri G (сентябрь 2010 г.). "Тип I Интерферон: друг или враг?" Полем Журнал экспериментальной медицины . 207 (10): 2053–63. doi : 10.1084/jem.20101664 . PMC 2947062 . PMID 20837696 .
- ^ Jump up to: а беременный в NG CT, Mendoza JL, Garcia KC, Oldstone MB (январь 2016 г.). «Альфа и бета -бета -тип 1 передача сигналов интерферона: проход для разнообразных биологических результатов» . Клетка . 164 (3): 349–52. doi : 10.1016/j.cell.2015.12.027 . PMC 4733246 . PMID 26824652 .
- ^ Jump up to: а беременный в дюймовый и Оуэнс Т., Хоруоши Р., Влодарцик А., Асгари Н. (март 2014 г.). «Интерфероны в центральной нервной системе: несколько инструментов играют много мелодий». Глиа 62 (3): 339–55. doi : 10.1002/glia.22608 . PMID 24588027 . S2CID 5826145 .
- ^ Lutfalla G, Roeckel N, Mogensen KE, Mattei MG, Uzé G (октябрь 1990). «Назначение гена рецептора интерферона человека-α в хромосому 21q22.1 с помощью гибридизации in situ». Журнал исследований интерферонов . 10 (5): 515–7. doi : 10.1089/jir.1990.10.515 . PMID 2148760 .
- ^ Lutfalla G, Holland SJ, Cinato E, Monneron D, Reboul J, Rogers NC, Smith JM, Stark GR, Gardiner K, Mogensen KE (октябрь 1995). «Мутантные клетки U5A дополняются субъединицей рецептора интерферона-αβ, генерируемой альтернативной обработкой нового члена кластера генов рецептора цитокиновых рецепторов» . Embo Journal . 14 (20): 5100–8. doi : 10.1002/j.1460-2075.1995.tb00192.x . PMC 394613 . PMID 7588638 .
- ^ Jump up to: а беременный в дюймовый и фон глин час Claudinon J, Monier MN, Lamaze C (2007). «Вмешательство в сортировку и торговлю рецептором интерферона: влияние на передачу сигналов». Биохими . 89 (6–7): 735–43. doi : 10.1016/j.biochi.2007.03.014 . PMID 17493737 .
- ^ Jump up to: а беременный в дюймовый Deonarain R, Chan DC, Platanias LC, Fish EN (2002). «Интерферон-α / β-рецепторные взаимодействия: сложная история, разворачивающаяся». Текущий фармацевтический дизайн . 8 (24): 2131–7. doi : 10.2174/1381612023393288 . PMID 12369858 .
- ^ Jump up to: а беременный Hebenstreit D, Horejs-Hoeck J, Duschl A (май 2005 г.). «Jak/Stat-зависимая регуляция генов цитокинами». News News & Perspectives . 18 (4): 243–9. doi : 10.1358/dnp.2005.18.4.908658 . PMID 16034480 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Ivashkiv LB, Donlin Lt (январь 2014 г.). «Регуляция ответов интерферона типа I» . Природные обзоры. Иммунология . 14 (1): 36–49. doi : 10.1038/nri3581 . PMC 4084561 . PMID 24362405 .
- ^ Kieseier BC (июнь 2011 г.). «Механизм действия интерферона-β при рецидиве рассеянного склероза». ЦНС лекарства . 25 (6): 491–502. doi : 10.2165/11591110-000000000-00000 . PMID 21649449 . S2CID 25516515 .
Внешние ссылки
[ редактировать ]- Рецептор,+интерферон+альфа-бета библиотеки США в Национальной медицинской библиотеке Медицинской (Mesh)