Influenza vaccine
 A flu shot being given to a US Navy crew member | |
| Vaccine description | |
|---|---|
| Target | Influenza virus |
| Vaccine type | inactivated, attenuated, recombinant |
| Clinical data | |
| Trade names | Afluria, Fluarix, Fluzone, others |
| AHFS/Drugs.com | Inactivated: Monograph Intranasal: Monograph Recombinant: Monograph |
| Pregnancy category | |
| Routes of administration | Intramuscular, intranasal, intradermal |
| ATC code | |
| Legal status | |
| Legal status | |
| Identifiers | |
| CAS Number | |
| ChemSpider |
|
| KEGG | |
Influenza vaccines, colloquially known as flu shots, are vaccines that protect against infection by influenza viruses.[14][15] New versions of the vaccines are developed twice a year, as the influenza virus rapidly changes.[14] While their effectiveness varies from year to year, most provide modest to high protection against influenza.[14][16] Vaccination against influenza began in the 1930s, with large-scale availability in the United States beginning in 1945.[17][18]
Both the World Health Organization and the US Centers for Disease Control and Prevention (CDC) recommend yearly vaccination for nearly all people over the age of six months, especially those at high risk,[14][19][20][21] and the influenza vaccine is now on the WHO's List of Essential Medicines.[22][23] The European Centre for Disease Prevention and Control (ECDC) also recommends yearly vaccination of high-risk groups,[24] particularly pregnant women, the elderly, children between six months and five years, and those with certain health problems.[14][21]
The vaccines are generally safe, including for people who have severe egg allergies.[25] A common side effect is soreness near the site of injection. Fever occurs in five to ten percent of children vaccinated, and temporary muscle pains or feelings of tiredness may occur. In certain years, the vaccine was linked to an increase in Guillain–Barré syndrome among older people at a rate of about one case per million doses.[14] Influenza vaccines are not recommended in those who have had a severe allergy to previous versions of the vaccine itself.[14][25] The vaccine comes in inactive and weakened viral forms. The live, weakened vaccine is generally not recommended in pregnant women, children less than two years old, adults older than 50, or people with a weakened immune system.[14] Depending on the type it can be injected into a muscle, sprayed into the nose, or injected into the middle layer of the skin (intradermal).[14] The intradermal vaccine was not available during the 2018–2019 and 2019–2020 influenza seasons.[26][27][28]
History
[edit]Vaccines are used in both humans and non-humans. Human vaccine is meant unless specifically identified as a veterinary, poultry or livestock vaccine.
Origins and development
[edit]During the worldwide Spanish flu pandemic of 1918, "Pharmacists tried everything they knew, everything they had ever heard of, from the ancient art of bleeding patients, to administering oxygen, to developing new vaccines and serums (chiefly against what we now call Hemophilus influenzae – a name derived from the fact that it was originally considered the etiological agent – and several types of pneumococci). Only one therapeutic measure, transfusing blood from recovered patients to new victims, showed any hint of success."[29]
In 1931, viral growth in embryonated hens' eggs was reported by Ernest William Goodpasture and colleagues at Vanderbilt University. The work was extended to growth of influenza virus by several workers, including Thomas Francis, Jonas Salk, Wilson Smith, and Macfarlane Burnet, leading to the first experimental influenza vaccines.[30] In the 1940s, the US military developed the first approved inactivated vaccines for influenza, which were used during World War II.[31] Hens' eggs continued to be used to produce virus used in influenza vaccines, but manufacturers made improvements in the purity of the virus by developing improved processes to remove egg proteins and to reduce systemic reactivity of the vaccine.[32] In 2012, the US Food and Drug Administration (FDA) approved influenza vaccines made by growing virus in cell cultures[33][34][35] and influenza vaccines made from recombinant proteins[36] have been approved, with plant-based influenza vaccines being tested[when?] in clinical trials.[37]
Acceptance
[edit]The egg-based technology for producing influenza vaccine was created in the 1950s.[38] In the US swine flu scare of 1976, President Gerald Ford was confronted with a potential swine flu pandemic. The vaccination program was rushed, yet plagued by delays and public relations problems. Meanwhile, maximum military containment efforts succeeded unexpectedly in confining the new strain to the single army base where it had originated. On that base, a number of soldiers fell severely ill, but only one died. The program was canceled after about 24% of the population had received vaccinations. An excess in deaths of 25 over normal annual levels as well as 400 excess hospitalizations, both from Guillain–Barré syndrome, were estimated to have occurred from the vaccination program itself, demonstrating that the vaccine itself is not free of risks.[39] In the end, however, even the maligned 1976 vaccine may have saved lives. A 2010 study found a significantly enhanced immune response against the 2009 pandemic H1N1 in study participants who had received vaccination against the swine flu in 1976.[40] The 2009 H1N1 "swine flu" outbreak resulted in the rapid approval of pandemic influenza vaccines.[41] Pandemrix was quickly modified to target the circulating strain and by late 2010, 70 million people had received a dose.[42] Eight years later, the BMJ gained access to vaccine pharmacovigilance reports compiled by GSK (GlaxoSmithKline) during the pandemic which the BMJ reported indicated death was 5.39 fold more likely with Pandemrix vs the other pandemic vaccines.[41][42]
Quadrivalent vaccines
[edit]
A quadrivalent flu vaccine administered by nasal mist was approved by the FDA in March 2012.[43][44] Fluarix Quadrivalent was approved by the FDA in December 2012.[45]
In 2014, the Canadian National Advisory Committee on Immunization (NACI) published a review of quadrivalent influenza vaccines.[46]
Starting with the 2018–2019 influenza season most of the regular-dose egg-based flu shots and all the recombinant and cell-grown flu vaccines in the United States are quadrivalent.[47] In the 2019–2020 influenza season all regular-dose flu shots and all recombinant influenza vaccine in the United States are quadrivalent.[48]
In November 2019, the FDA approved Fluzone High-Dose Quadrivalent for use in the United States starting with the 2020–2021 influenza season.[49][50]
In February 2020, the FDA approved Fluad Quadrivalent for use in the United States.[51][52] In July 2020, the FDA approved both Fluad and Fluad Quadrivalent for use in the United States for the 2020–2021 influenza season.[51][53]
The B/Yamagata lineage of influenza B, one of the four lineages targeted by quadrivalent vaccines, might have become extinct in 2020/2021 due to COVID-19 pandemic measures,[54] and there have been no naturally occurring cases confirmed since March 2020.[55][56] In 2023, the World Health Organization concluded that protection against the Yamagata lineage was no longer necessary in the seasonal flu vaccine, so future vaccines are recommended to be trivalent instead of quadrivalent.[55][56] For the 2024–2025 Northern Hemisphere influenza season, the FDA recommends removing B/Yamagata from all influenza vaccines.[57]
Medical uses
[edit]The US Centers for Disease Control and Prevention (CDC) recommends the flu vaccine as the best way to protect people against the flu and prevent its spread.[58] The flu vaccine can also reduce the severity of the flu if a person contracts a strain that the vaccine did not contain.[58] It takes about two weeks following vaccination for protective antibodies to form.[58][59]
A 2012 meta-analysis found that flu vaccination was effective 67 percent of the time; the populations that benefited the most were HIV-positive adults aged 18 to 55 (76 percent), healthy adults aged 18 to 46 (approximately 70 percent), and healthy children aged six months to 24 months (66 percent).[60] The influenza vaccine also appears to protect against myocardial infarction with a benefit of 15–45%.[61]
Effectiveness
[edit]Graphs are unavailable due to technical issues. There is more info on Phabricator and on MediaWiki.org. |
A vaccine is assessed by its efficacy – the extent to which it reduces risk of disease under controlled conditions – and its effectiveness – the observed reduction in risk after the vaccine is put into use.[68] In the case of influenza, effectiveness is expected to be lower than the efficacy because it is measured using the rates of influenza-like illness, which is not always caused by influenza.[69] Studies on the effectiveness of flu vaccines in the real world are difficult; vaccines may be imperfectly matched, virus prevalence varies widely between years, and influenza is often confused with other influenza-like illnesses.[70] However, in most years (16 of the 19 years before 2007), the flu vaccine strains have been a good match for the circulating strains,[71] and even a mismatched vaccine can often provide cross-protection.[58] The virus rapidly changes due to antigenic drift, a slight mutation in the virus that causes a new strain to arise.[72]
The effectiveness of seasonal flu vaccines varies significantly, with an estimated average efficacy of 50–60% against symptomatic disease,[73] depending on vaccine strain, age, prior immunity, and immune function, so vaccinated people can still contract influenza.[74] The effectiveness of flu vaccines is considered to be suboptimal, particularly among the elderly,[75] but vaccination is still beneficial in reducing the mortality rate and hospitalization rate due to influenza as well as duration of hospitalization.[74][76] Vaccination of school-age children has shown to provide indirect protection for other age groups. LAIVs are recommended for children based on superior efficacy, especially for children under 6, and greater immunity against non-vaccine strains when compared to inactivated vaccines.[77][78]
From 2012 to 2015 in New Zealand, vaccine effectiveness against admission to an intensive care unit was 82%.[79] Effectiveness against hospitalized influenza illness in the 2019–2020 United States flu season was 41% overall and 54% in people aged 65 years or older.[80] One review found 31% effectiveness against death among adults.[81][82]
Repeated annual influenza vaccination generally offers consistent year-on-year protection against influenza.[82] There is, however, suggestive evidence that repeated vaccinations may cause a reduction in vaccine effectiveness for certain influenza subtypes; this has no relevance to current recommendations for yearly vaccinations but might influence future vaccination policy.[83][84] As of 2019[update], the CDC recommends a yearly vaccine as most studies demonstrate overall effectiveness of annual influenza vaccination.[82]
There is not enough evidence to establish significant differences in the effectiveness of different influenza vaccine types,[85] but there are high-dose or adjuvanted products that induce a stronger immune response in the elderly.[86]
According to a 2016 study by faculty at the University of New South Wales, getting a flu shot was as effective or better at preventing a heart attack than even quitting smoking.[87]
Children
[edit]In April 2002, the Advisory Committee on Immunization Practices (ACIP) encouraged that children 6 to 23 months of age be vaccinated annually against influenza.[88] In 2010, ACIP recommended annual influenza vaccination for those 6 months of age and older.[88] Currently the CDC recommends that everyone except infants under the age of six months should receive the seasonal influenza vaccine.[19] Vaccination campaigns usually focus special attention on people who are at high risk of serious complications if they catch the flu, such as pregnant women, children under 59 months, the elderly, and people with chronic illnesses or weakened immune systems, as well as those to whom they are exposed, such as health care workers.[19][89]
As the death rate is also high among infants who catch influenza, the CDC and the WHO recommend that household contacts and caregivers of infants be vaccinated to reduce the risk of passing an influenza infection to the infant.[89][90]
In children, the vaccine appears to decrease the risk of influenza and possibly influenza-like illness.[91] In children under the age of two data are limited.[91] During the 2017–18 flu season, the CDC director indicated that 85 percent of the children who died "likely will not have been vaccinated".[92]
In the United States, as of January 2019[update], the CDC recommend that children aged six through 35 months may receive either 0.25 milliliters or 0.5 milliliters per dose of Fluzone Quadrivalent.[48][93] There is no preference for one or the other dose volume of Fluzone Quadrivalent for that age group.[48] All persons 36 months of age and older should receive 0.5 milliliters per dose of Fluzone Quadrivalent.[48] As of October 2018[update], Afluria Quadrivalent is licensed for children six months of age and older in the United States.[48][94] Children six months through 35 months of age should receive 0.25 milliliters for each dose of Afluria Quadrivalent.[48] All persons 36 months of age and older should receive 0.5 milliliters per dose of Afluria Quadrivalent.[48] As of February 2018[update], Afluria Tetra is licensed for adults and children five years of age and older in Canada.[95]
In 2014, the Canadian National Advisory Committee on Immunization (NACI) published a review of influenza vaccination in healthy 5–18-year-olds,[96] and in 2015, published a review of the use of pediatric Fluad in children 6–72 months of age.[97] In one study, conducted in a tertiary referral center, the rate of influenza vaccination in children was only 31%. Higher rates were found among immuno-suppressed pediatric patients (46%), and in patients with inflammatory bowel disease (50%).[98]
Adults
[edit]
In unvaccinated adults, 16% get symptoms similar to the flu, while about 10% of vaccinated adults do.[69] Vaccination decreased confirmed cases of influenza from about 2.4% to 1.1%.[69] No effect on hospitalization was found.[69]
In working adults, a review by the Cochrane Collaboration found that vaccination resulted in a modest decrease in both influenza symptoms and working days lost, without affecting transmission or influenza-related complications.[69] In healthy working adults, influenza vaccines can provide moderate protection against virologically confirmed influenza, though such protection is greatly reduced or absent in some seasons.[99]
In health care workers, a 2006 review found a net benefit.[100] Of the eighteen studies in this review, only two also assessed the relationship of patient mortality relative to staff influenza vaccine uptake; both found that higher rates of health care worker vaccination correlated with reduced patient deaths.[100] A 2014 review found benefits to patients when health care workers were immunized, as supported by moderate evidence[101] based in part on the observed reduction in all-cause deaths in patients whose health care workers were given immunization compared with comparison patients where the workers were not offered vaccine.[102]
Elderly
[edit]Evidence for an effect in adults over 65 is unclear.[103] Systematic reviews examining both randomized controlled and case–control studies found a lack of high-quality evidence.[99][104] Reviews of case–control studies found effects against laboratory-confirmed influenza, pneumonia, and death among the community-dwelling elderly.[105][106]
The group most vulnerable to non-pandemic flu, the elderly, benefits least from the vaccine. There are multiple reasons behind this steep decline in vaccine efficacy, the most common of which are the declining immunological function and frailty associated with advanced age.[107] In a non-pandemic year, a person in the United States aged 50–64 is nearly ten times more likely to die an influenza-associated death than a younger person, and a person over 65 is more than ten times more likely to die an influenza-associated death than the 50–64 age group.[108]
There is a high-dose flu vaccine specifically formulated to provide a stronger immune response.[109] Available evidence indicates that vaccinating the elderly with the high-dose vaccine leads to a stronger immune response against influenza than the regular-dose vaccine.[110][111][112]
A flu vaccine containing an adjuvant was approved by the US Food and Drug Administration (FDA) in November 2015, for use by adults aged 65 years of age and older. The vaccine is marketed as Fluad in the US and was first available in the 2016–2017 flu season. The vaccine contains the MF59C.1 adjuvant[113] which is an oil-in-water emulsion of squalene oil. It is the first adjuvanted seasonal flu vaccine marketed in the United States.[114][115][116] It is not clear if there is a significant benefit for the elderly to use a flu vaccine containing the MF59C.1 adjuvant.[117][118][119] Per Advisory Committee on Immunization Practices guidelines, Fluad can be used as an alternative to other influenza vaccines approved for people 65 years and older.[115]
Vaccinating health care workers who work with elderly people is recommended in many countries, with the goal of reducing influenza outbreaks in this vulnerable population.[120][121][122] While there is no conclusive evidence from randomized clinical trials that vaccinating health care workers helps protect elderly people from influenza, there is tentative evidence of benefit.[123]
Fluad Quad was approved for use in Australia in September 2019,[124] Fluad Quadrivalent was approved for use in the United States in February 2020,[51] and Fluad Tetra was approved for use in the European Union in May 2020.[125][126]
Pregnancy
[edit]As well as protecting mother and child from the effects of an influenza infection, the immunization of pregnant women tends to increase their chances of experiencing a successful full-term pregnancy.[127]
The trivalent inactivated influenza vaccine is protective in pregnant women infected with HIV.[128]
Safety
[edit]Side effects
[edit]Common side effects of vaccination include local injection-site reactions and cold-like symptoms. Fever, malaise, and myalgia are less common. Flu vaccines are contraindicated for people who have experienced a severe allergic reaction in response to a flu vaccine or to any component of the vaccine. LAIVs are not given to children or adolescents with severe immunodeficiency or to those who are using salicylate treatments because of the risk of developing Reye syndrome.[77] LAIVs are also not recommended for children under the age of 2,[78] pregnant women, and adults with immunosuppression. Inactivated flu vaccines cannot cause influenza and are regarded as safe during pregnancy.[77]
While side effects of the flu vaccine may occur, they are usually minor, including soreness, redness, and swelling around the point of injection, headache, fever, nausea or fatigue.[129] Side effects of a nasal spray vaccine may include runny nose, wheezing, sore throat, cough, or vomiting.[130]
In some people, a flu vaccine may cause serious side effects, including an allergic reaction, but this is rare. Furthermore, the common side effects and risks are mild and temporary when compared to the risks and severe health effects of the annual influenza epidemic.[58]
Contrary to a common misconception, flu shots cannot cause people to get the flu.[131][132]
Guillain–Barré syndrome
[edit]Although Guillain–Barré syndrome had been feared as a complication of vaccination, the CDC states that most studies on modern influenza vaccines have seen no link with Guillain–Barré.[133][134] Infection with influenza virus itself increases both the risk of death (up to one in ten thousand) and the risk of developing Guillain–Barré syndrome to a far higher level than the highest level of suspected vaccine involvement (approximately ten times higher by 2009 estimates).[135][136]
Although one review gives an incidence of about one case of Guillain–Barré per million vaccinations,[137] a large study in China, covering close to a hundred million doses of vaccine against the 2009 H1N1 "swine" flu found only eleven cases of Guillain–Barré syndrome, (0.1 per million doses) total incidence in persons vaccinated, actually lower than the normal rate of the disease in China, and no other notable side effects.[136][138]
Egg allergy
[edit]
Although most influenza vaccines are produced using egg-based techniques, influenza vaccines are nonetheless still recommended as safe for people with egg allergies, even if severe,[25] as no increased risk of allergic reaction to the egg-based vaccines has been shown for people with egg allergies.[139] Studies examining the safety of influenza vaccines in people with severe egg allergies found that anaphylaxis was very rare, occurring in 1.3 cases per million doses given.[25]
Monitoring for symptoms from vaccination is recommended in those with more severe symptoms.[140] A study of nearly 800 children with egg allergy, including over 250 with previous anaphylactic reactions, had zero systemic allergic reactions when given the live attenuated flu vaccine.[141][142]
Vaccines produced using other technologies, notably recombinant vaccines and those based on cell culture rather than egg protein, started to become available from 2012 in the US,[143] and later in Europe[144] and Australia.[139]
Other
[edit]Several studies have identified an increased incidence of narcolepsy among recipients of the pandemic H1N1 influenza AS03-adjuvanted vaccine;[145] efforts to identify a mechanism for this suggest that narcolepsy is autoimmune, and that the AS03-adjuvanted H1N1 vaccine may mimic hypocretin, serving as a trigger.[146]
Some injection-based flu vaccines intended for adults in the United States contain thiomersal (also known as thimerosal), a mercury-based preservative.[147][148] Despite some controversy in the media,[149] the World Health Organization's Global Advisory Committee on Vaccine Safety has concluded that there is no evidence of toxicity from thiomersal in vaccines and no reason on grounds of safety to change to more-expensive single-dose administration.[150]
Types
[edit]
Seasonal flu vaccines are available either as:[citation needed]
- a trivalent or quadrivalent injection, which contains the inactivated form of the virus. This is usually an intramuscular injection, though subcutaneous and intradermal routes can also be protective.[151]
- a nasal spray of live attenuated influenza vaccine, which contains the live but attenuated (weakened) form of the virus.
Injected vaccines induce protection based on an immune response to the antigens present on the inactivated virus, while the nasal spray works by establishing short-term infection in the nasal passages.[152]
Annual reformulation
[edit]Each year, three influenza strains are chosen for inclusion in the fothcoming year's seasonal flu vaccination by the Global Influenza Surveillance and Response System of the World Health Organization (WHO).[153] The recommendation for trivalent vaccine comprises two strains of Influenza A (one each of A/H1N1 and A/H3N2), and one strain of influenza B (B/Victoria), together representing strains thought most likely to cause significant human suffering in the coming season. Starting in 2012, WHO has also recommended a second influenza B strain (B/Yamagata) for use in quadrivalent vaccines; this was discontinued in 2024.[154]
- "The WHO Global Influenza Surveillance Network was established in 1952 (renamed "Global Influenza Surveillance and Response System" in 2011).[155] The network comprises four WHO Collaborating Centres (WHO CCs) and 112 institutions in 83 countries, which are recognized by WHO as WHO National Influenza Centres (NICs). These NICs collect specimens in their country, perform primary virus isolation and preliminary antigenic characterization. They ship newly isolated strains to WHO CCs for high level antigenic and genetic analysis, the result of which forms the basis for WHO recommendations on the composition of influenza vaccine for the Northern and Southern Hemisphere each year."[156]
Formal WHO recommendations were first issued in 1973. Beginning in 1999 there have been two recommendations per year: one for the northern hemisphere and the other for the southern hemisphere.[157]
Due to the widespread use of non-pharmaceutical interventions at the beginning of the COVID-19 pandemic, the B/Yamagata influenza lineage has not been isolated since March 2020, and may have been eradicated. Starting with the 2024 Southern Hemisphere influenza season, the WHO and other regulatory bodies have removed B/Yamagata from influenza vaccine recommendations.[154][57][158]
Recommendations
[edit]Various public health organizations, including the World Health Organization (WHO), recommend that yearly influenza vaccination be routinely offered, particularly to people at risk of complications of influenza and those individuals who live with or care for high-risk individuals, including:
- people aged 50 years of age or older[21]
- people with chronic lung diseases, including asthma[21]
- people with chronic heart diseases[21]
- people with chronic liver diseases[21]
- people with chronic kidney diseases[21]
- people who have had their spleen removed or whose spleen is not working properly[medical citation needed]
- people who are immunocompromised[21]
- residents of nursing homes and other long-term care facilities[21]
- health care workers (both to prevent sickness and to prevent spread to their patients)[159][160]
- women who are or will be pregnant during the influenza season[21]
- children and adolescents (aged 6 months through 18 years) who are receiving aspirin- or salicylate-containing medications and who might be at risk for experiencing Reye syndrome after influenza virus infection[21]
- American Indians/Alaska Natives[21]
- people who are extremely obese (body mass index ≥40 for adults)[21]
The flu vaccine is contraindicated for those under six months of age and those with severe, life-threatening allergies to flu vaccine or any ingredient in the vaccine.[19][161][25]
World Health Organization
[edit]As of 2016[update], the World Health Organization (WHO) recommends seasonal influenza vaccination for:[162][163][164][165][166]
First priority:
- Pregnant women
Second priority (in no particular order):
- Children aged 6–59 months
- Elderly
- Individuals with specific chronic medical conditions
- Health-care workers
Canada
[edit]The National Advisory Committee on Immunization (NACI), the group that advises the Public Health Agency of Canada, recommends that everyone over six months of age be encouraged to receive annual influenza vaccination, and that children between the age of six months and 24 months, and their household contacts, should be considered a high priority for the flu vaccine.[167] Particularly:
- People at high risk of influenza-related complications or hospitalization, including people who are morbidly obese, healthy pregnant women, children aged 6–59 months, the elderly, aboriginals, and people with one of an itemized list of chronic health conditions
- People capable of transmitting influenza to those at high risk, including household contacts and health care workers
- People who provide essential community services
- Certain poultry workers
Live attenuated influenza vaccine (LAIV) was not available in Canada for the 2019–2020 season.[167]
European Union
[edit]The European Centre for Disease Prevention and Control (ECDC) recommends vaccinating the elderly as a priority, with a secondary priority people with chronic medical conditions and health care workers.[168]
The influenza vaccination strategy is generally that of protecting vulnerable people, rather than limiting influenza circulation or eliminating human influenza sickness. This is in contrast with the high herd immunity strategies for other infectious diseases such as polio and measles.[169] This is also due in part to the financial and logistics burden associated with the need of an annual injection.[170]
United States
[edit]
In the United States routine influenza vaccination is recommended for all persons aged six months and over.[21][171] It takes up to two weeks after vaccination for sufficient antibodies to develop in the body.[171] The CDC recommends vaccination before the end of October,[21] although it considers getting a vaccine in December or even later to be still beneficial.[21][58][171] The U.S. military also requires a flu shot annually for its active and reserve servicemembers.[172]
According to the CDC, the live attenuated virus (LAIV4) (which comes in the form of the nasal spray in the US) should be avoided by some groups.[21][173]
Within its blanket recommendation for general vaccination in the United States, the CDC, which began recommending the influenza vaccine to health care workers in 1981, emphasizes to clinicians the special urgency of vaccination for members of certain vulnerable groups, and their caregivers:
- Vaccination is especially important for people at higher risk of serious influenza complications or people who live with or care for people at higher risk for serious complications.[174] In 2009, a new high-dose formulation of the standard influenza vaccine was approved.[175] The Fluzone High Dose is specifically for people 65 and older; the difference is that it has four times the antigen dose of the standard Fluzone.[176][177][178][179]
The US government requires hospitals to report worker vaccination rates. Some US states and hundreds of US hospitals require health care workers to either get vaccinations or wear masks during flu season. These requirements occasionally engender union lawsuits on narrow collective bargaining grounds, but proponents note that courts have generally endorsed forced vaccination laws affecting the general population during disease outbreaks.[180]
Vaccination against influenza is especially considered important for members of high-risk groups who would be likely to have complications from influenza, for example pregnant women[21][181] and children and teenagers from six months to 18 years of age who are receiving aspirin- or salicylate-containing medications and who might be at risk for experiencing Reye syndrome after influenza virus infection;[21]
- In raising the upper age limit to 18 years, the aim is to reduce both the time children and parents lose from visits to pediatricians and missing school and the need for antibiotics for complications[182]
- An added benefit expected from the vaccination of children is a reduction in the number of influenza cases among parents and other household members, and of possible spread to the general community.[182]
The CDC indicated that live attenuated influenza vaccine (LAIV), also called the nasal spray vaccine, was not recommended for the 2016–2017 flu season in the United States.[183]
Furthermore, the CDC recommends that health care personnel who care for severely immunocompromised persons receive injections (TIV or QIV) rather than LAIV.[184]
Australia
[edit]The Australian Government recommends seasonal flu vaccination for everyone over the age of six months. Australia uses inactivated vaccines.[185] Until 2021, the egg-based vaccine has been the only one available (and continues to be the only free one), but from March 2021 a new cell-based vaccine is available for those who wish to pay for it, and it is expected that this one will become the standard by 2026.[139] The standard flu vaccine is free for the following people:[186]
- children aged six months to five years;
- people aged 65 years and over;
- Aboriginal and Torres Strait Islander people aged six months and over;
- pregnant women; and
- anyone over six months of age with medical conditions such as severe asthma, lung disease or heart disease, low immunity or diabetes that can lead to complications from influenza.
Uptake
[edit]| Country | Region | % aged 65+ |
|---|---|---|
| Republic of Korea | Asia | 83 |
| Australia | Oceania | 75 |
| United Kingdom | Europe | 73 |
| United States | Americas | 68 |
| New Zealand | Oceania | 65 |
| Chile | Americas | 65 |
| Netherlands | Europe | 64 |
| Canada | Americas | 61 |
| Portugal | Europe | 61 |
| Israel | Asia | 58 |
| Ireland | Europe | 58 |
| Spain | Europe | 54 |
| Italy | Europe | 53 |
| Denmark | Europe | 52 |
| Japan | Asia | 50 |
| France | Europe | 50 |
| Sweden | Europe | 49 |
| Finland | Europe | 48 |
| Iceland | Europe | 45 |
| Luxembourg | Europe | 38 |
| Germany | Europe | 35 |
| Norway | Europe | 34 |
| Hungary | Europe | 27 |
| Czech Republic | Europe | 20 |
| Lithuania | Europe | 13 |
| Slovak Republic | Europe | 13 |
| Slovenia | Europe | 12 |
| Latvia | Europe | 8 |
| Turkey | Asia | 7 |
| Estonia | Europe | 5 |
At risk groups
[edit]Uptake of flu vaccination, both seasonally and during pandemics, is often low.[188] Systematic reviews of pandemic flu vaccination uptake have identified several personal factors that may influence uptake, including gender (higher uptake in men), ethnicity (higher in people from ethnic minorities) and having a chronic illness.[189][190] Beliefs in the safety and effectiveness of the vaccine are also important.[188]
A number of measures have been found to be useful to increase rates of vaccination in those over sixty including: patient reminders using leaflets and letters, postcard reminders, client outreach programs, vaccine home visits, group vaccinations, free vaccinations, physician payment, physician reminders and encouraging physician competition.[191]
Health care workers
[edit]Frontline health care workers are often recommended to get seasonal and any pandemic flu vaccination. For example, in the UK all health care workers involved in patient care are recommended to receive the seasonal flu vaccine, and were also recommended to be vaccinated against the H1N1/09 (later renamed A(H1N1)pdm09[note 1][192]) swine flu virus during the 2009 pandemic. However, uptake is often low.[160] During the 2009 pandemic, low uptake by healthcare workers was seen in countries including the UK,[160] Italy,[193] Greece,[194] and Hong Kong.[195]
In a 2010 survey of United States health care workers, 63.5% reported that they received the flu vaccine during the 2010–11 season, an increase from 61.9% reported the previous season. US Health professionals with direct patient contact had higher vaccination uptake, such as physicians and dentists (84.2%) and nurse practitioners (82.6%).[196][197][198]
The main reason to vaccinate health care workers is to prevent staff from spreading flu to their patients and to reduce staff absence at a time of high service demand, but the reasons health care workers state for their decisions to accept or decline vaccination may more often be to do with perceived personal benefits.[160]
In Victoria (Australia) public hospitals, rates of health care worker vaccination in 2005 ranged from 34% for non-clinical staff to 42% for laboratory staff. One of the reasons for rejecting vaccines was concern over adverse reactions; in one study, 31% of resident physicians at a teaching hospital incorrectly believed Australian vaccines could cause influenza.[199]
Manufacturing
[edit]
Research continues into the idea of a "universal" influenza vaccine that would not require tailoring to a particular strain, but would be effective against a broad variety of influenza viruses.[200] No vaccine candidates had been announced by November 2007,[201] but as of 2021[update], there are several universal vaccines candidates, in pre-clinical development and in clinical trials.[202][203][204][205]
In a 2007 report, the global capacity of approximately 826 million seasonal influenza vaccine doses (inactivated and live) was double the production of 413 million doses. In an aggressive scenario of producing pandemic influenza vaccines by 2013, only 2.8 billion courses could be produced in a six-month time frame. If all high- and upper-middle-income countries sought vaccines for their entire populations in a pandemic, nearly two billion courses would be required. If China pursued this goal as well, more than three billion courses would be required to serve these populations.[206] Vaccine research and development is ongoing to identify novel vaccine approaches that could produce much greater quantities of vaccine at a price that is affordable to the global population.[citation needed]
Egg-based
[edit]Most flu vaccines are grown by vaccine manufacturers in fertilized chicken eggs.[207][201] In the Northern hemisphere, the manufacturing process begins following the announcement (typically in February) of the WHO recommended strains for the winter flu season.[207][208] Three strains (representing an H1N1, an H3N2, and a B strain) of flu are selected and chicken eggs are inoculated separately. These monovalent harvests are then combined to make the trivalent vaccine.[209]
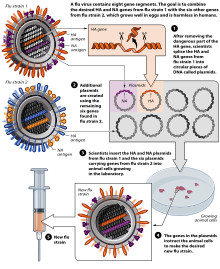
As of November 2007[update], both the conventional injection and the nasal spray are manufactured using chicken eggs. The European Union also approved Optaflu, a vaccine produced by Novartis using vats of animal cells. This technique is expected to be more scalable and avoid problems with eggs, such as allergic reactions and incompatibility with strains that affect avians like chickens.[201]
Influenza vaccines are produced in pathogen-free eggs that are eleven or twelve days old.[210] The top of the egg is disinfected by wiping it with alcohol and then the egg is candled to identify a non-veinous area in the allantoic cavity where a small hole is poked to serve as a pressure release.[211] A second hole is made at the top of the egg, where the influenza virus is injected in the allantoic cavity, past the chorioallantoic membrane. The two holes are then sealed with melted paraffin and the inoculated eggs are incubated for 48 hours at 37 degrees Celsius.[210] During incubation time, the virus replicates and newly replicated viruses are released into the allantoic fluid[212]
After the 48-hour incubation period, the top of the egg is cracked and the ten milliliters of allantoic fluid is removed, from which about fifteen micrograms of the flu vaccine can be obtained. At this point, the viruses have been weakened or killed and the viral antigen is purified and placed inside vials, syringes, or nasal sprayers.[212] Up to 3 eggs are needed to produce one dose of a trivalent vaccine, and an estimated 600 million eggs are produced each year for flu vaccine production.[213]
Other methods of manufacture
[edit]Methods of vaccine generation that bypass the need for eggs include the construction of influenza virus-like particles (VLP). VLP resemble viruses, but there is no need for inactivation, as they do not include viral coding elements, but merely present antigens in a similar manner to a virion. Some methods of producing VLP include cultures of Spodoptera frugiperda Sf9 insect cells and plant-based vaccine production (e.g., production in Nicotiana benthamiana). There is evidence that some VLPs elicit antibodies that recognize a broader panel of antigenically distinct viral isolates compared to other vaccines in the hemagglutination-inhibition assay (HIA).[214]
A gene-based DNA vaccine, used to prime the immune system after boosting with an inactivated H5N1 vaccine, underwent clinical trials in 2011.[215][216][217]
On November 20, 2012, Novartis received FDA approval for the first cell-culture vaccine.[143][34][218][219] In 2013, the recombinant influenza vaccine, Flublok, was approved for use in the United States.[36][220][221][222]
On September 17, 2020, the Committee for Medicinal Products for Human Use (CHMP) of the European Medicines Agency (EMA) adopted a positive opinion, recommending the granting of a marketing authorization for Supemtek, a quadrivalent influenza vaccine (recombinant, prepared in cell culture).[223] The applicant for this medicinal product is Sanofi Pasteur.[223] Supemtek was approved for medical use in the European Union in November 2020.[144][224]
Australia authorised its first and cell-based vaccine in March 2021, based on an "eternal cell line" of a dog kidney. Because of the way it is produced, it produces better-matched vaccine (to the flu strains).[139]
Vaccine manufacturing countries
[edit]According to the WHO, as of 2019[update], countries where influenza vaccine is produced include:[225]
- Australia
- Brazil
- Canada
- China
- France
- Germany
- Hungary
- India
- Iran
- Japan
- Mexico
- Netherlands
- Nicaragua
- Russian Federation
- South Korea
- United Kingdom
- United States
- Vietnam
In addition, Kazakhstan, Serbia and Thailand had facilities in final stages of establishing production.[225]
Cost-effectiveness
[edit]The cost-effectiveness of seasonal influenza vaccination has been widely evaluated for different groups and in different settings.[226] In the elderly (over 65), the majority of published studies have found that vaccination is cost saving, with the cost savings associated with influenza vaccination (e.g. prevented health care visits) outweighing the cost of vaccination.[227] In older adults (aged 50–64 years), several published studies have found that influenza vaccination is likely to be cost-effective, however the results of these studies were often found to be dependent on key assumptions used in the economic evaluations.[228] The uncertainty in influenza cost-effectiveness models can partially be explained by the complexities involved in estimating the disease burden,[229] as well as the seasonal variability in the circulating strains and the match of the vaccine.[230][231] In healthy working adults (aged 18–49 years), a 2012 review found that vaccination was generally not cost-saving, with the suitability for funding being dependent on the willingness to pay to obtain the associated health benefits.[232] In children, the majority of studies have found that influenza vaccination was cost-effective, however many of the studies included (indirect) productivity gains, which may not be given the same weight in all settings.[233] Several studies have attempted to predict the cost-effectiveness of interventions (including prepandemic vaccination) to help protect against a future pandemic, however estimating the cost-effectiveness has been complicated by uncertainty as to the severity of a potential future pandemic and the efficacy of measures against it.[234]
Research
[edit]Influenza research includes molecular virology, molecular evolution, pathogenesis, host immune responses, genomics, and epidemiology. These help in developing influenza countermeasures such as vaccines, therapies and diagnostic tools. Improved influenza countermeasures require basic research on how viruses enter cells, replicate, mutate, evolve into new strains and induce an immune response. The Influenza Genome Sequencing Project is creating a library of influenza sequences[235] that will help researchers' understanding of what makes one strain more lethal than another, what genetic determinants most affect immunogenicity, and how the virus evolves over time. Solutions to limitations in current[when?] vaccine methods are being[when?] researched.
A different approach uses Internet content to estimate the impact of an influenza vaccination campaign. More specifically, researchers have used data from Twitter and Microsoft's Bing search engine, and proposed a statistical framework which, after a series of operations, maps this information to estimates of the influenza-like illness reduction percentage in areas where vaccinations have been performed. The method has been used to quantify the impact of two flu vaccination programmes in England (2013/14 and 2014/15), where school-age children were administered a live attenuated influenza vaccine (LAIV). Notably, the impact estimates were in accordance with estimations from Public Health England based on traditional syndromic surveillance endpoints.[236][237]
Rapid response to pandemic flu
[edit]The rapid development, production, and distribution of pandemic influenza vaccines could potentially save millions of lives during an influenza pandemic. Due to the short time frame between identification of a pandemic strain and need for vaccination, researchers are looking at novel technologies for vaccine production that could provide better "real-time" access and be produced more affordably, thereby increasing access for people living in low- and moderate-income countries, where an influenza pandemic may likely originate, such as live attenuated (egg-based or cell-based) technology and recombinant technologies (proteins and virus-like particles).[238] As of July 2009[update], more than seventy known clinical trials have been completed or are ongoing for pandemic influenza vaccines.[239] In September 2009, the FDA approved four vaccines against the 2009 H1N1 influenza virus (the 2009 pandemic strain), and expected the initial vaccine lots to be available within the following month.[240]
In January 2020, the US Food and Drug Administration (FDA) approved Audenz as a vaccine for the H5N1 flu virus.[241] Audenz is a vaccine indicated for active immunization for the prevention of disease caused by the influenza A virus H5N1 subtype contained in the vaccine. Audenz is approved for use in persons six months of age and older at increased risk of exposure to the influenza A virus H5N1 subtype contained in the vaccine.[242]
Universal flu vaccines
[edit]A universal influenza vaccine that would not have to be designed and made for each flu season in each hemisphere would stabilize the supply, avoid error in predicting the season's variants, and protect against escape of the circulating strains by mutation.[200] Such a vaccine has been the subject of research for decades.[243]
One approach is to use broadly neutralizing antibodies that, unlike the annual seasonal vaccines used over the first decades of the 21st century that provoke the body to generate an immune response, instead provide a component of the immune response itself. The first neutralizing antibodies were identified in 1993, via experimentation.[244] It was found that the flu neutralizing antibodies bound to the stalk of the Hemagglutinin protein. Antibodies that could bind to the head of those proteins were identified. The highly conserved M2 proton channel was proposed as a potential target for broadly neutralizing antibodies.[243][245]
The challenges for researchers are to identify single antibodies that could neutralize many subtypes of the virus, so that they could be useful in any season, and that target conserved domains that are resistant to antigenic drift.[243]
Another approach is to take the conserved domains identified from these projects, and to deliver groups of these antigens to provoke an immune response; various approaches with different antigens, presented different ways (as fusion proteins, mounted on virus-like particles, on non-pathogenic viruses, as DNA, and others), are under development.[245][246][247]
Efforts have also been undertaken to develop universal vaccines that specifically activate a T-cell response, based on clinical data showing that people with a strong, early T-cell response have better outcomes when infected with influenza and because T-cells respond to conserved epitopes. The challenge for developers is that these epitopes are on internal protein domains that are only mildly immunogenic.[245]
Along with the rest of the vaccine field, people working on universal vaccines have experimented with vaccine adjuvants to improve the ability of their vaccines to create a sufficiently powerful and enduring immune response.[245][248]
Oral influenza vaccine
[edit]As of 2019, an oral flu vaccine was in clinical research.[249] The oral vaccine candidate is based on an adenovirus type 5 vector modified to remove genes needed for replication, with an added gene that expresses a small double-stranded RNA hairpin molecule as an adjuvant.[250] In 2020, a Phase II human trial of the pill form of the vaccine showed that it was well tolerated and provided similar immunity to a licensed injectable vaccine.[251]
COVID-19
[edit]An influenza vaccine and a COVID-19 vaccine may be given safely at the same time.[59][252] Preliminary research indicates that influenza vaccination does not prevent COVID-19, but may reduce the incidence and severity of COVID-19 infection.[253]
Criticism
[edit]Tom Jefferson, who has led Cochrane Collaboration reviews of flu vaccines, has called clinical evidence concerning flu vaccines "rubbish" and has therefore declared them to be ineffective; he has called for placebo-controlled randomized clinical trials, which most in the field hold as unethical. His views on the efficacy of flu vaccines are rejected by medical institutions including the CDC and the National Institutes of Health, and by key figures in the field like Anthony Fauci.[254]
Michael Osterholm, who led the Center for Infectious Disease Research and Policy 2012 review on flu vaccines, recommended getting the vaccine but criticized its promotion, saying, "We have overpromoted and overhyped this vaccine ... it does not protect as promoted. It's all a sales job: it's all public relations."[255]
Veterinary use
[edit]Veterinary influenza vaccination aims to achieve the following four objectives:[256]
- Protection from clinical disease
- Protection from infection with virulent virus
- Protection from virus excretion
- Serological differentiation of infected from vaccinated animals (so-called DIVA principle).
Horses
[edit]Horses with horse flu can run a fever, have a dry hacking cough, have a runny nose, and become depressed and reluctant to eat or drink for several days but usually recover in two to three weeks. "Vaccination schedules generally require a primary course of two doses, 3–6 weeks apart, followed by boosters at 6–12 month intervals. It is generally recognized that in many cases such schedules may not maintain protective levels of antibody and more frequent administration is advised in high-risk situations."[257]
It is a common requirement at shows in the United Kingdom that horses be vaccinated against equine flu and a vaccination card must be produced; the International Federation for Equestrian Sports (FEI) requires vaccination every six months.[258][259]
Poultry
[edit]It is possible to vaccinate poultry against specific strains of highly pathogenic avian influenza. Vaccination should be combined with other control measures such as infection monitoring, early detection and biosecurity.[260][261]
Pigs
[edit]Swine influenza vaccines are extensively used in pig farming in Europe and North America. Most swine flu vaccines include an H1N1 and an H3N2 strain.
Swine influenza has been recognized as a major problem since the outbreak in 1976. Evolution of the virus has resulted in inconsistent responses to traditional vaccines. Standard commercial swine flu vaccines are effective in controlling the problem when the virus strains match enough to have significant cross-protection. Customised (autogenous) vaccines made from the specific viruses isolated, are made and used in the more difficult cases.[262] The vaccine manufacturer Novartis claims that the H3N2 strain (first identified in 1998) has brought major losses to pig farmers. Abortion storms are a common sign and sows stop eating for a few days and run a high fever. The mortality rate can be as high as fifteen percent.[263]
Dogs
[edit]In 2004, influenza A virus subtype H3N8 was discovered to cause canine influenza. Because of the lack of previous exposure to this virus, dogs have no natural immunity to this virus. However, a vaccine was found in 2004.[264]
Notes
[edit]- ^ (H1N1)pdm09 is newer nomenclature for the 2009 pandemic H1N1 virus, not a different strain.
References
[edit]- ^ Jump up to: a b "AusPAR: Influenza Haemagglutinin Recombinant". Therapeutic Goods Administration (TGA). August 23, 2021. Archived from the original on September 11, 2021. Retrieved September 10, 2021.
- ^ Jump up to: a b "AusPAR: Inactivated quadrivalent influenza vaccine (split virion) influenza virus haemagglutinin". Therapeutic Goods Administration (TGA). December 2, 2020. Archived from the original on September 11, 2021. Retrieved September 10, 2021.
- ^ "Updates to the Prescribing Medicines in Pregnancy database". Therapeutic Goods Administration (TGA). December 21, 2022. Archived from the original on April 3, 2022. Retrieved January 2, 2023.
- ^ "Prescription medicines: registration of new chemical entities in Australia, 2017". Therapeutic Goods Administration (TGA). June 21, 2022. Archived from the original on April 10, 2023. Retrieved April 9, 2023.
- ^ "Prescription medicines: registration of new chemical entities in Australia, 2016". Therapeutic Goods Administration (TGA). June 21, 2022. Archived from the original on April 10, 2023. Retrieved April 10, 2023.
- ^ https://www.tga.gov.au/resources/auspar/auspar-flucelvax-quad-0 [bare URL]
- ^ "Summary Basis of Decision (SBD) for Supemtek". Health Canada. October 23, 2014. Archived from the original on May 30, 2022. Retrieved May 29, 2022.
- ^ "Regulatory Decision Summary - Flucelvax Quad". Health Canada. October 23, 2014. Archived from the original on June 7, 2022. Retrieved June 7, 2022.
- ^ "Regulatory Decision Summary - Flucelvax Quad". Health Canada. October 23, 2014. Archived from the original on June 7, 2022. Retrieved June 7, 2022.
- ^ "Regulatory Decision Summary - Influvac Tetra". Health Canada. October 23, 2014. Archived from the original on June 7, 2022. Retrieved June 7, 2022.
- ^ "Regulatory Decision Summary for Panenza (Haemagglutinin-Strain A (H1N1))". Drug and Health Products Portal. October 27, 2023. Retrieved April 2, 2024.
- ^ "Supemtek EPAR". European Medicines Agency. November 25, 2020. Retrieved June 27, 2024.
- ^ "Fluad Tetra". European Medicines Agency (EMA). May 20, 2020. Retrieved August 10, 2024.
- ^ Jump up to: a b c d e f g h i World Health Organization (November 2012). "Vaccines against influenza WHO position paper". Weekly Epidemiological Record. 87 (47): 461–76. hdl:10665/241993. PMID 23210147.
- ^ World Health Organization (May 2022). "Vaccines against influenza: WHO position paper – May 2022". Weekly Epidemiological Record. 97 (19): 185–208. hdl:10665/354265.
- ^ Manzoli L, Ioannidis JP, Flacco ME, De Vito C, Villari P (July 2012). "Effectiveness and harms of seasonal and pandemic influenza vaccines in children, adults and elderly: a critical review and re-analysis of 15 meta-analyses". Human Vaccines & Immunotherapeutics. 8 (7): 851–62. doi:10.4161/hv.19917. PMC 3495721. PMID 22777099.
- ^ Compans RW (2009). Vaccines for pandemic influenza. Dordrecht: Springer. p. 49. ISBN 978-3-540-92165-3. Archived from the original on August 3, 2020. Retrieved September 9, 2017.
- ^ Vaccine Analysis: Strategies, Principles, and Control. Springer. 2014. p. 61. ISBN 978-3-662-45024-6. Archived from the original on August 3, 2020. Retrieved September 9, 2017.
- ^ Jump up to: a b c d "Who Should and Who Should NOT get a Flu Vaccine". U.S. Centers for Disease Control and Prevention (CDC). October 11, 2019. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ The immunological basis for immunization series: module 23: influenza vaccines. World Health Organization (WHO). October 2017. hdl:10665/259211. ISBN 978-92-4-151305-0.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s Grohskopf LA, Alyanak E, Ferdinands JM, Broder KR, Blanton LH, Talbot HK, et al. (August 2021). "Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices, United States, 2021-22 Influenza Season" (PDF). MMWR Recomm Rep. 70 (5): 1–28. doi:10.15585/mmwr.rr7005a1. PMC 8407757. PMID 34448800. Archived (PDF) from the original on August 27, 2021. Retrieved August 29, 2021.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ Организация WH (2019). Модельный список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г. Женева: Всемирная организация здравоохранения . hdl : 10665/325771 . ВОЗ/MVP/EMP/IAU/2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ Организация WH (2021). Примерный список основных лекарственных средств Всемирной организации здравоохранения: 22-й список (2021 г.) . Женева: Всемирная организация здравоохранения . hdl : 10665/345533 . ВОЗ/MHP/HPS/EML/2021.02.
- ^ «Выполнение Рекомендации Совета по вакцинации против сезонного гриппа (2009/1019/ЕС)» (PDF) . Европейский центр профилактики и контроля заболеваний . Январь 2014 г. Архивировано (PDF) из оригинала 10 апреля 2020 г. . Проверено 10 апреля 2020 г.
- Разместить резюме в: «Выполнение Рекомендации Совета по вакцинации против сезонного гриппа» . Европейский центр профилактики и контроля заболеваний . 9 января 2014 г.
- ^ Jump up to: а б с д и «Вакцина против гриппа и люди с аллергией на яйца» . Центры США по контролю и профилактике заболеваний (CDC). 25 ноября 2019 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Внутрикожная вакцинация против гриппа» . Центры США по контролю и профилактике заболеваний (CDC) . 31 октября 2018 года. Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Вакцины против гриппа – США, сезон гриппа 2019–2020 гг.» . Центры США по контролю и профилактике заболеваний (CDC) . 22 августа 2019 года. Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Вакцина против вируса гриппа инактивированная» . Американское общество фармацевтов системы здравоохранения. 19 ноября 2018 года. Архивировано из оригинала 14 октября 2019 года . Проверено 13 октября 2019 г.
- ^ Медицинский институт (2005). Ноблер С.Л., Мак А., Махмуд А., Лемон С.М. (ред.). Угроза пандемического гриппа: готовы ли мы? Краткое содержание семинара . Пресса национальных академий. п. 62. дои : 10.17226/11150 . ISBN 978-0-309-09504-4 . ПМИД 20669448 .
- ^ Плоткин С.Л. и Плоткин С.А. «Краткая история вакцинации». В: Вакцины , Стэнли А. Плоткин, Уолтер А. Оренштейн, Пол А. Оффит, ред. Elsevier Health Sciences, 2008, стр. 6–7.
- ^ Артенштейн, AW «Грипп» В: Вакцины: биография , Эндрю В. Артенштейн, изд. стр. 191–205.
- ^ Хэмпсон А.В. (июнь 2008 г.). «Вакцины от пандемического гриппа. История наших современных вакцин, их ограничения и требования для борьбы с пандемической угрозой» . Анналы Медицинской академии, Сингапур . 37 (6): 510–17. doi : 10.47102/annals-acadmedsg.V37N6p510 . ПМИД 18618064 . S2CID 17102174 .
- ^ Милиан Э., Камен А.А. (2015). «Современные и новые технологии производства клеточных культур для вакцин против гриппа» . Биомед Рес Инт . 2015 : 504831. doi : 10.1155/2015/504831 . ПМК 4359798 . ПМИД 25815321 .
- ^ Jump up to: а б «FDA одобряет первую вакцину против сезонного гриппа, изготовленную с использованием технологии клеточных культур» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). Архивировано из оригинала 2 января 2013 года.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Клеточные вакцины против гриппа» . Центры США по контролю и профилактике заболеваний (CDC). 11 октября 2019 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «FDA одобряет новую вакцину против сезонного гриппа, изготовленную с использованием новой технологии» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 16 января 2013 г. Архивировано из оригинала 18 мая 2013 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Лэндри Н., Уорд Б.Дж., Трепанье С., Монтомоли Э., Даргис М., Лапини Г. и др. (декабрь 2010 г.). «Доклиническая и клиническая разработка вакцины на основе вирусоподобных частиц растительного происхождения против птичьего гриппа H5N1» . ПЛОС ОДИН . 5 (12): е15559. Бибкод : 2010PLoSO...515559L . дои : 10.1371/journal.pone.0015559 . ПМК 3008737 . ПМИД 21203523 .
- ^ Остерхольм, М.Т. (май 2005 г.). «Готовимся к следующей пандемии». Медицинский журнал Новой Англии . 352 (18): 1839–42. CiteSeerX 10.1.1.608.6200 . дои : 10.1056/NEJMp058068 . ПМИД 15872196 . S2CID 45893174 .
- ^ «Эпидемия свиного гриппа» . 9 октября 1999 г. Архивировано из оригинала 9 октября 1999 г.
- ^ Маккаллерс Дж.А., Ван Де Вельде Л.А., Эллисон К.Дж., Бранум К.С., Уэбби Р.Дж., Флинн П.М. (июнь 2010 г.). «У получателей вакцины против «свиного гриппа» 1976 года наблюдалась усиленная реакция нейтрализации нового вируса гриппа H1N1 2009 года» . Клинические инфекционные болезни . 50 (11): 1487–92. дои : 10.1086/652441 . ПМЦ 2946351 . ПМИД 20415539 .
- ^ Jump up to: а б Доши П. (20 сентября 2018 г.). «Вакцина Пандемрикс: почему общественности не сообщили о признаках раннего предупреждения?». БМЖ . 362 :к3948. дои : 10.1136/bmj.k3948 . ISSN 0959-8138 . S2CID 52308748 .
- ^ Jump up to: а б Доши П. (20 сентября 2018 г.). «Вакцина Пандемрикс: почему общественности не сообщили о признаках раннего предупреждения?». БМЖ . 362 : Инфографика. дои : 10.1136/bmj.k3948 . S2CID 52308748 .
- ^ «Первая четырехвалентная вакцина против сезонного гриппа получила одобрение FDA» . 2 марта 2012 г. Архивировано из оригинала 4 марта 2012 г.
- ^ «FDA одобряет первую четырехвалентную вакцину для профилактики сезонного гриппа» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). Архивировано из оригинала 21 декабря 2012 года.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Письмо-утверждение от 14 декабря 2012 г. – Fluarix Quadriвалент» . США Управление по контролю за продуктами и лекарствами (FDA). Архивировано из оригинала 2 января 2013 года.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Национальный консультативный комитет по иммунизации (NACI) (июль 2014 г.). Обзор литературы по четырехвалентным вакцинам против гриппа (PDF) . Оттава: Агентство общественного здравоохранения Канады. ISBN 978-1-100-24682-6 . Кат.: HP40-117/2014E-PDF Публикация: 140118. Архивировано (PDF) из оригинала 1 августа 2020 г. . Проверено 11 января 2020 г.
- ^ «Что следует знать о сезоне гриппа 2018–2019 гг.» . Центры по контролю и профилактике заболеваний (CDC) . 10 января 2019 года. Архивировано из оригинала 6 августа 2020 года . Проверено 5 февраля 2020 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с д и ж г «Часто задаваемые вопросы о гриппе (гриппе): сезон 2019–2020 гг.» . Центры США по контролю и профилактике заболеваний (CDC) . 5 ноября 2019 года. Архивировано из оригинала 1 декабря 2019 года . Проверено 30 ноября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Высокодозный четырехвалентный флюзон» . США Управление по контролю за продуктами и лекарствами (FDA). 4 ноября 2019 г. STN: BL 103914. Архивировано из оригинала 12 января 2020 г. . Проверено 5 февраля 2020 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «FDA одобрило четырехвалентную высокую дозу флюзона (вакцина против гриппа) для взрослых в возрасте 65 лет и старше» . Санофи (Пресс-релиз). 4 ноября 2019 г. Архивировано из оригинала 1 августа 2020 г. Проверено 5 февраля 2020 г.
- ^ Jump up to: а б с «Флуад Четырехвалентный» . США Управление по контролю за продуктами и лекарствами (FDA). 2 июля 2020 г. STN: 125510. Архивировано из оригинала 11 августа 2020 г. . Проверено 25 августа 2020 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Seqirus получает одобрение FDA на четырехвалентный препарат Fluad для взрослых 65 лет и старше» . Секирус (Пресс-релиз). 24 февраля 2020 года. Архивировано из оригинала 26 августа 2020 года . Проверено 25 августа 2020 г.
- ^ «Seqirus начинает поставки вакцин против гриппа 2020/21 года на рынок США» . Секирус (Пресс-релиз). 30 июля 2020 года. Архивировано из оригинала 26 августа 2020 года . Проверено 25 августа 2020 г.
- ^ Кутсакос М., Уитли А.К., Лори К., Кент С.Дж., Рокман С. (декабрь 2021 г.). «Вымирание линий гриппа во время пандемии COVID-19?» . Обзоры природы. Микробиология . 19 (12): 741–742. дои : 10.1038/s41579-021-00642-4 . ПМЦ 8477979 . ПМИД 34584246 .
- ^ Jump up to: а б Всемирная организация здравоохранения (29 сентября 2023 г.). «Вопросы и ответы: Рекомендуемый состав вакцин против вируса гриппа для использования в сезоне гриппа 2024 года в южном полушарии и разработка вакцинных вирусов-кандидатов для обеспечения готовности к пандемии» (PDF) . Архивировано (PDF) оригинала 10 октября 2023 г. Проверено 26 октября 2023 г.
- ^ Jump up to: а б Шнирринг Л. (29 сентября 2023 г.). «Консультанты ВОЗ рекомендуют вернуться к трехвалентной вакцине против гриппа» . ЦИДРАП . Архивировано из оригинала 18 декабря 2023 года . Проверено 26 октября 2023 г.
- ^ Jump up to: а б «Использование трехвалентных вакцин против гриппа в сезоне гриппа в США 2024–2025 гг.» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 5 марта 2024 года. Архивировано из оригинала 7 марта 2024 года . Проверено 7 марта 2024 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с д и ж «Ключевые факты о вакцине против сезонного гриппа» . Центры США по контролю и профилактике заболеваний (CDC). 2 декабря 2019 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Вакцина от гриппа» . Национальная служба здравоохранения Великобритании. 13 мая 2022 года. Архивировано из оригинала 26 октября 2021 года . Проверено 13 августа 2022 г.
- ^ Остерхольм М.Т., Келли Н.С., Соммер А., Белонгия Е.А. (январь 2012 г.). «Эффективность и результативность вакцин против гриппа: систематический обзор и метаанализ». «Ланцет». Инфекционные болезни . 12 (1): 36–44. дои : 10.1016/s1473-3099(11)70295-x . ПМИД 22032844 .
- ^ Макинтайр ЧР, Махимбо А., Моа А.М., Барнс М. (декабрь 2016 г.). «Вакцина против гриппа как коронарное вмешательство для профилактики инфаркта миокарда» . Сердце . 102 (24): 1953–1956. doi : 10.1136/heartjnl-2016-309983 . ПМК 5256393 . ПМИД 27686519 .
- ^ «Оценки эффективности вакцин прошлых сезонов» . Центры США по контролю и профилактике заболеваний (CDC) . 29 января 2020 года. Архивировано из оригинала 12 февраля 2020 года . Проверено 4 марта 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Центры по профилактике заболеваний (CDC) (13 августа 2004 г.). «Оценка эффективности вакцины против гриппа 2003-04 гг. среди детей и взрослых – Колорадо, 2003 г.» . ММВР. Еженедельный отчет о заболеваемости и смертности . 53 (31). Центры по контролю и профилактике заболеваний: 707–710. ISSN 1545-861X . ПМИД 15306754 . Архивировано из оригинала 27 апреля 2022 года . Проверено 27 апреля 2022 г. За столом.
- ^ Центры по профилактике контроля заболеваний (CDC) (16 января 2004 г.). «Предварительная оценка эффективности инактивированной вакцины против гриппа 2003-04 гг. - Колорадо, декабрь 2003 г.» . ММВР. Еженедельный отчет о заболеваемости и смертности . 53 (1). Центры по контролю и профилактике заболеваний: 8–11. ISSN 1545-861X . ПМИД 14724559 . Архивировано из оригинала 29 мая 2022 года . Проверено 25 апреля 2022 г.
- ^ «Отчеты о прошлых еженедельных наблюдениях» . Центры по контролю и профилактике заболеваний . 29 апреля 2022 года. Архивировано из оригинала 22 апреля 2022 года . Проверено 25 апреля 2022 г.
- ^ Чунг-младший (11 марта 2022 г.). «Промежуточные оценки эффективности вакцины против сезонного гриппа на 2021–2022 годы — США, февраль 2022 года» . ММВР. Еженедельный отчет о заболеваемости и смертности . 71 (10): 365–370. дои : 10.15585/mmwr.mm7110a1 . ISSN 0149-2195 . ПМК 8911998 . ПМИД 35271561 . Архивировано из оригинала 16 мая 2022 года . Проверено 25 мая 2022 г.
- ^ Имон Н. Дрейсбах (3 июня 2021 г.). «CDC не может оценить эффективность вакцины против гриппа после исторически мягкого сезона» . Хелио. Архивировано из оригинала 8 октября 2021 года . Проверено 18 апреля 2022 г.
- ^ Федсон Д.С. (1998). «Измерение защиты: эффективность против результативности». Развитие биологической стандартизации . 95 : 195–201. ПМИД 9855432 .
- ^ Jump up to: а б с д и Демикели В., Джефферсон Т., Феррони Е., Риветти А., Ди Пьетрантонж К. (февраль 2018 г.). «Вакцины для профилактики гриппа у здоровых взрослых» . Кокрейновская база данных систематических обзоров . 2020 (2): CD001269. дои : 10.1002/14651858.CD001269.pub6 . ПМК 6491184 . ПМИД 29388196 .
- ^ Джефферсон Т. (октябрь 2006 г.). «Вакцинация против гриппа: политика против фактических данных» . БМЖ . 333 (7574): 912–15. дои : 10.1136/bmj.38995.531701.80 . ПМЦ 1626345 . ПМИД 17068038 .
- ^ «Сезон гриппа 2007–2008 гг.» . Центры США по контролю и профилактике заболеваний (CDC). 26 июня 2008 г. Архивировано из оригинала 6 марта 2008 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Каррат Ф, Флахолт А (сентябрь 2007 г.). «Вакцина против гриппа: проблема антигенного дрейфа». Вакцина . 25 (39–40): 6852–6862. doi : 10.1016/j.vaccine.2007.07.027 . ПМИД 17719149 .
- ^ Саутто Г.А., Кирхенбаум Г.А., Росс Т.М. (19 января 2018 г.). «На пути к универсальной вакцине против гриппа: разные подходы к одной цели» . Вирусологический журнал . 15 (1): 17. дои : 10.1186/s12985-017-0918-y . ПМЦ 5785881 . ПМИД 29370862 .
- ^ Jump up to: а б Чоу Э.Дж., Дойл Дж.Д., Уеки Т.М. (12 июня 2019 г.). «Критические заболевания, связанные с вирусом гриппа: профилактика, диагностика, лечение» . Критическая помощь . 23 (1): 214. doi : 10.1186/s13054-019-2491-9 . ПМК 6563376 . ПМИД 31189475 .
- ^ Краммер Ф., Смит Г.Дж., Фушье Р.А., Пейрис М., Кедзерска К., Доэрти ПК. и др. (28 июня 2018 г.). «Грипп» . Обзоры природы. Учебники по болезням . 4 (1): 3. doi : 10.1038/s41572-018-0002-y . ПМК 7097467 . ПМИД 29955068 .
- ^ Дабестани Н.М., Лейднер А.Дж., Зайбер Э.Э., Ким Х., Грайцер С.Б., Фоппа И.М. и др. (сентябрь 2019 г.). «Обзор экономической эффективности вакцинации против гриппа взрослых и других профилактических услуг» . Профилактическая медицина . 126 : 105734. doi : 10.1016/j.ypmed.2019.05.022 . ПМЦ 6778688 . ПМИД 31152830 .
- ^ Jump up to: а б с Гебрехевет С., Макферсон П., Хо А. (7 декабря 2016 г.). «Грипп» . БМЖ . 355 : i6258. дои : 10.1136/bmj.i6258 . ПМК 5141587 . ПМИД 27927672 .
- ^ Jump up to: а б Принципи Н., Эспозито С. (4 марта 2018 г.). «Защита детей от гриппа: новые проблемы» . Человеческие вакцины и иммунотерапия . 14 (3): 750–757. дои : 10.1080/21645515.2017.1279772 . ПМК 5861800 . ПМИД 28129049 .
- ^ Томпсон М.Г., Пирс Н., Хуанг К.С., Прасад Н., Дуке Дж., Ньюберн Э.К. и др. (18 сентября 2018 г.). «Эффективность вакцины против гриппа в предотвращении госпитализаций в отделения интенсивной терапии в связи с гриппом и ослаблении тяжелых заболеваний среди взрослых в Новой Зеландии, 2012–2015 гг.» . Вакцина . 36 (39): 5916–5925. doi : 10.1016/j.vaccine.2018.07.028 . ISSN 0264-410X . ПМИД 30077480 . S2CID 51922011 . Архивировано из оригинала 27 мая 2022 года . Проверено 23 апреля 2022 г.
- ^ Тенфорд М.В., Талбот Х.К., Трабу Ч., Гаглани М., МакНил Т.С., Монто А.С. и др. (30 декабря 2020 г.). «Эффективность вакцины против гриппа против госпитализации в США, 2019–2020 гг.» . Журнал инфекционных болезней . 224 (5): 813–820. дои : 10.1093/infdis/jiaa800 . ISSN 0022-1899 . ПМЦ 8408767 . ПМИД 33378531 . Архивировано из оригинала 23 апреля 2022 года . Проверено 23 апреля 2022 г.
- ^ Фердинандс Дж. М., Томпсон М. Г., Блэнтон Л., Спенсер С., Грант Л., Фрай А. М. (23 июня 2021 г.). «Снижает ли вакцинация против гриппа тяжесть прорывных инфекций? Описательный обзор и рекомендации для дальнейших исследований» . Вакцина . 39 (28): 3678–3695. doi : 10.1016/j.vaccine.2021.05.011 . ISSN 0264-410X . ПМИД 34090700 . S2CID 235361401 . Архивировано из оригинала 23 апреля 2022 года . Проверено 23 апреля 2022 г.
- ^ Jump up to: а б с «Эффективность вакцины: насколько хорошо действуют вакцины против гриппа?» . Центры США по контролю и профилактике заболеваний (CDC) . 12 октября 2018 года. Архивировано из оригинала 25 октября 2019 года . Проверено 24 октября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Рамзи Л.С., Бьюкен С.А., Стирлинг Р.Г., Коулинг Б.Дж., Фенг С., Квонг Дж.К. и др. (январь 2019 г.). «Влияние повторной вакцинации на эффективность вакцины против гриппа: систематический обзор и метаанализ» . БМК Мед . 17 (1): 9. дои : 10.1186/s12916-018-1239-8 . ПМК 6327561 . ПМИД 30626399 .
- ^ Белонгия Э.А., Сковронски Д.М., штаб-квартира Маклина, Чемберс К., Сундарам М.Е., Де Серрес Дж. (июль 2017 г.). «Повторная ежегодная вакцинация против гриппа и эффективность вакцины: обзор фактических данных» . Эксперт Рев Вакцины . 16 (7): 723–36. дои : 10.1080/14760584.2017.1334554 . ПМИД 28562111 .
- ^ Джеммилл I, Ён Кей (7 июня 2018 г.). «Резюме обзора литературы NACI о сравнительной эффективности субъединичных и сплит-инактивированных вакцин против гриппа у пожилых людей» . Отчет об инфекционных заболеваниях в Канаде . 44 (6): 129–133. дои : 10.14745/ccdr.v44i06a02 . ISSN 1481-8531 . ПМК 6449119 . ПМИД 31015805 . Архивировано из оригинала 17 мая 2020 года . Проверено 2 июня 2020 г.
- ^ «Грипп и люди 65 лет и старше» . Центры по контролю и профилактике заболеваний . 26 августа 2021 года. Архивировано из оригинала 22 апреля 2022 года . Проверено 21 апреля 2022 г.
- ^ Макинтайр ЧР, Махимбо А., Моа А.М., Барнс М. (декабрь 2016 г.). «Вакцина против гриппа как коронарное вмешательство для профилактики инфаркта миокарда» . Сердце . 102 (24): 1953–1956. doi : 10.1136/heartjnl-2016-309983 . ПМК 5256393 . ПМИД 27686519 .
- ^ Jump up to: а б «Историческая шкала гриппа | Пандемический грипп (грипп) | CDC» . 11 марта 2020 года. Архивировано из оригинала 30 января 2022 года . Проверено 27 января 2022 г.
- ^ Jump up to: а б «Грипп (сезонный)» . Всемирная организация здравоохранения (ВОЗ) . 6 ноября 2018 года. Архивировано из оригинала 25 октября 2019 года . Проверено 24 октября 2019 г.
- ^ «Исследование детской смертности от гриппа показывает, что здоровые дети находятся в группе риска» . Центры США по контролю и профилактике заболеваний (CDC) . 12 февраля 2018 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б Джефферсон Т., Риветти А., Ди Пьетрантонж С., Демикели В. (февраль 2018 г.). «Вакцины для профилактики гриппа у здоровых детей» . Кокрейновская база данных систематических обзоров . 2018 (2): CD004879. дои : 10.1002/14651858.CD004879.pub5 . ПМК 6491174 . ПМИД 29388195 .
- ^ Стинхейсен Дж. (22 января 2018 г.). «Директор Центра по контролю и профилактике заболеваний США призывает делать прививки от гриппа, поскольку детская смертность растет» . Рейтер. Архивировано из оригинала 6 мая 2021 года . Проверено 26 января 2018 г.
- ^ «Высокодозный четырехвалентный флюзон» . США Управление по контролю за продуктами и лекарствами (FDA). 14 ноября 2019 года. Архивировано из оригинала 1 декабря 2019 года . Проверено 30 ноября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Афлурия Четырехвалентная» . США Управление по контролю за продуктами и лекарствами (FDA). 8 ноября 2019 года. Архивировано из оригинала 1 декабря 2019 года . Проверено 30 ноября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Национальный консультативный комитет по иммунизации (NACI) (ноябрь 2018 г.). «Дополнительное заявление – Афлурия Тетра – Заявление Консультативного комитета (ACS)» . Агентство общественного здравоохранения Канады . Оттава. Кат.: HP37-25E-PDF Публикация: 180566. Архивировано из оригинала 12 января 2020 г. . Проверено 11 января 2020 г.
- ^ Обзор литературы по вакцинации против гриппа здоровых детей в возрасте 5–18 лет (PDF) (Отчет). Оттава: Агентство общественного здравоохранения Канады. Июль 2014. ISBN. 978-1-100-24681-9 . Кат.: HP40-116/2014E-PDF Публикация: 140116. Архивировано (PDF) из оригинала 1 августа 2020 г. . Проверено 12 января 2020 г.
- ^ Обзор литературы по использованию детской вакцины против гриппа Fluad у детей в возрасте 6–72 месяцев (PDF) (отчет). Оттава: Агентство общественного здравоохранения Канады. 2015. Архивировано (PDF) из оригинала 17 мая 2020 г. . Проверено 11 января 2020 г.
- ^ Пелег Н., Зевит Н., Шамир Р., Чодик Г., Леви И. (январь 2015 г.). «Уровни сезонной вакцинации против гриппа и причины отказа от вакцинации детей с желудочно-кишечными заболеваниями». Вакцина . 33 (1): 182–186. doi : 10.1016/j.vaccine.2014.10.086 . ПМИД 25444802 .
- ^ Jump up to: а б Остерхольм М.Т., Келли Н.С., Соммер А., Белонгия Е.А. (январь 2012 г.). «Эффективность и результативность вакцин против гриппа: систематический обзор и метаанализ». «Ланцет». Инфекционные болезни . 12 (1): 36–44. дои : 10.1016/S1473-3099(11)70295-X . ПМИД 22032844 .
- ^ Jump up to: а б Берлс А., Джордан Р., Бартон П., Оловокуре Б., Уэйк Б., Албон Э. и др. (май 2006 г.). «Вакцинация медицинских работников против гриппа для защиты уязвимых слоев населения – является ли это эффективным использованием ресурсов здравоохранения? Систематический анализ фактических данных и экономическая оценка». Вакцина . 24 (19): 4212–21. doi : 10.1016/j.vaccine.2005.12.043 . ПМИД 16546308 .
- ^ Ахмед Ф., Линдли М.К., Оллред Н., Вайнбаум К.М., Гроскопф Л. (январь 2014 г.). «Влияние вакцинации против гриппа медицинского персонала на заболеваемость и смертность среди пациентов: систематический обзор и классификация доказательств» . Клинические инфекционные болезни . 58 (1): 50–57. дои : 10.1093/cid/cit580 . ПМИД 24046301 .
- ^ Гриффин М.Р. (январь 2014 г.). «Вакцинация медицинских работников против гриппа: подготовка к действию» . Клинические инфекционные болезни . 58 (1): 58–60. дои : 10.1093/cid/cit590 . ПМИД 24046312 .
- ^ Симонсен Л., Вибуд С., Тейлор Р.Дж., Миллер М.А., Джексон Л. (октябрь 2009 г.). «Польза от вакцинации против гриппа и снижения смертности: новые идеи, новые возможности». Вакцина . 27 (45): 6300–04. doi : 10.1016/j.vaccine.2009.07.008 . ПМИД 19840664 .
- ^ Демичели В., Джефферсон Т., Ди Пьетрантонж С., Феррони Е., Торнинг С., Томас Р.Э. и др. (февраль 2018 г.). «Вакцины для профилактики гриппа у пожилых» . Кокрейновская база данных систематических обзоров . 2 (11): CD004876. дои : 10.1002/14651858.CD004876.pub4 . ПМК 6491101 . ПМИД 29388197 .
- ^ Дарвишян М., Бийлсма М.Дж., Хак Э., ван ден Хеувел Э.Р. (декабрь 2014 г.). «Эффективность вакцины против сезонного гриппа у пожилых людей, проживающих в сообществе: метаанализ исследований случай-контроль с отрицательным тестом». «Ланцет». Инфекционные болезни . 14 (12): 1228–39. дои : 10.1016/S1473-3099(14)70960-0 . ПМИД 25455990 .
- ^ Никол К.Л., Нордин Дж.Д., Нельсон Д.Б., Маллули Дж.П., Хак Э. (октябрь 2007 г.). «Эффективность вакцины против гриппа у пожилых людей, проживающих в сообществе» . Медицинский журнал Новой Англии . 357 (14): 1373–81. doi : 10.1056/NEJMoa070844 . ПМИД 17914038 . S2CID 14850833 .
- ^ Симонсен Л., Тейлор Р.Дж., Вибуд С., Миллер М.А., Джексон Л.А. (октябрь 2007 г.). «Польза от вакцинации против гриппа среди пожилых людей в отношении смертности: продолжающиеся споры». «Ланцет». Инфекционные болезни . 7 (10): 658–66. дои : 10.1016/S1473-3099(07)70236-0 . ПМИД 17897608 .
- ^ Томпсон В.В., Шей Д.К., Вайнтрауб Э., Браммер Л., Кокс Н., Андерсон Л.Дж. и др. (январь 2003 г.). «Смертность, связанная с гриппом и респираторно-синцитиальным вирусом в США» . ДЖАМА . 289 (2): 179–86. дои : 10.1001/jama.289.2.179 . ПМИД 12517228 . S2CID 5018362 .
- ^ «Высокие дозы вакцины против гриппа для пожилых людей. Научная медицина» . Sciencebasedmedicine.org. 19 октября 2010 года. Архивировано из оригинала 8 мая 2013 года . Проверено 17 октября 2013 г.
- ^ «Высокодозная вакцина против сезонного гриппа Флюзон» . Центры США по контролю и профилактике заболеваний (CDC). 6 сентября 2019 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
- ^ Диас Гранадос К.А., Даннинг А.Дж., Киммел М., Кирби Д., Треанор Дж., Коллинз А. и др. (август 2014 г.). «Эффективность высоких доз вакцины против гриппа по сравнению со стандартной дозой у пожилых людей» . Медицинский журнал Новой Англии . 371 (7): 635–45. дои : 10.1056/NEJMoa1315727 . ПМИД 25119609 . S2CID 205096393 .
- ^ Уэллс С., Гробельна А. (8 января 2019 г.). «Высокие дозы вакцины против гриппа для взрослых: обзор клинической эффективности, экономической эффективности и руководящие принципы» (PDF) . Отчет быстрого реагирования . Оттава: Канадское агентство по лекарствам и технологиям в здравоохранении (CADTH). ISSN 1922-8147 . ПМИД 31141324 . Архивировано (PDF) оригинала 1 августа 2020 г. Проверено 15 августа 2022 г.
- ^ Масканьи П., Виченци Е., Кахасте-Рудницки А., Пелличчиотта Г., Монти А., Черви С. и др. (2012). «Оценка эффективности и безопасности вакцины против пандемического гриппа A/H1N1/2009 в группе медицинских работников». Профессиональная медицина . 103 (3): 220–29. ПМИД 22838300 .
- ^ «FDA одобряет первую вакцину против сезонного гриппа, содержащую адъювант» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 24 ноября 2015 года. Архивировано из оригинала 22 июля 2017 года . Проверено 20 августа 2017 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Вакцина против гриппа с адъювантом» . Центры США по контролю и профилактике заболеваний (CDC) . 4 сентября 2019 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Флуад» . США Управление по контролю за продуктами и лекарствами (FDA). 8 ноября 2019. STN 125510. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Вакцина против гриппа со скваленовым адъювантом: новый препарат. Не лучше имеющихся». Пресрайр Интернэшнл . 13 (74): 206–08. Декабрь 2004 г. PMID 15599987 .
- ^ Камиллони Б., Базилео М., Валенте С., Нунци Э., Иорио А.М. (2015). «Иммуногенность внутримышечных MF59-адъювантных и внутрикожных вакцин, усиленных против гриппа, у субъектов в возрасте старше 60 лет: обзор литературы» . Человеческие вакцины и иммунотерапия . 11 (3): 553–63. дои : 10.1080/21645515.2015.1011562 . ПМК 4514405 . ПМИД 25714138 .
- Разместить резюме в: «Обновленный обзор литературы по эффективности и результативности высоких доз (высокая доза флюзона) и трехвалентных инактивированных вакцин против гриппа с адъювантом MF59 (Fluad) у взрослых в возрасте 65 лет и старше» . Агентство общественного здравоохранения Канады . 1 мая 2018 г.
- ^ Ван Дамм П., Арну Р., Кафея Ф., Фике А., Ришар П., Томас С. и др. (май 2010 г.). «Оценка не меньшей эффективности внутрикожной вакцины против сезонного гриппа с адъювантом с использованием двух серологических методов: рандомизированное сравнительное исследование» . БМК Инфекционные болезни . 10 :134. дои : 10.1186/1471-2334-10-134 . ПМЦ 2895601 . ПМИД 20504306 .
- ^ Хаверкейт М., Д'Анкона Ф., Джамби С., Йохансен К., Лопалко П.Л., Коцца В. и др. (Коллектив контактных точек проекта VENICE) (май 2012 г.). «Обязательная и рекомендуемая вакцинация в ЕС, Исландии и Норвегии: результаты исследования VENICE 2010 о путях реализации национальных программ вакцинации» . Евронаблюдение . 17 (22). doi : 10.2807/ese.17.22.20183-en . ПМИД 22687916 .
- ^ Полевой РИ (ноябрь 2009 г.). «Обязательная вакцинация медицинских работников: чьи права должны быть на первом месте?» . П&Т . 34 (11): 615–18. ПМК 2810172 . ПМИД 20140133 .
- ^ Кассианос Г (2015). «Готовность европейских медицинских работников пройти вакцинацию против сезонного гриппа: текущая ситуация и предложения по улучшению» . Наркотики в контексте . 4 : 212268. дои : 10.7573/dic.212268 . ПМК 4316812 . ПМИД 25657810 .
- ^ Томас Р.Э., Джефферсон Т., Лассерсон Т.Дж. (июнь 2016 г.). «Вакцинация против гриппа для медицинских работников, осуществляющих уход за людьми в возрасте 60 лет и старше, проживающими в учреждениях длительного ухода» . Кокрановская база данных систематических обзоров . 2016 (6): CD005187. дои : 10.1002/14651858.CD005187.pub5 . ПМЦ 8504984 . ПМИД 27251461 .
- ^ «Краткий обзор решений по рецептурным лекарствам Fluad Quad в Австралии» . Управление терапевтических товаров (TGA) . 13 декабря 2019 года. Архивировано из оригинала 8 марта 2020 года . Проверено 24 августа 2020 г.
- ^ «Флуад Тетра ЭПАР» . Европейское агентство лекарственных средств (EMA) . 24 марта 2020 года. Архивировано из оригинала 1 августа 2020 года . Проверено 29 мая 2020 г.
- ^ «Информация о продукте Флуад Тетра» . Союзный реестр лекарственных средств . Архивировано из оригинала 5 марта 2023 года . Проверено 3 марта 2023 г.
- ^ Фелл Д.Б., Спрэг А.Е., Лю Н., Ясин А.С., Вен С.В., Смит Г. и др. (июнь 2012 г.). «Вакцинация против гриппа H1N1 во время беременности, исходы для плода и новорожденного» . Американский журнал общественного здравоохранения (представлена рукопись). 102 (6): е33–40. дои : 10.2105/AJPH.2011.300606 . ПМЦ 3483960 . ПМИД 22515877 .
- ^ Мадхи С.А., Катленд С.Л., Куванда Л., Вайнберг А., Хьюго А., Джонс С. и др. (сентябрь 2014 г.). «Вакцинация беременных женщин от гриппа и защита их детей». Медицинский журнал Новой Англии . 371 (10): 918–31. дои : 10.1056/NEJMoa1401480 . hdl : 2263/42412 . ПМИД 25184864 .
- ^ «Прививка от гриппа» . CDC . 2020. Архивировано из оригинала 2 декабря 2019 года . Проверено 24 сентября 2020 г.
- ^ «Заблуждения о вакцинах против гриппа» . CDC . 2020. Архивировано из оригинала 10 августа 2020 года . Проверено 24 сентября 2020 г.
- ^ Макнил-младший, генеральный директор (1 октября 2018 г.). «Прошлой зимой от гриппа умерло более 80 000 американцев, это самый высокий показатель за последние годы» . Нью-Йорк Таймс . Архивировано из оригинала 1 октября 2018 года . Проверено 24 июня 2024 г.
- ^ «5 мифов о вакцине от гриппа» . Всемирная организация здравоохранения . Архивировано из оригинала 14 февраля 2024 года . Проверено 24 июня 2024 г.
- ^ Хабер П., Сейвар Дж., Микаэлофф Ю., ДеСтефано Ф. (2009). «Вакцины и синдром Гийена-Барре». Безопасность лекарств . 32 (4): 309–23. дои : 10.2165/00002018-200932040-00005 . ПМИД 19388722 . S2CID 33670594 .
- ^ «Реорганизованный текст». JAMA Отоларингология – хирургия головы и шеи . 141 (5): 428. Май 2015 г. doi : 10.1001/jamaoto.2015.0540 . ПМИД 25996397 . S2CID 26612829 .
- ^ Стоу Дж., Эндрюс Н., Уайз Л., Миллер Э. (февраль 2009 г.). «Исследование временной связи синдрома Гийена-Барре с вакциной против гриппа и гриппоподобным заболеванием с использованием базы данных исследований общей практики Соединенного Королевства» . Американский журнал эпидемиологии . 169 (3): 382–88. дои : 10.1093/aje/kwn310 . ПМИД 19033158 .
- ^ Jump up to: а б Сивадон-Тарди В., Орликовски Д., Порчер Р., Шаршар Т., Дюран М.С., Энуф В. и др. (январь 2009 г.). «Синдром Гийена-Барре и инфекция вируса гриппа» . Клинические инфекционные болезни . 48 (1): 48–56. дои : 10.1086/594124 . ПМИД 19025491 .
- ^ Веллоцци С., Бурвен Д.Р., Добардджич А., Болл Р., Уолтон К., Хабер П. (март 2009 г.). «Безопасность трехвалентных инактивированных вакцин против гриппа у взрослых: предпосылки мониторинга безопасности вакцин против пандемического гриппа» . Вакцина . 27 (15): 2114–20. doi : 10.1016/j.vaccine.2009.01.125 . ПМИД 19356614 . Архивировано из оригинала 1 августа 2020 года . Проверено 21 мая 2020 г.
- ^ Рейнберг С. (2 февраля 2011 г.). «Прошлогодняя вакцина против гриппа H1N1 была безопасной, показали исследования» . Новости США и мировой отчет . Архивировано из оригинала 25 апреля 2013 года.
- ^ Jump up to: а б с д Робертс Л. (27 марта 2021 г.). «Первая в Австралии вакцина против гриппа на основе клеток, которая появится в этом сезоне гриппа» . Новости АВС . Архивировано из оригинала 27 апреля 2021 года . Проверено 28 апреля 2021 г.
- ^ Национальный консультативный комитет по иммунизации (NACI) (август 2012 г.). «Заявление о вакцине против сезонного гриппа на 2012–2013 гг.» (PDF) . Отчет об инфекционных заболеваниях в Канаде . 38 . Оттава. Архивировано из оригинала (PDF) 17 января 2013 года . Проверено 18 июля 2013 г.
- ^ Тернер П.Дж., Саузерн Дж., Эндрюс, Нью-Джерси, Миллер Э., Эрлевин-Лаженесс М. (декабрь 2015 г.). «Безопасность живой аттенуированной вакцины против гриппа у молодых людей с аллергией на яйца: многоцентровое проспективное когортное исследование» . БМЖ . 351 :h6291. дои : 10.1136/bmj.h6291 . ПМЦ 4673102 . ПМИД 26645895 .
- ^ Гринхот М. (декабрь 2015 г.). «Живая аттенуированная вакцина против гриппа для детей с аллергией на яйца». БМЖ . 351 : h6656. дои : 10.1136/bmj.h6656 . ПМИД 26657778 . S2CID 37037904 .
- ^ Jump up to: а б «Новартис получает одобрение FDA на Флуцелвакс, первую вакцину на клеточной культуре в США, помогающую защитить от сезонного гриппа» (пресс-релиз). Новартис. 20 ноября 2012 г. Архивировано из оригинала 28 ноября 2012 г.
- ^ Jump up to: а б «Супемтек ЭПАР» . Европейское агентство лекарственных средств (EMA) . 15 сентября 2020 года. Архивировано из оригинала 10 января 2021 года . Проверено 27 ноября 2020 г.
- ^ Технический отчет: Нарколепсия в сочетании с вакцинацией против пандемического гриппа (PDF) . Стокгольм, Швеция: Европейский центр профилактики и контроля заболеваний (ECDC). 2012. ISBN 978-92-9193-388-4 . Архивировано из оригинала (PDF) 31 декабря 2013 года . Проверено 30 декабря 2013 г.
- ^ Ён Э (2013). «Нарколепсия подтверждена как аутоиммунное заболевание». Природа . дои : 10.1038/nature.2013.14413 . S2CID 74850662 .
- ^ «Тимеросал в вакцине против гриппа» . Центры США по контролю и профилактике заболеваний . 16 октября 2015 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Тимеросал в вакцинах Тимеросал – Проблемы – Безопасность вакцин» . Центры США по контролю и профилактике заболеваний . 27 октября 2015 года. Архивировано из оригинала 2 ноября 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Оффит ПА (сентябрь 2007 г.). «Тимеросал и вакцины – поучительная история» . Медицинский журнал Новой Англии . 357 (13): 1278–79. дои : 10.1056/NEJMp078187 . ПМИД 17898096 . S2CID 36318722 .
- ^ Глобальный консультативный комитет по безопасности вакцин (14 июля 2006 г.). «Тиомерсал и вакцины» . Всемирная организация здравоохранения (ВОЗ). Архивировано из оригинала 6 ноября 2009 года . Проверено 20 ноября 2007 г.
- ^ Плоткин С.А., Оренштейн В.А. (1988). Вакцина . Филадельфия: Компания WB Saunders. п. 424. ИСБН 978-0-7216-1946-0 . Проверено 7 сентября 2020 г.
- ^ Монография о продукте: Flumist (PDF) , Astrazeneca Canada Inc., 20 июня 2014 г., заархивировано (PDF) из оригинала 30 сентября 2020 г. , получено 5 сентября 2020 г.
- ^ «Глобальная система эпиднадзора за гриппом и реагирования (ГСЭГО)» . Всемирная организация здравоохранения. Архивировано из оригинала 3 октября 2011 года . Проверено 22 октября 2019 г.
- ^ Jump up to: а б Шнирринг Л. (29 сентября 2023 г.). «Консультанты ВОЗ рекомендуют вернуться к трехвалентной вакцине против гриппа» . Центр исследований и политики в области инфекционных заболеваний . Архивировано из оригинала 18 декабря 2023 года . Проверено 23 января 2024 г.
- ^ «В центре внимания: грипп» . Всемирная организация здравоохранения. Архивировано из оригинала 18 октября 2019 года . Проверено 22 октября 2019 г.
- ^ «Глобальный эпиднадзор за гриппом» . ВОЗ . Архивировано из оригинала 30 апреля 2003 года.
- ^ Организация WH (2000). Отчет ВОЗ о глобальном эпиднадзоре за инфекционными заболеваниями, склонными к эпидемиям – гриппом . Всемирная организация здравоохранения (ВОЗ). hdl : 10665/66485 . WHO/CDS/CSR/ISR/2000/1.
- ^ «Рекомендации ЕС по составу вакцины против сезонного гриппа 2024/2025 гг.» . Европейское агентство лекарственных средств (EMA) . 26 марта 2024 года. Архивировано из оригинала 28 марта 2024 года . Проверено 28 марта 2024 г.
- ^ KW, Лай А., Ли К.С., Ко Д., Ли СС (октябрь 2016 г.). «Увеличение охвата вакцинацией против гриппа среди медицинских работников: обзор проблем и решений». Журнал госпитальной инфекции . 94 (2): 133–42. дои : 10.1016/j.jhin.2016.07.003 . ПМИД 27546456 .
- ^ Jump up to: а б с д Рубин Г.Дж., Поттс Х.В., Мичи С. (март 2011 г.). «Вероятное использование вакцин против свиного и сезонного гриппа среди работников здравоохранения. Поперечный анализ данных телефонного опроса в Великобритании». Вакцина . 29 (13): 2421–28. doi : 10.1016/j.vaccine.2011.01.035 . ПМИД 21277402 .
- ^ «Сезонная прививка от гриппа» . Центры США по контролю и профилактике заболеваний (CDC) . 9 декабря 2019 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 12 января 2020 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Использование вакцины» . Всемирная организация здравоохранения (ВОЗ). Архивировано из оригинала 15 декабря 2012 года . Проверено 15 января 2017 г.
- ^ «Информационный бюллетень о гриппе (сезонном)» . Всемирная организация здравоохранения (ВОЗ). Ноябрь 2016. Архивировано из оригинала 30 ноября 2014 года . Проверено 15 января 2017 г.
- ^ «Грипп (сезонный)» . ВОЗ . 6 ноября 2018 года. Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
- ^ «Методика оценки охвата прививками против гриппа целевых групп (2016 г.)» . ВОЗ/Европа . 19 марта 2018 года. Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
- ^ «Рекомендации по вакцинации против гриппа в зимний период 2019–2020 годов» . ВОЗ/Европа . 24 сентября 2019 года. Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
- ^ Jump up to: а б Глава Канадского руководства по иммунизации, посвященная гриппу, и заявление о вакцине против сезонного гриппа на 2019–2020 гг. (PDF) (отчет). Агентство общественного здравоохранения Канады. Май 2019 г. Кат.: HP37-25E-PDF; Публикация: 180883. Архивировано (PDF) из оригинала 16 июля 2020 г. . Проверено 2 июня 2020 г.
- ^ «Группы риска тяжелого гриппа» . Европейский центр профилактики и контроля заболеваний (ECDC) . 20 октября 2017 года. Архивировано из оригинала 22 октября 2019 года . Проверено 22 октября 2019 г.
- ^ «Обзоры ECDC – Новые рекомендации ВОЗ по сезонному гриппу…» Европейский центр профилактики и контроля заболеваний (ECDC) . Архивировано из оригинала 10 мая 2017 года . Проверено 25 декабря 2016 г.
- ^ «Руководство ECDC: Приоритетные группы риска для вакцинации против гриппа» (PDF) . Европейский центр профилактики и контроля заболеваний (ECDC). стр. 7–8. Архивировано из оригинала (PDF) 25 декабря 2016 года . Проверено 25 декабря 2016 г.
- ^ Jump up to: а б с «Дети и грипп (грипп)» . Центры США по контролю и профилактике заболеваний (CDC). 23 октября 2019 г. Архивировано из оригинала 11 ноября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Рахман К. (21 октября 2021 г.). «Полный список вакцин, утвержденных военными США» . Newsweek . Архивировано из оригинала 19 декабря 2023 года.
- ^ «Живая аттенуированная вакцина против гриппа [LAIV] (вакцина против гриппа в виде назального спрея)» . Центры США по контролю и профилактике заболеваний (CDC) . 16 сентября 2019 года. Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Вакцинация против гриппа: Краткое изложение для клиницистов – медицинских работников – Сезонный грипп (грипп)» . Центры США по контролю и профилактике заболеваний (CDC). 6 сентября 2018 г. Архивировано из оригинала 24 февраля 2008 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Флузон, высокие дозы флюзона и внутрикожный флюзон» . США Управление по контролю за продуктами и лекарствами (FDA). 11 июля 2017. Архивировано из оригинала 22 июля 2017 года . Проверено 1 июня 2020 г.
- ^ Коуч Р.Б., Винокур П., Брейди Р., Белше Р., Чен В.Х., Кейт Т.Р. и др. (ноябрь 2007 г.). «Безопасность и иммуногенность высоких доз трехвалентной вакцины против гриппа среди пожилых людей» . Вакцина . 25 (44): 7656–63. doi : 10.1016/j.vaccine.2007.08.042 . ПМК 2243220 . ПМИД 17913310 .
- ^ Ли Дж.К., Лам Г.К., Шин Т., Ким Дж., Кришнан А., Гринберг Д.П. и др. (май 2018 г.). «Эффективность и действенность высоких доз вакцинации против гриппа по сравнению со стандартными дозами для пожилых людей: систематический обзор и метаанализ». Эксперт Рев Вакцины . 17 (5): 435–443. дои : 10.1080/14760584.2018.1471989 . ПМИД 29715054 . S2CID 21688517 .
- ^ Робертсон, Калифорния, Диас Гранадос, Калифорния, Декер, МД, Чит А, Мерсер М, Гринберг Д.П. (декабрь 2016 г.). «Высокодозная вакцина против гриппа Флюзон» . Эксперт Рев Вакцины . 15 (12): 1495–1505. дои : 10.1080/14760584.2016.1254044 . ПМИД 27813430 .
- ^ Обновленный обзор литературы об эффективности и действенности высоких доз (Fluzone High-Dose) и трехвалентных инактивированных вакцин против гриппа с адъювантом MF59 (Fluad) у взрослых в возрасте 65 лет и старше (PDF) (Отчет). Оттава: Агентство общественного здравоохранения Канады. Май 2018 г. HP40-210/2018E-PDF. Архивировано (PDF) из оригинала 21 июля 2020 г. Проверено 1 июня 2020 г.
- ^ Таннер Л. (13 января 2013 г.). «Больницы принимают жесткие меры в отношении работников, отказывающихся от прививки от гриппа» . Новости Эн-Би-Си. Архивировано из оригинала 3 декабря 2013 года . Проверено 24 июля 2014 г.
- ^ Центры по профилактике заболеваний (CDC) (декабрь 2010 г.). «Охват вакцинацией против сезонного гриппа и гриппа H1N1 2009 г. среди беременных женщин - 10 штатов, сезон гриппа 2009–10 гг.» (PDF) . Еженедельный отчет о заболеваемости и смертности (MMWR) . 59 (47): 1541–45. ПМИД 21124293 . Архивировано (PDF) из оригинала 25 июня 2017 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б Альтман Л.К. (28 февраля 2008 г.). «Группа экспертов рекомендует делать прививки от гриппа детям до 18 лет» . Нью-Йорк Таймс . Архивировано из оригинала 22 января 2015 года.
- ^ «ACIP голосует против использования LAIV в сезоне гриппа 2016–2017 гг.» (пресс-релиз). Центры США по контролю и профилактике заболеваний (CDC). 22 июня 2016. Архивировано из оригинала 25 ноября 2016 года . Проверено 26 ноября 2016 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «График прививок» . Центры США по контролю и профилактике заболеваний (CDC). Архивировано из оригинала 5 ноября 2014 года . Проверено 4 ноября 2014 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Часто задаваемые вопросы о вакцинах против гриппа» . Healthdirect, Министерство здравоохранения, Правительство Австралии. 1 апреля 2019 года. Архивировано из оригинала 29 мая 2019 года . Проверено 29 мая 2019 г.
- ^ «Информационный бюллетень по гриппу» . Healthdirect, Министерство здравоохранения, Правительство Австралии. 1 апреля 2019 года. Архивировано из оригинала 29 мая 2019 года . Проверено 29 мая 2019 г.
- ^ «Использование медицинских услуг – Уровень вакцинации против гриппа – Данные ОЭСР» . ОЭСР . Архивировано из оригинала 8 августа 2020 года . Проверено 24 апреля 2020 г.
- ^ Jump up to: а б Хан Ю.К., Мичи С., Поттс Х.В., Рубин Г.Дж. (март 2016 г.). «Прогностические факторы использования вакцины против гриппа во время пандемии гриппа A H1N1v («свиной грипп») 2009/10 г.: результаты пяти национальных исследований в Соединенном Королевстве» . Профилактическая медицина . 84 : 57–61. дои : 10.1016/j.ypmed.2015.12.018 . ПМЦ 4766366 . ПМИД 26757401 .
- ^ Биш А., Ярдли Л., Николл А., Мичи С. (сентябрь 2011 г.). «Факторы, связанные с применением вакцинации против пандемического гриппа: систематический обзор». Вакцина . 29 (38): 6472–84. doi : 10.1016/j.vaccine.2011.06.107 . ПМИД 21756960 .
- ^ Брайен С., Квонг Дж.К., Бакеридж Д.Л. (февраль 2012 г.). «Детерминанты вакцинации против пандемического гриппа A/H1N1 2009 г.: систематический обзор». Вакцина . 30 (7): 1255–64. doi : 10.1016/j.vaccine.2011.12.089 . ПМИД 22214889 .
- ^ Томас Р.Э., Лоренцетти Д.Л. (май 2018 г.). «Вмешательства по повышению уровня вакцинации против гриппа среди населения в возрасте 60 лет и старше» . Кокрановская база данных систематических обзоров . 5 (5): CD005188. дои : 10.1002/14651858.CD005188.pub4 . ПМК 6494593 . ПМИД 29845606 .
- ^ Центры по профилактике заболеваний (CDC) (октябрь 2009 г.). «Обновленная информация о моновалентных вакцинах против гриппа A (H1N1) 2009 г.» (PDF) . Еженедельный отчет о заболеваемости и смертности (MMWR) . 58 (39): 1100–01. ПМИД 19816398 . Архивировано (PDF) из оригинала 29 июня 2011 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Ла Торре Дж., Ди Тьене Д., Кадедду К., Риккарди В., Бочча А. (декабрь 2009 г.). «Поведение итальянских медицинских работников в отношении профилактических мер против пандемического гриппа H1N1, октябрь 2009 г.». Евронаблюдение . 14 (49). ПМИД 20003908 .
- ^ Амодио Э, Анастази Дж, Марсала М.Г., Торрегросса М.В., Романо Н., Фиренце А (февраль 2011 г.). «Вакцинация против пандемического гриппа А (H1N1) 2009 г. среди медицинских работников крупной клинической больницы Сицилии (Италия)». Вакцина . 29 (7): 1408–12. doi : 10.1016/j.vaccine.2010.12.041 . ПМИД 21199700 .
- ^ Чор Дж.С., Нгай К.Л., Гоггинс В.Б., Вонг М.С., Вонг С.И., Ли Н. и др. (август 2009 г.). «Готовность медицинских работников Гонконга принять предпандемическую вакцинацию против гриппа на разных уровнях готовности ВОЗ: два анкетных опроса» . БМЖ . 339 : b3391. дои : 10.1136/bmj.b3391 . ПМЦ 2731837 . ПМИД 19706937 .
- ^ Шнирринг Л. (18 августа 2011 г.). «CDC обновляет рекомендации по вакцинации против гриппа» . Центр исследований и политики в области инфекционных заболеваний (CIDRAP) . Архивировано из оригинала 25 октября 2019 года . Проверено 24 октября 2019 г.
- ^ Центры по профилактике заболеваний (CDC) (август 2011 г.). «Охват вакцинацией против гриппа среди медицинского персонала – США, сезон гриппа 2010–2011 гг.» (PDF) . Еженедельный отчет о заболеваемости и смертности (MMWR) . 60 (32): 1073–77. ПМИД 21849963 . Архивировано (PDF) из оригинала 25 мая 2017 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Центры по профилактике заболеваний (CDC) (сентябрь 2012 г.). «Охват вакцинацией против гриппа среди медицинского персонала: сезон гриппа 2011–2012 гг., США» (PDF) . Еженедельный отчет о заболеваемости и смертности (MMWR) . 61 : 753–57. ПМИД 23013720 . Архивировано (PDF) из оригинала 24 июня 2017 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Булл А.Л., Беннетт Н., Питчер ХК, Руссо П.Л., Ричардс М.Дж. (февраль 2007 г.). «Охват вакцинацией против гриппа медицинских работников в государственных больницах штата Виктория». Медицинский журнал Австралии . 186 (4): 185–86. дои : 10.5694/j.1326-5377.2007.tb00858.x . ПМИД 17309419 . S2CID 25091208 .
- ^ Jump up to: а б Аббаси Дж. (ноябрь 2019 г.). «Поиски универсальной вакцины от гриппа набирают обороты». ДЖАМА . 322 (20): 1942–1944. дои : 10.1001/jama.2019.16816 . ПМИД 31693060 . S2CID 207903441 .
- ^ Jump up to: а б с Гринфилдбойс Н. (8 ноября 2007 г.). Новые и старые способы изготовления вакцины от гриппа (радиопередача). ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Архивировано из оригинала 24 октября 2019 года . Проверено 23 октября 2019 г.
- ^ Нахбагауэр Р., Краммер Ф. (апрель 2017 г.). «Универсальные вакцины против вируса гриппа и терапевтические антитела» . Клиническая микробиология и инфекции . 23 (4): 222–228. дои : 10.1016/j.cmi.2017.02.009 . ПМК 5389886 . ПМИД 28216325 .
- ^ Бальфур Х. (2 июня 2021 г.). «Начинаются первые испытания универсальной вакцины против гриппа на людях» . Европейский фармацевтический обзор . Архивировано из оригинала 29 марта 2022 года . Проверено 6 февраля 2022 г.
Испытание фазы I (NCT04896086) оценит безопасность и иммуногенность экспериментальной вакцины FluMos-v1.
- ^ Бернштейн Д.И., Гуптилль Дж., Нафиси А., Нахбагауэр Р., Берланда-Скорца Ф., Фезер Дж. и др. (январь 2020 г.). «Иммуногенность универсальных вакцин-кандидатов против вируса гриппа на основе химерного гемагглютинина: промежуточные результаты рандомизированного плацебо-контролируемого клинического исследования фазы 1» . «Ланцет». Инфекционные болезни . 20 (1): 80–91. дои : 10.1016/S1473-3099(19)30393-7 . ПМК 6928577 . ПМИД 31630990 .
- ^ Нахбагауэр Р., Фезер Дж., Нафиси А., Бернштейн Д.И., Гуптилл Дж., Уолтер Э.Б. и др. (январь 2021 г.). «Подход к универсальной вакцине против вируса гриппа на основе химерного гемагглютинина вызывает широкий и длительный иммунитет в рандомизированном плацебо-контролируемом исследовании фазы I» . Природная медицина . 27 (1): 106–114. дои : 10.1038/s41591-020-1118-7 . ПМИД 33288923 .
- ^ «Стратегии вакцинации против гриппа для широкого глобального доступа» . Путь . Октябрь 2007 г. Архивировано из оригинала 14 октября 2019 г. Проверено 16 сентября 2009 г.
- ^ Jump up to: а б «как это сделано» (PDF) . Архивировано из оригинала (PDF) 5 июля 2010 г.
- ^ «Вирусы и реагенты для вакцин против гриппа» . Всемирная организация здравоохранения (ВОЗ). Архивировано из оригинала 27 мая 2013 года.
- ^ «Рекомендации по производству и контролю гриппозной вакцины (инактивированной)» (PDF) . Всемирная организация здравоохранения (ВОЗ). Архивировано (PDF) из оригинала 28 октября 2013 г. Проверено 27 мая 2013 г.
- ^ Jump up to: а б Раканьелло V (декабрь 2009 г.). «Рост вируса гриппа в яйцах» . Блог вирусологии. Архивировано из оригинала 25 декабря 2014 года.
- ^ Иззат Ф (апрель 2012 г.). «Культивирование вируса в курином эмбрионе» . Ютуб. Архивировано из оригинала 26 мая 2015 года.
- ^ Jump up to: а б «Как делают вакцины против гриппа» . Центры США по контролю и профилактике заболеваний (CDC). 26 ноября 2019 года. Архивировано из оригинала 2 декабря 2019 года . Проверено 2 декабря 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Зееманн Г., Кок М. (2008). «Плодородные яйца – ценный продукт для производства вакцин» . Селекционеры Ломана . Архивировано из оригинала 23 ноября 2023 года . Проверено 19 октября 2023 г.
- ^ Брайт Р.А., Картер Д.М., Данилюк С., Тоапанта Ф.Р., Ахмад А., Гаврилов В. и др. (май 2007 г.). «Частицы, подобные вирусу гриппа, вызывают более широкий иммунный ответ, чем цельный вирион-инактивированный вирус гриппа или рекомбинантный гемагглютинин». Вакцина . 25 (19): 3871–78. doi : 10.1016/j.vaccine.2007.01.106 . ПМИД 17337102 .
- ^ «Примирование ДНК-вакцины повышает эффективность вакцины против птичьего гриппа (Новости НИЗ)» . 3 октября 2011 г. Архивировано из оригинала 27 сентября 2012 г.
- ^ Номер клинического испытания NCT00776711 «Вакцины для профилактики птичьего гриппа» на сайте ClinicalTrials.gov.
- ^ Номер клинического испытания NCT01086657 для «Открытого рандомизированного исследования фазы I на здоровых взрослых по безопасности и иммуногенности интервалов первичной бустерной терапии моновалентной вакциной против субъединицы гриппа (H5N1), A/Индонезия/05/2005 (Sanofi Pasteur, Inc), вводится отдельно или после вакцины с рекомбинантной ДНК-плазмидой (H5), VRC-AVIDNA036-00-VP (VRC, NIAID)» на сайте ClinicalTrials.gov
- ^ Центр оценки и исследований биологических препаратов. «Одобренные продукты – Письмо об одобрении – Флюсельвакс от 20 ноября 2012 г.» . США Управление по контролю за продуктами и лекарствами (FDA). Архивировано из оригинала 3 декабря 2012 года.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Seqirus получает одобрение FDA на Flucelvax Quadriвалент (вакцину против гриппа) для людей в возрасте четырех лет и старше» (пресс-релиз). Секирус . 23 мая 2016. Архивировано из оригинала 16 января 2017 года . Проверено 15 января 2017 г.
- ^ Роос Р. (14 октября 2019 г.). «FDA одобрило первую вакцину против гриппа, выращенную в клетках насекомых» . Центр исследований и политики в области инфекционных заболеваний (CIDRAP) . Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
- ^ «Флублок» . США Управление по контролю за продуктами и лекарствами (FDA). 26 февраля 2018. STN 125285. Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Флублок Четырехвалентный» . США Управление по контролю за продуктами и лекарствами (FDA). 2 августа 2019. STN 125285. Архивировано из оригинала 14 октября 2019 года . Проверено 14 октября 2019 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Супемтек: Ожидается решение ЕС» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2020 г. Архивировано из оригинала 23 сентября 2020 г. Проверено 21 сентября 2020 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Информация о продукции Supemtek» . Союзный реестр лекарственных средств . Архивировано из оригинала 5 марта 2023 года . Проверено 3 марта 2023 г.
- ^ Jump up to: а б Воробей Э., Вуд Дж.Г., Чедвик С., Ньюолл А.Т., Торвальдсен С., Моен А. и др. (январь 2021 г.). «Мировой потенциал производства вакцин против сезонного и пандемического гриппа в 2019 году» . Вакцина . 39 (3): 512–520. doi : 10.1016/j.vaccine.2020.12.018 . ПМЦ 7814984 . ПМИД 33341308 .
- ^ Джит М., Ньюолл А.Т., Бьютелс П. (апрель 2013 г.). «Ключевые вопросы оценки воздействия и экономической эффективности стратегий вакцинации против сезонного гриппа» . Человеческие вакцины и иммунотерапия . 9 (4): 834–40. дои : 10.4161/hv.23637 . ПМЦ 3903903 . ПМИД 23357859 .
- ^ Постма М.Ю., Балтуссен Р.П., Палаш А.М., Вильшут Дж.К. (апрель 2006 г.). «Дополнительные доказательства благоприятной экономической эффективности вакцинации против гриппа пожилых людей». Экспертный обзор фармакоэкономических исследований и результатов исследований . 6 (2): 215–27. дои : 10.1586/14737167.6.2.215 . ПМИД 20528557 . S2CID 12765724 .
- ^ Ньюолл А.Т., Келли Х., Харсли С., Скаффхэм, Пенсильвания (2009). «Экономическая эффективность вакцинации против гриппа среди пожилых людей: критический обзор экономических оценок для возрастной группы от 50 до 64 лет» . Фармакоэкономика . 27 (6): 439–50. дои : 10.2165/00019053-200927060-00001 . ПМИД 19640008 . S2CID 20855671 .
- ^ Ньюолл А.Т., Вибуд С., Вуд Дж.Г. (июнь 2010 г.). «Смертность, обусловленная гриппом, у австралийцев старше 50 лет: сравнение различных подходов к моделированию» . Эпидемиология и инфекции . 138 (6): 836–42. дои : 10.1017/S095026880999118X . ПМИД 19941685 . S2CID 29939376 .
- ^ Ньюалл А.Т., Дехоллен Дж.П., Крейтон П., Бойтелс П., Вуд Дж.Г. (август 2013 г.). «Понимание экономической эффективности вакцинации против гриппа у детей: методологический выбор и сезонная изменчивость» . Фармакоэкономика . 31 (8): 693–702. дои : 10.1007/s40273-013-0060-7 . ПМИД 23645539 . S2CID 8616720 .
- ^ Ньюолл, А.Т., Скаффхэм, Пенсильвания (декабрь 2011 г.). «Неопределенность и изменчивость моделей экономической эффективности гриппа». Австралийский и новозеландский журнал общественного здравоохранения . 35 (6): 576, ответ автора 576–77. дои : 10.1111/j.1753-6405.2011.00788.x . ПМИД 22151168 . S2CID 22402257 .
- ^ Гэтвуд Дж., Мельцер М.И., Мессонье М., Ортега-Санчес И.Р., Балкришнан Р., Проссер Л.А. (январь 2012 г.). «Сезонная вакцинация против гриппа здоровых взрослых трудоспособного возраста: обзор экономических оценок». Наркотики . 72 (1): 35–48. дои : 10.2165/11597310-000000000-00000 . ПМИД 22191794 . S2CID 46305863 .
- ^ Ньюолл А.Т., Джит М., Бойтелс П. (август 2012 г.). «Экономические оценки вакцинации детей от гриппа: критический обзор» . Фармакоэкономика . 30 (8): 647–60. дои : 10.2165/11599130-000000000-00000 . ПМИД 22788257 . S2CID 38289883 .
- ^ Ньюалл А.Т., Вуд Дж.Г., Удин Н., Макинтайр С.Р. (февраль 2010 г.). «Экономическая эффективность фармацевтических стратегий смягчения последствий пандемического гриппа» . Новые инфекционные заболевания . 16 (2): 224–30. дои : 10.3201/eid1602.090571 . ПМЦ 2957998 . ПМИД 20113551 .
- ^ «Проект секвенирования генома гриппа – обзор» . Национальные институты здравоохранения – Национальный институт аллергии и инфекционных заболеваний. Архивировано из оригинала 27 июня 2011 года . Проверено 27 мая 2013 г.
- ^ Лампос В., Йом-Тов Э., Пебоди Р., Кокс И.Дж. (2015). «Оценка воздействия медицинского вмешательства с помощью пользовательского интернет-контента» (PDF) . Интеллектуальный анализ данных и обнаружение знаний . 29 (5): 1434–57. дои : 10.1007/s10618-015-0427-9 . S2CID 215415165 . Архивировано из оригинала 28 августа 2021 года . Проверено 15 августа 2022 г.
- ^ Вагнер М., Лампос В., Йом-Тов Э., Пебоди Р., Кокс И.Дж. (декабрь 2017 г.). «Оценка воздействия на население новой программы вакцинации детей от гриппа в Англии с использованием контента социальных сетей» . Журнал медицинских интернет-исследований . 19 (12): е416. дои : 10.2196/jmir.8184 . ПМК 6257312 . ПМИД 29269339 .
- ^ «Острые респираторные инфекции (обновление, сентябрь 2009 г.)» . Всемирная организация здравоохранения (ВОЗ). Сентябрь 2009. Архивировано из оригинала 29 сентября 2009 года . Проверено 16 сентября 2009 г.
- ^ «Таблицы клинических испытаний прототипных вакцин против пандемического гриппа» . Всемирная организация здравоохранения (ВОЗ). Июль 2009. Архивировано из оригинала 6 марта 2009 года . Проверено 21 сентября 2009 г.
- ^ «FDA одобрило вакцины против вируса гриппа H1N1 2009» (пресс-релиз). 15 сентября 2009 года. Архивировано из оригинала 15 октября 2009 года . Проверено 15 октября 2009 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Киоун А. (4 февраля 2020 г.). «FDA одобрило Audenz компании Seqirus в качестве вакцины против потенциальной пандемии гриппа» . Биокосмос . Архивировано из оригинала 5 февраля 2020 года . Проверено 5 февраля 2020 г.
- ^ «Оденц» . США Управление по контролю за продуктами и лекарствами (FDA). 31 января 2020 г. STN: 125692. Архивировано из оригинала 6 августа 2020 г. . Проверено 5 февраля 2020 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с Чо А., Раммерт Дж. (апрель 2016 г.). «Последствия широкого применения нейтрализующих антител в разработке универсальной вакцины против гриппа» . Современное мнение в вирусологии . 17 : 110–115. дои : 10.1016/j.coviro.2016.03.002 . ПМЦ 4940123 . ПМИД 27031684 .
- ^ Окуно Ю, Исегава Ю, Сасао Ф, Уэда С (май 1993 г.). «Общий нейтрализующий эпитоп, консервативный между гемагглютининами штаммов вируса гриппа А H1 и H2» . Журнал вирусологии . 67 (5): 2552–2558. doi : 10.1128/JVI.67.5.2552–2558.1993 . ПМК 237575 . ПМИД 7682624 .
- ^ Jump up to: а б с д Соема ПК, Компьер Р., Амори Дж.П., Керстен Г.Ф. (август 2015 г.). «Вакцины против гриппа нынешнего и следующего поколения: стратегии разработки и производства» . Европейский журнал фармацевтики и биофармацевтики . 94 : 251–263. дои : 10.1016/j.ejpb.2015.05.023 . hdl : 1887/43765 . ПМИД 26047796 .
- ^ Дэн Л., Чо К.Дж., Фирс В., Саеленс Х (февраль 2015 г.). «Универсальные вакцины против гриппа А на основе M2e» . Вакцина . 3 (1): 105–36. doi : 10.3390/vaccines3010105 . ПМЦ 4494237 . ПМИД 26344949 .
- ^ Готлиб Т., Бен-Йедидиа Т. (ноябрь 2014 г.). «Эпитопные подходы к созданию универсальной вакцины против гриппа». Журнал аутоиммунитета . 54 : 15–20. дои : 10.1016/j.jaut.2014.07.005 . ПМИД 25172355 .
- ^ Тусси Д.Н., Массари П. (апрель 2014 г.). «Иммунный адъювантный эффект молекулярно определенных лигандов толл-подобных рецепторов» . Вакцина . 2 (2): 323–53. doi : 10.3390/vaccines2020323 . ПМЦ 4494261 . ПМИД 26344622 .
- ^ Седерстрем Дж. (19 июля 2019 г.). «Исследователи изучают пероральную вакцину против гриппа и варианты лечения» . Темы о наркотиках. Архивировано из оригинала 8 июня 2020 года . Проверено 27 января 2020 г.
- ^ Джасти М., Брэгдон Ч.Р., Шутцер С., Рубаш Х., Хайр Т., Харрис У.Х. (декабрь 1989 г.). «Врастание кости в тотальный протез тазобедренного сустава у собак с пористым покрытием. Количественная оценка с помощью сканирующей электронной микроскопии обратного рассеяния и анализа изображений». Сканирующая микроскопия . 3 (4): 1051–6, обсуждение 1056–57. дои : 10.1016/s1473-3099(15)00252-2 . ПМИД 2633331 .
- ^ Либовиц Д., Готлиб К., Колхаткар Н.С., Гарг С.Дж., Ашер Дж.М., Назарено Дж. и др. (апрель 2020 г.). «Эффективность, иммуногенность и безопасность пероральной вакцины против гриппа: плацебо-контролируемое и активно-контролируемое исследование 2-й фазы заражения человека». «Ланцет». Инфекционные болезни . 20 (4). Эльзевир: 435–444. дои : 10.1016/S1473-3099(19)30584-5 . ПМИД 31978354 . S2CID 210892802 .
- ^ Триггл Н (8 октября 2021 г.). «Этой зимой жизненно необходима прививка от гриппа вместе с вакциной от Covid» . Новости Би-би-си . Архивировано из оригинала 14 ноября 2021 года . Проверено 13 августа 2022 г.
- ^ Каллауэй Э (16 мая 2022 г.). «Вакцина против гриппа может снизить риск заражения COVID» . Природа . 605 (7911): 602. Бибкод : 2022Natur.605..602C . дои : 10.1038/d41586-022-01315-9 . ПМИД 35581411 . S2CID 248859545 .
- ^ Браунли С. (1 ноября 2009 г.). «Имеет ли вакцина значение?» . Атлантика . Архивировано из оригинала 9 декабря 2014 года . Проверено 8 декабря 2014 г.
- ^ Рабин РЦ (5 ноября 2012 г.). «Переоценка прививок от гриппа по мере приближения сезона» . Нью-Йорк Таймс . Архивировано из оригинала 10 ноября 2016 года . Проверено 30 декабря 2016 г.
«Мы чрезмерно рекламировали и преувеличивали эту вакцину», — сказал Майкл Т. Остерхольм, директор Центра исследований и политики в области инфекционных заболеваний, а также его Центра передового опыта в области исследований и надзора за гриппом. «Это не защищает, как рекламируется. Это все работа по продажам, это все связи с общественностью».
- ↑ Отчет о гриппе (онлайн-книга). Архивировано 10 мая 2016 г. в Wayback Machine главе «Птичий грипп» Тимма К. Хардера и Ортруды Вернер.
- ^ equiflunet_vaccines. Архивировано 10 января 2006 г. в Wayback Machine.
- ^ «Федерация конного спорта и скачек ОАЭ» . 22 марта 2005 г. Архивировано из оригинала 22 марта 2005 г.
- ^ «Руководство FEI» (PDF) . Архивировано (PDF) из оригинала 26 октября 2007 г.
- ^ «Вакцинация домашней птицы против высокопатогенного гриппа птиц – Доступные вакцины и стратегии вакцинации» . efsa.europa.eu . 10 октября 2023 г. . Проверено 9 мая 2024 г.
- ^ «Создание вакцинного вируса-кандидата (CVV) для вируса HPAI (птичьего гриппа)» . Центры США по контролю и профилактике заболеваний (CDC) . 3 июня 2024 г. . Проверено 15 июня 2024 г.
- ^ «Вирус свиного гриппа стал эндемичным» . 15 сентября 2007 г. Архивировано из оригинала 29 апреля 2009 г.
- ^ «Специальные вакцины для свиней» . Архивировано из оригинала 30 апреля 2009 года.
- ^ [ PubMed ] [ Перекрестная ссылка ] Караджа К., Дубови Э.Дж., Сигер Л., Оукс А., Одонне Дж.К., Цзяньшэн Ю. и др. (февраль 2007 г.). «Оценка способности вакцин против вируса гриппа лошадей, переносимых оспой канареек, индуцировать гуморальный иммунный ответ против вирусов гриппа собак у собак». Американский журнал ветеринарных исследований . 68 (2): 208–12. дои : 10.2460/ajvr.68.2.208 . ПМИД 17269888 .
Дальнейшее чтение
[ редактировать ]- Иммунологическая основа серии иммунизации: модуль 23: Вакцины против гриппа . Всемирная организация здравоохранения (ВОЗ). Октябрь 2017 г. hdl : 10665/259211 . ISBN 978-92-4-151305-0 .
- Рамзи М., изд. (21 января 2021 г.). «Глава 19: Грипп» . Иммунизация против инфекционных заболеваний . Общественное здравоохранение Англии. Архивировано из оригинала 12 ноября 2019 года . Проверено 24 октября 2019 г.
- Холл Е, Води А.П., Хамборски Дж., Морелли В., Шилли С., ред. (2021). «Глава 12: Грипп» . Эпидемиология и профилактика болезней, предупреждаемых с помощью вакцин (14-е изд.). США Вашингтон, округ Колумбия: Центры по контролю и профилактике заболеваний (CDC). Архивировано из оригинала 30 декабря 2016 года . Проверено 24 октября 2019 г.
- Бадд А., Блэнтон Л., Гроскопф Л., Кэмпбелл А., Дуган В., Вентворт Д.Э. и др. (29 марта 2019 г.). «Глава 6: Грипп» . В Roush SW, Baldy LM, Hall MA (ред.). Руководство по эпиднадзору за болезнями, предупреждаемыми с помощью вакцин . Атланта, Джорджия: Центры США по контролю и профилактике заболеваний (CDC). Архивировано из оригинала 1 августа 2020 года . Проверено 24 октября 2019 г.
- Национальный консультативный комитет по иммунизации (май 2020 г.). «Глава Канадского руководства по иммунизации, посвященная гриппу, и заявление о вакцине против сезонного гриппа на 2020–2021 годы» (PDF) . Агентство общественного здравоохранения Канады . Кат.: HP37-25F-PDF; Публикация: 200003. Архивировано (PDF) из оригинала 3 августа 2020 г. . Проверено 2 июня 2020 г.
- Разместить резюме в: Янг К., Джеммилл И., Харрисон Р. и др. (Национальный консультативный комитет по иммунизации) (7 мая 2020 г.). «Краткое содержание заявления NACI о вакцине против сезонного гриппа на 2020–2021 годы» . Отчет об инфекционных заболеваниях в Канаде . Том. 46, нет. 5.
- Национальный консультативный комитет по иммунизации (NACI) (май 2018 г.). Обзор литературы NACI о сравнительной эффективности и иммуногенности субъединичных и разделенных вакцин против гриппа, инактивированных вирусом, у взрослых в возрасте 65 лет и старше (PDF) . Правительство Канады. ISBN 978-0-660-26438-7 . Кат.: HP40-213/2018E-PDF; Публикация: 180039. Архивировано (PDF) из оригинала 18 июля 2020 г. . Проверено 12 января 2020 г.
- Разместить резюме в: Джеммилл И., Янг К. и др. (Национальный консультативный комитет по иммунизации) (7 июня 2018 г.). «Резюме обзора литературы NACI о сравнительной эффективности субъединичных и сплит-инактивированных вакцин против гриппа у пожилых людей» . Отчет об инфекционных заболеваниях в Канаде . Том. 44, нет. 6.
- Раджарам С., Войчик Р., Мур С., Ортис де Лехарасу Р., де Лузиньян С., Монтомоли Э. и др. (август 2020 г.). «Влияние кандидатного вируса гриппа и производства яиц на эффективность вакцин: обзор литературы и консенсус экспертов» . Вакцина . 38 (38): 6047–6056. doi : 10.1016/j.vaccine.2020.06.021 . ПМИД 32600916 .
Внешние ссылки
[ редактировать ]- Информационное заявление об инактивированной вакцине против гриппа , Центры США по контролю и профилактике заболеваний (CDC)
- Live, Intranasal Influenza Vaccine Information Statement, US Centers for Disease Control and Prevention (CDC)
- Seasonal Influenza (Flu) Vaccination and Preventable Disease, US Centers for Disease Control and Prevention (CDC)
- Misconceptions about Seasonal Flu and Flu Vaccines, US Centers for Disease Control and Prevention (CDC)
- Influenza Vaccines at the U.S. National Library of Medicine Medical Subject Headings (MeSH)