Грипп
| Грипп | |
|---|---|
| Другие имена | грипп, грипп, грипп (по-французски грипп) |
 | |
| Вирус гриппа | |
| Специальность | Инфекционное заболевание |
| Symptoms | Fever, runny nose, sore throat, muscle pain, headache, coughing, fatigue |
| Usual onset | 1–4 days after exposure |
| Duration | 2–8 days |
| Causes | Influenza viruses |
| Prevention | Hand washing, flu vaccines |
| Medication | Antiviral drugs such as oseltamivir |
| Frequency | 3–5 million severe cases per year[1][2] |
| Deaths | >290,000–650,000 deaths per year[3][4] |
Грипп , широко известный как « грипп » или просто « грипп », представляет собой инфекционное заболевание, вызываемое вирусами гриппа . Симптомы варьируются от легких до тяжелых и часто включают лихорадку , насморк , боль в горле , мышечную боль , головную боль , кашель и усталость . Эти симптомы начинаются через один-четыре (обычно два) дня после контакта с вирусом и длятся от двух до восьми дней. Могут возникнуть диарея и рвота , особенно у детей. Грипп может перерасти в пневмонию из-за вируса или последующей бактериальной инфекции . Другие осложнения включают острый респираторный дистресс-синдром , менингит , энцефалит и ухудшение ранее существовавших проблем со здоровьем, таких как астма и сердечно-сосудистые заболевания .
Существует четыре типа вируса гриппа: типы А, В, С и D. Водоплавающие птицы являются основным источником вируса гриппа А (IAV), который также широко распространен у различных млекопитающих, включая человека и свиней. Вирус гриппа B (IBV) и вирус гриппа C (ICV) преимущественно поражают людей, а вирус гриппа D (IDV) обнаруживается у крупного рогатого скота и свиней. Вирус гриппа А и вирус гриппа В циркулируют у человека и вызывают сезонные эпидемии , а вирус гриппа С вызывает легкую инфекцию, преимущественно у детей. Вирус гриппа D может заразить человека, но неизвестно, вызывает ли он заболевание. У человека вирусы гриппа в основном передаются при воздушно-капельным путем кашле и чихании. Также происходит передача через аэрозоли и поверхности, загрязненные вирусом.
Frequent hand washing and covering one's mouth and nose when coughing and sneezing reduce transmission. Annual vaccination can help to provide protection against influenza. Influenza viruses, particularly influenza A virus, evolve quickly, so flu vaccines are updated regularly to match which influenza strains are in circulation. Vaccines provide protection against influenza A virus subtypes H1N1 and H3N2 and one or two influenza B virus subtypes. Influenza infection is diagnosed with laboratory methods such as antibody or antigen tests and a polymerase chain reaction (PCR) to identify viral nucleic acid. The disease can be treated with supportive measures and, in severe cases, with antiviral drugs such as oseltamivir. In healthy individuals, influenza is typically self-limiting and rarely fatal, but it can be deadly in high-risk groups.
In a typical year, five to 15 percent of the population contracts influenza. There are 3 to 5 million severe cases annually, with up to 650,000 respiratory-related deaths globally each year. Deaths most commonly occur in high-risk groups, including young children, the elderly, and people with chronic health conditions. In temperate regions, the number of influenza cases peaks during winter, whereas in the tropics, influenza can occur year-round. Since the late 1800s, pandemic outbreaks of novel influenza strains have occurred every 10 to 50 years. Five flu pandemics have occurred since 1900: the Spanish flu from 1918 to 1920, which was the most severe; the Asian flu in 1957; the Hong Kong flu in 1968; the Russian flu in 1977; and the swine flu pandemic in 2009.
Signs and symptoms

The symptoms of influenza are similar to those of a cold, although usually more severe and less likely to include a runny nose.[8][9] The time between exposure to the virus and development of symptoms (the incubation period) is one to four days, most commonly one to two days. Many infections are asymptomatic.[10] The onset of symptoms is sudden, and initial symptoms are predominately non-specific, including fever, chills, headaches, muscle pain, malaise, loss of appetite, lack of energy, and confusion. These are usually accompanied by respiratory symptoms such as a dry cough, sore or dry throat, hoarse voice, and a stuffy or runny nose. Coughing is the most common symptom.[1] Gastrointestinal symptoms may also occur, including nausea, vomiting, diarrhea,[11] and gastroenteritis,[12] especially in children. The standard influenza symptoms typically last for two to eight days.[13] Some studies suggest influenza can cause long-lasting symptoms in a similar way to long COVID.[14][15][16]
Symptomatic infections are usually mild and limited to the upper respiratory tract, but progression to pneumonia is relatively common. Pneumonia may be caused by the primary viral infection or a secondary bacterial infection. Primary pneumonia is characterized by rapid progression of fever, cough, labored breathing, and low oxygen levels that cause bluish skin. It is especially common among those who have an underlying cardiovascular disease such as rheumatic heart disease. Secondary pneumonia typically has a period of improvement in symptoms for one to three weeks[17] followed by recurrent fever, sputum production, and fluid buildup in the lungs,[1] but can also occur just a few days after influenza symptoms appear.[17] About a third of primary pneumonia cases are followed by secondary pneumonia, which is most frequently caused by the bacteria Streptococcus pneumoniae and Staphylococcus aureus.[10][1]
Virology
Types of virus

Influenza viruses comprise four species, each the sole member of its own genus. The four influenza genera comprise four of the seven genera in the family Orthomyxoviridae. They are:[1][18]
- Influenza A virus , genus Alphainfluenzavirus
- Influenza B virus , genus Betainfluenzavirus
- Influenza C virus , genus Gammainfluenzavirus
- Influenza D virus , genus Deltainfluenzavirus
Influenza A virus is responsible for most cases of severe illness as well as seasonal epidemics and occasional pandemics. It infects people of all ages but tends to disproportionately cause severe illness in the elderly, the very young, and those with chronic health issues. Birds are the primary reservoir of influenza A virus, especially aquatic birds such as ducks, geese, shorebirds, and gulls,[19][20] but the virus also circulates among mammals, including pigs, horses, and marine mammals.
Subtypes of Influenza A are defined by the combination of the antigenic viral proteins haemagglutinin (H) and neuraminidase (N) in the viral envelope; for example, "H1N1" designates an IAV subtype that has a type-1 hemagglutinin (H) protein and a type-1 neuraminidase (N) protein.[21] Almost all possible combinations of H (1 thru 16) and N (1 thru 11) have been isolated from wild birds.[22][23] In addition H17, H18, N10 and N11 have been found in bats.[24][23] The influenza A virus subtypes in circulation among humans as of 2018[update] are H1N1 and H3N2.[2]
Influenza B virus mainly infects humans but has been identified in seals, horses, dogs, and pigs.[23] Influenza B virus does not have subtypes like influenza A virus but has two antigenically distinct lineages, termed the B/Victoria/2/1987-like and B/Yamagata/16/1988-like lineages,[1] or simply (B/)Victoria(-like) and (B/)Yamagata(-like).[23][2] Both lineages are in circulation in humans,[1] disproportionately affecting children.[11] However, the B/Yamagata lineage might have become extinct in 2020/2021 due to COVID-19 pandemic measures.[25] Influenza B viruses contribute to seasonal epidemics alongside influenza A viruses but have never been associated with a pandemic.[23]
Influenza C virus, like influenza B virus, is primarily found in humans, though it has been detected in pigs, feral dogs, dromedary camels, cattle, and dogs.[12][23] Influenza C virus infection primarily affects children and is usually asymptomatic[1][11] or has mild cold-like symptoms, though more severe symptoms such as gastroenteritis and pneumonia can occur.[12] Unlike influenza A virus and influenza B virus, influenza C virus has not been a major focus of research pertaining to antiviral drugs, vaccines, and other measures against influenza.[23] Influenza C virus is subclassified into six genetic/antigenic lineages.[12][26]
Influenza D virus has been isolated from pigs and cattle, the latter being the natural reservoir. Infection has also been observed in humans, horses, dromedary camels, and small ruminants such as goats and sheep.[23][26] Influenza D virus is distantly related to influenza C virus. While cattle workers have occasionally tested positive to prior influenza D virus infection, it is not known to cause disease in humans.[1][11][12] Influenza C virus and influenza D virus experience a slower rate of antigenic evolution than influenza A virus and influenza B virus. Because of this antigenic stability, relatively few novel lineages emerge.[26]
Influenza virus nomenclature

Every year, millions of influenza virus samples are analysed to monitor changes in the virus' antigenic properties, and to inform the development of vaccines.[27]
To unambiguously describe a specific isolate of virus, researchers use the internationally accepted influenza virus nomenclature,i[28] which describes, among other things, the species of animal from which the virus was isolated, and the place and year of collection. As an example – A/chicken/Nakorn-Patom/Thailand/CU-K2/04(H5N1):
- A stands for the genus of influenza (A, B, C or D).
- chicken is the animal species the isolate was found in (note: human isolates lack this component term and are thus identified as human isolates by default)
- Nakorn-Patom/Thailand is the place this specific virus was isolated
- CU-K2 is the laboratory reference number that identifies it from other influenza viruses isolated at the same place and year
- 04 represents the year of isolation 2004
- H5 stands for the fifth of several known types of the protein hemagglutinin.
- N1 stands for the first of several known types of the protein neuraminidase.[29]
The nomenclature for influenza B, C and D, which are less variable, is simpler. Examples are B/Santiago/29615/2020 and C/Minnesota/10/2015.[29]
Genome and structure

Influenza viruses have a negative-sense, single-stranded RNA genome that is segmented. The negative sense of the genome means it can be used as a template to synthesize messenger RNA (mRNA).[10] Influenza A virus and influenza B virus have eight genome segments that encode 10 major proteins. Influenza C virus and influenza D virus have seven genome segments that encode nine major proteins.[12]
Three segments encode three subunits of an RNA-dependent RNA polymerase (RdRp) complex: PB1, a transcriptase, PB2, which recognizes 5' caps, and PA (P3 for influenza C virus and influenza D virus), an endonuclease.[30] The M1 matrix protein and M2 proton channel share a segment, as do the non-structural protein (NS1) and the nuclear export protein (NEP).[1] For influenza A virus and influenza B virus, hemagglutinin (HA) and neuraminidase (NA) are encoded on one segment each, whereas influenza C virus and influenza D virus encode a hemagglutinin-esterase fusion (HEF) protein on one segment that merges the functions of HA and NA. The final genome segment encodes the viral nucleoprotein (NP).[30] Influenza viruses also encode various accessory proteins, such as PB1-F2 and PA-X, that are expressed through alternative open reading frames[1][31] and which are important in host defense suppression, virulence, and pathogenicity.[32]
The virus particle, called a virion, is pleomorphic and varies between being filamentous, bacilliform, or spherical in shape. Clinical isolates tend to be pleomorphic, whereas strains adapted to laboratory growth typically produce spherical virions. Filamentous virions are about 250 nanometers (nm) by 80 nm, bacilliform 120–250 by 95 nm, and spherical 120 nm in diameter.[33]
The core of the virion comprises one copy of each segment of the genome bound to NP nucleoproteins in separate ribonucleoprotein (RNP) complexes for each segment. There is a copy of the RdRp, all subunits included, bound to each RNP. The genetic material is encapsulated by a layer of M1 matrix protein which provides structural reinforcement to the outer layer, the viral envelope.[3] The envelope comprises a lipid bilayer membrane incorporating HA and NA (or HEF[26]) proteins extending outward from its exterior surface. HA and HEF[26] proteins have a distinct "head" and "stalk" structure. M2 proteins form proton channels through the viral envelope that are required for viral entry and exit. Influenza B viruses contain a surface protein named NB that is anchored in the envelope, but its function is unknown.[1]
Life cycle
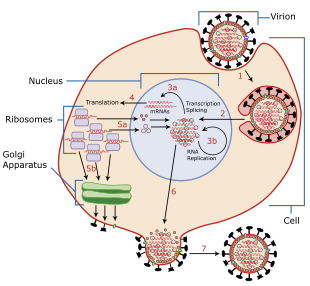
The viral life cycle begins by binding to a target cell. Binding is mediated by the viral HA proteins on the surface of the envelope, which bind to cells that contain sialic acid receptors on the surface of the cell membrane.[1][19][3] For N1 subtypes with the "G147R" mutation and N2 subtypes, the NA protein can initiate entry. Prior to binding, NA proteins promote access to target cells by degrading mucus, which helps to remove extracellular decoy receptors that would impede access to target cells.[3] After binding, the virus is internalized into the cell by an endosome that contains the virion inside it. The endosome is acidified by cellular vATPase[31] to have lower pH, which triggers a conformational change in HA that allows fusion of the viral envelope with the endosomal membrane.[32] At the same time, hydrogen ions diffuse into the virion through M2 ion channels, disrupting internal protein-protein interactions to release RNPs into the host cell's cytosol. The M1 protein shell surrounding RNPs is degraded, fully uncoating RNPs in the cytosol.[31][3]
RNPs are then imported into the nucleus with the help of viral localization signals. There, the viral RNA polymerase transcribes mRNA using the genomic negative-sense strand as a template. The polymerase snatches 5' caps for viral mRNA from cellular RNA to prime mRNA synthesis and the 3'-end of mRNA is polyadenylated at the end of transcription.[30] Once viral mRNA is transcribed, it is exported out of the nucleus and translated by host ribosomes in a cap-dependent manner to synthesize viral proteins.[31] RdRp also synthesizes complementary positive-sense strands of the viral genome in a complementary RNP complex which are then used as templates by viral polymerases to synthesize copies of the negative-sense genome.[1][3] During these processes, RdRps of avian influenza viruses (AIVs) function optimally at a higher temperature than mammalian influenza viruses.[13]
Newly synthesized viral polymerase subunits and NP proteins are imported to the nucleus to further increase the rate of viral replication and form RNPs.[30] HA, NA, and M2 proteins are trafficked with the aid of M1 and NEP proteins[32] to the cell membrane through the Golgi apparatus[30] and inserted into the cell's membrane. Viral non-structural proteins including NS1, PB1-F2, and PA-X regulate host cellular processes to disable antiviral responses.[1][32][3] PB1-F2 also interacts with PB1 to keep polymerases in the nucleus longer.[20] M1 and NEP proteins localize to the nucleus during the later stages of infection, bind to viral RNPs and mediate their export to the cytoplasm where they migrate to the cell membrane with the aid of recycled endosomes and are bundled into the segments of the genome.[1][3]
Progeny viruses leave the cell by budding from the cell membrane, which is initiated by the accumulation of M1 proteins at the cytoplasmic side of the membrane. The viral genome is incorporated inside a viral envelope derived from portions of the cell membrane that have HA, NA, and M2 proteins. At the end of budding, HA proteins remain attached to cellular sialic acid until they are cleaved by the sialidase activity of NA proteins. The virion is then released from the cell. The sialidase activity of NA also cleaves any sialic acid residues from the viral surface, which helps prevent newly assembled viruses from aggregating near the cell surface and improving infectivity.[1][3] Similar to other aspects of influenza replication, optimal NA activity is temperature- and pH-dependent.[13] Ultimately, presence of large quantities of viral RNA in the cell triggers apoptosis (programmed cell death), which is initiated by cellular factors to restrict viral replication.[31]
Antigenic drift and shift

Two key processes that influenza viruses evolve through are antigenic drift and antigenic shift. Antigenic drift is when an influenza virus' antigens change due to the gradual accumulation of mutations in the antigen's (HA or NA) gene.[19] This can occur in response to evolutionary pressure exerted by the host immune response. Antigenic drift is especially common for the HA protein, in which just a few amino acid changes in the head region can constitute antigenic drift.[2][26] The result is the production of novel strains that can evade pre-existing antibody-mediated immunity.[1][11] Antigenic drift occurs in all influenza species but is slower in B than A and slowest in C and D.[26] Antigenic drift is a major cause of seasonal influenza,[34] and requires that flu vaccines be updated annually. HA is the main component of inactivated vaccines, so surveillance monitors antigenic drift of this antigen among circulating strains. Antigenic evolution of influenza viruses of humans appears to be faster than in swine and equines. In wild birds, within-subtype antigenic variation appears to be limited but has been observed in poultry.[1][11]
Antigenic shift is a sudden, drastic change in an influenza virus' antigen, usually HA. During antigenic shift, antigenically different strains that infect the same cell can reassort genome segments with each other, producing hybrid progeny. Since all influenza viruses have segmented genomes, all are capable of reassortment.[12][26] Antigenic shift only occurs among influenza viruses of the same genus[30] and most commonly occurs among influenza A viruses. In particular, reassortment is very common in AIVs, creating a large diversity of influenza viruses in birds, but is uncommon in human, equine, and canine lineages.[35] Pigs, bats, and quails have receptors for both mammalian and avian influenza A viruses, so they are potential "mixing vessels" for reassortment.[23] If an animal strain reassorts with a human strain,[2] then a novel strain can emerge that is capable of human-to-human transmission. This has caused pandemics, but only a limited number, so it is difficult to predict when the next will happen.[1][11] The Global Influenza Surveillance and Response System of the World Health Organization (GISRS) tests several millions of specimens annually to monitor the spread and evolution of influenza viruses.[36][37][38]
Mechanism
Transmission
People who are infected can transmit influenza viruses through breathing, talking, coughing, and sneezing, which spread respiratory droplets and aerosols that contain virus particles into the air. A person susceptible to infection can contract influenza by coming into contact with these particles.[17][39] Respiratory droplets are relatively large and travel less than two meters before falling onto nearby surfaces. Aerosols are smaller and remain suspended in the air longer, so they take longer to settle and can travel further.[39][4] Inhalation of aerosols can lead to infection,[40] but most transmission is in the area about two meters around an infected person via respiratory droplets[10] that come into contact with mucosa of the upper respiratory tract.[40] Transmission through contact with a person, bodily fluids, or intermediate objects (fomites) can also occur,[10][39] since influenza viruses can survive for hours on non-porous surfaces.[4] If one's hands are contaminated, then touching one's face can cause infection.[41]
Influenza is usually transmissible from one day before the onset of symptoms to 5–7 days after.[11] In healthy adults, the virus is shed for up to 3–5 days. In children and the immunocompromised, the virus may be transmissible for several weeks.[10] Children ages 2–17 are considered to be the primary and most efficient spreaders of influenza.[1][11] Children who have not had multiple prior exposures to influenza viruses shed the virus at greater quantities and for a longer duration than other children.[1] People at risk of exposure to influenza include health care workers, social care workers, and those who live with or care for people vulnerable to influenza. In long-term care facilities, the flu can spread rapidly.[11] A variety of factors likely encourage influenza transmission, including lower temperature, lower absolute and relative humidity, less ultraviolet radiation from the sun,[40][42] and crowding.[39] Influenza viruses that infect the upper respiratory tract like H1N1 tend to be more mild but more transmissible, whereas those that infect the lower respiratory tract like H5N1 tend to cause more severe illness but are less contagious.[10]
Pathophysiology
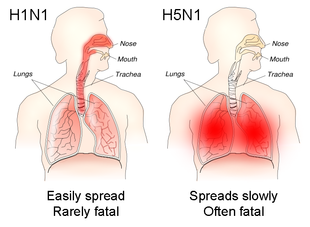
In humans, influenza viruses first cause infection by infecting epithelial cells in the respiratory tract. Illness during infection is primarily the result of lung inflammation and compromise caused by epithelial cell infection and death, combined with inflammation caused by the immune system's response to infection. Non-respiratory organs can become involved, but the mechanisms by which influenza is involved in these cases are unknown. Severe respiratory illness can be caused by multiple, non-exclusive mechanisms, including obstruction of the airways, loss of alveolar structure, loss of lung epithelial integrity due to epithelial cell infection and death, and degradation of the extracellular matrix that maintains lung structure. In particular, alveolar cell infection appears to drive severe symptoms since this results in impaired gas exchange and enables viruses to infect endothelial cells, which produce large quantities of pro-inflammatory cytokines.[17]
Pneumonia caused by influenza viruses is characterized by high levels of viral replication in the lower respiratory tract, accompanied by a strong pro-inflammatory response called a cytokine storm.[1] Infection with H5N1 or H7N9 especially produces high levels of pro-inflammatory cytokines.[19] In bacterial infections, early depletion of macrophages during influenza creates a favorable environment in the lungs for bacterial growth since these white blood cells are important in responding to bacterial infection. Host mechanisms to encourage tissue repair may inadvertently allow bacterial infection. Infection also induces production of systemic glucocorticoids that can reduce inflammation to preserve tissue integrity but allow increased bacterial growth.[17]
The pathophysiology of influenza is significantly influenced by which receptors influenza viruses bind to during entry into cells. Mammalian influenza viruses preferentially bind to sialic acids connected to the rest of the oligosaccharide by an α-2,6 link, most commonly found in various respiratory cells,[1][19][3] such as respiratory and retinal epithelial cells.[31] AIVs prefer sialic acids with an α-2,3 linkage, which are most common in birds in gastrointestinal epithelial cells[1][19][3] and in humans in the lower respiratory tract.[44] Cleavage of the HA protein into HA1, the binding subunit, and HA2, the fusion subunit, is performed by different proteases, affecting which cells can be infected. For mammalian influenza viruses and low pathogenic AIVs, cleavage is extracellular, which limits infection to cells that have the appropriate proteases, whereas for highly pathogenic AIVs, cleavage is intracellular and performed by ubiquitous proteases, which allows for infection of a greater variety of cells, thereby contributing to more severe disease.[1][35][45]
Immunology
Cells possess sensors to detect viral RNA, which can then induce interferon production. Interferons mediate expression of antiviral proteins and proteins that recruit immune cells to the infection site, and they notify nearby uninfected cells of infection. Some infected cells release pro-inflammatory cytokines that recruit immune cells to the site of infection. Immune cells control viral infection by killing infected cells and phagocytizing viral particles and apoptotic cells. An exacerbated immune response can harm the host organism through a cytokine storm.[1][13][31] To counter the immune response, influenza viruses encode various non-structural proteins, including NS1, NEP, PB1-F2, and PA-X, that are involved in curtailing the host immune response by suppressing interferon production and host gene expression.[1][32]
B cells, a type of white blood cell, produce antibodies that bind to influenza antigens HA and NA (or HEF[26]) and other proteins to a lesser degree. Once bound to these proteins, antibodies block virions from binding to cellular receptors, neutralizing the virus. In humans, a sizeable antibody response occurs about one week after viral exposure.[46] This antibody response is typically robust and long-lasting, especially for influenza C virus and influenza D virus.[1][26] People exposed to a certain strain in childhood still possess antibodies to that strain at a reasonable level later in life, which can provide some protection to related strains.[1] There is, however, an "original antigenic sin", in which the first HA subtype a person is exposed to influences the antibody-based immune response to future infections and vaccines.[2]
Prevention
Vaccination

Annual vaccination is the primary and most effective way to prevent influenza and influenza-associated complications, especially for high-risk groups.[10][1][47] Vaccines against the flu are trivalent or quadrivalent, providing protection against an H1N1 strain, an H3N2 strain, and one or two influenza B virus strains corresponding to the two influenza B virus lineages.[10][2] Two types of vaccines are in use: inactivated vaccines that contain "killed" (i.e. inactivated) viruses and live attenuated influenza vaccines (LAIVs) that contain weakened viruses.[1] There are three types of inactivated vaccines: whole virus, split virus, in which the virus is disrupted by a detergent, and subunit, which only contains the viral antigens HA and NA.[48] Most flu vaccines are inactivated and administered via intramuscular injection. LAIVs are sprayed into the nasal cavity.[1]
Vaccination recommendations vary by country. Some recommend vaccination for all people above a certain age, such as 6 months,[47] whereas other countries limit recommendations to high-risk groups.[1][11] Young infants cannot receive flu vaccines for safety reasons, but they can inherit passive immunity from their mother if vaccinated during pregnancy.[49] Influenza vaccination helps to reduce the probability of reassortment.[13]

In general, influenza vaccines are only effective if there is an antigenic match between vaccine strains and circulating strains.[10][2] Most commercially available flu vaccines are manufactured by propagation of influenza viruses in embryonated chicken eggs, taking 6–8 months.[2] Flu seasons are different in the northern and southern hemisphere, so the WHO meets twice a year, once for each hemisphere, to discuss which strains should be included based on observation from HA inhibition assays.[10][3] Other manufacturing methods include an MDCK cell culture-based inactivated vaccine and a recombinant subunit vaccine manufactured from baculovirus overexpression in insect cells.[2][50]
Antiviral chemoprophylaxis
Influenza can be prevented or reduced in severity by post-exposure prophylaxis with the antiviral drugs oseltamivir, which can be taken orally by those at least three months old, and zanamivir, which can be inhaled by those above seven years. Chemoprophylaxis is most useful for individuals at high risk for complications and those who cannot receive the flu vaccine.[10] Post-exposure chemoprophylaxis is only recommended if oseltamivir is taken within 48 hours of contact with a confirmed or suspected case and zanamivir within 36 hours.[10][11] It is recommended for people who have yet to receive a vaccine for the current flu season, who have been vaccinated less than two week since contact, if there is a significant mismatch between vaccine and circulating strains, or during an outbreak in a closed setting regardless of vaccination history.[11]
Infection control
Hand hygiene is important in reducing the spread of influenza. This includes frequent hand washing with soap and water, using alcohol-based hand sanitizers, and not touching one's eyes, nose, and mouth with one's hands. Covering one's nose and mouth when coughing or sneezing is important.[51] Other methods to limit influenza transmission include staying home when sick,[1] avoiding contact with others until one day after symptoms end,[11] and disinfecting surfaces likely to be contaminated by the virus.[1]
Research thus far has not shown a significant reduction in seasonal influenza with mask usage. The effectiveness of screening at points of entry into countries is not well researched.[51] Social distancing measures such as school closures, isolation or quarantine, and limiting mass gatherings may reduce transmission,[1][51] but these measures are often expensive, unpopular, and difficult to implement. Consequently, the commonly recommended methods of infection control are respiratory etiquette, hand hygiene, and mask wearing, which are inexpensive and easy. Pharmaceutical measures are effective but may not be available in the early stages of an outbreak.[52]
In health care settings, infected individuals may be cohorted or assigned to individual rooms. Protective clothing such as masks, gloves, and gowns is recommended when coming into contact with infected individuals if there is a risk of exposure to infected bodily fluids. Keeping patients in negative pressure rooms and avoiding aerosol-producing activities may help,[10] but special air handling and ventilation systems are not considered necessary to prevent the spread of influenza in the air.[4] In residential homes, new admissions may need to be closed until the spread of influenza is controlled.[11]
Since influenza viruses circulate in animals such as birds and pigs, prevention of transmission from these animals is important. Water treatment, indoor raising of animals, quarantining sick animals, vaccination, and biosecurity are the primary measures used. Placing poultry houses and piggeries on high ground away from high-density farms, backyard farms, live poultry markets, and bodies of water helps to minimize contact with wild birds.[1] Closure of live poultry markets appears to the most effective measure[19] and has shown to be effective at controlling the spread of H5N1, H7N9, and H9N2.[20] Other biosecurity measures include cleaning and disinfecting facilities and vehicles, banning visits to poultry farms, not bringing birds intended for slaughter back to farms,[53] changing clothes, disinfecting foot baths, and treating food and water.[1]
If live poultry markets are not closed, then "clean days" when unsold poultry is removed and facilities are disinfected and "no carry-over" policies to eliminate infectious material before new poultry arrive can be used to reduce the spread of influenza viruses. If a novel influenza viruses has breached the aforementioned biosecurity measures, then rapid detection to stamp it out via quarantining, decontamination, and culling may be necessary to prevent the virus from becoming endemic.[1] Vaccines exist for avian H5, H7, and H9 subtypes that are used in some countries.[19] In China, for example, vaccination of domestic birds against H7N9 successfully limited its spread, indicating that vaccination may be an effective strategy[35] if used in combination with other measures to limit transmission.[1] In pigs and horses, management of influenza is dependent on vaccination with biosecurity.[1]
Diagnosis

Diagnosis based on symptoms is fairly accurate in otherwise healthy people during seasonal epidemics and should be suspected in cases of pneumonia, acute respiratory distress syndrome (ARDS), sepsis, or if encephalitis, myocarditis, or breakdown of muscle tissue occur.[17] Because influenza is similar to other viral respiratory tract illnesses, laboratory diagnosis is necessary for confirmation. Common sample collection methods for testing include nasal and throat swabs.[1] Samples may be taken from the lower respiratory tract if infection has cleared the upper but not lower respiratory tract. Influenza testing is recommended for anyone hospitalized with symptoms resembling influenza during flu season or who is connected to an influenza case. For severe cases, earlier diagnosis improves patient outcome.[47] Diagnostic methods that can identify influenza include viral cultures, antibody- and antigen-detecting tests, and nucleic acid-based tests.[54]
Вирусы можно выращивать в культуре клеток млекопитающих или яйцах с эмбрионами в течение 3–10 дней для мониторинга цитопатического эффекта. Окончательное подтверждение затем можно сделать с помощью окрашивания антителами, гемадсорбции с использованием эритроцитов или иммунофлуоресцентной микроскопии. Культуры из флаконов с оболочкой, которые могут идентифицировать инфекцию с помощью иммуноокрашивания до появления цитопатического эффекта, более чувствительны, чем традиционные культуры, и дают результаты через 1–3 дня. [ 1 ] [ 47 ] [ 54 ] Культуры можно использовать для характеристики новых вирусов, наблюдения за чувствительностью к противовирусным препаратам и мониторинга антигенного дрейфа, но они относительно медленны и требуют специальных навыков и оборудования. [ 1 ]
Серологические анализы можно использовать для выявления гуморальной реакции на грипп после естественного инфицирования или вакцинации. Общие серологические анализы включают анализы ингибирования гемагглютинации, которые выявляют HA-специфические антитела, анализы нейтрализации вируса, которые проверяют, нейтрализовали ли антитела вирус, и иммуноферментные анализы. Эти методы, как правило, относительно недороги и быстры, но менее надежны, чем тесты на основе нуклеиновых кислот. [ 1 ] [ 54 ]
Прямые флуоресцентные или иммунофлуоресцентные тесты на антитела (DFA/IFA) включают окрашивание респираторных эпителиальных клеток в образцах флуоресцентно-меченными антителами, специфичными для гриппа, с последующим исследованием под флуоресцентным микроскопом. Они могут различать вирус гриппа А и вирус гриппа В, но не могут подтипировать вирус гриппа А. [ 54 ] Экспресс-тесты для диагностики гриппа (RIDT) представляют собой простой способ получения результатов анализа, имеют низкую стоимость и дают результаты менее чем за 30 минут, поэтому они широко используются, но они не позволяют отличить вирус гриппа А от вируса гриппа В или между подтипы вируса гриппа А и не так чувствительны, как тесты на основе нуклеиновых кислот. [ 1 ] [ 54 ]
Тесты на основе нуклеиновых кислот (NAT) усиливают и обнаруживают вирусную нуклеиновую кислоту. Большинство этих тестов занимают несколько часов. [ 54 ] но быстрые молекулярные анализы столь же быстры, как и RIDT. [ 47 ] Среди NAT полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) является наиболее традиционной и считается золотым стандартом диагностики гриппа. [ 54 ] потому что он быстрый и может подтипировать вирус гриппа А, но он относительно дорог и более склонен к ложноположительным результатам, чем посев. [ 1 ] Другие использованные NAT включают анализы на основе петлевой изотермической амплификации , простые анализы на основе амплификации и амплификацию на основе последовательностей нуклеиновых кислот. Методы секвенирования нуклеиновых кислот позволяют идентифицировать инфекцию путем получения последовательности нуклеиновых кислот из вирусных образцов для выявления устойчивости вируса и противовирусных препаратов. Традиционным методом является секвенирование по Сэнгеру , но он в значительной степени заменен методами следующего поколения , которые имеют большую скорость и производительность секвенирования. [ 54 ]
Управление
Лечение в случаях легкого или умеренного заболевания является поддерживающим и включает жаропонижающие препараты, такие как ацетаминофен и ибупрофен . [ 55 ] достаточное потребление жидкости во избежание обезвоживания и отдых. [ 11 ] Лекарства от кашля и спреи для горла могут быть полезны при боли в горле. Во время болезни рекомендуется избегать употребления алкоголя и табака. [ 55 ] Аспирин не рекомендуется применять для лечения гриппа у детей из-за повышенного риска развития синдрома Рея . [ 56 ] Кортикостероиды не рекомендуются, за исключением случаев лечения септического шока или основного заболевания, такого как хроническая обструктивная болезнь легких или обострение астмы, поскольку они связаны с повышенной смертностью. [ 47 ] Если возникает вторичная бактериальная инфекция, может потребоваться применение антибиотиков. [ 11 ]
Противовирусные препараты
| Лекарство | Путь введения | Утвержденный возраст использования |
|---|---|---|
| Осельтамивир | Оральный | Минимум две недели |
| Занамивир | Вдыхание | Минимум пять лет |
| Перамивир | Внутривенная инъекция | По крайней мере 18 лет |
| Ланинамивир | Вдыхание [ 1 ] | Доза 40 миллиграммов (мг) для людей старше 10 лет, 20 мг для детей младше 10 лет [ 57 ] |
| Балоксавир марбоксил | Оральный [ 4 ] | Минимум 12 лет [ 47 ] |
Противовирусные препараты в основном используются для лечения тяжелобольных пациентов, особенно с ослабленной иммунной системой. Противовирусные препараты наиболее эффективны, если их начать в первые 48 часов после появления симптомов. Более позднее введение может быть полезным для тех, у кого есть основные иммунные дефекты, для людей с более тяжелыми симптомами или для тех, у кого более высокий риск развития осложнений, если эти люди все еще выделяют вирус. Противовирусное лечение также рекомендуется, если человек госпитализирован с подозрением на грипп вместо того, чтобы ждать результатов анализов, и если симптомы ухудшаются. [ 1 ] [ 47 ] Большинство противовирусных препаратов против гриппа делятся на две категории: ингибиторы нейраминидазы (НА) и ингибиторы М2. [ 13 ] Балоксавир марбоксил является заметным исключением, он нацелен на эндонуклеазную активность вирусной РНК-полимеразы и может использоваться в качестве альтернативы ингибиторам NA и M2 для вируса гриппа А и вируса гриппа B. [ 10 ] [ 19 ] [ 4 ]
Ингибиторы NA воздействуют на ферментативную активность рецепторов NA, имитируя связывание сиаловой кислоты в активном центре NA на вирионах вируса гриппа A и вируса гриппа B. [ 1 ] так что высвобождение вируса из инфицированных клеток и скорость репликации вируса нарушаются. [ 11 ] Ингибиторы NA включают осельтамивир, который принимают перорально в форме пролекарства и преобразуются в активную форму в печени, и занамивир, который представляет собой порошок, который вдыхают назально. Осельтамивир и занамивир эффективны для профилактики и постконтактной профилактики, а исследования в целом показывают, что ингибиторы NA эффективны в снижении частоты осложнений, госпитализации и смертности. [ 1 ] и продолжительность болезни. [ 13 ] [ 47 ] [ 4 ] Кроме того, чем раньше будут назначены ингибиторы NA, тем лучше результат. [ 4 ] хотя позднее введение все же может быть полезным в тяжелых случаях. [ 1 ] [ 47 ] Другие ингибиторы NA включают ланинамивир. [ 1 ] и перамивир, последний из которых может использоваться в качестве альтернативы осельтамивиру для людей, которые не могут его переносить или усваивать. [ 47 ]
Адамантаны представляют собой амантадин и римантадин препараты для перорального применения, которые блокируют ионный канал М2 вируса гриппа. [ 1 ] предотвращение вирусного разоблачения. [ 4 ] Эти препараты эффективны только против вируса гриппа А. [ 47 ] но больше не рекомендуются к использованию из-за широко распространенной устойчивости к ним среди вирусов гриппа А. [ 4 ] Устойчивость к адамантану впервые возникла у H3N2 в 2003 году, а к 2008 году она стала всемирной. Устойчивость к осельтамивиру больше не широко распространена, поскольку пандемический штамм H1N1 2009 года (H1N1 pdm09), устойчивый к адамантану, по-видимому, заменил устойчивые штаммы в обращении. После пандемии 2009 года резистентность к осельтамивиру наблюдалась в основном у пациентов, проходящих терапию. [ 1 ] особенно дети с ослабленным иммунитетом и маленькие дети. [ 4 ] Устойчивость к осельтамивиру обычно регистрируется при вирусе H1N1, но реже сообщается о вирусах H3N2 и гриппа B. [ 1 ] По этой причине осельтамивир рекомендуется в качестве препарата первого выбора для иммунокомпетентных людей, тогда как для людей с ослабленным иммунитетом осельтамивир рекомендуется против вируса H3N2 и гриппа B, а занамивир против H1N1 pdm09. Резистентность к занамивиру наблюдается реже, возможна устойчивость к перамивиру и балоксавиру марбоксилу. [ 4 ]
Прогноз
У здоровых людей инфекция гриппа обычно проходит самостоятельно и редко приводит к летальному исходу. [ 10 ] [ 11 ] Симптомы обычно длятся 2–8 дней. [ 13 ] Грипп может привести к тому, что люди пропустят работу или учебу, он связан со снижением производительности труда, а у пожилых людей – с уменьшением независимости. Усталость и недомогание могут сохраняться в течение нескольких недель после выздоровления, а у здоровых взрослых могут возникнуть легочные нарушения, на устранение которых может потребоваться несколько недель. Осложнения и смертность в первую очередь возникают в группах высокого риска и у госпитализированных. Тяжелое заболевание и смертность обычно связаны с пневмонией, вызванной первичной вирусной инфекцией или вторичной бактериальной инфекцией. [ 1 ] [ 11 ] который может перейти в ОРДС. [ 13 ]
Другие респираторные осложнения, которые могут возникнуть, включают синусит , бронхит , бронхиолит , избыточное накопление жидкости в легких и обострение хронического бронхита и астмы. Могут возникнуть инфекция среднего уха и круп , чаще всего у детей. [ 10 ] [ 1 ] Вторичная инфекция S. aureus наблюдалась, прежде всего у детей, и вызывала синдром токсического шока после гриппа с гипотонией, лихорадкой, покраснением и шелушением кожи. [ 1 ] Осложнения, поражающие сердечно-сосудистую систему, встречаются редко и включают перикардит, молниеносный миокардит с учащенным, замедленным или нерегулярным сердцебиением , а также обострение ранее существовавшего сердечно-сосудистого заболевания. [ 10 ] [ 11 ] Воспаление или отек мышц, сопровождающееся разрушением мышечной ткани, встречается редко, обычно у детей, что проявляется сильной болезненностью и болью в мышцах ног, а также нежеланием ходить в течение 2–3 дней. [ 1 ] [ 11 ] [ 17 ]
Грипп может влиять на беременность, в том числе вызывать меньшие размеры новорожденных, повышенный риск преждевременных родов и повышенный риск детской смертности незадолго до или после рождения. [ 11 ] В редких случаях с гриппом были связаны неврологические осложнения, включая асептический менингит, энцефалит, диссеминированный энцефаломиелит, поперечный миелит и синдром Гийена-Барре . [ 17 ] Кроме того, могут возникать фебрильные судороги и синдром Рея, чаще всего у детей. [ 1 ] [ 11 ] Грипп-ассоциированная энцефалопатия может возникать непосредственно в результате инфекции центральной нервной системы из-за присутствия вируса в крови и проявляться внезапным началом лихорадки с судорогами с последующим быстрым прогрессированием до комы. [ 10 ] Атипичная форма энцефалита, называемая летаргическим энцефалитом, характеризующаяся головной болью, сонливостью и комой, в редких случаях может возникнуть через некоторое время после заражения. [ 1 ] У людей, переживших грипп-ассоциированную энцефалопатию, могут возникнуть неврологические дефекты. [ 10 ] В первую очередь у детей, в тяжелых случаях иммунная система редко может значительно перепроизводить лейкоциты , которые выделяют цитокины, вызывая тяжелое воспаление. [ 10 ]
Люди, достигшие возраста 65 лет, [ 11 ] из-за ослабления иммунной системы в результате старения или хронического заболевания, являются группой высокого риска развития осложнений, как и дети в возрасте до одного года и дети, которые ранее не подвергались многократному воздействию вирусов гриппа. Беременные женщины подвергаются повышенному риску, который увеличивается с каждым триместром. [ 1 ] и длится до двух недель после родов. [ 11 ] [ 47 ] Ожирение, в частности индекс массы тела более 35–40, связано с большей репликацией вируса, увеличением тяжести вторичной бактериальной инфекции и снижением эффективности вакцинации. В группу риска также входят люди с сопутствующими заболеваниями, в том числе те, у кого есть врожденные или хронические проблемы с сердцем или заболеваниями легких (например, астма), почек, печени, крови, неврологические или метаболические (например, диабет ) расстройства. [ 10 ] [ 1 ] [ 11 ] как и люди с ослабленным иммунитетом в результате химиотерапии, асплении , длительного лечения стероидами, дисфункции селезенки или ВИЧ- инфекции. [ 11 ] Употребление табака, в том числе в прошлом, подвергает человека риску. [ 47 ] Роль генетики при гриппе недостаточно изучена. [ 1 ] но это может быть фактором смертности от гриппа. [ 13 ]
Эпидемиология

Грипп обычно характеризуется сезонными эпидемиями и спорадическими пандемиями. Большая часть бремени гриппа является результатом сезонов гриппа, вызванных вирусом гриппа А и вирусом гриппа В. Среди подтипов вируса гриппа А H1N1 и H3N2 циркулируют у людей и вызывают сезонный грипп. Непропорционально большое количество случаев заболевания встречается у детей, но наиболее тяжелые причины наблюдаются у пожилых, очень маленьких, [ 1 ] и люди с ослабленным иммунитетом. [ 4 ] В обычный год вирусами гриппа заражаются 5–15% населения планеты. [ 3 ] [ 54 ] вызывая 3–5 миллионов случаев тяжелых заболеваний ежегодно [ 1 ] [ 2 ] и ежегодно на их долю приходится 290 000–650 000 смертей из-за респираторных заболеваний. [ 3 ] [ 4 ] [ 59 ] Ежегодно гриппом заболевают 5–10% взрослых и 20–30% детей. [ 23 ] Зарегистрированное количество случаев гриппа обычно намного ниже фактического числа. [ 1 ] [ 49 ]
По оценкам, во время сезонных эпидемий около 80% здоровых людей, страдающих кашлем или болью в горле, болеют гриппом. [ 1 ] Примерно у 30–40% людей, госпитализированных по поводу гриппа, развивается пневмония, и около 5% всех тяжелых случаев пневмонии в больницах вызваны гриппом, который также является наиболее распространенной причиной ОРДС у взрослых. У детей грипп и респираторно-синцитиальный вирус являются двумя наиболее распространенными причинами ОРДС. [ 17 ] Около 3–5% детей ежегодно заболевают средним отитом, вызванным гриппом. [ 10 ] Взрослые, у которых развивается органная недостаточность в результате гриппа, и дети с оценкой PIM и острой почечной недостаточностью имеют более высокий уровень смертности. [ 17 ] При сезонном гриппе смертность концентрируется среди очень молодых и пожилых людей, тогда как во время пандемий гриппа чаще всего заболевают молодые люди. [ 13 ]

В регионах с умеренным климатом число случаев гриппа варьируется от сезона к сезону. Снижение уровня витамина D , предположительно из-за меньшего количества солнечного света. [ 42 ] более низкая влажность, более низкая температура и незначительные изменения в белках вируса, вызванные антигенным дрейфом, способствуют ежегодным эпидемиям, пик которых приходится на зимний сезон. В северном полушарии это период с октября по май (точнее, с декабря по апрель). [ 13 ] ), а в южном полушарии это с мая по октябрь (точнее с июня по сентябрь). [ 13 ] ). Таким образом, в регионах с умеренным климатом каждый год наблюдается два различных сезона гриппа: один в северном полушарии и один в южном полушарии. [ 1 ] [ 11 ] [ 2 ] В тропических и субтропических регионах сезонность более сложна и, по-видимому, зависит от различных климатических факторов, таких как минимальная температура, количество солнечных часов, максимальное количество осадков и высокая влажность. [ 1 ] [ 60 ] Таким образом, грипп в этих регионах может возникать круглый год. [ 13 ] Эпидемии гриппа в наше время имеют тенденцию начинаться в восточном или южном полушарии. [ 60 ] при этом Азия является ключевым резервуаром. [ 13 ]
Вирус гриппа А и вирус гриппа В циркулируют совместно, поэтому имеют одинаковые пути передачи. [ 1 ] Однако сезонность вируса гриппа С плохо изучена. Инфекция вируса гриппа С чаще всего встречается у детей в возрасте до двух лет, а к взрослому возрасту большинство людей подвергаются воздействию вируса. Госпитализация, связанная с вирусом гриппа С, чаще всего происходит у детей в возрасте до трех лет и часто сопровождается коинфекцией другим вирусом или бактерией, что может усугубить тяжесть заболевания. При рассмотрении всех случаев госпитализации детей раннего возраста по поводу респираторных заболеваний вирус гриппа С, по-видимому, составляет лишь небольшой процент таких случаев. Могут возникать крупные вспышки инфекции вируса гриппа С, поэтому заболеваемость значительно варьируется. [ 12 ]
Вспышки гриппа, вызванные новыми вирусами гриппа, являются обычным явлением. [ 30 ] В зависимости от уровня ранее существовавшего иммунитета у населения новые вирусы гриппа могут быстро распространяться и вызывать пандемии с миллионами смертей. Эти пандемии, в отличие от сезонного гриппа, вызваны антигенными сдвигами с участием вирусов гриппа животных. На сегодняшний день все известные пандемии гриппа были вызваны вирусами гриппа А и следовали одной и той же схеме распространения от точки происхождения до остального мира в течение нескольких волн в течение года. [ 1 ] [ 11 ] [ 47 ] Пандемические штаммы, как правило, связаны с более высоким уровнем заболеваемости пневмонией у здоровых людей. [ 17 ] Обычно после каждой пандемии гриппа пандемический штамм продолжает циркулировать как причина сезонного гриппа, заменяя предыдущие штаммы. [ 1 ] С 1700 по 1889 год пандемии гриппа случались примерно раз в 50–60 лет. С тех пор пандемии возникали примерно раз в 10–50 лет, поэтому со временем они могут стать более частыми. [ 60 ]
История
Первая эпидемия гриппа могла произойти около 6000 г. до н. э. в Китае. [ 62 ] а возможные описания гриппа существуют в греческих писаниях V века до нашей эры. [ 60 ] [ 63 ] И в 1173–1174 гг., и в 1387 г. по всей Европе произошли эпидемии, получившие название «грипп». Неясно, были ли эти эпидемии или другие эпидемии вызваны гриппом, поскольку в то время не существовало единой схемы наименования эпидемических респираторных заболеваний, а «грипп» стал четко ассоциироваться с респираторными заболеваниями лишь столетия спустя. [ 64 ] Грипп, возможно, был завезен в Америку еще в 1493 году, когда эпидемическое заболевание, напоминающее грипп, убило большую часть населения Антильских островов . [ 65 ] [ 66 ]
Первое убедительное свидетельство о пандемии гриппа было сделано в 1510 году . Это началось в Восточной Азии, а затем распространилось на Северную Африку, а затем на Европу. [ 67 ] После пандемии возник сезонный грипп с последующими пандемиями в 1557 и 1580 годах. [ 64 ] Пандемия гриппа в 1557 году потенциально была первым случаем, когда грипп был связан с выкидышами и смертью беременных женщин. [ 68 ] Пандемия гриппа 1580 года возникла летом в Азии, распространилась на Африку, затем на Европу и, наконец, на Америку. [ 60 ] К концу XVI века грипп стал восприниматься как специфическое, узнаваемое заболевание с эпидемическими и эндемическими формами. [ 64 ] В 1648 году было обнаружено, что лошади тоже болеют гриппом. [ 67 ]
Данные о гриппе после 1700 года более точны, поэтому после этого момента легче идентифицировать пандемии гриппа. [ 69 ] Первая пандемия гриппа XVIII века началась весной 1729 года в России и в течение трех лет распространялась по всему миру отчетливыми волнами, причем более поздние были более смертоносными. Другая пандемия гриппа произошла в 1781–1782 годах и началась осенью в Китае. [ 60 ] В результате этой пандемии грипп стал ассоциироваться с внезапными вспышками лихорадочных заболеваний. [ 69 ] Следующая пандемия гриппа произошла с 1830 по 1833 год и началась зимой в Китае. Эта пандемия имела высокий уровень заболеваемости, но уровень смертности был низким. [ 34 ] [ 60 ]
Незначительная пандемия гриппа произошла с 1847 по 1851 год одновременно с третьей пандемией холеры и была первой пандемией гриппа, произошедшей с регистрацией естественной статистики, поэтому смертность от гриппа была четко зафиксирована впервые. [ 69 ] Чума птиц (ныне признанная высокопатогенным птичьим гриппом) была признана в 1878 году. [ 69 ] и вскоре был связан с передачей вируса людям. [ 67 ] Ко времени пандемии 1889 года , которая, возможно, была вызвана штаммом H2N2, [ 70 ] грипп стал легко узнаваемой болезнью. [ 67 ]
Микробный агент, ответственный за грипп, был ошибочно идентифицирован в 1892 году Р.Ф. Дж. Пфайффером как вид бактерий Haemophilus influenzae , в названии которого сохранилось слово «грипп». [ 67 ] [ 69 ] С 1901 по 1903 год итальянские и австрийские исследователи смогли доказать, что птичий грипп, названный тогда «птичьей чумой», [ 35 ] Был вызван микроскопическим агентом, меньшим, чем бактерии, в результате использования фильтров со слишком маленькими порами, чтобы бактерии могли пройти через них. Однако фундаментальные различия между вирусами и бактериями еще не были полностью поняты. [ 69 ]

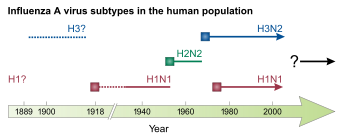
С 1918 по 1920 год пандемия испанского гриппа стала самой разрушительной пандемией гриппа и одной из самых смертоносных пандемий в истории. Пандемия, вызванная штаммом гриппа А H1N1, [ 72 ] вероятно, началось в Соединенных Штатах, а затем распространилось по всему миру через солдат во время и после Первой мировой войны . Первоначальная волна в первой половине 1918 года была относительно незначительной и напоминала прошлые пандемии гриппа, но вторая волна, случившаяся позднее в том же году, имела гораздо более высокий уровень смертности. [ 60 ] Третья волна с более низкой смертностью произошла во многих местах через несколько месяцев после второй. [ 34 ] По оценкам, к концу 1920 года около трети [ 13 ] до половины всех людей в мире были инфицированы, причем десятки миллионов человек умерли, причем непропорционально молодые люди. [ 60 ] Во время пандемии 1918 года был четко определен респираторный путь передачи инфекции. [ 34 ] и было показано, что грипп вызывается «проходцем через фильтр», а не бактерией, но еще десять лет не было единого мнения о причине гриппа, и исследования гриппа пошли на спад. [ 69 ] После пандемии H1N1 циркулировал среди людей в сезонной форме. [ 1 ] до следующей пандемии. [ 69 ]
В 1931 году Ричард Шоп опубликовал три статьи, в которых вирус был назван причиной свиного гриппа, недавно обнаруженной болезни среди свиней, которая характеризовалась во время второй волны пандемии 1918 года. [ 68 ] [ 69 ] Исследования Шопа активизировали исследования человеческого гриппа, и с тех пор в результате исследований гриппа возникли многие достижения в области вирусологии, серологии, иммунологии, экспериментальных моделей на животных, вакцинологии и иммунотерапии. [ 69 ] Всего через два года после открытия вирусов гриппа, в 1933 году, вирус гриппа А был идентифицирован как возбудитель человеческого гриппа. [ 68 ] [ 73 ] Подтипы вируса гриппа А были открыты в 1930-х годах. [ 69 ] а вирус гриппа B был открыт в 1940 году. [ 23 ]
Во время Второй мировой войны правительство США работало над разработкой инактивированных вакцин против гриппа, в результате чего в 1945 году в США была лицензирована первая вакцина против гриппа. [ 1 ] Вирус гриппа С был открыт два года спустя, в 1947 году. [ 23 ] В 1955 году было подтверждено, что птичий грипп вызывается вирусом гриппа А. [ 35 ] После Второй мировой войны произошло четыре пандемии гриппа. Первым из них был азиатский грипп с 1957 по 1958 год, вызванный штаммом H2N2. [ 1 ] [ 52 ] и начинается в китайской Юньнань провинции . Число смертей, вероятно, превысило один миллион, в основном среди очень молодых и очень старых людей. [ 60 ] Это была первая пандемия гриппа, произошедшая при наличии глобальной системы эпиднадзора и лабораторий, способных изучать новый вирус гриппа. [ 34 ] После пандемии H2N2 стал подтипом вируса гриппа А, ответственным за сезонный грипп. [ 1 ] Первый противовирусный препарат против гриппа, амантадин , был одобрен в 1966 году, а с 1990-х годов стали использоваться дополнительные противовирусные препараты. [ 4 ]
В 1968 году H3N2 был завезен людям в результате реаранжировки птичьего штамма H3N2 и штамма H2N2, циркулировавшего у людей. Новый штамм H3N2 появился в Гонконге и распространился по всему миру, вызвав пандемию гонконгского гриппа , которая привела к гибели 500 000–2 000 000 человек. Это была первая пандемия, которая значительно распространилась воздушным транспортом. [ 3 ] [ 34 ] H2N2 и H3N2 циркулировали совместно после пандемии до 1971 года, когда распространенность H2N2 снизилась и был полностью заменен H3N2. [ 3 ] В 1977 году H1N1 вновь появился у людей, возможно, после того, как он был выпущен из морозильной камеры в результате несчастного случая в лаборатории, и вызвал псевдопандемию . [ 34 ] [ 69 ] Этот штамм H1N1 был антигенно похож на штаммы H1N1, циркулировавшие до 1957 года. С 1977 года как H1N1, так и H3N2 циркулируют среди людей как часть сезонного гриппа. [ 1 ] В 1980 году была введена система классификации, используемая для подтипирования вирусов гриппа. [ 74 ]

В какой-то момент вирус гриппа B разделился на два штамма, названные B/Victoria-like и B/Yamagata-like, оба из которых циркулируют среди людей с 1983 года. [ 23 ]
В 1996 году высокопатогенный подтип гриппа А H5N1 был обнаружен у гусей в провинции Гуандун , Китай. [ 35 ] а год спустя появился в птицеводстве в Гонконге, постепенно распространившись оттуда по всему миру. Тогда произошла небольшая вспышка вируса H5N1 среди людей в Гонконге. [ 45 ] и спорадические случаи заболевания людей произошли с 1997 года с высоким уровнем смертности. [ 19 ] [ 54 ]
Самой последней пандемией гриппа была пандемия свиного гриппа в 2009 году , которая возникла в Мексике и привела к сотням тысяч смертей. [ 34 ] Заболевание было вызвано новым штаммом H1N1, который представлял собой реассортацию вирусов человеческого, свиного и птичьего гриппа. [ 20 ] [ 4 ] Пандемия 2009 года привела к замене ранее находившихся в обращении штаммов H1N1 новым штаммом, но не другими вирусами гриппа. Следовательно, вирусы H1N1, H3N2 и обе линии вируса гриппа B циркулируют в сезонной форме после пандемии 2009 года. [ 1 ] [ 34 ] [ 35 ]
В 2011 году вирус гриппа D был обнаружен у свиней в Оклахоме, США, а крупный рогатый скот позже был идентифицирован как основной резервуар вируса гриппа D. [ 12 ] [ 23 ]
В том же году, [ 54 ] птичий H7N9 был обнаружен в Китае и начал вызывать инфекции среди людей в 2013 году, начиная с Шанхая и Аньхоя и оставаясь в основном в Китае. Высокопатогенный H7N9 появился где-то в 2016 году и иногда случайно заражал людей. , реже заражали людей с 1990-х годов, Другие вирусы птичьего гриппа, включая H5N1, H5N5, H5N6 , H5N8 , H6N1 , H7N2 , H7N7 и H10N7 и начали распространяться по большей части мира с 2010-х годов. [ 19 ] Будущие пандемии гриппа, которые могут быть вызваны вирусом гриппа птичьего происхождения, [ 35 ] рассматриваются как почти неизбежные, а растущая глобализация облегчила распространение пандемического вируса. [ 34 ] поэтому предпринимаются постоянные усилия по подготовке к будущим пандемиям. [ 68 ] и улучшить профилактику и лечение гриппа. [ 1 ]
Этимология
Слово грипп происходит от итальянского слова influenza , от средневекового латинского influentia , первоначально означавшего «посещение» или «влияние». Такие термины, как influenza di freddo , что означает «влияние холода», и influenza di stelle , что означает «влияние звезд», засвидетельствованы с 14 века. Последний указывал на причину болезни, которую в то время некоторые приписывали неблагоприятным астрологическим условиям. Еще в 1504 году грипп стал означать «посещение» или «вспышку» какой-либо болезни, поражающей одновременно множество людей в одном месте. Во время вспышки гриппа в 1743 году, которая началась в Италии и распространилась по всей Европе, это слово достигло английского языка и было переведено на английский язык в произношении. С середины 1800-х годов слово «грипп» также использовалось для обозначения тяжелых простудных заболеваний. [ 75 ] [ 76 ] [ 77 ] Сокращенная форма слова «грипп» впервые засвидетельствована в 1839 году как грипп, а правописание гриппа подтверждено в 1893 году. [ 78 ] Другие названия, которые использовались для гриппа, включают эпидемический катар , la Grippe с французского , потливость и, особенно когда речь идет о пандемическом штамме 1918 года, испанскую лихорадку . [ 79 ]
У животных
Птицы
Водные птицы, такие как утки, гуси, кулики и чайки, являются основным резервуаром вирусов гриппа А (IAV). [ 19 ] [ 20 ]
Из-за воздействия птичьего гриппа на экономически важные птицефермы в 1981 году была разработана система классификации, которая разделяла штаммы птичьего вируса на высокопатогенные (и, следовательно, потенциально требующие решительных мер контроля) и низкопатогенные. Тест на это основан исключительно на воздействии на цыплят: штамм вируса является высокопатогенным птичьим гриппом (ВПГП), если 75% или более цыплят умирают после преднамеренного заражения им. Альтернативной классификацией является низкопатогенный птичий грипп (LPAI), который вызывает легкие симптомы или не вызывает их вообще. [ 80 ] С тех пор эта система классификации была модифицирована с учетом структуры белка гемагглютинина вируса. [ 81 ] На генетическом уровне AIV можно идентифицировать как вирус HPAI, если он имеет многоосновный сайт расщепления в белке НА, который содержит дополнительные остатки в гене НА. [ 20 ] [ 35 ] Другие виды птиц, особенно водоплавающие, могут заразиться вирусом ВПГП, не проявляя серьезных симптомов, и могут распространять инфекцию на большие расстояния; Точные симптомы зависят от вида птицы и штамма вируса. [ 80 ] Классификация штамма птичьего вируса как HPAI или LPAI не позволяет предсказать, насколько серьезным может быть заболевание, если оно заразит людей или других млекопитающих. [ 80 ] [ 82 ]
Симптомы инфекции HPAI у кур включают отсутствие энергии и аппетита, снижение яйценоскости, яйца с мягкой или деформированной скорлупой, отек головы, гребня, сережек и скакательных суставов, пурпурное окрашивание сережек, гребней и ножек, выделения из носа, кашель. , чихание, нарушение координации и диарея; птицы, инфицированные вирусом HPAI, также могут внезапно умереть без каких-либо признаков инфекции. [ 53 ] Известные вирусы HPAI включают грипп A (H5N1) и A (H7N9). Вирусы HPAI стали основным бременем болезней в 21 веке, что привело к гибели большого количества птиц. В случае H7N9 некоторые циркулирующие штаммы изначально были низкопатогенными, но стали высокопатогенными в результате мутации с приобретением многоосновного сайта расщепления НА. Птичий H9N2 также вызывает беспокойство, поскольку, хотя он и низкопатогенен, он является частым донором генов H5N1 и H7N9 во время рекомбинации. [ 1 ]
Перелетные птицы могут распространять грипп на большие расстояния. Примером этого может служить случай, когда штамм H5N1 в 2005 году заразил птиц на озере Цинхай в Китае, которое является местом остановки и размножения многих перелетных птиц, что впоследствии распространило вирус более чем на 20 стран Азии, Европы и Ближнего Востока. [ 19 ] [ 35 ] ВПЧ могут передаваться от диких птиц домашним уткам на свободном выгуле и, в свою очередь, домашней птице через загрязненную воду, аэрозоли и фомиты. [ 1 ] Таким образом, утки выступают в качестве ключевых промежуточных звеньев между дикими и домашними птицами. [ 35 ] Передача вируса домашней птице обычно происходит на приусадебных фермах и на рынках живых животных, где несколько видов взаимодействуют друг с другом. Оттуда вирус AIV может распространиться на птицефабрики при отсутствии адекватной биобезопасности. Среди домашней птицы передача ВПГП происходит через аэрозоли и зараженные фекалии. [ 1 ] клетки, корма и мертвые животные. [ 19 ] Произошла обратная передача вирусов HPAI от домашних птиц диким птицам, что привело к массовой гибели и межконтинентальному распространению. [ 20 ]
Иногда вирусы AIV заражали людей через аэрозоли, фомиты и загрязненную воду. [ 1 ] Направленная передача от диких птиц встречается редко. [ 35 ] Вместо этого большая часть передачи происходит через домашнюю птицу, в основном кур, уток и гусей, а также множество других птиц, таких как цесарки, куропатки, фазаны и перепела. [ 20 ] Основным фактором риска заражения AIV является контакт с птицами на фермах и рынках живой птицы. [ 19 ] Обычно инкубационный период заражения ВГП составляет 3–5 дней, но может достигать 9 дней. H5N1 и H7N9 вызывают тяжелое заболевание нижних дыхательных путей, тогда как другие ВГВ, такие как H9N2, вызывают более легкое заболевание верхних дыхательных путей, обычно с конъюнктивитом. [ 1 ] Имела место ограниченная передача птичьих подтипов H2, H5-7, H9 и H10 от одного человека к другому через дыхательные капли, аэрозоли и фомиты, но устойчивой передачи AIV от человека к человеку не произошло. [ 1 ] [ 2 ]
Свиньи

Грипп свиней — это респираторное заболевание, похожее на грипп у людей, которое встречается во всем мире. Часто встречаются бессимптомные инфекции. Симптомы обычно появляются через 1–3 дня после заражения и включают лихорадку, вялость, анорексию, потерю веса, затрудненное дыхание, кашель, чихание и выделения из носа. У свиноматок беременность может прерваться. Осложнения включают вторичные инфекции и потенциально смертельную бронхопневмонию . Свиньи становятся заразными в течение дня после заражения и обычно распространяют вирус в течение 7–10 дней, что может быстро распространяться внутри стада. Свиньи обычно выздоравливают в течение 3–7 дней после появления симптомов. Меры профилактики и контроля включают инактивированные вакцины и выбраковку инфицированных стад. Вирус гриппа А подтипов H1N1, H1N2 и H3N2 обычно вызывает свиной грипп. [ 83 ]
Некоторые вирусы гриппа А могут передаваться аэрозольным путем от свиней к человеку и наоборот. [ 1 ] Свиньи вместе с летучими мышами и перепелами, [ 23 ] признаны сосудом для смешивания вирусов гриппа, поскольку в их дыхательных путях имеются рецепторы сиаловых кислот α-2,3 и α-2,6. По этой причине свиней могут инфицировать вирусы гриппа как птиц, так и млекопитающих. При коинфекции возможна рекомбинация. [ 20 ] Ярким примером этого стала рекомбинация вирусов свиного, птичьего и человеческого гриппа, вызвавшая пандемию гриппа 2009 года. [ 20 ] [ 4 ] Передача инфекции от человека к свиньям встречается чаще, чем от свиней к человеку. [ 20 ]
Другие животные
Вирусы гриппа были обнаружены у многих других животных, включая крупный рогатый скот, лошадей, собак, кошек и морских млекопитающих. Почти все вирусы гриппа А, очевидно, произошли от предковых вирусов птиц. Исключением являются гриппоподобные вирусы летучих мышей, происхождение которых неясно. Эти вирусы летучих мышей имеют подтипы HA и NA H17, H18, N10 и N11. H17N10 и H18N11 не способны реассортироваться с другими вирусами гриппа А, но они все еще способны реплицироваться у других млекопитающих. [ 1 ]
Вирусы лошадиного гриппа А включают H7N7 и две линии. [ 1 ] H3N8 . Однако H7N7 не выявлялся у лошадей с конца 1970-х годов. [ 30 ] так что, возможно, он вымер у лошадей. [ 20 ] H3N8 у лошадей распространяется аэрозольным путем и вызывает респираторные заболевания. [ 1 ] Лошадиный H3N8 преимущественно связывается с α-2,3 сиаловыми кислотами, поэтому лошадей обычно считают тупиками-хозяевами, но произошла передача вируса собакам и верблюдам, что вызывает опасения, что лошади могут смешивать сосуды для рекомбинации. У собак единственными циркулирующими вирусами гриппа А являются лошадиный H3N8 и птичий H3N2. Реассоциации собачьего H3N8 с другими подтипами не наблюдалось. H3N2 имеет гораздо более широкий круг хозяев и может реассоциироваться с H1N1 и H5N1. Изолированный случай заражения H6N1, вероятно, от курицы, был обнаружен при заражении собаки, поэтому у собак могут возникнуть другие вирусы AIV. [ 20 ]
Широкий спектр других млекопитающих пострадал от вируса птичьего гриппа А, как правило, из-за поедания инфицированных птиц. [ 84 ] Были случаи, когда могла произойти передача заболевания между млекопитающими, включая тюленей и коров. [ 85 ] [ 86 ] [ 30 ] Были идентифицированы различные мутации, связанные с адаптацией AIV к млекопитающим. Поскольку белки HA различаются по тому, с какими сиаловыми кислотами они связываются, мутации в сайте связывания рецептора HA могут позволить AIV инфицировать млекопитающих. Другие мутации включают мутации, влияющие на то, какие белки NA сиаловых кислот расщепляются, и мутацию в субъединице полимеразы PB2, которая улучшает переносимость более низких температур в дыхательных путях млекопитающих и усиливает сборку RNP за счет стабилизации связывания NP и PB2. [ 20 ]
Вирус гриппа В в основном встречается у людей, но также обнаруживается у свиней, собак, лошадей и тюленей. [ 23 ] Аналогичным образом, вирус гриппа С в первую очередь заражает людей, но наблюдался у свиней, собак, крупного рогатого скота и дромадеров. [ 12 ] [ 23 ] Вирус гриппа D вызывает гриппоподобное заболевание у свиней, но его влияние на его естественный резервуар - крупный рогатый скот - относительно неизвестно. Он может сам по себе вызывать респираторное заболевание, напоминающее человеческий грипп, или может быть частью комплекса респираторных заболеваний крупного рогатого скота (BRD) с другими патогенами во время коинфекции. BRD вызывает беспокойство в отрасли крупного рогатого скота, поэтому возможное участие вируса гриппа D в BRD привело к исследованию вакцин для крупного рогатого скота, которые могут обеспечить защиту от вируса гриппа D. [ 23 ] [ 26 ] В обращении находятся две антигенные линии: D/swine/Oklahoma/1334/2011 (D/OK) и D/bovine/Oklahoma/660/2013 (D/660). [ 23 ]
Ссылки
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а к ап ак с как в В из хорошо топор является тот нет бб до нашей эры др. быть парень бг чб с минет БК с бм млрд быть б.п. БК бр бс БТ этот бв б бх к бз что КБ копия компакт-диск Этот см. cg ч Там СиДжей ск кл см CN Краммер Ф., Смит Г.Дж., Фушье Р.А., Пейрис М., Кедзерска К., Доэрти ПК. и др. (июнь 2018 г.). «Грипп» . Обзоры природы. Праймеры по болезням . 4 (1): 3. doi : 10.1038/s41572-018-0002-y . ПМК 7097467 . ПМИД 29955068 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м Саутто Г.А., Кирхенбаум Г.А., Росс Т.М. (январь 2018 г.). «На пути к универсальной вакцине против гриппа: разные подходы к одной цели» . Вирусологический журнал . 15 (1): 17. дои : 10.1186/s12985-017-0918-y . ПМЦ 5785881 . ПМИД 29370862 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п Аллен Джей Ди, Росс ТМ (2018). «Вирусы гриппа H3N2 у человека: вирусные механизмы, эволюция и оценка» . Человеческие вакцины и иммунотерапия . 14 (8): 1840–1847. дои : 10.1080/21645515.2018.1462639 . ПМК 6149781 . ПМИД 29641358 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д Лампехо Т. (июль 2020 г.). «Грипп и противовирусная резистентность: обзор» . Европейский журнал клинической микробиологии и инфекционных заболеваний . 39 (7): 1201–1208. дои : 10.1007/s10096-020-03840-9 . ПМЦ 7223162 . ПМИД 32056049 .
- ^ «Симптомы и диагностика гриппа» . Центры США по контролю и профилактике заболеваний (CDC) . 10 июля 2019 года. Архивировано из оригинала 27 декабря 2019 года . Проверено 24 января 2020 г.
- ^ «Симптомы и осложнения гриппа» . Центры США по контролю и профилактике заболеваний (CDC). 26 февраля 2019 года. Архивировано из оригинала 1 августа 2020 года . Проверено 6 июля 2019 г.
- ^ Позвоните С.А., Волленвейдеру М.А., Хорнунгу К.А., Симелу Д.Л., МакКинни В.П. (февраль 2005 г.). «Болеет ли этот пациент гриппом?». ДЖАМА . 293 (8): 987–997. дои : 10.1001/jama.293.8.987 . ПМИД 15728170 .
- ^ Аллан ГМ, Эрролл Б (февраль 2014 г.). «Профилактика и лечение простуды: осмысление доказательств» . CMAJ . 186 (3): 190–9. дои : 10.1503/cmaj.121442 . ПМЦ 3928210 . ПМИД 24468694 .
- ^ «Простуда против гриппа» . 11 августа 2016 года. Архивировано из оригинала 6 января 2017 года . Проверено 5 января 2017 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В Дхармапалан Д. (октябрь 2020 г.). «Грипп» . Индийский журнал педиатрии . 87 (10): 828–832. дои : 10.1007/s12098-020-03214-1 . ПМК 7091034 . ПМИД 32048225 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление Гебрехевет С., Макферсон П., Хо А. (декабрь 2016 г.). «Грипп» . БМЖ . 355 : i6258. дои : 10.1136/bmj.i6258 . ПМК 5141587 . ПМИД 27927672 .
- ^ Перейти обратно: а б с д и ж г час я дж Седердал Б.К., СП Уильямс (январь 2020 г.). «Эпидемиология и клиническая характеристика вируса гриппа С» . Вирусы . 12 (1): 89. дои : 10.3390/v12010089 . ПМК 7019359 . ПМИД 31941041 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д Петерандерл С., Герольд С., Шмольдт С. (август 2016 г.). «Инфекция вирусом гриппа человека» . Семинары по респираторной медицине и медицине интенсивной терапии . 37 (4): 487–500. дои : 10.1055/s-0036-1584801 . ПМК 7174870 . ПМИД 27486731 .
- ^ Триггл Н (28 сентября 2021 г.). «Как показывают исследования, люди также страдают «затяжным гриппом» . Новости BBC онлайн . Архивировано из оригинала 25 марта 2022 года . Проверено 10 июня 2024 г.
- ^ Зауэрвейн К. (14 декабря 2023 г.). « Длительный грипп» возник как последствие, аналогичное длительному COVID» . Медицинский факультет Вашингтонского университета в Сент-Луисе (пресс-релиз). Архивировано из оригинала 10 июня 2024 года . Проверено 10 июня 2024 г.
- ^ Се Ю, Чой Т, Аль-Али З (март 2024 г.). «Долгосрочные результаты после госпитализации по поводу COVID-19 по сравнению с сезонным гриппом: когортное исследование». «Ланцет». Инфекционные болезни . 24 (3): 239–255. дои : 10.1016/S1473-3099(23)00684-9 . ПМИД 38104583 .
- ^ Перейти обратно: а б с д и ж г час я дж к Калил А.С., Томас П.Г. (июль 2019 г.). «Критические заболевания, связанные с вирусом гриппа: патофизиология и эпидемиология» . Критическая помощь . 23 (1): 258. дои : 10.1186/s13054-019-2539-x . ПМК 6642581 . ПМИД 31324202 .
- ^ «Таксономия вирусов: выпуск 2019 г.» . Международный комитет по таксономии вирусов. Архивировано из оригинала 20 марта 2020 года . Проверено 9 марта 2021 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот Ли Ю.Т., Линстер М., Менденхолл И.Х., Су Ю.К., Смит Г.Дж. (декабрь 2019 г.). «Вирусы птичьего гриппа у людей: уроки прошлых вспышек» . Британский медицинский бюллетень . 132 (1): 81–95. дои : 10.1093/bmb/ldz036 . ПМК 6992886 . PMID 31848585 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н Джозеф У, Су Ю.К., Виджайкришна Д., Смит Г.Дж. (январь 2017 г.). «Экология и адаптивная эволюция межвидовой передачи гриппа А» . Грипп и другие респираторные вирусы . 11 (1): 74–84. дои : 10.1111/irv.12412 . ПМК 5155642 . ПМИД 27426214 .
- ^ CDC (1 февраля 2024 г.). «Вирусы гриппа типа А» . Центры по контролю и профилактике заболеваний . Проверено 3 мая 2024 г.
- ^ «FluGlobalNet – Птичий грипп» . science.vla.gov.uk . Проверено 5 июня 2024 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с Аша К., Кумар Б. (февраль 2019 г.). «Новая угроза вируса гриппа D: что мы знаем на данный момент!» . Журнал клинической медицины . 8 (2): 192. дои : 10.3390/jcm8020192 . ПМК 6406440 . ПМИД 30764577 .
- ^ «Подтипы гриппа А и пораженные виды | Сезонный грипп (грипп) | CDC» . Центры по контролю и профилактике заболеваний . 17 июня 2024 г. Проверено 18 июня 2024 г.
- ^ Куцакос М., Уитли А.К., Лори К., Кент С.Дж., Рокман С. (декабрь 2021 г.). «Вымирание линий гриппа во время пандемии COVID-19?» . Обзоры природы. Микробиология . 19 (12): 741–742. дои : 10.1038/s41579-021-00642-4 . ПМЦ 8477979 . ПМИД 34584246 .
- ^ Перейти обратно: а б с д и ж г час я дж к Су С, Фу X, Ли Г, Керлин Ф, Вейт М (ноябрь 2017 г.). «Новый вирус гриппа D: эпидемиология, патология, эволюция и биологические характеристики» . Вирулентность . 8 (8): 1580–1591. дои : 10.1080/21505594.2017.1365216 . ПМК 5810478 . ПМИД 28812422 .
- ^ «70 лет ГСЭГО – Глобальной системе эпиднадзора за гриппом и реагирования» . Всемирная организация здравоохранения . 19 сентября 2022 г. Проверено 13 июня 2024 г.
- ^ «Пересмотр системы номенклатуры вирусов гриппа: Меморандум ВОЗ» . Бюллетень Всемирного органа здравоохранения . 58 (4): 585–591. 1980. ПМК 2395936 . ПМИД 6969132 .
Этот Меморандум был составлен подписантами, перечисленными на странице 590, по случаю встречи, состоявшейся в Женеве в феврале 1980 года.
- ^ Перейти обратно: а б Техническое примечание: Номенклатура вирусов гриппа . Панамериканская организация здравоохранения (отчет). 22 ноября 2022 года. Архивировано из оригинала 10 августа 2023 года . Проверено 27 мая 2024 г.
- ^ Перейти обратно: а б с д и ж г час я МакКоли Дж.В., Хонго С., Каверин Н.В., Кохс Г., Ламб Р.А., Матросович М.Н. и др. (2011). «Ортомиксовирусиды» . Международный комитет по таксономии вирусов. Архивировано из оригинала 8 августа 2022 года . Проверено 9 марта 2021 г.
- ^ Перейти обратно: а б с д и ж г Шим Дж.М., Ким Дж., Тенсон Т., Мин Дж.Ю., Кайнов Д.Е. (август 2017 г.). «Инфекция вирусом гриппа, реакция интерферона, противовирусная реакция и апоптоз» . Вирусы . 9 (8): 223. дои : 10.3390/v9080223 . ПМК 5580480 . ПМИД 28805681 .
- ^ Перейти обратно: а б с д и Хао В., Ван Л., Ли С. (октябрь 2020 г.). «Роль неструктурных белков вируса гриппа А» . Патогены . 9 (10): 812. doi : 10.3390/pathogens9100812 . ПМЦ 7600879 . ПМИД 33023047 .
- ^ Дадонайте Б., Виджаякришнан С., Фодор Э., Бхелла Д., Хатчинсон Э.К. (август 2016 г.). «Нитчатые вирусы гриппа» . Журнал общей вирусологии . 97 (8): 1755–1764. дои : 10.1099/jgv.0.000535 . ПМЦ 5935222 . ПМИД 27365089 .
- ^ Перейти обратно: а б с д и ж г час я дж Сондерс-Гастингс PR, Кревски Д. (декабрь 2016 г.). «Обзор истории пандемического гриппа: понимание закономерностей возникновения и передачи» . Патогены . 5 (4): 66. doi : 10.3390/pathogens5040066 . ПМК 5198166 . ПМИД 27929449 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Лисетт С.Дж., Дюшатель Ф., Дигард П. (июнь 2019 г.). «Краткая история птичьего гриппа» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 374 : 20180257.doi : (1775 ) 10.1098/rstb.2018.0257 . ПМК 6553608 . ПМИД 31056053 .
- ^ «Глобальная система эпиднадзора за гриппом и реагирования (ГСЭГО)» . Всемирная организация здравоохранения. Архивировано из оригинала 3 октября 2011 года . Проверено 24 марта 2021 г.
- ^ Брур С., Кэмпбелл Х., Хирве С., Хейг С., Джексон С., Моен А. и др. (ноябрь 2020 г.). «Использование глобальной системы эпиднадзора за гриппом и реагирования на него для глобального эпиднадзора за респираторно-синцитиальными вирусами: возможности и проблемы» . Грипп и другие респираторные вирусы . 14 (6): 622–629. дои : 10.1111/irv.12672 . ПМЦ 7578328 . ПМИД 31444997 .
 В эту статью включен текст , доступный по лицензии CC BY 4.0 .
В эту статью включен текст , доступный по лицензии CC BY 4.0 .
- ^ «70 лет ГСЭГО – Глобальной системе эпиднадзора за гриппом и реагирования» . Всемирная организация здравоохранения . 19 сентября 2022 г. Проверено 13 июня 2024 г.
- ^ Перейти обратно: а б с д Каттер Дж.С., Спронкен М.И., Фраай П.Л., Фушье Р.А., Херфст С. (февраль 2018 г.). «Пути передачи респираторных вирусов среди человека» . Современное мнение в вирусологии . 28 : 142–151. дои : 10.1016/j.coviro.2018.01.001 . ПМК 7102683 . ПМИД 29452994 .
- ^ Перейти обратно: а б с Киллингли Б., Нгуен-Ван-Там Дж. (сентябрь 2013 г.). «Пути передачи гриппа» . Грипп и другие респираторные вирусы . 7 (Приложение 2): 42–51. дои : 10.1111/irv.12080 . ПМЦ 5909391 . ПМИД 24034483 .
- ^ Вебер Т.П., Стилианакис Н.И. (ноябрь 2008 г.). «Инактивация вирусов гриппа А в окружающей среде и пути передачи: критический обзор» . Журнал инфекции . 57 (5): 361–373. дои : 10.1016/j.jinf.2008.08.013 . ПМЦ 7112701 . ПМИД 18848358 .
- ^ Перейти обратно: а б Морияма М., Хугентоблер В.Дж., Ивасаки А. (сентябрь 2020 г.). «Сезонность респираторных вирусных инфекций» . Ежегодный обзор вирусологии . 7 (1): 83–101. doi : 10.1146/annurev-virology-012420-022445 . ПМИД 32196426 .
- ^ Ю Э (февраль 2014 г.). «Исследование конформации и сцепления специфических олигосахаридов, связанных с H1N1, H5N1 и человеческим гриппом, для разработки второго препарата Тамифлю» . Биомолекулы и терапия . 22 (2): 93–99. дои : 10.4062/biomolther.2014.005 . ПМЦ 3975476 . ПМИД 24753813 .
- ^ Шао В., Ли Х, Горая М.У., Ван С., Чен Дж.Л. (август 2017 г.). «Эволюция вируса гриппа А путем мутации и реассортации» . Международный журнал молекулярных наук . 18 8):1650.doi : ( 10.3390/ijms18081650 . ПМК 5578040 . ПМИД 28783091 .
- ^ Перейти обратно: а б Штайнхауэр Д.А. (май 1999 г.). «Роль расщепления гемагглютинина в патогенности вируса гриппа» . Вирусология . 258 (1): 1–20. дои : 10.1006/виро.1999.9716 . ПМИД 10329563 .
- ^ Эйнав Т., Джентлес Л.Е., Блум Дж.Д. (июль 2020 г.). «SnapShot: Грипп в цифрах» . Клетка . 182 (2): 532–532.e1. doi : 10.1016/j.cell.2020.05.004 . ПМИД 32707094 . S2CID 220715148 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот Чоу Э.Дж., Дойл Дж.Д., Уеки Т.М. (июнь 2019 г.). «Критические заболевания, связанные с вирусом гриппа: профилактика, диагностика, лечение» . Критическая помощь . 23 (1): 214. doi : 10.1186/s13054-019-2491-9 . ПМК 6563376 . ПМИД 31189475 .
- ^ Трегонинг Дж.С., Рассел Р.Ф., Киннер Э. (март 2018 г.). «Адъювантные вакцины против гриппа» . Человеческие вакцины и иммунотерапия . 14 (3): 550–564. дои : 10.1080/21645515.2017.1415684 . ПМЦ 5861793 . ПМИД 29232151 .
- ^ Перейти обратно: а б Принципи Н., Эспозито С. (март 2018 г.). «Защита детей от гриппа: новые проблемы» . Человеческие вакцины и иммунотерапия . 14 (3): 750–757. дои : 10.1080/21645515.2017.1279772 . ПМК 5861800 . ПМИД 28129049 .
- ^ Барр И.Г., Донис Р.О., Кац Дж.М., МакКоли Дж.В., Одагири Т., Трусхайм Х. и др. (октябрь 2018 г.). «Гриппозные вакцины, полученные из клеточных культур, в тяжелый эпидемический сезон 2017–2018 гг.: шаг к повышению эффективности вакцин против гриппа» . НПЖ Вакцины . 3 : 44. doi : 10.1038/s41541-018-0079-z . ПМК 6177469 . ПМИД 30323955 .
- ^ Перейти обратно: а б с Джефферсон Т., Дули Л., Феррони Э., Аль-Ансари Л.А., ван Дрил М.Л., Бавазир Г.А. и др. (январь 2023 г.). «Физические вмешательства для прекращения или уменьшения распространения респираторных вирусов» . Кокрановская база данных систематических обзоров . 1 (1): CD006207. дои : 10.1002/14651858.CD006207.pub6 . ПМЦ 9885521 . ПМИД 36715243 .
- ^ Перейти обратно: а б Сондерс-Гастингс П., Криспо Дж.А., Сикора Л., Кревски Д. (сентябрь 2017 г.). «Эффективность мер индивидуальной защиты в снижении передачи пандемического гриппа: систематический обзор и метаанализ» . Эпидемии . 20 : 1–20. дои : 10.1016/j.epidem.2017.04.003 . HDL : 10393/38995 . ПМИД 28487207 .
- ^ Перейти обратно: а б «Птичий грипп (AI)» . Служба инспекции здоровья животных и растений Министерства сельского хозяйства США. Архивировано из оригинала 23 марта 2021 года . Проверено 9 марта 2021 г.
- ^ Перейти обратно: а б с д и ж г час я дж к Вемула С.В., Чжао Дж., Лю Дж., Ван Х., Бисвас С., Хьюлетт И. (апрель 2016 г.). «Современные подходы к диагностике вирусных инфекций гриппа у человека» . Вирусы . 8 (4): 96. дои : 10.3390/v8040096 . ПМЦ 4848591 . ПМИД 27077877 .
- ^ Перейти обратно: а б «Грипп: Медицинская энциклопедия MedlinePlus» . Национальная медицинская библиотека США. Архивировано из оригинала 14 февраля 2010 года . Проверено 7 февраля 2010 г.
- ^ Бандай АЗ, Арул А., Винеш П., Сингх М.П., Гоял К., Сингх С. (июль 2021 г.). «Болезнь Кавасаки и грипп – новые уроки старых ассоциаций» . Клиническая ревматология . 40 (7): 2991–2999. дои : 10.1007/s10067-020-05534-1 . ПМЦ 7778392 . ПМИД 33387094 .
- ^ «Ланинамивир» . Национальный центр развития трансляционных наук. Архивировано из оригинала 28 августа 2021 года . Проверено 9 марта 2021 г.
- ^ «Оценочное количество заболеваний гриппом, посещений врача, госпитализаций и смертей в США – сезон гриппа 2018–2019 гг.» . Центры США по контролю и профилактике заболеваний (CDC) . 9 января 2020 года. Архивировано из оригинала 9 декабря 2020 года . Проверено 5 марта 2020 г.
- ^ «Ежегодно от респираторных заболеваний, связанных с сезонным гриппом, умирают до 650 000 человек» . Женева: Всемирная организация здравоохранения. 13 декабря 2017 года. Архивировано из оригинала 3 мая 2021 года . Проверено 16 июня 2021 г.
- ^ Перейти обратно: а б с д и ж г час я дж Поттер CW (октябрь 2001 г.). «История гриппа». Журнал прикладной микробиологии . 91 (4): 572–579. дои : 10.1046/j.1365-2672.2001.01492.x . ПМИД 11576290 . S2CID 26392163 .
- ^ Палезе П. (декабрь 2004 г.). «Грипп: старые и новые угрозы» . Природная медицина . 10 (12 доп.): S82–S87. дои : 10.1038/nm1141 . ПМИД 15577936 . S2CID 1668689 .
- ^ Мордини Э., Грин М., ред. (2013). Интернет-аналитика в чрезвычайных ситуациях в области общественного здравоохранения: раннее выявление и реагирование на кризисы, вызванные вспышками заболеваний . ИОС Пресс. п. 67. ИСБН 978-1614991755 .
- ^ Мартин П.М., Мартин-Гранель Э. (июнь 2006 г.). «2500-летняя эволюция термина эпидемия» . Новые инфекционные заболевания . 12 (6): 976–980. дои : 10.3201/eid1206.051263 . ПМЦ 3373038 . ПМИД 16707055 .
- ^ Перейти обратно: а б с Моренс Д.М., Норт М., Таубенбергер Дж.К. (декабрь 2010 г.). «Рассказы очевидцев о пандемии гриппа 1510 года в Европе» . Ланцет . 376 (9756): 1894–1895. дои : 10.1016/S0140-6736(10)62204-0 . ПМК 3180818 . ПМИД 21155080 .
- ^ Герра Ф (1988). «Самая ранняя американская эпидемия. Грипп 1493 года». История социальных наук . 12 (3): 305–325. дои : 10.2307/1171451 . JSTOR 1171451 . ПМИД 11618144 .
- ^ Герра Ф (1993). «Европейско-американский обмен». История и философия наук о жизни . 15 (3): 313–327. ПМИД 7529930 .
- ^ Перейти обратно: а б с д и Моренс Д.М., Таубенбергер Дж.К., Фолкерс Г.К., Фаучи А.С. (декабрь 2010 г.). «500-летие пандемического гриппа» . Клинические инфекционные болезни . 51 (12): 1442–1444. дои : 10.1086/657429 . ПМК 3106245 . ПМИД 21067353 .
- ^ Перейти обратно: а б с д Форум Института медицины (США) по микробным угрозам (2005 г.). «1: История гриппа» . В Кноблер С., Мак А., Махмуд А., Лемон С. (ред.). Угроза пандемического гриппа: готовы ли мы? Краткое содержание семинара (2005 г.) . Вашингтон, округ Колумбия: Издательство национальных академий. стр. 60–61. дои : 10.17226/11150 . ISBN 978-0-309-09504-4 . ПМИД 20669448 . Архивировано из оригинала 10 июня 2024 года . Проверено 10 марта 2021 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л Таубенбергер Дж. К., Халтин Й. В., Моренс Д. М. (2007). «Открытие и характеристика вируса пандемического гриппа 1918 года в историческом контексте» . Противовирусная терапия . 12 (4 части Б): 581–591. дои : 10.1177/135965350701200S02.1 . ПМК 2391305 . ПМИД 17944266 .
- ^ Вийген Л., Кейертс Э., Моэс Э., Толен И., Воллантс Э., Леми П. и др. (февраль 2005 г.). «Полная геномная последовательность человеческого коронавируса OC43: анализ молекулярных часов предполагает относительно недавнее событие передачи зоонозного коронавируса» . Журнал вирусологии . 79 (3): 1595–1604. doi : 10.1128/JVI.79.3.1595-1604.2005 . ПМК 544107 . ПМИД 15650185 .
- ^ Таубенбергер Дж. К., Моренс Д. М. (январь 2006 г.). «Грипп 1918 года: мать всех пандемий» . Новые инфекционные заболевания . 12 (1): 15–22. дои : 10.3201/eid1201.050979 . ПМЦ 3291398 . ПМИД 16494711 .
- ^ Таубенбергер Дж. К., Халтин Й. В., Моренс Д. М. (2007). «Открытие и характеристика вируса пандемического гриппа 1918 года в историческом контексте» . Противовирусная терапия . 12 (4 части Б): 581–591. дои : 10.1177/135965350701200S02.1 . ПМК 2391305 . ПМИД 17944266 .
- ^ Смит В., Эндрюс Ч., Лэйдлоу П. П. (1933). «Вирус, полученный от больных гриппом» . Ланцет . 2 (5732): 66–68. дои : 10.1016/S0140-6736(00)78541-2 .
- ^ Хайнен П.П. (15 сентября 2003 г.). «Свиной грипп: зооноз» . Ветеринары завтра . ISSN 1569-0830 . Архивировано из оригинала 11 февраля 2007 года . Проверено 28 декабря 2016 г.
- ^ Васкес-Эспиноса Э, Лагана С, Васкес Ф (октябрь 2020 г.). «Испанка и художественная литература» . Испанский журнал химиотерапии . 33 (5): 296–312. дои : 10.37201/req/049.2020 . ПМЦ 7528412 . ПМИД 32633114 .
- ^ «грипп (сущ.)» . Интернет-этимологический словарь. Архивировано из оригинала 28 января 2021 года . Проверено 9 марта 2021 г.
- ^ «грипп» . Оксфордский словарь английского языка. Архивировано из оригинала 16 октября 2021 года . Проверено 9 марта 2021 г.
- ^ «грипп (сущ.)» . Интернет-этимологический словарь. Архивировано из оригинала 21 июля 2021 года . Проверено 20 июля 2021 г.
- ^ Калишер CH (август 2009 г.). «Свиной грипп» . Хорватский медицинский журнал . 50 (4): 412–415. дои : 10.3325/cmj.2009.50.412 . ПМЦ 2728380 . ПМИД 19673043 .
- ^ Перейти обратно: а б с Александр DJ, Brown IH (апрель 2009 г.). «История высокопатогенного птичьего гриппа». Revue Scientifique et Technique . 28 (1): 19–38. doi : 10.20506/rst.28.1.1856 . ПМИД 19618616 .
- ^ «Информационный бюллетень по A(H5N1)» . www.ecdc.europa.eu . 15 июня 2017 года. Архивировано из оригинала 21 мая 2024 года . Проверено 21 мая 2024 г.
- ^ CDC (5 апреля 2024 г.). «Текущая ситуация с птичьим гриппом в США у людей» . Центры США по контролю и профилактике заболеваний (CDC) . Архивировано из оригинала 22 мая 2024 года . Проверено 22 мая 2024 г.
- ^ «Свиной грипп» . Всемирная организация здоровья животных. Архивировано из оригинала 4 марта 2021 года . Проверено 9 марта 2021 г.
- ^ «Птичий грипп «перекинулся» на выдр и лис в Великобритании» . Новости Би-би-си . 2 февраля 2023 г. Проверено 11 июня 2024 г.
- ^ «Исследование смертности тюленей от птичьего гриппа H5N1 выявило множественные линии | CIDRAP» . Центр исследований и политики в области инфекционных заболеваний . 15 марта 2023 г. Проверено 13 июня 2024 г.
- ^ Козлов М. (июнь 2024 г.). «Огромное количество вируса птичьего гриппа обнаружено в сыром молоке инфицированных коров». Природа . дои : 10.1038/d41586-024-01624-1 . ПМИД 38840011 .
Дальнейшее чтение
| Внешние видео | |
|---|---|
- Браун Дж. (2018). Грипп: столетняя охота за лечением самой смертельной болезни в истории . Нью-Йорк: Атрия. ISBN 978-1501181245 .
- Санкт-Муриц А.А. (1921). Грипп: краткая история гриппа в США, Европе, на Гавайях . Гонолулу, Гавайи, США Америка: Издательство Advertiser Publishing Co.