Гипопластический синдром левых отделов сердца
| Гипопластический синдром левых отделов сердца | |
|---|---|
| Другие имена | Цианотическая болезнь сердца – гипоплазия левых отделов сердца. [1] |
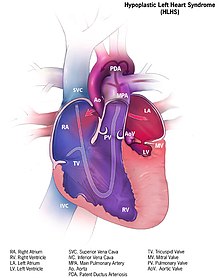 | |
| Иллюстрация сердца с синдромом гипоплазии левых отделов сердца | |
| Специальность | Кардиология |
Гипопластический синдром левых отделов сердца ( HLHS ) — редкий врожденный порок сердца , при котором левая половина сердца сильно недоразвита и неспособна поддерживать большой круг кровообращения. [2] По оценкам, на его долю приходится 2-3% всех врожденных пороков сердца. [3] Ранние признаки и симптомы включают плохое питание, цианоз и снижение пульса в конечностях. [4] Считается, что этиология является многофакторной и возникает в результате сочетания генетических мутаций и дефектов, приводящих к изменению кровотока в сердце. [5] [6] [7] Могут быть затронуты несколько структур, включая левый желудочек , аорту , аортальный клапан или митральный клапан , что приводит к снижению системного кровотока. [8]
Диагностика может быть поставлена пренатально с помощью УЗИ или вскоре после рождения с помощью эхокардиографии. [5] Первоначальное лечение направлено на поддержание проходимости артериального протока – соединения между легочной артерией и аортой, которое закрывается вскоре после рождения. [9] После этого пациенту в течение следующих нескольких лет жизни проводится трехэтапное паллиативное лечение. [10] Процедура Норвуда обычно проводится в течение нескольких дней после рождения. [10] Процедура Гленна обычно проводится в возрасте от трех до шести месяцев. [10] Наконец, процедура Фонтана проводится где-то в возрасте от двух до пяти лет. [10]
Если не лечить, пациенты с HLHS умирают в течение первых недель жизни, а 70% тех, кто перенес трехэтапную паллиативную операцию, достигают взрослого возраста. После операции у детей с HLHS обычно наблюдается задержка нервно-психического развития и моторики, а во взрослом возрасте они подвергаются повышенному риску сердечной недостаточности. [11] [12]
Эпидемиология
[ редактировать ]HLHS встречается примерно у 1 из 3841 живорождений в Соединенных Штатах или примерно у 1025 живорождений в год в США. [13] [14] В целом, по оценкам, он составляет 2-3% всех случаев врожденных пороков сердца и является наиболее частым пороком одного желудочка. [3] Считается, что оно чаще встречается у младенцев мужского пола, в 1,5 раза чаще, чем у младенцев женского пола. [15] Недавний систематический обзор выявил небольшое снижение распространенности HLHS с 0,689/1000 в 1995–1999 годах до 0,475/1000 в 2010–2017 годах. [3] Считается, что это связано с улучшением пренатального выявления и дородового консультирования, а также последующей беременности.
Признаки и симптомы
[ редактировать ]
Закрытие артериального протока в сердце, которое сильно недоразвито слева, приводит к цианозу и дыхательной недостаточности, которые могут прогрессировать до кардиогенного шока и смерти. Ранние симптомы могут включать плохое питание или цианоз, не реагирующий на введение кислорода. Периферический пульс может быть слабым, а конечности холодными на ощупь. [5]
HLHS часто сочетается с низким весом при рождении и преждевременными родами. [5]
У новорожденных с небольшим дефектом межпредсердной перегородки, называемым «рестриктивным», происходит неадекватное смешивание насыщенной кислородом и дезоксигенированной крови. У этих новорожденных быстро наступает декомпенсация и развивается ацидоз и цианоз. [5]
На ЭКГ часто наблюдаются отклонение оси вправо и гипертрофия правого желудочка, но они не указывают на СЛГС. Рентгенография грудной клетки может выявить большое сердце ( кардиомегалию ) или увеличение легочной сосудистой сети. У новорожденных с HLHS обычно нет шумов в сердце шумы легочного кровотока или шумы трикуспидальной регургитации . , но в некоторых случаях могут быть слышны [5]
Сопутствующая трикуспидальная регургитация или дисфункция правого желудочка могут вызвать гепатомегалии . развитие [5]
Патогенез
[ редактировать ]Большинство случаев HLHS являются спорадическими, то есть возникают у пациентов, у которых в семейном анамнезе не было HLHS. [4] Некоторые случаи могут иметь генетический компонент, поскольку было показано, что HLHS передается по наследству и связан со специфическими генными мутациями. [16] [17] Возможные способствующие факторы могут включать внутриутробный инфаркт, инфекционные изменения и селективную кардиомиопатию левого желудочка.
Генетика
[ редактировать ]Генетические локусы, связанные с HLHS, включают GJA1 (коннексин 43) , HAND1 , NKX2.5 , 10q22 и 6q23. [15] [18] [6] Существует небольшой риск рецидива при будущих беременностях, который оценивается в 2-4% и увеличивается до 25% в семьях с двумя больными детьми. [4] Считается, что это опосредовано генетическими мутациями с неполной пенетрантностью . [15]
HLHS также связан с несколькими генетическими синдромами, включая трисомию 13 (синдром Патау) , трисомию 18 (синдром Эдвардса) , частичную трисомию 9 , синдром Тернера (XO) , синдром Якобсена (синдром делеции 11q) , синдром Холта-Орама и синдром Смита-Орама. Синдром Лемли-Опитца . [15] [18]
Изменение кровотока
[ редактировать ]Популярная теория, получившая название «нет потока — нет роста», предполагает, что первичные анатомические дефекты аортального и митрального клапанов приводят к порокам развития левого желудочка и его выносящего тракта. [9] Эти первичные дефекты можно разделить на те, которые приводят к обструкции выносящих путей или снижению наполнения левого желудочка. [7] Обструкция выносящего тракта приводит к гипертрофии левого желудочка и уменьшению просвета левого желудочка. Одним из примеров этого может быть аортальный стеноз. Стеноз аорты, возникающий во время развития плода, приводит к дополнительной нагрузке на левый желудочек внутриутробно. В конечном итоге это может привести к снижению перфузии через левый желудочек, что, как полагают, подавляет рост желудочков. [19]
Патофизиология
[ редактировать ]При рождении артериальный проток все еще открыт, и сопротивление кровотоку в легких выше, чем обычно. Это обеспечивает адекватную оксигенацию за счет смешивания между предсердиями и нормальный внешний вид при рождении. Когда проток начинает закрываться и сопротивление легочных сосудов снижается, кровоток через проток ограничивается, а приток крови к легким увеличивается. [5]
В типичной анатомии левая часть сердца получает богатую кислородом кровь из легких и перекачивает ее в остальную часть тела. Пациенты с HLHS могут иметь ряд пороков развития сердца, которые в конечном итоге приводят к уменьшению размера левого желудочка, который не может обеспечить достаточный приток крови к остальной части тела. [20] Выделяют три основных анатомических варианта заболевания, дифференцированных по стенозу или атрезии аортального и митрального клапанов. [20]
Подтип митральной атрезии и атрезии аорты (МА-АА) является наиболее тяжелой формой HLHS, приводящей к полному отсутствию поступления кровотока в левый желудочек, что приводит к невозможности выброса левого желудочка. [20] При митральном стенозе и атрезии аорты (МС-АА) кровь способна заполнять левый желудочек, однако не может поступать в большой круг кровообращения через гипоплазированную восходящую аорту. [20] Наконец, самой легкой формой является подтип митрального стеноза и аортального стеноза (МС-АС). [20] У этих пациентов, хотя левый желудочек способен обеспечивать некоторый приток крови к остальным частям тела, общий системный выброс левого желудочка остается недостаточным. [20]
Во всех этих случаях кровь не может перекачиваться через левый желудочек к остальным частям тела. Новорожденный зависит от тока крови через дефект межпредсердной перегородки для смешивания оксигенированной и дезоксигенированной крови, а также от открытого артериального протока, позволяющего крови достигать аорты и большого круга кровообращения через правый желудочек. Именно это определяет HLHS как дефект « единственного желудочка ». [15]
Из-за недоразвития левой половины сердца внутриутробно повышенная постнагрузка вызывает гипертензию левого предсердия, отек легких и, следовательно, поражение легких плода еще до рождения. [19]
Диагностика
[ редактировать ]Синдром гипоплазии левых отделов сердца можно диагностировать пренатально или после рождения с помощью эхокардиографии. Типичные результаты включают небольшой размер левого желудочка и аорты, аномалии митрального и аортального клапанов, ретроградный кровоток в поперечной дуге аорты и поток между предсердиями слева направо. Его часто распознают во втором триместре беременности, между 18 и 24 неделями беременности. [5]
Управление
[ редактировать ]Медицинский
[ редактировать ]Без вмешательства, продлевающего жизнь, HLHS приводит к летальному исходу, но при вмешательстве младенец может выжить. Кардиоторакальный хирург может выполнить серию операций или полную трансплантацию сердца . В то время как хирургическое вмешательство стало стандартом лечения в Соединенных Штатах, другие национальные системы здравоохранения, особенно во Франции, подходят к диагностике HLHS более консервативно, с упором на прерывание беременности или сострадательный уход после родов. [8]
Перед операцией проток необходимо оставить открытым, чтобы обеспечить приток крови с помощью лекарств, содержащих простагландин . [9] Воздух с меньшим содержанием кислорода, чем обычно, используется для младенцев с синдромом гипоплазии левых отделов сердца. Эти низкие уровни кислорода увеличивают сопротивление легочных сосудов (PVR) и, таким образом, улучшают приток крови к остальной части тела из-за большей разницы давлений между легкими и телом. Достижение уровня кислорода ниже атмосферного требует использования вдыхаемого азота. [21] Оксид азота является мощным вазодилататором легких и, таким образом, снижает ЛСС и улучшает венозный возврат. Любой фактор, увеличивающий PVR, будет препятствовать правостороннему кровотоку. [22] [23]
Хирургический
[ редактировать ]Хирургические операции при гипоплазии левых отделов сердца сложны и должны быть индивидуализированы для каждого пациента. Кардиолог должен оценить все медицинские и хирургические варианты в каждом конкретном случае. [ нужна ссылка ]
В настоящее время младенцы подвергаются поэтапной реконструктивной хирургии ( процедура Норвуда или Сано в течение нескольких дней после рождения, процедура Гленна или Хеми-Фонтана в возрасте от 3 до 6 месяцев и процедура Фонтана в возрасте от 1,5 до 5 лет). или трансплантация сердца. [10] Текущие ожидания заключаются в том, что 70% людей с HLHS могут достичь совершеннолетия. [18] Многие исследования показывают, что чем выше объем (количество проведенных операций) в больнице, тем ниже уровень смертности (смертности). [24] [25] Факторы, повышающие риск у младенца, включают меньший вес при рождении, дополнительные врожденные аномалии, генетический синдром или наличие сильно ограничительной межпредсердной перегородки. [26] Для пациентов без этих дополнительных факторов риска 5-летняя выживаемость сейчас приближается к 80%. [26] Исследования показывают, что около 75% детей, выживших после операции, демонстрируют задержку развития в одной или нескольких областях, таких как двигательные, когнитивные или языковые нарушения, при этом около трети детей с одним желудочком без генетического синдрома имеют значительные нарушения. [27] Текущие исследования сосредоточены на выявлении связей между травмами, связанными с развитием нервной системы, хирургическими процедурами и процедурами интенсивной терапии, а также генетической предрасположенностью с целью модификации вмешательств, которые нарушают развитие нервной системы и психосоциальные результаты. [28] Альтернативой традиционной процедуре Норвуда является гибридная процедура. [29]
Некоторые врачи предлагают сострадательную помощь вместо операций, которые приводят к смерти ребенка, обычно в течение 2 недель после рождения. Сострадательный уход контролируется врачом и может осуществляться как в больнице, так и на дому. Однако из-за значительного улучшения хирургического вмешательства, когда во многих больницах достигается более 90% выживаемости, ведутся споры о том, следует ли по-прежнему предлагать семьям сострадательную помощь. [30] Исследование, проведенное в 2003 году, пришло к выводу, что выборка врачей, являющихся экспертами в лечении детей с HLHS, разделилась поровну, когда их спросили, что бы они сделали, если бы их собственные дети родились с HLHS: 1/3 заявили, что они выбрали бы хирургическое вмешательство, 1 /3 заявили, что они выбрали бы паллиативное (сострадательное) лечение без хирургического вмешательства, и 1/3 заявили, что они не уверены, какой выбор они сделают. [31]
Трехэтапная процедура является паллиативной процедурой (а не лечением), поскольку кровообращение ребенка задействует только две из четырех камер сердца. [ нужна ссылка ]

Процедура Норвуда
[ редактировать ]Первым шагом является процедура Норвуда . [32] В этой процедуре правый желудочек используется для перекачки крови в большой круг кровообращения. Поскольку правый желудочек больше не перекачивает кровь напрямую в легкие, для прохождения дезоксигенированной крови через легкие требуется шунт. Либо подключичную артерию можно подключить к малому кругу кровообращения ( шунт Блалока-Тауссига ), либо выполнить шунт непосредственно из правого желудочка в малый круг кровообращения ( шунт Сано ). Узкую аорту расширяют с помощью пластыря для улучшения притока крови к организму. [33]
В это время ребенок может быть слабым с медицинской точки зрения и иметь проблемы с питанием, поскольку сердце работает очень усердно. В правом желудочке наблюдается значительная степень венозного перемешивания, что приводит к снижению насыщения оксигенацией. Кроме того, как шунты Блалока-Тауссига, так и шунты Сано подвергают легкие воздействию системного артериального давления, что приводит к длительной легочной гипертензии и, в конечном итоге, к сердечной недостаточности. [32]
Гибридная процедура
[ редактировать ]Вместо процедуры Норвуда можно использовать гибридную процедуру. [32] [34] [35] Гибридная процедура не требует использования искусственного кровообращения или выполнения стернотомии . Вместо шестичасовой операции гибрид обычно занимает от одного до двух часов. При этой процедуре стент помещается в артериальный проток для поддержания его проходимости, а на левую и правую ветви легочной артерии накладываются бандажи, чтобы ограничить давление и избыточную циркуляцию в легких. [36] Результаты гибридного подхода сопоставимы с результатами Норвуда. [37]
Процедура Гленна
[ редактировать ]Второй этап — двунаправленный метод Гленна или Хеми-Фонтан (см. также процедуру Кавасима ) — облегчает некоторые проблемы, возникающие при паллиативном лечении этапа I. [32] При этой операции верхняя полая вена перевязывается от сердца и соединяется с малым кругом кровообращения. В это время удаляют шунт Блалока-Тауссига или Сано. Легкие больше не подвергаются системному артериальному давлению, но значительно снижают венозное давление. Хотя венозная кровь из верхней половины тела больше не смешивается с насыщенной кислородом кровью в правом желудочке, венозное смешивание из нижней половины тела все еще происходит, что приводит к некоторой степени десатурации кислорода. [32]
Fontan procedure
[ редактировать ]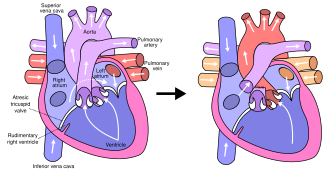
Последняя процедура, процедура Фонтана , завершает восстановление гипоплазии левого сердца. [32] Хотя существует несколько вариантов, функциональный эффект заключается в перенаправлении венозной крови из нижней части тела (через нижнюю полую вену) из правого предсердия в легочную артерию. Это должно исключить любое смешивание оксигенированной и дезоксигенированной крови в правом желудочке. Правый желудочек выполняет традиционную работу левого, снабжая организм насыщенной кислородом кровью, тогда как пассивное системное венозное давление выполняет традиционную работу правого, передавая дезоксигенированную кровь в легкие. [32]
Фетальная хирургия
[ редактировать ]Вмешательства, выполняемые во время развития плода, находятся в стадии изучения. Когда признаки HLHS обнаруживаются пренатально с помощью ультразвука, чрескожная процедура, включающая введение баллонного катетера, может открыть дефект межпредсердной перегородки, чтобы предотвратить гипертензию в левом предсердии и способствовать улучшению развития сердца. [38] [39]
Прогноз
[ редактировать ]95% нелеченых младенцев с HLHS умирают в первые недели жизни. [5]
Ранняя выживаемость улучшилась с момента внедрения процедуры Норвуда. [18] Поскольку долгосрочных исследований взрослых с HLHS не проводилось, статистические данные обычно получают от пациентов, перенесших Фонтан; По оценкам, 70% пациентов с HLHS могут достичь взрослого возраста. [18]
Прогноз зависит от здоровья ребенка, так как при распространенных детских заболеваниях у детей раннего возраста повышается потребность в дыхательной и сердечной деятельности. Эта хрупкая популяция имеет небольшой сердечный резерв для удовлетворения этих потребностей и обеспечения гемодинамической стабильности во время заболеваний. [40]
Дети с HLHS и другими сопоставимыми одножелудочковыми заболеваниями как группа имеют худшие результаты в области нервного развития , чем их здоровые сверстники. нарушения речи, исполнительных функций и более высокий уровень тревожных и депрессивных расстройств. Были продемонстрированы [41] Некоторые из этих результатов могут быть следствием генетических факторов, связанных с HLHS, а другие можно модифицировать путем изменения процедур и среды здравоохранения. В настоящее время появляется клинический консенсус относительно важности постоянного наблюдения за развитием нервной системы с самых ранних лет до взрослой жизни. [11] [42] Кроме того, недавний метаанализ, сравнивающий двадцать два исследования, показал, что в 64,7% исследований сообщалось о задержке двигательного развития у детей с физиологией одного желудочка, например, с синдромом гипоплазии левых отделов сердца. [12]
Как и у пациентов с другими типами пороков сердца, связанных с пороками развития клапанов, [43] Пациенты с HLHS подвергаются высокому риску эндокардита и должны находиться под наблюдением кардиолога до конца своей жизни, чтобы проверить функцию сердца. [ нужна ссылка ]
Трансплантация сердца может быть показана, как правило, после завершения операции Фонтана. [18] В одном многоцентровом исследовании (пациенты, перенесшие операцию Фонтан с 1993 по 2001 год) сообщалось о 76%-ной годовой выживаемости у пациентов, доживших до трансплантации. [44]
Будущее терапии стволовыми клетками
[ редактировать ]Систематический обзор выявил 23 статьи, опубликованные с 2010 года, а также девять соответствующих клинических исследований, связанных с врожденными пороками сердца и недавними достижениями в терапии стволовыми клетками. [45] Доклинические исследования были сосредоточены на нескольких типах стволовых клеток, включая: мезенхимальные стволовые клетки (МСК), аутологичные клетки пуповинной крови, сердечные стволовые клетки c-kit+ и неонатальные мезенхимальные стволовые клетки тимуса. [45] Эти типы клеток продемонстрировали способность дифференцироваться в сердечную ткань, что делает их идеальными для регенеративной терапии сердца. Первое использование аутологичных клеток пуповинной крови было проведено в клинике Майо в 2015 году, и было обнаружено, что после процедуры улучшается функция правого желудочка у пациента. [45] Первое использование сердечных клеток-предшественников произошло в ходе исследования «Транскоронарная инфузия сердечных клеток-предшественников у пациентов с физиологией одного желудочка» (TICAP) в 2011 году. [45]
Текущие испытания
[ редактировать ]В настоящее время проводится несколько исследований, проверяющих осуществимость и эффективность терапии стволовыми клетками при заболеваниях одного желудочка, таких как HLHS. [45] Эти испытания сосредоточены на том, какие стволовые клетки наиболее эффективны, каковы наилучшие сроки трехэтапного восстановления и каков оптимальный метод доставки.
- Испытание фазы IIb, проверяющее эффективность внутримиокардиальных инъекций клеток пуповинной крови во время восстановления стадии II (Glenn). [46]
- Испытание фазы I, проверяющее эффективность инфузии аутологичных клеток пуповинной крови во время восстановления стадии 1 (по Норвуду) в течение двух-трех дней после рождения. [47]
- Исследование ELPIS представляет собой открытую пилотную фазу I/IIb, проверяющую эффективность и безопасность внутримиокардиальных инъекций донорских мезенхимальных стволовых клеток человека пациентам во время операции 2 (Glenn) и 3 (Fontan) операций. [48]
- Испытание фазы I, проверяющее эффективность внутримиокардиальных инъекций пуповинной крови во время восстановления 2-го этапа (Glenn). [49]
- Исследование PERSEUS представляет собой исследование фазы II, в котором проверяется эффективность интракоронарной инфузии сердечных клеток-предшественников и оценивается функция через 3 месяца после лечения. [50]
- Исследование APOLLON — это клиническое исследование III фазы, проверяющее эффективность и безопасность интракоронарных инъекций аутологичных сердечных стволовых клеток на этапе 2 (Glenn) или этапе 3 (Fontan) восстановления. [51]
- Исследование CHILD — это фаза I клинического исследования, проверяющая возможность и безопасность внутримиокардиальных инъекций клеток c-kit+ во время восстановления стадии 2 (Glenn). [52]
Важно иметь в виду, что пациенты с HLHS подвергаются повышенному риску развития сердечной недостаточности во взрослом возрасте. Остается неизвестным, снизят ли эти потенциальные методы лечения будущий риск сердечной недостаточности у этих пациентов.
Ссылки
[ редактировать ]- ^ «Синдром гипопластического левого сердца: Медицинская энциклопедия MedlinePlus» . medlineplus.gov . Проверено 28 мая 2019 г.
- ^ Червенков С.И.; Джейкобс, JP; Вайнберг, П.М.; Айелло, В.Д.; Беланд, MJ; Колан, С.Д.; Эллиотт, MJ; Франклин, Р.К.; Гейнор, Дж. В.; Крогманн, О.Н.; Куросава, Х; Марушевский, Б; Стеллин, Г. (2006). «Номенклатура, определение и классификация синдрома гипоплазии левых отделов сердца» . Кардиология у молодых . 16 (4): 339–368. дои : 10.1017/s1047951106000291 . ПМИД 16839428 .
- ^ Перейти обратно: а б с Лю, Инцзюань; Чен, Сен; Зюльке, Лизль; Блэк, Грэм С.; Чой, Мун-Кит; Ли, Нинсю; Кивни, Бернард Д. (01 апреля 2019 г.). «Глобальная распространенность врожденных пороков сердца при рождении в 1970-2017 гг.: обновленный систематический обзор и метаанализ 260 исследований» . Международный журнал эпидемиологии . 48 (2): 455–463. дои : 10.1093/ije/dyz009 . ISSN 1464-3685 . ПМК 6469300 . ПМИД 30783674 .
- ^ Перейти обратно: а б с Бэррон, DJ, Килби, MD, Дэвис, Б., Райт, JG, Джонс, TJ, и Браун, WJ (2009). «Синдром гипоплазии левых отделов сердца». Ланцет . 374 (9689): 551–564. дои : 10.1016/s0140-6736(09)60563-8 . ПМИД 19683641 . S2CID 3285769 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б с д и ж г час я дж Фултон, Дэвид Р. (26 октября 2017 г.). «Синдром гипоплазии левых отделов сердца» . До настоящего времени . Проверено 30 ноября 2017 г.
- ^ Перейти обратно: а б Хинтон, Р.Б., Мартин, Л.Дж., Раме-Гауда, С., Табангин, М.Э., Крайп, Л.Х. и Бенсон, Д.В. (2009). «Синдром гипоплазии левых отделов сердца связан с хромосомами 10q и 6q и генетически связан с двустворчатым аортальным клапаном» . Журнал Американского колледжа кардиологов . 53 (12): 1065–1071. дои : 10.1016/j.jacc.2008.12.023 . ПМК 2703749 . ПМИД 19298921 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б Крицмайр, Стейси М.; Коссу, Энн Э. (2021), «Синдром гипопластического левого сердца» , StatPearls , Остров сокровищ (Флорида): StatPearls Publishing, PMID 32119463 , получено 12 ноября 2021 г.
- ^ Перейти обратно: а б Нозеда С., Миалет-Марти Т., Баскен А. (апрель 2012 г.). «Тяжелая гипоплазия левого желудочка: паллиативная помощь после пренатальной диагностики». Архив педиатрии . 19 (4): 374–380. дои : 10.1016/j.arcped.2012.01.022 . ПМИД 22397767 .
- ^ Перейти обратно: а б с Крусян, А.; Алькахтани, А.; Бэррон, диджей; Браун, штат Вашингтон; Ричардсон, Р.В.; О'Салливан, Дж.; Андерсон, Р.Х.; Хендерсон, диджей; Чаудри, Б. (10 августа 2017 г.). «Переоценка синдрома гипоплазии левых отделов сердца с точки зрения развития и морфологии» . Сиротский журнал редких заболеваний . 12 (1): 138. дои : 10.1186/s13023-017-0683-4 . ISSN 1750-1172 . ПМК 5551014 . ПМИД 28793912 .
- ^ Перейти обратно: а б с д и Гипопластический синдром левых отделов сердца (HLHS) | Детская больница Филадельфии
- ^ Перейти обратно: а б Марино, Брэдли С.; Липкин, Пол Х.; Ньюбургер, Джейн В.; Пикок, Джорджина; Гердес, Марша; Гейнор, Дж. Уильям; Муссатто, Кэтлин А.; Узарк, Карен; Голдберг, Карен С. (28 августа 2012 г.). «Результаты развития нервной системы у детей с врожденным пороком сердца: оценка и лечение: научное заявление Американской кардиологической ассоциации» . Тираж . 126 (9): 1143–1172. дои : 10.1161/CIR.0b013e318265ee8a . ISSN 0009-7322 . ПМИД 22851541 .
- ^ Перейти обратно: а б Спронг, Мааике, Калифорния; Братья Уильям; ван дер Нет, Джанджаап; Брер, Йоханнес MPJ; де Врис, Линда С.; Сликер, Мартин Г.; из Брюсселя, Марко (01.10.2021). «Задержка двигательного развития после кардиохирургической операции у детей с критическим врожденным пороком сердца: систематический обзор литературы и метаанализ» . Детская физиотерапия . 33 (4): 186–197. дои : 10.1097/PEP.0000000000000827 . ISSN 1538-005X . ПМИД 34618742 . S2CID 238255373 .
- ^ «Факты о синдроме гипопластического левого сердца | Врожденные пороки сердца» . Центры по контролю и профилактике заболеваний . 26 октября 2017 г. Проверено 30 ноября 2017 г.
- ^ Паркер С.Э., Май Коннектикут, Кэнфилд М.А., Рикард Р., Ван Ю., Мейер Р.Е., Андерсон П., Мейсон К.А., Коллинз Дж.С., Кирби Р.С., Корреа А.; Национальная сеть по предотвращению врожденных дефектов. (2010). «Обновленные национальные оценки распространенности отдельных врожденных дефектов в Соединенных Штатах, 2004–2006 годы». Исследование врожденных дефектов. Часть A: Клиническая и молекулярная тератология . 88 (12): 1008–16. дои : 10.1002/bdra.20735 . ПМИД 20878909 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б с д и Фултон, Дэвид Р. (26 октября 2017 г.). «Синдром гипоплазии левых отделов сердца» . До настоящего времени . Проверено 30 ноября 2017 г.
- ^ Хинтон, Р.Б., Мартин, Л.Дж., Табангин, М.Э., Мазви, М.Л., Крайп, Л.Х. и Бенсон, Д.В. (2007). «Синдром гипоплазии левых отделов сердца передается по наследству» . Журнал Американского колледжа кардиологов . 50 (16): 1590–1595. дои : 10.1016/j.jacc.2007.07.021 . ПМИД 17936159 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Дасгупта С., Мартинес А.М., Зуппан К.В., Шах М.М., Бейли Л.Л., Флетчер В.Х. (2001). «Идентификация мутаций гена щелевого соединения коннексина 43 (альфа1) у пациентов с синдромом гипоплазии левых отделов сердца с помощью денатурирующего градиентного гель-электрофореза (DGGE)». Мутат. Рез. 479 (1–2): 173–86. дои : 10.1016/S0027-5107(01)00160-9 . ПМИД 11470490 .
- ^ Перейти обратно: а б с д и ж Файнштейн, Дж. А.; Бенсон, Д.В.; Дубин, А.М.; Коэн, MS; Макси, DM; Мале, WT; Паль, Э; Виллафанье, Дж; Бхатт, AB; Пэн, LF; Джонсон, бакалавр; Марсден, Алабама ; Дэниелс, CJ; Радд, Северная Каролина; Кальдароне, Калифорния; Муссатто, Калифорния; Моралес, Д.Л.; Айви, Д.Д.; Гейнор, JW; Тведделл, Дж. С.; Дил, Би Джей; Фурк, АК; Розенталь, ГЛ; О да, Р.Г.; Ганайем, Н.С.; Читэм, Япония; Турецкий, В; Мартин, Греция (3 января 2012 г.). «Синдром гипопластического левого сердца: современные соображения и ожидания» . Журнал Американского колледжа кардиологов . 59 (1 дополнение): С1–42. дои : 10.1016/j.jacc.2011.09.022 . ПМК 6110391 . ПМИД 22192720 .
- ^ Перейти обратно: а б Шидлоу, Дэвид Н.; Фрейд, Линдси; Фридман, Кевин; Творецки, Уэйн (2017). «Вмешательства плода при структурных заболеваниях сердца». Эхокардиография . 34 (12): 1834–1841. дои : 10.1111/echo.13667 . ISSN 1540-8175 . ПМИД 29287139 . S2CID 12087225 .
- ^ Перейти обратно: а б с д и ж Червенков, В.И.; Джейкобс, ML; Тахта, Ю.А. (апрель 2000 г.). «Проект номенклатуры и базы данных врожденной хирургии сердца: синдром гипоплазии левых отделов сердца» . Анналы торакальной хирургии . 69 (4 приложения): S170–179. дои : 10.1016/s0003-4975(99)01283-7 . ISSN 0003-4975 . ПМИД 10798427 .
- ^ Грин А., Пай С., Йетман А.Т. (август 2002 г.). «Физиологическая основа и соображения ухода за больными при использовании субатмосферных концентраций кислорода в HLHS». Достижения в области ухода за новорожденными . 2 (4): 177–86. дои : 10.1053/adnc.2002.33542 . ПМИД 12881932 .
- ^ Хамбадконе С.; Ли Дж.; Де Леваль MR; Каллен С.; Динфилд Дж. Э.; Редингтон А.Н. (2003). «Базальное сопротивление легочных сосудов и чувствительность к оксиду азота на поздних стадиях после операции типа Фонтана» . Тираж . 107 (25): 3204–3208. дои : 10.1161/01.cir.0000074210.49434.40 . ПМИД 12821557 .
- ^ Норвуд, Висконсин (1991). «Синдром гипоплазии левых отделов сердца» . Анналы торакальной хирургии . 52 (3): 688–695. дои : 10.1016/0003-4975(91)90978-у . ПМИД 1898174 .
- ^ Макхью, Кентукки; Хиллман, генеральный директор; Гурка, МЮ; Гутгеселл, HP (январь – февраль 2010 г.). «Трехэтапное паллиативное лечение синдрома гипоплазии левых отделов сердца в Консорциуме университетской системы здравоохранения». Врожденный порок сердца . 5 (1): 8–15. дои : 10.1111/j.1747-0803.2009.00367.x . ПМИД 20136852 .
- ^ Хирш, Дж. К.; Герни, Дж. Г.; Донохью, Дж. Э.; Гебремариам, А; Бове, Эль; Ойе, Р.Г. (июль 2008 г.). «Больничная смертность при Норвуде и операциях по переключению артерий в зависимости от институционального объема». Детская кардиология . 29 (4): 713–7. дои : 10.1007/s00246-007-9171-2 . ПМИД 18080151 . S2CID 23456242 .
- ^ Перейти обратно: а б Войтович, П.; Тласкал, Т.; Гебауэр, Р.; Райх, О.; Халупецкий, В.; Томек, В.; Крупичкова, С.; Матейка, Т.; Хехт, П. (декабрь 2014 г.). «Отдаленные результаты лечения детей, прооперированных по поводу синдрома гипоплазии левых отделов сердца в Детском кардиологическом центре» . Кор и Васа . 56 (6): е449–е455. дои : 10.1016/j.crvasa.2014.07.006 . ISSN 0010-8650 .
- ^ Муссатто, Кэтлин А.; Хоффманн, Раймонд Г.; Хоффман, Джордж М.; Тведделл, Джеймс С.; Медведь, Лорел; Цао, Юмей; Брозиг, Шерил (2014). «Риск и распространенность задержки развития у детей раннего возраста с врожденными пороками сердца» . Педиатрия . 133 (3): e570–577. дои : 10.1542/пед.2013-2309 . ISSN 1098-4275 . ПМЦ 3934337 . ПМИД 24488746 .
- ^ Верновский, Гил; Лихт, Дэниел Дж. (2016). «Результаты развития нервной системы у детей с врожденным пороком сердца – на что мы можем повлиять?» . Детская реанимационная медицина . 17 (8 Приложение 1): С232–С242. дои : 10.1097/PCC.0000000000000800 . ISSN 1529-7535 . ПМЦ 4975480 . ПМИД 27490605 .
- ^ Яброди, Мухаммед; Мастропьетро, Кристофер В. (04 октября 2016 г.). «Синдром гипопластического левого сердца: от комфортного ухода к долгосрочному выживанию» . Педиатрические исследования . 81 (1–2): 142–149. дои : 10.1038/пр.2016.194 . ISSN 0031-3998 . ПМЦ 5313512 . ПМИД 27701379 .
- ^ Верновский, Гил (1 сентября 2008 г.). «Сдвиг парадигмы в сторону хирургического вмешательства у новорожденных с синдромом гипоплазии левых отделов сердца». Архив педиатрии и подростковой медицины . 162 (9): 849–54. дои : 10.1001/archpedi.162.9.849 . ПМИД 18762602 .
- ^ Кон, Александр А.; Акерсон, Линн; Ло, Бернард (31 мая 2003 г.). «Выбор, который сделали бы врачи, если бы они были родителями ребенка с синдромом гипоплазии левых отделов сердца». Американский журнал кардиологии . 91 (12): 1506–1509. дои : 10.1016/S0002-9149(03)00412-0 . ПМИД 12804748 .
- ^ Перейти обратно: а б с д и ж г Файнштейн, Джеффри А.; Бенсон, Д. Вудро; Дубин, Энн М.; Коэн, Мерил С.; Макси, Дон М.; Мале, Уильям Т.; Паль, Эльфрида; Виллафанье, Хуан; Бхатт, Ами Б. (январь 2012 г.). «Синдром гипопластического левого сердца» . Журнал Американского колледжа кардиологов . 59 (1): С1–С42. дои : 10.1016/j.jacc.2011.09.022 . ПМК 6110391 . ПМИД 22192720 .
- ^ "новый norwood.gif" . Архивировано из оригинала 24 ноября 2010 года.
- ^ Мерфи, Майкл О.; Беллшам-Ревелл, Ханна; Морган, Гарет Дж.; Красеманн, Томас; Розенталь, Эрик; Куреши, Шакил А .; Салих, Джанер; Остин, Конал Б.; Андерсон, Дэвид Р. (2015). «Гибридная процедура для новорожденных с синдромом гипоплазии левых отделов сердца из группы высокого риска по Норвуду: промежуточные результаты» . Анналы торакальной хирургии . 100 (6): 2286–2292. doi : 10.1016/j.athoracsur.2015.06.098 . ПМИД 26433522 .
- ^ Чаухан, Моника; Мастропьетро, Кристофер В. (2014). «Синдром гипопластического левого сердца в отделении неотложной помощи: обновленная информация». Журнал неотложной медицины . 46 (2): e51–e54. doi : 10.1016/j.jemermed.2013.08.061 . ПМИД 24188609 .
- ^ «Детская больница Бостона | Взгляды педиатров» . Архивировано из оригинала 29 февраля 2012 г. Проверено 14 мая 2010 г.
- ^ Галантович М., Читэм Дж.П., Филлипс А. и др. (июнь 2008 г.). «Гибридный подход к синдрому гипоплазии левых отделов сердца: промежуточные результаты после кривой обучения». Энн. Торак. Сург . 85 (6): 2063–70, обсуждение 2070–1. дои : 10.1016/j.athoracsur.2008.02.009 . ПМИД 18498821 .
- ^ Суд, Викрам; Зампи, Джеффри Д.; Романо, Дженнифер С. (6 апреля 2020 г.). «Синдром гипопластического левого сердца при неповрежденной межпредсердной перегородке» . JTCVS Открыть . 1 : 51–56. дои : 10.1016/j.xjon.2020.03.001 . ПМК 9390260 . ПМИД 36003193 .
- ^ Каннингем, Ф. Гэри; Левено, Кеннет Дж.; Блум, Стивен Л.; Спонг, Кэтрин Ю .; Даше, Джоди С.; Хоффман, Барбара Л.; Кейси, Брайан М.; Шеффилд, Жанна С. (2013). «Визуализация плода» . Уильямс Акушерство (24-е изд.). Нью-Йорк, штат Нью-Йорк: McGraw-Hill Education.
- ^ Ньевес, Джо Энн; Узарк, Карен; Радд, Нэнси А.; Строун, Дженнифер; Шмельцер, Энн; Добролет, Нэнси (01 апреля 2017 г.). «Межэтапный домашний мониторинг после первой стадии паллиативного лечения новорожденных при синдроме гипоплазии левых отделов сердца: стратегии семейного образования» . Медсестра интенсивной терапии . 37 (2): 72–88. дои : 10.4037/ccn2017763 . ISSN 0279-5442 . ПМИД 28365652 . S2CID 39147698 .
- ^ Уайт, Брайан Р.; Роджерс, Линдси С.; Киршен, Мэтью П. (2019). «Последние достижения в нашем понимании последствий развития нервной системы при врожденных пороках сердца» . Современное мнение в педиатрии . 31 (6): 783–788. дои : 10.1097/MOP.0000000000000829 . ISSN 1040-8703 . ПМК 6852883 . ПМИД 31693588 .
- ^ Гурвиц, Мишель; Бернс, Кристин М.; Бриндис, Ральф; Броберг, Крейг С.; Дэниелс, Курт Дж.; Фуллер, Стефани MPN; Хонейн, Маргарет А.; Хайри, Пол; Кюль, Карен С. (26 апреля 2016 г.). «Новые направления исследований врожденных пороков сердца у взрослых: отчет Национального института сердца, легких и крови/Рабочая группа Ассоциации по врожденным порокам сердца у взрослых» . Журнал Американского колледжа кардиологов . 67 (16): 1956–1964. дои : 10.1016/j.jacc.2016.01.062 . ISSN 0735-1097 . ПМК 4846980 . ПМИД 27102511 .
- ^ «Эндокардит: Факторы риска» . MayoClinic.com . Проверено 23 октября 2007 г.
- ^ Тейлор, Д.О., Стелик, Дж., Эдвардс, Л.Б., Аврора, П., Кристи, Дж.Д., Доббелс, Ф., ... и Герц, Мичиган (2009). «Реестр Международного общества трансплантации сердца и легких: двадцать шестой официальный отчет о трансплантации сердца у взрослых — 2009 г.». Журнал трансплантации сердца и легких . 28 (10): 1007–1022. дои : 10.1016/j.healun.2009.08.014 . ПМИД 19782283 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б с д и Браун, Мэтью А.; Раджамартандан, Шива; Фрэнсис, Берлин; О'Лири-Келли, Меган К.; Синха, Пранава (январь 2020 г.). «Обновленная информация о технологиях стволовых клеток при врожденных пороках сердца» . Журнал кардиохирургии . 35 (1): 174–179. дои : 10.1111/jocs.14312 . ISSN 1540-8191 . ПМИД 31705822 . S2CID 207963021 .
- ^ Тимоти Дж. Нельсон (12 мая 2021 г.). «Исследование фазы IIb внутримиокардиальной инъекции аутологичных мононуклеарных клеток, полученных из пуповинной крови, во время хирургического лечения стадии II правожелудочково-зависимых вариантов синдрома гипопластического левого сердца (AutoCell-S2)» .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Пепе, Сальваторе (31 августа 2020 г.). «Исследование безопасности лечения аутологичными стволовыми клетками пуповинной крови у пациентов с синдромом гипоплазии левых отделов сердца, перенесших операцию на сердце Норвуда» . Детский научно-исследовательский институт Мердока.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Лонгеверон Инк. (24 сентября 2021 г.). «Инъекции Ломецела-Б пациентам с синдромом гипоплазии левых отделов сердца: исследование фазы I/II (ELPIS)» .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Тимоти Дж. Нельсон (08 марта 2021 г.). «Исследование безопасности фазы I аутологичных мононуклеарных клеток, полученных из пуповинной крови, во время хирургического паллиативного лечения синдрома гипопластического левого сердца на II стадии» .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ О, Хидемаса (3 января 2017 г.). «Исследование фазы 2 внутрикоронарной инфузии сердечных клеток-предшественников у пациентов с одножелудочковым заболеванием сердца» . Университет Окаяма, Центр трансляционных исследований медицинских инноваций, Кобе, Хёго, Япония.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Японская компания регенеративной медицины, Ltd. (15 ноября 2020 г.). «Исследование эффективности и безопасности аутологичных сердечных стволовых клеток (JRM-001), обработанных после реконструктивной хирургии у педиатрических пациентов с врожденным пороком сердца: многоцентровое рандомизированное одинарное слепое исследование в параллельных группах» .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Университет Майами (05.10.2021). «Инъекция аутологичных сердечных стволовых клеток пациентам с синдромом гипоплазии левых отделов сердца: открытое пилотное исследование» .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь )
Внешние ссылки
[ редактировать ]- Синдром гипопластического левого сердца. Архивировано 14 марта 2013 г. на сайте Wayback Machine. Информация для родителей.