Катехоламинергическая полиморфная желудочковая тахикардия
| Катехоламинергическая полиморфная желудочковая тахикардия | |
|---|---|
| Другие имена | КПВТ |
 | |
| Двунаправленная желудочковая тахикардия у пациента с CPVT | |
| Специальность | Кардиология |
| Симптомы | Потеря сознания , внезапная сердечная смерть. [1] |
| Обычное начало | Детство/юность |
| Причины | Генетический |
| Факторы риска | Семейная история |
| Метод диагностики | Электрокардиограмма (ЭКГ), генетическое тестирование , провокация адреналином, тест с физической нагрузкой [1] |
| Дифференциальный диагноз | Синдром удлиненного интервала QT , Синдром Бругада , Синдром Андерсена-Тавиля , Синдром ранней реполяризации |
| Уход | Избегание напряженных физических упражнений, приема лекарств, имплантируемого кардиовертера-дефибриллятора. [2] |
| Медикамент | Блокаторы бета-адренорецепторов , Верапамил , Флекаинид [2] |
| Прогноз | 13–20% угрожающих жизни аритмий в течение 7–8 лет. [3] |
| Частота | 1:10,000 [4] |
Катехоламинергическая полиморфная желудочковая тахикардия ( КПЖТ ) представляет собой наследственное генетическое заболевание , которое предрасполагает больных к потенциально опасным для жизни аномальным сердечным ритмам или аритмиям . Аритмии, наблюдаемые при CPVT, обычно возникают во время физических упражнений или во время эмоционального стресса и обычно принимают форму двунаправленной желудочковой тахикардии или фибрилляции желудочков . Пострадавшие могут протекать бессимптомно, но у них также могут наблюдаться потери сознания или даже внезапная сердечная смерть .
CPVT вызван генетическими мутациями , влияющими на белки , которые регулируют концентрацию кальция в клетках сердечной мышцы . Наиболее часто идентифицируемым геном является RYR2 , который кодирует белок, включенный в ионный канал, известный как рианодиновый рецептор ; этот канал высвобождает кальций из внутреннего хранилища кальция в клетке, саркоплазматического ретикулума , во время каждого сердцебиения.
CPVT часто диагностируется на основании ЭКГ, записанной во время теста на толерантность к физической нагрузке , но его также можно диагностировать с помощью генетического теста . Это состояние лечат с помощью лекарств, включая блокаторы бета-адренорецепторов или флекаинид , или хирургическими процедурами, включая симпатическую денервацию и имплантацию дефибриллятора . Считается, что от него страдает примерно один человек из десяти тысяч, и, по оценкам, он является причиной 15% всех необъяснимых внезапных сердечных смертей у молодых людей. Впервые это состояние было определено в 1978 году. [5] и лежащая в основе генетика были описаны в 2001 году. [6]
Признаки и симптомы
[ редактировать ]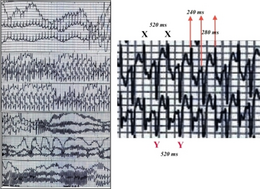
Хотя у людей с CPVT могут не возникать какие-либо симптомы, наиболее частыми симптомами являются потеря сознания или внезапная потеря сознания, называемая обмороком . [1] Эти отключения часто происходят во время физических упражнений или в ответ на эмоциональный стресс — ситуации, в которых химические посланники, известные как катехоламины , такие как адреналин , высвобождаются в организме. Потеря сознания может быть ошибочно истолкована как вызванная простым обмороком или эпилепсией , что часто приводит к задержке в постановке правильного диагноза. [7] У трети заболевших первым проявлением заболевания может быть остановка сердца, потенциально приводящая к внезапной смерти. [8] Это может произойти у очень маленьких детей и проявляться как синдром внезапной детской смерти или «смерть в кроватке». [1] Примерно у 30% людей с CPVT есть член семьи, у которого были потери сознания, судороги или внезапная смерть в ответ на физические упражнения или стресс. [7]
У пациентов с ХПЖВ выброс катехоламинов может привести к нарушению сердечного ритма или аритмии, известной как желудочковая тахикардия . [4] Желудочковая тахикардия может принимать характерную форму, известную как двунаправленная желудочковая тахикардия. Эта форма желудочковой тахикардии встречается относительно нечасто, но ее обнаружение позволяет предположить основной диагноз CPVT или связанного с ним состояния синдрома Андерсена-Тавиля . [8] [9] Эти желудочковые аритмии в некоторых случаях прекращаются сами по себе, вызывая потерю сознания, от которой человек затем выздоравливает. Однако, если аномальный сердечный ритм сохраняется, он может перерасти в более опасную аритмию, известную как фибрилляция желудочков, вызывающую остановку сердца и, если не лечить, внезапную смерть. [10]
При клиническом обследовании у лиц с CPVT обычно наблюдается очень мало аномальных признаков. Однако у людей с CPVT может развиться менее серьезное нарушение сердечного ритма, называемое фибрилляцией предсердий , которое можно обнаружить при обследовании по нерегулярному пульсу. [8] Кроме того, примерно у 20% пациентов с ХПЖТ отмечается замедление сердечного ритма в состоянии покоя, известное как синусовая брадикардия . [4]
Механизм
[ редактировать ]Связь возбуждения-сокращения
[ редактировать ]Аритмии, с которыми сталкиваются люди с CPVT, вызваны нарушениями в том, как клетки сердечной мышцы контролируют уровень кальция . [11] Кальций взаимодействует с белковыми волокнами или миофибриллами внутри клетки, которые позволяют клетке сокращаться, поэтому концентрацию кальция внутри каждой клетки необходимо жестко регулировать. Во время каждого сердцебиения концентрация кальция должна повышаться, чтобы позволить мышцам сокращаться, а затем падать, чтобы позволить мышцам расслабиться. Этот процесс достигается за счет использования запасов внутри клетки, известных как саркоплазматический ретикулум . [12]

В начале каждого сердечного сокращения кальций высвобождается из саркоплазматического ретикулума через специализированные каналы, известные как рианодиновые рецепторы . [12] Рианодиновые рецепторы открываются, когда концентрация кальция вблизи канала увеличивается. Это происходит, когда в ответ на электрический сигнал клеточной мембраны, называемый потенциалом действия , небольшое количество кальция проникает через клеточную мембрану в клетку через кальциевые каналы L-типа , многие из которых расположены в специализированных участках мембраны. называемые Т-трубочки, предназначенные для приближения этих поверхностных ионных каналов к саркоплазматической сети. [13]
Увеличение концентрации кальция запускает рианодиновые рецепторы саркоплазматического ретикулума, которые высвобождают порцию кальция, известную как кальциевая искра . Каждая искра вызывает высвобождение дальнейших искр из соседних рианодиновых рецепторов, создавая организованный подъем кальция по всей клетке, известный как переходный процесс кальция. В конце каждого сердцебиения кальций перекачивается обратно белком SERCA вместе с его регуляторным белком фосфоламбаном . Затем кальций удерживается в саркоплазматической сети с помощью белка под названием кальсеквестрин . [12]
Тонкая настройка этого процесса может быть достигнута путем фосфорилирования этих белков. Например, во время физических упражнений катехоламины активируют бета-адренорецепторы на поверхности клеток, которые заставляют протеинкиназу А фосфорилировать кальциевый канал L-типа, увеличивая приток кальция в клетку. Одновременно фосфорилирование регуляторного белка фосфоламбана приводит к попаданию большего количества кальция в саркоплазматический ретикулум. Общий эффект от этого заключается в увеличении переходного уровня кальция с каждым сокращением, что приводит к более сильному сокращению. [13]
Кальций-зависимые аритмии
[ редактировать ]Изменения в белках, участвующих в соединении возбуждения и сокращения, могут нарушить этот тщательно регулируемый процесс. У пациентов с ХПЖТ обычно жесткая регуляция кальция может нарушиться, что приведет к аритмиям. [11] Хотя кальций обычно высвобождается из саркоплазматического ретикулума в ответ на потенциал действия, кальциевые искры также могут возникать спонтанно. В здоровом сердце спонтанная кальциевая искра, как правило, является изолированным событием и не идет дальше, но если рианодиновые рецепторы или белки, которые их регулируют, ненормальны, эти искры могут вызвать высвобождение соседних рианодиновых рецепторов, которые распространяются по клетке в виде волны кальция. . [11] Эти волны кальция гораздо более вероятны, когда клетки сердечной мышцы стимулируются катехоламинами, такими как адреналин, которые увеличивают концентрацию кальция в саркоплазматическом ретикулуме и сенсибилизируют рианодиновые рецепторы. [14] Неконтролируемая волна кальция может быть вытеснена через клеточную мембрану через натрий-кальциевый обменник , вызывая электрический ток, известный как замедленная постдеполяризация . Постдеполяризация, если она достаточно велика, может вызвать дополнительные потенциалы действия, преждевременные сокращения желудочков или устойчивые аритмии. [15]
Причины
[ редактировать ]| Тип | МОЙ БОГ | Ген | Локус | Наследование | Примечания |
|---|---|---|---|---|---|
| КПВТ1 | 604772 | РИР2 | 1q42.1-q43 | ОБЪЯВЛЕНИЕ | Рианодиновый рецептор — высвобождает кальций из саркоплазматического ретикулума. |
| КПВТ2 | 611938 | CASQ2 | 1п13.3-п11 | АР | Кальсеквестрин — кальциевый буфер внутри саркоплазматического ретикулума. [8] |
| КПВТ3 | 614021 | ТЕКРЛ | 7p22-p14 | АР | Транс-2,3-еноил-КоА-редуктазоподобный белок - взаимодействует с рианодиновыми рецепторами и кальсеквестрином. |
| КПВТ4 | 614916 | СПОКОЙСТВИЕ1 | 14q32.11 | ОБЪЯВЛЕНИЕ | Кальмодулин — стабилизирует рианодиновые рецепторы. |
| КПВТ5 | 615441 | ТВЕРДЫЙ | 6q22.31 | АР | Триадин - образует комплекс с кальсеквестрином для взаимодействия с рианодиновыми рецепторами. |
CPVT может быть вызван мутациями в нескольких генах, каждый из которых отвечает за регулирование концентрации кальция в клетках сердечной мышцы. Наиболее часто выявляемой генетической мутацией при ХПЖТ является мутация гена RYR2 , который кодирует сердечный рианодиновый рецептор, ответственный за высвобождение кальция из саркоплазматического ретикулума. [16] Мутации, связанные с CPVT, также были идентифицированы в гене CASQ2, который кодирует кальсеквестрин. [17] белок, связывающий кальций в саркоплазматическом ретикулуме. Другие гены, связанные с более редкими атипичными формами ХПЖВ. [16] включают TECRL, кодирующий транс-2,3-еноил-КоА-редуктазе белок, подобный , CALM1 , CALM2 и CALM3 , кодирующие кальмодулин, и TRDN, кодирующий триадин. [18]
CPVT1: мутации RYR2
[ редактировать ]Наиболее часто выявляемые генетические мутации у пациентов с ХПЖТ происходят в гене RYR2, который кодирует сердечный рианодиновый рецептор. [11] Мутации в этом гене приводят к аутосомно-доминантной форме типичного CPVT, известной как CPVT1. [16] Хотя точный эффект различается в зависимости от конкретных мутаций в этом гене, многие мутации RYR2 вызывают открытие рианодинового рецептора в ответ на более низкие концентрации кальция — порог высвобождения кальция ниже. [11] В результате саркоплазматический ретикулум спонтанно высвобождает кальций через эти аномальные рианодиновые рецепторы, когда концентрация кальция в саркоплазматическом ретикулуме повышается. Этот процесс известен как высвобождение кальция, вызванное перегрузкой депо. [10] Содержание кальция в саркоплазматическом ретикулуме увеличивается в ответ на стимуляцию катехоламинов, что объясняет, почему аритмии у пациентов с CPVT возникают в то время, когда уровень катехоламинов повышен. Некоторые предполагают, что повышенная чувствительность к кальцию возникает только тогда, когда рианодиновый рецептор фосфорилируется протеинкиназой А, в то время как другие предполагают, что повышенная чувствительность возникает и в условиях покоя. [11]
Были предложены две теории основного механизма, с помощью которого мутации в RYR2 способствуют высвобождению кальция, вызванному перегрузкой депо: разархивирование домена и развязывание FKBP12.6 . [10] Разархивирование домена относится к разделению двух важных областей рианодинового рецептора: N-конца и центрального домена. Благодаря этому механизму мутация может дестабилизировать закрытое состояние рианодинового рецептора и повысить его чувствительность к кальцию. [10] Второй потенциальный механизм связан с регуляторным белком FKBP12.6, белком, который связывается и стабилизирует рианодиновый рецептор. Связывание FKBP12.6 с рианодиновым рецептором регулируется фосфорилированием. Фосфорилирование протеинкиназой А приводит к диссоциации FKBP12.6, делая рианодиновый рецептор более чувствительным к цитозольному кальцию. Мутации RYR2 могут препятствовать связыванию FKB12.6 с рианодиновым рецептором и тем самым повышать чувствительность к кальцию. Вполне вероятно, что FKBP12.6 играет роль в некоторых мутациях CPVT, но не в других. [10]
Мутации RYR2, ответственные за CPVT, в основном обнаруживаются в четырех основных доменах гена. [10] Мутации, затрагивающие III и IV домены гена (соответствующие N-концевому участку белка и цитозольному линкеру соответственно), встречаются в 46% случаев. Мутации встречаются реже, затрагивая домены I и II, оба из которых кодируют участки N-концевой области белка. [10] Мутации RYR2, связанные с CPVT, которые происходят за пределами этих четырех доменов, очень редки и составляют всего лишь 10% зарегистрированных случаев. Мутации RYR2 чаще всего представляют собой миссенс-мутации , такие как замены одиночных нуклеотидов, вызывающие замену одной аминокислоты на другую, хотя были описаны замены и дупликации в рамке считывания. О более разрушительных нонсенс-мутациях, связанных с CPVT, не сообщалось, возможно, потому, что эти варианты могут приводить к различным сердечным заболеваниям, таким как кардиомиопатии . [10]
CPVT2: мутации CASQ2
[ редактировать ]Мутации в гене CASQ2 связаны с аутосомно-рецессивной формой типичного CPVT, известной как CPVT2. [16] Этот ген кодирует кальсеквестрин, основной кальцийсвязывающий белок и кальциевый буфер в саркоплазматическом ретикулуме. [19] [20] Мутации в CASQ2 составляют лишь 3-5% случаев CPVT. [16] Четырнадцать мутаций CASQ2 были идентифицированы в связи с CPVT. Две из них являются нонсенс-мутациями, из-за которых белок становится аномально коротким, две — делеционными мутациями, а десять — миссенс-мутациями, которые заменяют одну аминокислоту другой в цепи, образующей белок. [11]
Мутации в CASQ2 вызывают снижение кальцийбуферной способности саркоплазматического ретикулума. Это означает, что резкие изменения общего кальция в саркоплазме будут меньше буферизоваться и, следовательно, приведут к более значительным изменениям в свободном кальции. Более высокие пики свободного кальция имеют больший потенциал вызывать высвобождение кальция из саркоплазматического ретикулума, вызванное перегрузкой депо, что приводит к постдеполяризации. [10]
Помимо своей роли кальциевого буфера, кальсеквестрин также регулирует высвобождение кальция из саркоплазматического ретикулума путем прямой модуляции рианодиновых рецепторов. При низкой концентрации кальция мономеры кальсеквестрина образуют комплекс с белками триадином и джанктином , которые ингибируют рианодиновые рецепторы. [19] Однако при высоких концентрациях кальция кальсеквестрин образует полимеры, которые диссоциируют от комплекса каналов рианодинового рецептора, устраняя ингибирующую реакцию и увеличивая чувствительность рианодинового рецептора к спонтанному высвобождению кальция. [10]
Снижение CASQ2 также связано с высокими уровнями кальретикулина , белка, который, помимо прочего, регулирует обратный захват кальция в саркоплазматический ретикулум с помощью SERCA. [21] В отсутствие CASQ2 уровни кальретикулина увеличиваются и обеспечивают некоторое компенсаторное связывание кальция в саркоплазматическом ретикулуме. Вполне возможно, что кальретикулин может способствовать возникновению аритмий, наблюдаемых в связи с мутациями CASQ2. [21]
Диагностика
[ редактировать ]
Диагностика ХПЖ может быть затруднена, поскольку структура сердца у лиц, страдающих этим заболеванием, кажется нормальной при оценке с помощью эхокардиограммы , МРТ сердца или КТ сердца , в то время как электрическая функция сердца также выглядит нормальной в состоянии покоя при оценке с помощью стандартная ЭКГ в 12 отведениях . [1] [2] Однако в ответ на физическую нагрузку или введение катехоламинов, таких как адреналин аномальные сердечные ритмы, такие как двунаправленная желудочковая тахикардия или частые полиморфные желудочковые эктопические сокращения . , могут наблюдаться [22]
ЭКГ в 12 отведениях
[ редактировать ]ЭКГ в покое в 12 отведениях является полезным тестом для дифференциации CPVT от других электрических заболеваний сердца, которые могут вызывать аналогичные аномальные сердечные ритмы. В отличие от таких состояний, как синдром удлиненного интервала QT и синдром Бругада , ЭКГ в 12 отведениях покоя у пациентов с CPVT обычно нормальна. [8] Однако примерно у 20% больных наблюдается замедление сердечного ритма в состоянии покоя или синусовая брадикардия . [8]
Упражнения и другие провокационные тесты
[ редактировать ]
Тестирование с физической нагрузкой , обычно выполняемое на беговой дорожке или велотренажере , может помочь диагностировать ЦПВТ. Во время теста у пациентов с CPVT часто наблюдаются эктопические сокращения, которые могут прогрессировать до двунаправленной, а затем и полиморфной желудочковой тахикардии по мере увеличения интенсивности нагрузки. [23] Некоторые из лиц с подозрением на CPVT, например маленькие дети, могут быть не в состоянии выполнить тест на толерантность к физической нагрузке. В этих случаях альтернативные формы тестирования включают адреналин-провокационное тестирование, во время которого адреналин вводится в вену в постепенно увеличивающихся дозах под тщательным контролем и ЭКГ-мониторингом. [22] Кроме того, можно провести долгосрочное или холтеровское мониторирование ЭКГ , хотя эта форма тестирования с меньшей вероятностью выявит аритмию. Инвазивные электрофизиологические исследования не дают полезной информации для диагностики ДЦЖТ или оценки риска опасных для жизни аритмий. [2] [22]
Генетическое тестирование
[ редактировать ]CPVT также можно диагностировать путем выявления вызывающей заболевание мутации в гене , связанном с CPVT, с помощью генетического тестирования . [2] [22] Этот метод может быть единственным способом идентифицировать состояние у умершего человека с подозрением на CPVT, и в этом случае он может быть известен как молекулярное вскрытие . [24]
Уход
[ редактировать ]Лечение ХПЖТ направлено на предотвращение возникновения летальных аномальных сердечных ритмов и на быстрое восстановление нормального ритма, если они все же возникают. Поскольку аритмии при CPVT обычно возникают в то время, когда сердце подвергается воздействию высоких уровней адреналина или других подобных химических веществ (катехоламинов), многие методы лечения CPVT направлены на снижение уровней катехоламинов, воздействию которых подвергается сердце, или блокирование их воздействия на сердце. сердце. [8]
Лечение первой линии для людей с ХПВТ включает в себя рекомендации по образу жизни. Это включает в себя отказ от спортивных состязаний, очень напряженных физических упражнений и стрессовых ситуаций, поскольку в этих условиях может возникнуть высокий уровень адреналина, что может спровоцировать аритмии. [2]
Медикамент
[ редактировать ]Некоторые лекарства могут быть полезны людям с CPVT. Основой лечения являются бета-блокаторы , которые блокируют воздействие адреналина и других катехоламинов на сердце, снижая вероятность развития аномальных сердечных ритмов. [2] Доказано , что из всех бета-блокаторов надолол является наиболее эффективным для лечения ХПЖВ. [25] Этот препарат снижает частоту сердечных сокращений в большей степени, чем другие бета-блокаторы, и его нужно принимать только один раз в день, что снижает риск пропуска дозы. Надолол может быть трудно достать, и он доступен не во всех странах, а альтернативным бета-блокатором, подходящим для использования при ХПЖВ, может быть пропранолол , который, однако, имеет более сложный режим дозирования. [25] Недавно опубликованные данные свидетельствуют о том, что использование селективных бета-блокаторов , таких как атенолол , бисопролол или метопролол , связано с очень высокой частотой неудач лечения. [25]
Флекаинид класса 1с — это антиаритмический препарат , который рекомендуется пациентам с ХПЖТ, у которых наблюдаются нарушения сердечного ритма, несмотря на прием бета-блокаторов. [2] Флекаинид снижает риск аритмий у пациентов с CPVT, но остается неясным, как флекаинид достигает этого. Некоторые предполагают, что флекаинид напрямую взаимодействует с сердечными рианодиновыми рецепторами, что часто является аномальным у пациентов с ХПЖТ, в то время как другие предполагают, что антиаритмические эффекты флекаинида полностью зависят от его эффекта блокирования натриевых каналов . [26]
Верапамил — антагонист кальциевых каналов , который в сочетании с бета-блокаторами может снизить риск аритмий у пациентов с ХПЖВ. [27] Пропафенон — еще одно антиаритмическое средство, которое может снизить риск аритмий, возможно, за счет прямого воздействия на рианодиновый рецептор. [26]
Симпатическая денервация
[ редактировать ]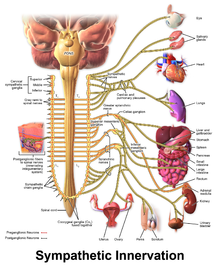
У некоторых людей с ХППЖ продолжают наблюдаться опасные для жизни аритмии, несмотря на фармацевтическую терапию. В этом случае можно использовать хирургическую процедуру, чтобы воздействовать на нервы, питающие сердце, которые сообщаются с помощью катехоламинов. [2] Совокупность нервов, известная как симпатическая нервная система, снабжает сердце и другие органы. Эти нервы при активации заставляют сердце биться сильнее и быстрее. [28] Симпатическая нервная система использует норадреналин , катехоламин, в качестве химического мессенджера или нейромедиатора , который может способствовать развитию аритмий у пациентов с CPVT. [2]
Чтобы предотвратить это, область симпатической нервной системы можно намеренно повредить во время операции, известной как сердечная симпатическая денервация или симпатэктомия. [29] Хотя симпатическая нервная система питается сердцем с обеих сторон, во время симпатэктомии часто затрагиваются только левосторонние нервы, хотя может потребоваться разрушение нервов с обеих сторон. [29] Благодаря этому процессу симпатэктомия эффективна для снижения, но не устранения риска дальнейших опасных для жизни аритмий. [4]
Имплантируемый кардиовертер-дефибриллятор
[ редактировать ]
В то время как медикаментозное лечение и симпатэктомия направлены в первую очередь на предотвращение возникновения аномальных сердечных ритмов, имплантируемый дефибриллятор (ИКД) может использоваться для лечения аритмий, которые лекарства не смогли предотвратить, и восстановления нормального сердечного ритма. [2] Эти устройства, обычно имплантируемые под кожу в передней части грудной клетки ниже плеча, могут постоянно контролировать сердце на предмет аномальных сердечных ритмов. Если обнаружена опасная для жизни аритмия, устройство может нанести небольшой электрический разряд, чтобы остановить аномальный ритм и перезапустить сердце. [1]
Имплантируемые дефибрилляторы часто рекомендуются пациентам с CPVT, у которых наблюдались потери сознания, желудочковые аритмии или остановка сердца, несмотря на прием соответствующих лекарств. [2] Эти устройства спасают жизни, поскольку было показано, что их использование обеспечивает значительное улучшение выживаемости пациентов с CPVT. [25] Было высказано предположение, что возникающий всплеск адреналина, вызванный болью от поражения электрическим током от устройства, теоретически может вызвать цикл повторяющихся аритмий и шоков, известный как электрический шторм. [4] поэтому людям с имплантированным ИКД для CPVT настоятельно рекомендуется принимать бета-блокаторы, чтобы ослабить действие адреналина. [4]
Прогноз
[ редактировать ]У значительной части людей с CPVT будет наблюдаться опасное для жизни нарушение сердечного ритма, при этом оценки этого риска варьируются от 13 до 20% в течение 7–8 лет. [3] Опасные для жизни аритмии более вероятны, если CPVT был диагностирован в детстве, если человек с CPVT не принимает бета-блокаторы и если аритмии возникают при тестировании с физической нагрузкой, несмотря на прием бета-блокаторов. [2]
Во время лечения надололом , предпочтительным бета-блокатором для лечения ХППВ, частота событий оценивается в 0,8% в год. У пациентов, получающих бета-блокаторы, опасные для жизни аритмии более вероятны, если человек уже пережил остановку сердца , перенес обморок или является носителем вызывающих заболевание мутаций, затрагивающих высококонсервативную концевую часть гена RYR2 . [25] называемый С-концевым доменом (аминокислоты 4889–4969). [30]
Эпидемиология
[ редактировать ]По оценкам, CPVT поражает 1 из 10 000 человек. [4] Симптомы CPVT обычно впервые наблюдаются в первом или втором десятилетии жизни. [25] и более 60% больных испытывают первый эпизод обморока или остановки сердца к 20 годам. [1] Обмороки во время физических упражнений или сильные эмоции следует рассматривать как тревожный сигнал. [25] так как это особенность заболевания. Наконец, небольшое количество пациентов может проявиться в более позднем возрасте, и генетическое тестирование у этих пациентов часто не позволяет выявить причинный ген. [4]
История
[ редактировать ]В 1960 году норвежский кардиолог Кнут Берг опубликовал отчет о трех сестрах, у которых были потери сознания во время физических упражнений или эмоционального стресса, что сейчас считается первым описанием CPVT. [8] Двунаправленная желудочковая тахикардия, связанная с этим состоянием, была описана в 1975 году. [1] Термин «катехоламинергическая полиморфная желудочковая тахикардия» впервые был использован в 1978 году. [5] В 1999 году первая генетическая мутация, вызвавшая идентификацию CPVT, была локализована в хромосоме 1q42-q43. [31] который был обнаружен в 2001 году как вариант гена RYR2. [6] Продолжающиеся исследования направлены на определение лучших методов лечения ХПЖТ, улучшение понимания механизмов аритмии и выявление других генов, вызывающих это состояние. [32]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час Лю Н., Наполитано С., Приори С. (2013). Глава 31: Катехоламинергическая полиморфная желудочковая тахикардия. В кн.: Электрические болезни сердца. Том 2, Диагностика и лечение . Артур Уайльд, Игорь Гусак, Майкл Дж. Акерман, Вин-Куанг Шен и Чарльз Анцелевич (2-е изд.). Лондон: Спрингер. ISBN 978-1-4471-4978-1 . OCLC 846445829 .
- ^ Jump up to: а б с д и ж г час я дж к л м Приори С.Г., Бломстрем-Лундквист С., Маццанти А., Блом Н., Боргрефе М., Камм Дж., Эллиотт П.М., Фицсаймонс Д., Хатала Р., Хиндрикс Г., Кирххоф П., Кьельдсен К., Кук К.Х., Эрнандес-Мадрид А., Николау Н., Нореквал ТМ, Сполдинг С., Ван Вельдхуизен DJ (ноябрь 2015 г.). «Руководство ESC по ведению пациентов с желудочковыми аритмиями и профилактике внезапной сердечной смерти, 2015 г.: Рабочая группа по ведению пациентов с желудочковыми аритмиями и предотвращению внезапной сердечной смерти Европейского общества кардиологов (ESC). Одобрено : Ассоциация Европейской детской и врожденной кардиологии (AEPC)» . Европейский кардиологический журнал . 36 (41): 2793–2867. doi : 10.1093/eurheartj/ehv316 . hdl : 11380/1140282 . ПМИД 26320108 .
- ^ Jump up to: а б Хаяши М., Денджой И., Экстрамиана Ф., Мальтрет А., Бюиссон Н.Р., Лупоглазофф Дж.М., Клуг Д., Хаяши М., Такацуки С., Виллейн Е., Камблок Дж., Мессали А., Гишени П., Лунарди Дж., Линхардт А. (май 2009 г.). «Частота и факторы риска аритмических событий при катехоламинергической полиморфной желудочковой тахикардии» . Тираж . 119 (18): 2426–34. doi : 10.1161/CIRCULATIONAHA.108.829267 . ПМИД 19398665 .
- ^ Jump up to: а б с д и ж г час Обейсекере М.Н., Анцелевич С., Кран А.Д. (февраль 2015 г.). «Лечение желудочковых аритмий при подозрении на каналопатии» . Кровообращение: аритмия и электрофизиология . 8 (1): 221–31. дои : 10.1161/CIRCEP.114.002321 . ПМИД 25691556 .
- ^ Jump up to: а б Кумель, Филипп; Фидель, Дж; Люсет, В; Аттуэль, П; Буврен, Ю (1978). «Вызванные катехоламинами тяжелые желудочковые аритмии с синдромом Адамса-Стокса у детей: отчет о четырех случаях». Британский кардиологический журнал .
- ^ Jump up to: а б Приори, Сильвия Г.; Наполитано, Карло; Тисо, Наташа; Мемми, Мирелла; Виньяти, Габриэле; Блуаза, Рафаэлла; Соррентино, Винченцо; Даниэли, Джан Антонио (16 января 2001 г.). «Мутации в гене сердечного рианодинового рецептора (hRyR2) лежат в основе катехоламинергической полиморфной желудочковой тахикардии» . Тираж . 103 (2): 196–200. дои : 10.1161/01.CIR.103.2.196 . ISSN 0009-7322 . ПМИД 11208676 . S2CID 5872126 .
- ^ Jump up to: а б Лю Н., Коломби Б., Райчева-Буоно Е.В., Блуаз Р., Приори С.Г. (май 2007 г.). «Катехоламинергическая полиморфная желудочковая тахикардия». Герц . 32 (3): 212–7. дои : 10.1007/s00059-007-2975-2 . ПМИД 17497254 . S2CID 40499394 .
- ^ Jump up to: а б с д и ж г час Ливе К.В., ван дер Верф С., Уайльд А.А. (май 2016 г.). «Катехоламинергическая полиморфная желудочковая тахикардия» . Тиражный журнал . 80 (6): 1285–91. doi : 10.1253/circj.CJ-16-0326 . ПМИД 27180891 .
- ^ Тристани-Фирузи М., Этеридж С.П. (2013). «Глава 32 - Синдромы Андерсена-Тавиля и Тимоти». В Гусак I, Анцелевич С (ред.). Электрические болезни сердца. Том 1, Основные основы и первичные электрические заболевания (2-е изд.). Лондон: Спрингер. ISBN 978-1-4471-4881-4 . OCLC 841465583 .
- ^ Jump up to: а б с д и ж г час я дж Приори С.Г., Чен С.Р. (апрель 2011 г.). «Наследственная дисфункция обработки Ca2+ саркоплазматического ретикулума и аритмогенеза» . Исследование кровообращения . 108 (7): 871–83. дои : 10.1161/CIRCRESAHA.110.226845 . ПМК 3085083 . ПМИД 21454795 .
- ^ Jump up to: а б с д и ж г Венетуччи Л., Денегри М., Наполитано С., Приори С.Г. (октябрь 2012 г.). «Наследственные кальциевые каналопатии в патофизиологии аритмий». Обзоры природы Кардиология . 9 (10): 561–75. дои : 10.1038/nrcardio.2012.93 . ПМИД 22733215 . S2CID 24883043 .
- ^ Jump up to: а б с Берс, Д.М. (2001). Связь возбуждения-сокращения и сократительная сила сердца (2-е изд.). Дордрехт: Kluwer Academic Publishers. ISBN 978-0-7923-7157-1 . OCLC 47659382 .
- ^ Jump up to: а б Эйснер Д.А., Колдуэлл Дж.Л., Кистамас К., Траффорд А.В. (июль 2017 г.). «Кальций и связь возбуждения-сокращения в сердце» . Исследование кровообращения . 121 (2): 181–195. дои : 10.1161/CIRCRESAHA.117.310230 . ПМК 5497788 . ПМИД 28684623 .
- ^ Берс Д.М. (январь 2002 г.). «Кальций и сердечные ритмы: физиологические и патофизиологические» . Исследование кровообращения . 90 (1): 14–7. дои : 10.1161/res.90.1.14 . ПМИД 11786512 .
- ^ Погвизд С.М., Берс Д.М. (февраль 2004 г.). «Клеточная основа триггерных аритмий при сердечной недостаточности». Тенденции сердечно-сосудистой медицины . 14 (2): 61–6. дои : 10.1016/j.tcm.2003.12.002 . ПМИД 15030791 .
- ^ Jump up to: а б с д и Приори, Сильвия Г.; Маццанти, Андреа; Сантьяго, Деметрио Дж.; Кукавица, Дени; Транкуччо, Алессандро; Ковачич, Джейсон К. (май 2021 г.). «Точная медицина при катехоламинергической полиморфной желудочковой тахикардии» . Журнал Американского колледжа кардиологов . 77 (20): 2592–2612. doi : 10.1016/j.jacc.2020.12.073 . ПМИД 34016269 . S2CID 235072676 .
- ^ Лахат, Хадас; Прас, Илон; Олендер, Цвия; Авидан, Нили; Бен-Ашер, Эдна; Мужик, Орна; Леви-Ниссенбаум, Этгар; Хури, Асад; Лорбер, Авраам; Гольдман, Болеслав; Ланцет, Дорон (декабрь 2001 г.). «Миссенс-мутация в высококонсервативной области CASQ2 связана с аутосомно-рецессивной катехоламин-индуцированной полиморфной желудочковой тахикардией в бедуинских семьях из Израиля» . Американский журнал генетики человека . 69 (6): 1378–1384. дои : 10.1086/324565 . ПМЦ 1235548 . ПМИД 11704930 .
- ^ Ру-Бюиссон, Натали; Каше, морской пехотинец; Фурест-Льёвен, Энн; Фоконье, Джереми; Брокар, Жюли; Данжуа, Изабель; Дюран, Филипп; Гишени, Паскаль; Киндт, Флоренция; Ленхардт, Антуан; Ле Марек, Эрве (15 июня 2012 г.). «Отсутствие триадина, белка комплекса высвобождения кальция, ответственно за сердечную аритмию с внезапной смертью у человека» . Молекулярная генетика человека . 21 (12): 2759–2767. дои : 10.1093/hmg/dds104 . ISSN 0964-6906 . ПМЦ 3363337 . ПМИД 22422768 .
- ^ Jump up to: а б Фаджиони М, Крыштал Д.О., Кнольманн БК (август 2012 г.). «Мутации кальсеквестрина и катехоламинергическая полиморфная желудочковая тахикардия» . Детская кардиология . 33 (6): 959–67. дои : 10.1007/s00246-012-0256-1 . ПМЦ 3393815 . ПМИД 22421959 .
- ^ Лю Н., Priori SG (январь 2008 г.). «Нарушение гомеостаза кальция и аритмогенеза, вызванное мутациями сердечного рианодинового рецептора и кальсеквестрина» . Сердечно-сосудистые исследования . 77 (2): 293–301. дои : 10.1093/cvr/cvm004 . ПМИД 18006488 .
- ^ Jump up to: а б Ландстрем А.П., Добрев Д., Веренс XH (июнь 2017 г.). «Сигнализация кальция и сердечные аритмии» . Исследование кровообращения . 120 (12): 1969–1993. дои : 10.1161/CIRCRESAHA.117.310083 . ПМК 5607780 . ПМИД 28596175 .
- ^ Jump up to: а б с д Priori SG, Wilde AA, Horie M, Cho Y, Behr ER, Berul C, Blom N, Brugada J, Chiang CE, Huikuri H, Kannankeril P, Krahn A, Leenhardt A, Moss A, Schwartz PJ, Shimizu W, Tomaselli G , Трейси С. (декабрь 2013 г.). «Заявление экспертов HRS/EHRA/APHRS о диагностике и ведении пациентов с наследственными синдромами первичной аритмии: документ одобрен HRS, EHRA и APHRS в мае 2013 г. и ACCF, AHA, PACES и AEPC в июне 2013 г.» . Сердечный ритм . 10 (12): 1932–63. дои : 10.1016/j.hrthm.2013.05.014 . ПМИД 24011539 .
- ^ Обейсекере М.Н., Кляйн Г.Дж., Моди С., Леонг-Сит П., Гула Л.Дж., Йи Р., Сканес А.К., Кран А.Д. (декабрь 2011 г.). «Как проводить и интерпретировать провокационные тесты для диагностики синдрома Бругада, синдрома удлиненного интервала QT и катехоламинергической полиморфной желудочковой тахикардии» . Кровообращение: аритмия и электрофизиология . 4 (6): 958–64. дои : 10.1161/CIRCEP.111.965947 . ПМИД 22203660 .
- ^ Семсарян С., Инглес Дж. (октябрь 2016 г.). «Молекулярное вскрытие жертв наследственной аритмии» . Журнал аритмии . 32 (5): 359–365. дои : 10.1016/j.joa.2015.09.010 . ПМК 5063264 . ПМИД 27761159 .
- ^ Jump up to: а б с д и ж г Маццанти, Андреа; Кукавица, Дени; Транкуччо, Алессандро; Мемми, Мирелла; Блуаза, Рафаэлла; Гамбелли, Патрик; Марино, Майра; Ортис-Дженга, Мартин; Морини, Массимо; Монтефорте, Никола; Джордано, Умберто (30 марта 2022 г.). «Исходы пациентов с катехоламинергической полиморфной желудочковой тахикардией, получавших β-блокаторы» . JAMA Кардиология . 7 (5): 504–512. дои : 10.1001/jamacardio.2022.0219 . ISSN 2380-6583 . ПМЦ 8968697 . ПМИД 35353122 .
- ^ Jump up to: а б Ливе К.В., Уайльд А.А., ван дер Верф С. (май 2016 г.). «Роль флекаинида в лечении катехоламинергической полиморфной желудочковой тахикардии» . Обзор аритмии и электрофизиологии . 5 (1): 45–9. дои : 10.15420/aer.2016.3.3 . ПМЦ 4939313 . ПМИД 27403293 .
- ^ Россо Р., Калман Дж.М., Роговски О., Диамант С., Биргер А., Бинер С., Белхассен Б., Вискин С. (сентябрь 2007 г.). «Блокаторы кальциевых каналов и бета-блокаторы по сравнению с одними бета-блокаторами для предотвращения аритмий, вызванных физической нагрузкой, при катехоламинергической полиморфной желудочковой тахикардии». Сердечный ритм . 4 (9): 1149–54. дои : 10.1016/j.hrthm.2007.05.017 . ПМИД 17765612 .
- ^ Шивкумар К., Аджиджола О.А., Ананд И., Армор Дж.А., Чен П.С., Эслер М., Де Феррари ГМ, Фишбейн М.К., Голдбергер Дж.Дж., Харпер Р.М., Джойнер М.Дж., Халса С.С., Кумар Р., Лейн Р., Махаджан А., По С., Шварц П.Дж., Сомерс В.К., Вальдеррабано М., Васеги М., Зипес Д.П. (июль 2016 г.). «Клиническая нейрокардиология, определяющая ценность сердечно-сосудистой терапии, основанной на нейробиологии» . Журнал физиологии . 594 (14): 3911–54. дои : 10.1113/JP271870 . ПМЦ 4945719 . ПМИД 27114333 .
- ^ Jump up to: а б Шварц П.Дж., генеральный менеджер De Ferrari, Пульезе Л. (июнь 2017 г.). «Сердечная симпатическая денервация 100 лет спустя: Джоннеско никогда бы в это не поверил». Международный журнал кардиологии . 237 : 25–28. doi : 10.1016/j.ijcard.2017.03.020 . ПМИД 28318666 .
- ^ Дхинвал, Сонали; Лобо, Джошуа; Кабра, Ванесса; Сантьяго, Деметрио Дж.; Наяк, Ашок Р.; Драйден, Келли; Самсо, Монтсеррат (23 мая 2017 г.). «Модель аллостеризма сердечного рианодинового рецептора, опосредованного фосфорилированием и FKBP12.6, основанная на крио-ЭМ» . Научная сигнализация . 10 (480): eaai8842. дои : 10.1126/scisignal.aai8842 . ISSN 1945-0877 . ПМИД 28536302 . S2CID 1931284 .
- ^ Свон Х., Пийппо К., Виитасало М., Хейккиля П., Паавонен Т., Кайнулайнен К., Кере Дж., Кето П., Контула К., Тойвонен Л. (декабрь 1999 г.). «Аритмическое нарушение, картированное на хромосоме 1q42-q43, вызывает злокачественную полиморфную желудочковую тахикардию в структурно нормальном сердце» . Журнал Американского колледжа кардиологов . 34 (7): 2035–42. дои : 10.1016/S0735-1097(99)00461-1 . ПМИД 10588221 .
- ^ Бехере С.П., Вайндлинг С.Н. (2016). «Катехоламинергическая полиморфная желудочковая тахикардия: захватывающая новая эра» . Анналы детской кардиологии . 9 (2): 137–46. дои : 10.4103/0974-2069.180645 . ПМЦ 4867798 . ПМИД 27212848 .