EF-Вы
| Фактор удлинения термо нестабильный | |||
|---|---|---|---|
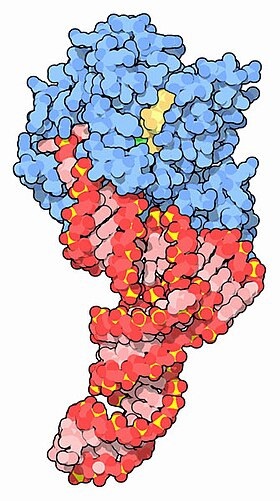 EF-Tu (синий) в комплексе с тРНК (красный) и GTP (желтый) [ 1 ] | |||
| Идентификаторы | |||
| Символ | EF-Вы | ||
| Пфам | ГТП_ЭФТУ | ||
| Пфам Клан | CL0023 | ||
| ИнтерПро | ИПР004541 | ||
| PROSITE | PDOC00273 | ||
| КАТ | 1 ЭТУ | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1ЭТУ / ОБЛАСТЬ ПРИМЕНЕНИЯ / СУПФАМ | ||
| CDD | cd00881 | ||
| |||
| EF-Вы | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | GTP_EFTU_D2 | ||
| Пфам | PF03144 | ||
| ИнтерПро | ИПР004161 | ||
| CDD | cd01342 | ||
| |||
| Фактор элонгации Tu домен 3 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | GTP_EFTU_D3 | ||
| Пфам | PF03143 | ||
| ИнтерПро | ИПР004160 | ||
| CDD | cd01513 | ||
| |||
EF-Tu ( термонестабильный фактор элонгации ) — прокариотический фактор элонгации, ответственный за катализацию связывания аминоацил -тРНК (аа-тРНК) с рибосомой . Это G-белок , который облегчает отбор и связывание аа-тРНК с А-сайтом рибосомы. что отражает его решающую роль в трансляции . EF-Tu является одним из наиболее распространенных и высококонсервативных белков у прокариот, [ 2 ] [ 3 ] [ 4 ] Он обнаружен в митохондриях эукариот как TUFM . [ 5 ]
Как семейство факторов элонгации, EF-Tu также включает в себя его эукариотический и архейный гомолог, альфа-субъединицу eEF-1 (EF-1A).
Фон
[ редактировать ]Факторы элонгации являются частью механизма синтеза новых белков посредством трансляции в рибосоме. Транспортные РНК (тРНК) несут отдельные аминокислоты , которые интегрируются в последовательность белка, и имеют антикодон для конкретной аминокислоты, которой они заряжены. Информационная РНК (мРНК) несет генетическую информацию, которая кодирует первичную структуру белка, и содержит кодоны , кодирующие каждую аминокислоту. Рибосома создает белковую цепь, следуя коду мРНК и интегрируя аминокислоту аминоацил-тРНК (также известную как заряженная тРНК) в растущую полипептидную цепь. [ 6 ] [ 7 ]
На рибосоме имеется три участка связывания тРНК. Это аминоацил/акцепторный сайт (сокращенно А), пептидильный сайт (сокращенно Р) и сайт выхода (сокращенно Е). P-сайт удерживает тРНК, связанную с синтезируемой полипептидной цепью, а A-сайт является местом связывания заряженной тРНК с антикодоном, комплементарным кодону мРНК, связанному с этим сайтом. После связывания заряженной тРНК с А-участком пептидная связь между растущей полипептидной цепью тРНК Р-участка и аминокислотой тРНК А-участка образуется , и весь полипептид переносится из Р-участка. тРНК к тРНК А-сайта. Затем в процессе, катализируемом прокариотическим фактором элонгации EF-G (исторически известным как транслоказа), происходит скоординированная транслокация тРНК и мРНК, при этом тРНК P-сайта перемещается в E-сайт, где она диссоциирует от рибосомы. , и тРНК А-сайта перемещается, чтобы занять свое место в Р-сайте. [ 6 ] [ 7 ]
Биологические функции
[ редактировать ]
Синтез белка
[ редактировать ]EF-Tu участвует в процессе элонгации полипептида при синтезе белка. У прокариот основной функцией EF-Tu является транспортировка правильной аа-тРНК к А-сайту рибосомы. Как G-белок, он использует GTP для облегчения своей функции. Вне рибосомы EF-Tu образует комплекс с GTP (EF-Tu • GTP) с аа-тРНК, образуя стабильный тройной комплекс EF-Tu • GTP • аа-тРНК . [ 8 ] EF-Tu • GTP связывает все правильно заряженные аа-тРНК с примерно одинаковым сродством, за исключением тех, которые заряжены остатками инициации и селеноцистеином . [ 9 ] [ 10 ] Этого можно достичь, поскольку, хотя разные аминокислотные остатки имеют разные свойства боковой цепи , тРНК, связанные с этими остатками, имеют разные структуры, чтобы компенсировать различия в аффинности связывания боковой цепи. [ 11 ] [ 12 ]
Связывание аа-тРНК с EF-Tu • GTP позволяет транслоцировать тройной комплекс в А-участок активной рибосомы, в котором антикодон тРНК связывается с кодоном мРНК. Если правильный антикодон связывается с кодоном мРНК, рибосома меняет конфигурацию и изменяет геометрию GTPase- домена EF-Tu, что приводит к гидролизу GTP, связанного с EF-Tu, до GDP и Pi . Таким образом, рибосома функционирует как белок, активирующий ГТФазу (GAP) для EF-Tu. При гидролизе GTP конформация EF-Tu резко меняется и диссоциирует от комплекса аа-тРНК и рибосомы. [ 4 ] [ 13 ] Затем аа-тРНК полностью входит в А-участок, где ее аминокислота приближается к полипептиду Р-участка , а рибосома катализирует ковалентный перенос полипептида на аминокислоту. [ 10 ]
В цитоплазме на деактивированный EF-Tu • GDP действует прокариотический фактор элонгации EF-Ts , который заставляет EF-Tu высвободить связанный GDP. в 5–10 раз выше, чем GDP При диссоциации EF-T EF-Tu способен образовывать комплекс с GTP из-за того, что концентрация GTP в цитоплазме , что приводит к реактивации EF-Tu • GTP, который затем может связываться с еще одна аа-тРНК. [ 8 ] [ 13 ]
Поддержание точности перевода
[ редактировать ]EF-Tu способствует точности перевода тремя способами. При трансляции фундаментальная проблема заключается в том, что почти родственные антикодоны обладают такой же аффинностью связывания с кодоном, как и родственные антикодоны, так что связывания антикодонов с кодонами одного только в рибосоме недостаточно для поддержания высокой точности трансляции. Это решается тем, что рибосома не активирует GTPase-активность EF-Tu, если тРНК в A-сайте рибосомы не соответствует кодону мРНК, что преимущественно увеличивает вероятность выхода неправильной тРНК из рибосомы. [ 14 ] Кроме того, независимо от совпадения тРНК, EF-Tu также вызывает задержку после освобождения от аа-тРНК, прежде чем аа-тРНК полностью войдет в А-сайт (процесс, называемый аккомодацией). Этот период задержки представляет собой вторую возможность для неправильно заряженных аа-тРНК выйти из А-сайта до того, как неправильная аминокислота будет необратимо добавлена к полипептидной цепи. [ 15 ] [ 16 ] Третий механизм — это менее изученная функция EF-Tu — грубая проверка ассоциаций аа-тРНК и отбраковка комплексов, в которых аминокислота не связана с правильной кодирующей ее тРНК. [ 11 ]
Другие функции
[ редактировать ]EF-Tu был обнаружен в больших количествах в цитоскелетах бактерий, локализуясь под клеточной мембраной вместе с MreB , элементом цитоскелета, который поддерживает форму клеток. [ 17 ] [ 18 ] Было показано, что дефекты EF-Tu приводят к дефектам морфологии бактерий. [ 19 ] Кроме того, EF-Tu обладает некоторыми шапероноподобными характеристиками, при этом некоторые экспериментальные данные позволяют предположить, что он способствует рефолдингу ряда денатурированных белков in vitro . [ 20 ] [ 21 ] Было обнаружено, что EF-Tu «подсвечивает» поверхность клеток патогенных бактерий Staphylococcus aureus , Mycoplasma pneumoniae и Mycoplasma hyopneumoniae , где EF-Tu процессируется и может связываться с рядом молекул-хозяев. [ 22 ] У Bacillus cereus EF-Tu также подрабатывает на поверхности, где действует как сенсор окружающей среды и связывается с веществом P. [ 23 ]
Структура
[ редактировать ]
EF-Tu представляет собой мономерный белок с молекулярной массой около 43 кДа в Escherichia coli . [ 24 ] [ 25 ] [ 26 ] Белок состоит из трех структурных доменов : GTP-связывающего домена и двух олигонуклеотид -связывающих доменов, часто называемых доменом 2 и доменом 3. N-концевой домен I EF-Tu является GTP-связывающим доменом. Он состоит из шести бета-цепей , окруженных шестью альфа-спиралями . [ 8 ] Домены II и III EF-Tu, олигонуклеотидсвязывающие домены, имеют бета-цилиндра . структуру [ 27 ] [ 28 ]
GTP-связывающий домен I претерпевает резкие конформационные изменения при гидролизе GTP до GDP, что позволяет EF-Tu диссоциировать от аа-тРНК и покинуть рибосому. [ 29 ] Реактивация EF-Tu достигается за счет связывания GTP в цитоплазме, что приводит к значительному конформационному изменению, которое реактивирует сайт связывания тРНК EF-Tu. В частности, связывание GTP с EF-Tu приводит к повороту домена I на ~90° относительно доменов II и III, обнажая остатки активного сайта связывания тРНК. [ 30 ]
Домен 2 имеет структуру бета-цилиндра и участвует в связывании с заряженной тРНК. [ 31 ] Этот домен структурно связан с C-концевым доменом EF2 , с которым он имеет слабое сходство последовательностей. Этот домен также обнаружен в других белках, таких как фактор инициации трансляции IF-2 и белки, устойчивые к тетрациклину . Домен 3 представляет собой С-концевой домен, который имеет структуру бета-цилиндра и участвует в связывании как с заряженной тРНК, так и с EF1B (или EF-T). [ 32 ]
Эволюция
[ редактировать ]Этот раздел может потребовать очистки Википедии , чтобы соответствовать стандартам качества . Конкретная проблема такова: все еще ужасно, подумайте о том, чтобы просто исключить раздел «дальше». ( декабрь 2023 г. ) |
GTP-связывающий домен консервативен как в EF-1alpha/EF-Tu, так и в EF-2 / EF-G и, таким образом, кажется типичным для GTP-зависимых белков, которые связывают неинициаторные тРНК с рибосомой . Семейство GTP-связывающих факторов трансляции также включает эукариот. пептидной цепи фактора высвобождения GTP-связывающие субъединицы [ 33 ] и фактор высвобождения пептидной цепи прокариот 3 (RF-3); [ 34 ] прокариотический гомолог GTP-связывающий белок lepA и его у дрожжей (GUF1) и Caenorhabditis elegans (ZK1236.1); дрожжи HBS1; [ 35 ] крысиный Eef1a1 (ранее «статин S1»); [ 36 ] и прокариотический селеноцистеин -специфичный фактор элонгации selB. [ 37 ]
Актуальность заболевания
[ редактировать ]Наряду с рибосомой EF-Tu является одной из наиболее важных мишеней для антибиотиками . ингибирования трансляции, опосредованного [ 8 ] Антибиотики, нацеленные на EF-Tu, можно отнести к одной из двух групп в зависимости от механизма действия и к одному из четырех структурных семейств. В первую группу входят антибиотики пульвомицин и GE2270A, которые ингибируют образование тройного комплекса. [ 38 ] Вторая группа включает антибиотики кирромицин и энацилоксин и предотвращает высвобождение EF-Tu из рибосомы после гидролиза ГТФ. [ 39 ] [ 40 ] [ 41 ]
См. также
[ редактировать ]- Прокариотические факторы элонгации
- ЭФ-Ц (коэффициент удлинения термостабильный)
- EF-G (коэффициент удлинения G)
- EF-P (коэффициент удлинения P)
- эЭФ-1
- EFR (EF-Ваш приемник)
Ссылки
[ редактировать ]- ^ PDB Молекула месяца EF-Tu
- ^ Вейланд А., Хармарк К., Кул Р.Х., Анборг П.Х., Пармеджиани А. (март 1992 г.). «Фактор элонгации Tu: молекулярный переключатель в биосинтезе белка» . Молекулярная микробиология . 6 (6): 683–8. дои : 10.1111/j.1365-2958.1992.tb01516.x . ПМИД 1573997 .
- ^ «TIGR00485: EF-Ту» . Национальный центр биотехнологической информации . 3 марта 2017 г.
- ^ Перейти обратно: а б Ямамото Х., Цинь Ю., Ахенбах Дж., Ли К., Киджек Дж., Спан СМ., Нирхаус К.Х. (февраль 2014 г.). «EF-G и EF4: транслокация и обратная транслокация на бактериальной рибосоме». Обзоры природы. Микробиология . 12 (2): 89–100. дои : 10.1038/nrmicro3176 . ПМИД 24362468 . S2CID 27196901 .
- ^ Линг М., Меранте Ф., Чен Х.С., Дафф С., Дункан А.М., Робинсон Б.Х. (ноябрь 1997 г.). «Ген фактора элонгации митохондрий человека tu (EF-Tu): последовательность кДНК, геномная локализация, геномная структура и идентификация псевдогена». Джин . 197 (1–2): 325–36. дои : 10.1016/S0378-1119(97)00279-5 . ПМИД 9332382 .
- ^ Перейти обратно: а б Лаурсен Б.С., Соренсен Х.П., Мортенсен К.К., Сперлинг-Петерсен Х.У. (март 2005 г.). «Инициация синтеза белка у бактерий» . Обзоры микробиологии и молекулярной биологии . 69 (1): 101–23. дои : 10.1128/MMBR.69.1.101-123.2005 . ПМЦ 1082788 . ПМИД 15755955 .
- ^ Перейти обратно: а б Рамакришнан V (февраль 2002 г.). «Строение рибосом и механизм трансляции» . Клетка . 108 (4): 557–72. дои : 10.1016/s0092-8674(02)00619-0 . ПМИД 11909526 . S2CID 2078757 .
- ^ Перейти обратно: а б с д Краб И.М., Пармеджиани А (1 января 2002 г.). Механизмы EF-Tu, пионера ГТФазы . Том. 71. стр. 513–51. дои : 10.1016/S0079-6603(02)71050-7 . ISBN 9780125400718 . ПМИД 12102560 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ «Фактор элонгации трансляции EFTu/EF1A, бактериальная/органелла (IPR004541)» . ИнтерПро .
- ^ Перейти обратно: а б Диван, Джойс (2008). «Перевод: Синтез белка» . Политехнический институт Ренсселера . Архивировано из оригинала 30 июня 2017 г. Проверено 9 марта 2017 г.
- ^ Перейти обратно: а б ЛаРивьер Ф.Дж., Вольфсон А.Д., Уленбек О.К. (октябрь 2001 г.). «Равномерное связывание аминоацил-тРНК с фактором элонгации Tu путем термодинамической компенсации». Наука . 294 (5540): 165–8. Бибкод : 2001Sci...294..165L . дои : 10.1126/science.1064242 . ПМИД 11588263 . S2CID 26192336 .
- ^ Луи А., Рибейро Н.С., Рид Б.Р., Юрнак Ф. (апрель 1984 г.). «Относительное сродство всех аминоацил-тРНК Escherichia coli к фактору элонгации Tu-GTP» . Журнал биологической химии . 259 (8): 5010–6. дои : 10.1016/S0021-9258(17)42947-4 . ПМИД 6370998 .
- ^ Перейти обратно: а б Кларк Б.Ф., Нюборг Дж. (февраль 1997 г.). «Тройной комплекс EF-Tu и его роль в биосинтезе белка». Современное мнение в области структурной биологии . 7 (1): 110–6. дои : 10.1016/s0959-440x(97)80014-0 . ПМИД 9032056 .
- ^ Нильссон Дж., Ниссен П. (июнь 2005 г.). «Факторы элонгации рибосомы». Современное мнение в области структурной биологии . 15 (3): 349–54. дои : 10.1016/j.sbi.2005.05.004 . ПМИД 15922593 .
- ^ Уитфорд ПК, Геггьер П., Альтман Р.Б., Бланшар СК, Онучич Дж.Н., Санбонмацу К.Ю. (июнь 2010 г.). «Аккомодация аминоацил-тРНК в рибосоме включает обратимые перемещения по множеству путей» . РНК . 16 (6): 1196–204. дои : 10.1261/rna.2035410 . ПМЦ 2874171 . ПМИД 20427512 .
- ^ Ноэль Дж. К., Уитфорд ПК (октябрь 2016 г.). «Как EF-Tu может способствовать эффективной корректуре аа-тРНК рибосомой» . Природные коммуникации . 7 : 13314. Бибкод : 2016NatCo...713314N . дои : 10.1038/ncomms13314 . ПМК 5095583 . ПМИД 27796304 .
- ^ Дефеу Суфо Х.Дж., Реймольд К., Линн У., Кнуст Т., Гешер Дж., Грауманн П.Л. (февраль 2010 г.). «Бактериальный фактор элонгации трансляции EF-Tu взаимодействует и колокализуется с актиноподобным белком MreB» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (7): 3163–8. Бибкод : 2010PNAS..107.3163D . дои : 10.1073/pnas.0911979107 . ПМК 2840354 . ПМИД 20133608 .
- ^ Майер Ф (01 января 2003 г.). «Цитоскелеты у прокариот». Международная клеточная биология . 27 (5): 429–38. дои : 10.1016/s1065-6995(03)00035-0 . ПМИД 12758091 . S2CID 40897586 .
- ^ Майер Ф (01 января 2006 г.). «Цитоскелетные элементы бактерий Mycoplasma pneumoniae, Thermoanaerobacterium sp. и Escherichia coli, выявленные с помощью электронной микроскопии». Журнал молекулярной микробиологии и биотехнологии . 11 (3–5): 228–43. дои : 10.1159/000094057 . ПМИД 16983198 . S2CID 23701662 .
- ^ Ришарм Дж. (ноябрь 1998 г.). «Белко-дисульфид-изомеразная активность фактора элонгации EF-Tu». Связь с биохимическими и биофизическими исследованиями . 252 (1): 156–61. дои : 10.1006/bbrc.1998.9591 . ПМИД 9813162 .
- ^ Кудлицки В., Коффман А., Крамер Г., Хардести Б. (декабрь 1997 г.). «Ренатурация роданезы с помощью фактора элонгации трансляции (EF) Tu. Рефолдинг белка за счет сгибания EF-Tu» . Журнал биологической химии . 272 (51): 32206–10. дои : 10.1074/jbc.272.51.32206 . ПМИД 9405422 .
- ^ Виджаджа, Майкл; Харви, Кейт Луиза; Хагеманн, Лиза; Берри, Иэн Джеймс; Яроцкий, Вероника Мария; Раймонд, Бенджамин Бернар Армандо; Такки, Джессика Ли; Грюндель, Энн; Стил, Джоэл Рики; Падула, Мэтью Пол; Чарльз, Ян Джордж; Думке, Роджер; Джорджевич, Стивен Филип (11 сентября 2017 г.). «Фактор элонгации Tu представляет собой многофункциональный и перерабатываемый белок, подрабатывающий по совместительству» . Научные отчеты . 7 (1): 11227. doi : 10.1038/s41598-017-10644-z . ISSN 2045-2322 . ПМК 5593925 .
- ^ Н'Диай, Ава Р.; Боррель, Валери; Расин, Петер-Жан; Кламенс, Томас; Депайрас, Сеголен; Джерси, Оливер; Шаак, Беатрис; Шевалье, Сильви; Лесуэтье, Оливер; Фейоле, Марк Дж.Дж. (04 февраля 2019 г.). «Механизм действия подрабатывающего белка EfTu как сенсора вещества P в Bacillus cereus» . Научные отчеты 9 1):1304.doi : ( 10.1038/s41598-018-37506-6 . ISSN 2045-2322 . ПМК 6361937 .
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 .
- ^ Кальдас Т.Д., Эль Ягуби А., Кохияма М., Ришарм Дж. (октябрь 1998 г.). «Очистка факторов элонгации EF-Tu и EF-G из Escherichia coli методом ковалентной хроматографии на тиол-сефарозе». Экспрессия и очистка белков . 14 (1): 65–70. дои : 10.1006/prep.1998.0922 . ПМИД 9758752 .
- ^ Выборг О., Андерсен Дж., Кнудсен Ч.Р., Кларк Б.Ф., Нюборг Дж. (август 1996 г.). «Картирование остатков Tu фактора элонгации Escherichia coli, участвующих в связывании аминоацил-тРНК» . Журнал биологической химии . 271 (34): 20406–11. дои : 10.1074/jbc.271.34.20406 . ПМИД 8702777 .
- ^ Вурмбах П., Нирхаус К.Х. (1 января 1979 г.). «Выделение факторов элонгации синтеза белка EF-Tu, EF-Ts и EF-G из Escherichia coli» . Нуклеиновые кислоты и синтез белка . Часть H. Методы энзимологии. Том. 60. С. 593–606 . дои : 10.1016/s0076-6879(79)60056-3 . ISBN 9780121819606 . ПМИД 379535 .
- ^ Ван Ю, Цзян Ю, Мейеринг-Фосс М, Спринцл М, Сиглер ПБ (август 1997 г.). «Кристаллическая структура комплекса ЭФ-Ту.ЭФ-Ц из Thermus thermophilus». Структурная биология природы . 4 (8): 650–6. дои : 10.1038/nsb0897-650 . ПМИД 9253415 . S2CID 10644042 .
- ^ Ниссен П., Кьельдгаард М., Тируп С., Полехина Г., Решетникова Л., Кларк Б.Ф., Нюборг Дж. (декабрь 1995 г.). «Кристаллическая структура тройного комплекса Phe-tRNAPhe, EF-Tu и аналога GTP». Наука 270 (5241): 1464–72. дои : 10.1126/science.270.5241.1464 . ПМИД 7491491 . S2CID 24817616 .
- ^ Мёллер В., Шиппер А., Амонс Р. (сентябрь 1987 г.). «Консервативная аминокислотная последовательность вокруг Arg-68 фактора элонгации артемии 1 альфа участвует в связывании гуаниновых нуклеотидов и аминоацил-транспортных РНК». Биохимия . 69 (9): 983–9. дои : 10.1016/0300-9084(87)90232-х . ПМИД 3126836 .
- ^ Кьелдгаард М., Ниссен П., Тируп С., Нюборг Дж. (сентябрь 1993 г.). «Кристаллическая структура фактора элонгации EF-Tu Thermus aquaticus в конформации GTP» . Структура 1 (1): 35–50. дои : 10.1016/0969-2126(93) 90007-4 ПМИД 8069622 .
- ^ Ниссен П., Кьельдгаард М., Тируп С., Полехина Г., Решетникова Л., Кларк Б.Ф., Нюборг Дж. (декабрь 1995 г.). «Кристаллическая структура тройного комплекса Phe-tRNAPhe, EF-Tu и аналога GTP». Наука 270 (5241): 1464–72. дои : 10.1126/science.270.5241.1464 . ПМИД 7491491 . S2CID 24817616 .
- ^ Ван Ю, Цзян Ю, Мейеринг-Фосс М, Спринцл М, Сиглер ПБ (август 1997 г.). «Кристаллическая структура комплекса ЭФ-Ту.ЭФ-Ц из Thermus thermophilus». Нат. Структура. Биол . 4 (8): 650–6. дои : 10.1038/nsb0897-650 . ПМИД 9253415 . S2CID 10644042 .
- ^ Стэнсфилд И., Джонс К.М., Кушниров В.В., Дагкесаманская А.Р., Позняковский А.И., Паушкин С.В., Ньеррас Ч.Р., Кокс Б.С., Тер-Аванесян М.Д., Туите М.Ф. (сентябрь 1995 г.). «Продукты генов SUP45 (eRF1) и SUP35 взаимодействуют, опосредуя терминацию трансляции у Saccharomyces cerevisiae» . ЭМБО Дж . 14 (17): 4365–73. дои : 10.1002/j.1460-2075.1995.tb00111.x . ПМЦ 394521 . ПМИД 7556078 .
- ^ Гренцманн Г., Брешемье-Бэй Д., Эрге-Амар В., Бэкингем Р.Х. (май 1995 г.). «Функция фактора высвобождения полипептидной цепи RF-3 в Escherichia coli. Действие RF-3 при терминации происходит преимущественно на UGA-содержащих стоп-сигналах» . Ж. Биол. Хим . 270 (18): 10595–600. дои : 10.1074/jbc.270.18.10595 . ПМИД 7737996 .
- ^ Нельсон Р.Дж., Цигельхоффер Т., Николет С., Вернер-Уошберн М., Крейг Э.А. (октябрь 1992 г.). «Машина трансляции и белок теплового шока массой 70 кД взаимодействуют в синтезе белка». Клетка . 71 (1): 97–105. дои : 10.1016/0092-8674(92)90269-I . ПМИД 1394434 . S2CID 7417370 .
- ^ Энн Д.К., Муцацос И.К., Накамура Т., Лин Х.Х., Мао П.Л., Ли М.Дж., Чин С., Лием Р.К., Ван Е (июнь 1991 г.). «Выделение и характеристика крысиного хромосомного гена полипептида (pS1), антигенно связанного со статинами» . Ж. Биол. Хим . 266 (16): 10429–37. дои : 10.1016/S0021-9258(18)99243-4 . ПМИД 1709933 .
- ^ Форчхаммер К., Лейнфельдер В., Бок А. (ноябрь 1989 г.). «Идентификация нового фактора трансляции, необходимого для включения селеноцистеина в белок». Природа . 342 (6248): 453–6. Бибкод : 1989Natur.342..453F . дои : 10.1038/342453a0 . ПМИД 2531290 . S2CID 4251625 .
- ^ Сельва Э., Беретта Г., Монтанини Н., Сэдлер Г.С., Гастальдо Л., Феррари П., Лоренцетти Р., Ландини П., Рипамонти Ф., Гольдштейн Б.П. (июль 1991 г.). «Антибиотик GE2270 a: новый ингибитор синтеза бактериального белка. I. Выделение и характеристика» . Журнал антибиотиков . 44 (7): 693–701. дои : 10.7164/антибиотики.44.693 . ПМИД 1908853 .
- ^ Хогг Т., Местерс-младший, Хильгенфельд Р. (февраль 2002 г.). «Ингибирующие механизмы антибиотиков, воздействующих на фактор элонгации Tu». Современная наука о белках и пептидах . 3 (1): 121–31. дои : 10.2174/1389203023380855 . ПМИД 12370016 .
- ^ Андерсен Г.Р., Ниссен П., Нюборг Дж. (август 2003 г.). «Факторы элонгации в биосинтезе белка». Тенденции биохимических наук . 28 (8): 434–41. дои : 10.1016/S0968-0004(03)00162-2 . ПМИД 12932732 .
- ^ Пармеджиани А., Ниссен П. (август 2006 г.). «Антибиотики, нацеленные на фактор элонгации Tu: четыре разные структуры, два механизма действия» . Письма ФЭБС . 580 (19): 4576–81. Бибкод : 2006FEBSL.580.4576P . дои : 10.1016/j.febslet.2006.07.039 . ПМИД 16876786 . S2CID 20811259 .
Внешние ссылки
[ редактировать ]- Пептид + Элонгация + Фактор + Tu в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P49410 (фактор элонгации Tu, митохондрии) в PDBe-KB .