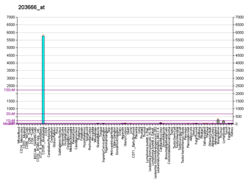
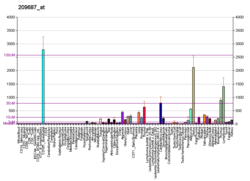
Фактор 1, полученный из стромальных клеток
| CXCL12 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CXCL12 , IRH, PBSF, SCYB12, SDF1, TLSF, TPAR1, хемокиновый лиганд 12 мотива CXC | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 600835 ; МГИ : 103556 ; Гомологен : 128606 ; Генные карты : CXCL12 ; OMA : CXCL12 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Фактор 1, происходящий из стромальных клеток ( SDF-1 ), также известный как хемокин 12 мотива CXC (CXCL12), представляет собой хемокина белок , который у людей кодируется CXCL12 геном на хромосоме 10 . [5] Он повсеместно экспрессируется во многих тканях и типах клеток. [6] Факторы 1-альфа и 1-бета, происходящие из стромальных клеток, представляют собой небольшие цитокины, принадлежащие к семейству хемокинов , члены которых активируют лейкоциты и часто индуцируются провоспалительными стимулами, такими как липополисахарид , TNF или IL1 . Для хемокинов характерно наличие 4 консервативных цистеинов , образующих 2 дисульфидные связи . Их можно разделить на 2 подсемейства. В подсемействе CC остатки цистеина примыкают друг к другу. В подсемействе CXC они разделены промежуточной аминокислотой. Белки SDF1 относятся к последней группе. [5] Передача сигналов CXCL12 наблюдалась при нескольких видах рака. [7] [8] Ген CXCL12 также содержит один из 27 SNP , связанных с повышенным риском развития ишемической болезни сердца . [9]
Структура
[ редактировать ]Ген
[ редактировать ]Ген CXCL12 расположен на хромосоме 10 в участке 10q11.21 и содержит 4 экзона. . [10] Этот ген производит 7 изоформ путем альтернативного сплайсинга . [11]
Белок
[ редактировать ]Этот белок принадлежит к семейству интеркринных альфа ( хемокинов СХС). [11] SDF-1 производится в двух формах: SDF-1α/CXCL12a и SDF-1β/CXCL12b путем попеременного сплайсинга одного и того же гена. [12] Хемокины характеризуются наличием четырех консервативных цистеинов , образующих две дисульфидные связи . Белки CXCL12 принадлежат к группе хемокинов CXC, начальная пара цистеинов которых разделена одной промежуточной аминокислотой . CXCL12 Кроме того, первые 8 остатков N-конца служат сайтом связывания рецептора , хотя непосредственно в активации рецептора участвовали только Lys-1 и Pro-2. Между тем, мотив RFFESH (остатки 12-17) в области петли функционируют как сайт стыковки для связывания рецептора CXCL12. [13]
Функция
[ редактировать ]CXCL12 экспрессируется во многих тканях мышей, включая мозг , тимус , сердце , легкие , печень , почки , селезенку , тромбоциты и костный мозг . [14] [15] CXCL12 оказывает сильное хемотаксическое воздействие на лимфоциты . [16] [17] [18] [19] В ходе эмбриогенеза он направляет миграцию кроветворных плода клеток из печени в костный мозг и образование крупных кровеносных сосудов. Также было показано, что передача сигналов CXCL12 регулирует экспрессию CD20 на В-клетках. CXCL12 также является хемотаксисом для мезенхимальных стволовых клеток и экспрессируется в области воспалительного разрушения кости, где он опосредует их подавляющее действие на остеокластогенез . [20]
Во взрослом возрасте CXCL12 играет важную роль в ангиогенезе , рекрутируя эндотелиальные клетки-предшественники (EPC) из костного мозга посредством CXCR4-зависимого механизма. [21]
CXCR4 , ранее называвшийся LESTR или фузин, является рецептором CXCL12. [16] Раньше это взаимодействие CXCL12-CXCR4 считалось исключительным (в отличие от других хемокинов и их рецепторов), но недавно было высказано предположение, что CXCL12 может также связывать рецептор CXCR7 (теперь называемый ACKR3). [22] [23] [24] Блокируя CXCR4, основной корецептор проникновения ВИЧ-1, CXCL12 действует как эндогенный ингибитор CXCR4-тропных штаммов ВИЧ-1. [25]
ЦНС
[ редактировать ]Во время эмбрионального развития CXCL12 играет роль в формировании мозжечка посредством миграции нейронов. [26] В ЦНС CXCL12 способствует пролиферации клеток, нейрогенезу (развитию и росту нервной ткани), а также нейровоспалению. Нейральные клетки-предшественники (NPC) представляют собой стволовые клетки, которые дифференцируются в глиальные и нейрональные клетки. CXCL12 способствует их миграции к участкам поражения головного мозга, особенно на обширные расстояния. Оказавшись на месте повреждения, NPC могут начать восстановление ткани повреждения с помощью стволовых клеток. [27] Ось CXCL12/CXCR4 обеспечивает сигналы для аксонов и нейритов, тем самым способствуя росту нейритов (нейроны, образующие отростки) и нейрогенезу. [28] Как и другие хемокины, CXCL12 участвует в миграции клеток, которая способствует воспалению. Что касается ЦНС, CXCL12 играет роль в нейровоспалении, привлекая лейкоциты через гематоэнцефалический барьер. [27] однако чрезмерное производство и накопление CXCL12 может стать токсичным, а вызванное воспаление может привести к серьезным последствиям. [29]
Клиническое значение
[ редактировать ]У людей CXCL12 вовлечен в широкий спектр биомедицинских состояний, затрагивающих несколько систем органов. [30] Более того, передача сигналов CXCL12 в сочетании с передачей сигналов CXCR7 вовлечена в прогрессирование рака поджелудочной железы. [7] В системе мочевыводящих путей метилирование промотора CXCL12 и экспрессия PD-L1 могут быть мощными прогностическими биомаркерами биохимического рецидива у пациентов с карциномой простаты после радикальной простатэктомии, и продолжаются дальнейшие исследования, чтобы подтвердить, может ли метилирование CXCL12 помочь в стратегиях активного наблюдения. [31] В области онкологии ассоциированные с меланомой фибробласты стимулируются путем стимуляции аденозинового рецептора A2B с последующей стимуляцией фактора роста фибробластов и увеличением экспрессии CXCL12. [8]
Клинический маркер
[ редактировать ]Мультилокусное исследование оценки генетического риска, основанное на комбинации 27 локусов, включая ген CXCL12, выявило лиц с повышенным риском как возникновения, так и рецидивов ишемической болезни сердца, а также увеличило клиническую пользу от терапии статинами. Исследование было основано на групповом исследовании на уровне сообщества (исследование «Диета Мальмё и рак») и четырех дополнительных рандомизированных контролируемых исследованиях когорт первичной профилактики (JUPITER и ASCOT) и когорт вторичной профилактики (CARE и PROVE IT-TIMI 22). [9]
Рассеянный склероз
[ редактировать ]Неврологическое состояние, возникающее в результате неправильного взаимодействия между иммунной и нервной системами при рассеянном склерозе . Рассеянный рассеянный склероз характеризуется демиелинизацией нервов из-за атаки иммунной системы организма на ЦНС. Повышенные уровни CXCL12 наблюдаются в спинномозговой жидкости пациентов с рассеянным склерозом. CXCL12 проникает через гематоэнцефалический барьер и вызывает нейровоспаление , которое способствует повреждению аксонов и, следовательно, прогрессированию рассеянного склероза. [32] [ ненадежный медицинский источник ]
болезнь Альцгеймера
[ редактировать ]Хотя CXCL12 может быть вредным для пациентов с рассеянным склерозом, недавние исследования показывают, что этот хемокин может быть полезен в замедлении прогрессирования пациентов с болезнью Альцгеймера. Болезнь Альцгеймера — еще одно неврологическое заболевание и наиболее распространенная форма деменции, при которой значительно снижается когнитивная способность. Одной из основных характеристик болезни Альцгеймера является накопление мозговых бляшек, известных как бета-амилоид. Существуют нейропротекторные свойства CXCL12 у мышей с этими бляшками/болезнью Альцгеймера. PAK — это белок, связанный с поддержанием дендритных шипов, которые необходимы в синапсах для получения информации от аксонов. Неправильная локализация PAK происходит у пациентов с болезнью Альцгеймера, однако предварительная обработка нейронов мышей CXCL12 показала подавление этой неправильной локализации. [33] [ ненадежный медицинский источник ] Кроме того, предварительная обработка CXCL снизила распространенность апоптоза и окислительного повреждения, обычно вызываемого наличием бета-амилоидных бляшек. [33]
Как мишень для наркотиков
[ редактировать ]Хемокины и хемокиновые рецепторы, из которых выделяется CXCR, регулируют множество процессов, таких как морфогенез, ангиогенез и иммунные реакции, и считаются потенциальными мишенями для разработки лекарств. Клинические образцы указывают на высокий уровень экспрессии CXCR4 при идиопатическом легочном фиброзе легких. Экспериментальные данные также указывают на то, что CXCR4/CXCR12 связаны с патогенезом фиброза легких. [34] В системе желудочно-кишечного тракта ось CXCL12-CXCR4 исследуется в качестве антифиброзной терапии при лечении хронического панкреатита. [35] Например, блокирование CXCR4 , рецептора CXCL12, с помощью Плериксафора (AMD-3100) повышало эффективность комбретастатина в мышиной модели рака молочной железы, предположительно за счет предотвращения рекрутирования макрофагов в опухоли. [15] [16] AMD-3100 также широко используется в сочетании с G-CSF для мобилизации гемопоэтических стволовых клеток в кровоток, что позволяет собирать их для трансплантации костного мозга . [36]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000107562 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000061353 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Перейти обратно: а б «Ген Энтреза: лиганд 12 хемокина CXCL12 (мотив CXC) (фактор 1, происходящий из стромальных клеток)» .
- ^ «BioGPS – ваша генная портальная система» . biogps.org . Проверено 11 октября 2016 г.
- ^ Перейти обратно: а б Го JC, Ли J, Чжоу L, Ян JY, Чжан ZG, Лян ZY, Чжоу WX, Ю Л, Чжан ТП, Чжао Ю.П. (август 2016 г.). «Ось CXCL12-CXCR7 способствует инвазивному фенотипу рака поджелудочной железы» . Онкотаргет . 7 (38): 62006–62018. дои : 10.18632/oncotarget.11330 . ПМК 5308707 . ПМИД 27542220 .
- ^ Перейти обратно: а б Соррентино С, Миле Л, Порта А, Пинто А, Морелло С (август 2016 г.). «Активация аденозинового рецептора A2B в меланомах B16 индуцирует экспрессию CXCL12 в FAP-положительных опухолевых стромальных клетках, усиливая прогрессирование опухоли» . Онкотаргет . 7 (39): 64274–64288. дои : 10.18632/oncotarget.11729 . ПМЦ 5325441 . ПМИД 27590504 .
- ^ Перейти обратно: а б Мега Дж.Л., Ститциел Н.О., Смит Дж.Г., Чесман Д.И., Колфилд М.Дж., Девлин Дж.Дж., Нордио Ф., Хайд КЛ., Кэннон КП, Сакс Ф.М., Поултер Н.Р., Север П.С., Ридкер П.М., Браунвальд Э., Меландер О, Катиресан С., Сабатин М.С. (июнь 2015 г.). «Генетический риск, события ишемической болезни сердца и клиническая польза терапии статинами: анализ исследований первичной и вторичной профилактики» . Ланцет . 385 (9984): 2264–71. дои : 10.1016/S0140-6736(14)61730-X . ПМЦ 4608367 . ПМИД 25748612 .
- ^ «Информация о гене CXCL12 - Атлас белков человека» . www.proteinatlas.org . Проверено 20 марта 2024 г.
- ^ Перейти обратно: а б «CXCL12 - предшественник фактора 1, полученный из стромальных клеток - Homo sapiens (человек) - ген и белок CXCL12» . ЮниПрот .
- ^ Де Ла Лус Сьерра М., Ян Ф., Наразаки М., Сальвуччи О., Дэвис Д., Ярчоан Р., Чжан Х.Х., Фалес Х., Тосато Дж. (апрель 2004 г.). «Дифференциальная обработка стромального фактора-1альфа и стромального фактора-1бета объясняет функциональное разнообразие» . Кровь . 103 (7): 2452–9. дои : 10.1182/кровь-2003-08-2857 . ПМИД 14525775 .
- ^ Крамп М.П., Гонг Дж.Х., Лоетшер П., Раджаратнам К., Амара А., Арензана-Сейсдедос Ф., Вирелизье Дж.Л., Баджолини М., Сайкс Б.Д., Кларк-Льюис I (декабрь 1997 г.). «Структура раствора и основа функциональной активности фактора-1, полученного из стромальных клеток; диссоциация активации CXCR4 от связывания и ингибирования ВИЧ-1» . Журнал ЭМБО . 16 (23): 6996–7007. дои : 10.1093/emboj/16.23.6996 . ПМЦ 1170303 . ПМИД 9384579 .
- ^ Шредер А.Дж., Лехнер О., Темплин М., Диттмар К.Е., Махтенс С., Менгель М., Пробст-Кеппер М., Францке А., Волленсак Т., Гацлафф П., Ацподен Дж., Буер Дж., Лаубер Дж. (апрель 2002 г.). «Экспрессия и передача сигналов CXCR4/CXCL12 при раке почки» . Британский журнал рака . 86 (8): 1250–6. дои : 10.1038/sj.bjc.6600221 . ПМЦ 2375348 . ПМИД 11953881 .
- ^ Кусто С., Барон Б., Феличе А., Серия Е (5 июля 2022 г.). «Сравнительный профиль общего белка и шести ангиогенно-активных факторов роста в трех продуктах тромбоцитов» . GMS Междисциплинарная пластическая и реконструктивная хирургия DGPW . 11 (Doc06): Doc06. дои : 10.3205/iprs000167 . ПМЦ 9284722 . ПМИД 35909816 .
- ^ Перейти обратно: а б Блеул CC, Фульбригге Р.К., Казасновас Дж.М., Аюти А., Спрингер Т.А. (сентябрь 1996 г.). «Высокоэффективный хемоаттрактант лимфоцитов, фактор 1 стромального происхождения (SDF-1)» . Журнал экспериментальной медицины . 184 (3): 1101–9. дои : 10.1084/jem.184.3.1101 . ПМК 2192798 . ПМИД 9064327 .
- ^ Ара Т., Накамура Ю., Эгава Т., Сугияма Т., Абэ К., Кисимото Т., Мацуи Ю., Нагасава Т. (апрель 2003 г.). «Нарушение колонизации гонад первичными зародышевыми клетками у мышей, лишенных хемокина, фактора-1, полученного из стромальных клеток (SDF-1)» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (9): 5319–23. Бибкод : 2003PNAS..100.5319A . дои : 10.1073/pnas.0730719100 . ПМК 154343 . ПМИД 12684531 .
- ^ Аскари А.Т., Унзек С., Попович З.Б., Голдман К.К., Форуди Ф., Кедровски М., Ровнер А., Эллис С.Г., Томас Дж.Д., ДиКорлето П.Е., Тополь Э.Дж., Пенн М.С. (август 2003 г.). «Влияние фактора 1, полученного из стромальных клеток, на возвращение стволовых клеток и регенерацию тканей при ишемической кардиомиопатии». Ланцет . 362 (9385): 697–703. дои : 10.1016/S0140-6736(03)14232-8 . ПМИД 12957092 . S2CID 24354002 .
- ^ Ма К., Джонс Д., Боргесани П.Р., Сигал Р.А., Нагасава Т., Кишимото Т., Бронсон Р.Т., Спрингер Т.А. (август 1998 г.). «Нарушение B-лимфопоэза, миелопоэза и нарушение миграции нейронов мозжечка у мышей с дефицитом CXCR4 и SDF-1» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (16): 9448–53. Бибкод : 1998PNAS...95.9448M . дои : 10.1073/pnas.95.16.9448 . ПМК 21358 . ПМИД 9689100 .
- ^ Такано Т., Ли Ю.Дж., Кукита А., Ямаза Т., Аюкава Ю., Морияма К., Уэхара Н., Номияма Х., Кояно К., Кукита Т. (2014). «Мезенхимальные стволовые клетки заметно подавляют воспалительное разрушение костей у крыс с артритом, вызванным адъювантом» . Лабораторное исследование . 94 (3): 286–96. дои : 10.1038/labinvest.2013.152 . ПМИД 24395111 .
- ^ Чжэн Х, Фу Г, Дай Т, Хуан Х (2007). «Миграция эндотелиальных клеток-предшественников, опосредованная фактором-1альфа/CXCR4, происходящим из стромальных клеток, через путь передачи сигнала PI3K/Akt/eNOS» . Журнал сердечно-сосудистой фармакологии . 50 (3): 274–80. дои : 10.1097/FJC.0b013e318093ec8f . ПМИД 17878755 . S2CID 13616442 .
- ^ Балабанян К., Лаган Б., Инфантино С., Чоу К.Ю., Харриаг Дж., Моппс Б., Арензана-Сейседос Ф., Телен М., Бачелери Ф. (2005). «Хемокин SDF-1/CXCL12 связывается с сиротским рецептором RDC1 в Т-лимфоцитах и передает сигналы через него» . Журнал биологической химии . 280 (42): 35760–6. дои : 10.1074/jbc.M508234200 . ПМИД 16107333 .
- ^ Бернс Дж. М., Саммерс BC, Ван Й., Меликян А., Берахович Р., Мяо З., Пенфолд М. Е., Саншайн М. Дж., Литтман Д. Р., Куо С. Дж., Вэй К., Макмастер Б. Е., Райт К., Ховард MC, Шалл Т. Дж. (2006). «Новый хемокиновый рецептор SDF-1 и I-TAC, участвующий в выживании клеток, клеточной адгезии и развитии опухолей» . Журнал экспериментальной медицины . 203 (9): 2201–13. дои : 10.1084/jem.20052144 . ПМК 2118398 . ПМИД 16940167 .
- ^ Круз-Оренго Л., Холман Д.В., Дорси Д., Чжоу Л., Чжан П., Райт М., МакКэндлесс Э.Э., Патель Дж.Р., Люкер Г.Д., Литтман Д.Р., Рассел Дж.Х., Кляйн Р.С. (2011). «CXCR7 влияет на проникновение лейкоцитов в паренхиму ЦНС, контролируя количество CXCL12 в аблюминальной области во время аутоиммунитета» . Журнал экспериментальной медицины . 208 (2): 327–39. дои : 10.1084/jem.20102010 . ПМК 3039853 . ПМИД 21300915 .
- ^ Оберлин Э., Амара А., Бачелери Ф., Бессия С., Вирелизье Дж.Л., Аренцана-Сейсдедос Ф., Шварц О., Херд Дж.М., Кларк-Льюис И., Леглер Д.Ф., Лётшер М., Баджолини М., Мозер Б. (1996). «Хемокин CXC SDF-1 является лигандом для LESTR/фузина и предотвращает заражение ВИЧ-1, адаптированным к Т-клеточной линии» (PDF) . Природа . 382 (6594): 833–5. Бибкод : 1996Natur.382..833O . дои : 10.1038/382833a0 . ПМИД 8752281 . S2CID 4233446 .
- ^ Бажетто А., Бонавиа Р., Барберо С., Флорио Т., Скеттини Г. (июль 2001 г.). «Хемокины и их рецепторы в центральной нервной системе». Границы нейроэндокринологии . 22 (3): 147–84. дои : 10.1006/frne.2001.0214 . ПМИД 11456467 . S2CID 29689159 .
- ^ Перейти обратно: а б Ли М., Хейл Дж.С., Рич Дж.Н., Рансохофф Р.М., Латия Дж.Д. (октябрь 2012 г.). «Хемокин CXCL12 при нейродегенеративных заболеваниях: сигнал SOS для восстановления стволовыми клетками» . Тенденции в нейронауках . 35 (10): 619–28. дои : 10.1016/j.tins.2012.06.003 . ПМК 3461091 . ПМИД 22784557 .
- ^ Гийон А (март 2014 г.). «Хемокин CXCL12 и его рецепторы как основные игроки во взаимодействии между иммунной и нервной системами» . Границы клеточной нейронауки . 8:65 . дои : 10.3389/fncel.2014.00065 . ПМЦ 3944789 . ПМИД 24639628 .
- ^ Гийон А (2014). «Хемокин CXCL12 и его рецепторы как основные игроки во взаимодействии между иммунной и нервной системами» . Границы клеточной нейронауки . 8:65 . дои : 10.3389/fncel.2014.00065 . ПМЦ 3944789 . ПМИД 24639628 .
- ^ Поццобон Т., Гольдони Дж., Виола А., Молон Б. (сентябрь 2016 г.). «Передача сигналов CXCR4 в здоровье и болезни». Письма по иммунологии . 177 : 6–15. дои : 10.1016/j.imlet.2016.06.006 . hdl : 11577/3222781 . ПМИД 27363619 .
- ^ Гольц Д., Холмс Э.Э., Гевенслебен Х., Зайлер В., Дитрих Дж., Юнг М., Релер М., Меллер С., Эллингер Дж., Кристиансен Г., Дитрих Д. (июль 2016 г.). «Метилирование промотора CXCL12 и экспрессия PD-L1 как прогностические биомаркеры у пациентов с раком простаты» . Онкотаргет . 7 (33): 53309–53320. дои : 10.18632/oncotarget.10786 . ПМК 5288188 . ПМИД 27462860 .
- ^ Крумбхольц М., Тейл Д., Чепок С., Хеммер Б., Кивисакк П., Рансохофф Р.М., Хофбауэр М., Фарина С., Дерфусс Т., Хартл С., Ньюкомб Дж., Холфельд Р., Мейнл Э. (январь 2006 г.). «Хемокины при рассеянном склерозе: активация CXCL12 и CXCL13 по-разному связана с рекрутированием иммунных клеток ЦНС» . Мозг: журнал неврологии . 129 (Часть 1): 200–11. дои : 10.1093/brain/awh680 . ПМИД 16280350 .
- ^ Перейти обратно: а б Раман Д., Милатович С.З., Милатович Д., Сплиттгербер Р., Фан Г.Х., Ричмонд А. (ноябрь 2011 г.). «Хемокины, макрофагальный воспалительный белок-2 и фактор-1α, происходящий из стромальных клеток, подавляют нейротоксичность, вызванную бета-амилоидом» . Токсикология и прикладная фармакология . 256 (3): 300–13. Бибкод : 2011ToxAP.256..300R . дои : 10.1016/j.taap.2011.06.006 . ПМК 3236026 . ПМИД 21704645 .
- ^ Ли Ф, Сюй X, Гэн Дж, Ван X, Дай Х (март 2020 г.). «Аутокринная ось CXCR4/CXCL12 способствует фиброзу легких посредством модуляции активности фибробластов легких» . Экспериментальная и терапевтическая медицина . 19 (3): 1844–1854. дои : 10.3892/etm.2020.8433 . ПМК 7027131 . ПМИД 32104240 .
- ^ Нессе А., Элленридер В. (сентябрь 2016 г.). «Ось NEMO-CXCL12/CXCR4: новая точка зрения для антифиброзной терапии при хроническом панкреатите?». Гут . 66 (2): Gutjnl–2016–312874. дои : 10.1136/gutjnl-2016-312874 . ПМИД 27590996 . S2CID 3493909 .
- ^ Де Клерк Э. (2019) Мозобил (R) (Plerixafor, AMD3100), через 10 лет после его одобрения Управлением по контролю за продуктами и лекарствами США. Антивир Чем Химетер 27:1.
Дальнейшее чтение
[ редактировать ]- Куция М., Реца Р., Миекус К., Ванцек Дж., Вояковски В., Яновска-Вечорек А., Ратайчак Дж., Ратайчак М.З. (август 2005 г.). «Торговля нормальными стволовыми клетками и метастазирование раковых стволовых клеток связаны с аналогичными механизмами: ключевая роль оси SDF-1-CXCR4». Стволовые клетки . 23 (7): 879–94. doi : 10.1634/stemcells.2004-0342 . ПМИД 15888687 . S2CID 22504846 .
- Крычек И., Вэй С., Келлер Э., Лю Р., Цзоу В. (март 2007 г.). «Фактор стромы (SDF-1/CXCL12) и патогенез опухолей человека» . Американский журнал физиологии. Клеточная физиология . 292 (3): C987–95. doi : 10.1152/ajpcell.00406.2006 . ПМИД 16943240 . S2CID 7423893 .
- Стеллос К., Гаваз М. (март 2007 г.). «Тромбоциты и фактор-1, полученный из стромальных клеток, в рекрутировании клеток-предшественников». Семинары по тромбозам и гемостазу . 33 (2): 159–64. дои : 10.1055/s-2007-969029 . ПМИД 17340464 . S2CID 260320898 .
- Ван Дж, Лю Х, Лу Х, Цзян С, Цуй Икс, Юй Л, Фу Икс, Ли Ц, Ван Дж (март 2015 г.). «Субпопуляция CXCR4(+)CD45(-) BMMNC превосходит нефракционированные BMMNC по защите после ишемического инсульта у мышей» . Мозг, поведение и иммунитет . 45 : 98–108. дои : 10.1016/j.bbi.2014.12.015 . ПМЦ 4342301 . ПМИД 25526817 .
- Арья М., Ахмед Х., Силхи Н., Уильямсон М., Патель Х.Р. (2007). «Клиническое значение и терапевтическое значение ключевого взаимодействия CXCL12-CXCR4 (хемокиновый лиганд-рецептор) при миграции раковых клеток». Биология опухолей . 28 (3): 123–31. дои : 10.1159/000102979 . ПМИД 17510563 . S2CID 44356923 .