Лизин
 Скелетная формула L -лизина
| |||
| |||
| Имена | |||
|---|---|---|---|
| Имена IUPAC
L -lysine
D -lysine | |||
| Систематическое имя IUPAC
(2 с ) -2,6-диаминогексановая кислота ( L -лизин)
(2 R ) -2,6-диаминогексановая кислота ( D -лизин) | |||
| Другие имена
Лизин, д -лизин, l -лизин, лис, h -lys -oh
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
| ||
| Чеби | |||
| Химический | |||
| Chemspider | |||
| Echa Infocard | 100.000.673 | ||
| Кегг | |||
PubChem CID
|
|||
| НЕКОТОРЫЙ |
| ||
Comptox Dashboard ( EPA )
|
|||
| Характеристики | |||
| C 6 H 14 N 2 O 2 | |||
| Молярная масса | 146.190 g·mol −1 | ||
| 1,5 кг/л | |||
| Фармакология | |||
| B05xb03 ( Кто ) | |||
| Дополнительная страница данных | |||
| Лизин (страница данных) | |||
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |||
Лизин (символ Lys или k ) [ 2 ] является α-аминокислотой , которая является предшественником многих белков . Он содержит α-аминогруппу (которая находится в протонированном −nh + 3 образуется при растворенных в воде), группу α-карбоновой кислоты (которая находится в депротонированном −coo − образуется при растворенном в воде), и лизил боковой цепи ( (CH 2 ) 4 NH 2 ), классифицируя его как основную , заряженную (при физиологическом рН ), алифатическая аминокислота. Это кодируется кодонами AAA и AAG. Как и почти все другие аминокислоты, α-углерод является хиральным , а лизин может относиться либо к энантиомеру , либо к раковой смесью обоих. Для целей настоящей статьи лизин будет ссылаться на биологически активную энантиомер L -лизин, где α -углерод находится в S. конфигурации
Человеческое тело не может синтезировать лизин. Это важно у людей и поэтому должно быть получено из рациона. У организмов, которые синтезируют лизин, два основных путя биосинтеза существуют , диаминопимелатные и α-аминоадипатные пути, которые используют различные ферменты и субстраты и обнаруживаются в различных организмах. лизина Катаболизм происходит через один из нескольких путей, наиболее распространенным из которых является путь сахаропина .
Лизин играет несколько ролей в людях, что наиболее важно, протеиногенез , но также в сшивании коллагеновых полипептидов, поглощении незаменимых минеральных питательных веществ и в производстве карнитина , что является ключевым в метаболизме жирных кислот . Лизин также часто участвует в модификациях гистонов и, следовательно, влияет на эпигеном . Ε-аминогруппа часто участвует в водородной связи и в качестве общей основы в катализе . Группа ε- аммония ( −nh + 3 ) прикреплен к четвертому углероду из α-углерода, который прикреплен к карбоксилу ( −coOH ) группа. [ 3 ]
Из-за его важности в нескольких биологических процессах отсутствие лизина может привести к нескольким болезненным состояниям, включая дефектные соединительные ткани, нарушение метаболизма жирных кислот, анемию и дефицит системной белковой энергии. Напротив, переизбыток лизина, вызванная неэффективным катаболизмом, может вызвать серьезные неврологические расстройства .
Лизин был сначала выделен немецким биологическим химиком Фердинанд Генрих Эдмунд Дрехсель в 1889 году от гидролиза белка казеина , [ 4 ] и, таким образом, назвал его лизин, от греческого λύσις (лизис) 'ослабление'. [ 5 ] [ 6 ] В 1902 году немецкие химики Эмиль Фишер и Фриц Вейгерт определили химическую структуру Лизина, синтезируя ее. [ 7 ]
Символ k однобуплектую был назначен лизину за то, что он был алфавитно ближе всего, причем L был назначен на структурно более простой лейцине, а м и метионином. [ 8 ]
Биосинтез
[ редактировать ]
Два пути были идентифицированы в природе для синтеза лизина. Диаминопимелатный , которое также (DAP) путь принадлежит к семейству биосинтетического аспартата участвует в синтезе треонина , метионина и изолецина , [ 9 ] [ 10 ] Принимая во внимание, что путь α-аминоадипата (AAA) является частью семейства биосинтетических глутаматов . [ 11 ] [ 12 ]
DAP TAPWAY
[ редактировать ]Путь DAP обнаружен как у прокариот , так и в растениях и начинается с катализированной дигидродипиколинатсинтазы (DHDP) (EC 4.3.3.7) между реакции конденсации полуаспартатом аспартата, L -аспартата полуалдегида и пирувата (4 с ) -4-гидрокси. -2,3,4,5-тетрагидро- (2 с ) -дипиколиновая кислота (HTPA). [ 13 ] [ 14 ] [ 15 ] [ 16 ] [ 17 ] Затем продукт уменьшается с помощью дигидродипиколинатредуктазы (DHDPR) (EC 1.3.1.26), причем NAD (P) H в качестве донора протона даст 2,3,4,5-тетрагидродипиколинат (THDP). [ 18 ] С этого момента было обнаружено четыре вариации пути, а именно пути ацетилазы, аминотрансферазы, дегидрогеназы и сукцинилазы. [ 9 ] [ 19 ] В вариантах ацетилазы и сукцинилазы используются четыре фализированные ферменты , в пути аминотрансферазы используются два фермента, а путь дегидрогеназы использует один фермент. [ 20 ] Эти четыре варианта пути сходятся при образовании предпоследнего продукта, мезо -диаминопимелата, который впоследствии ферментативно декарбоксилируется в необратимой реакции, катализируемой диаминопимелатом декарбоксилазой (DAPDC) (EC 4.1.20) с получением L -лизина. [ 21 ] [ 22 ] Путь DAP регулируется на нескольких уровнях, в том числе вверх по течению в ферментах, участвующих в обработке аспартат, а также на начальной стадии катализированной конденсации DHDP. [ 22 ] [ 23 ] Лизин придает сильную петлю отрицательной обратной связи на эти ферменты и, впоследствии, регулирует весь путь. [ 23 ]
AAA путь
[ редактировать ]Путь AAA включает конденсацию α-кетоглутарата и ацетил-КоА через промежуточный AAA для синтеза L- лизина. Было показано, что этот путь присутствует у нескольких видов дрожжей , а также в протистах и более высоких грибах. [ 12 ] [ 24 ] [ 25 ] [ 26 ] [ 27 ] [ 28 ] [ 29 ] Также сообщалось, что альтернативный вариант маршрута AAA был обнаружен в Thermus Thermophilus и Pyrococcus horikoshii , что может указывать на то, что этот путь более широко распространен в прокариотах, чем первоначально предложил. [ 30 ] [ 31 ] [ 32 ] Первая и ограничивающая скорость в пути AAA-это реакция конденсации между ацетил-КоА и α-кетоглутаратом, катализируемым гомоцитрат-синтазой (HCS) (EC 2.3.3.14), чтобы получить промежуточный гомоцитрил-коа, гидролизируется который тот же фермент для производства гомоцитрата . [ 33 ] Гомоцитрат ферментатически дегидратируется гомоаконитазой (HAC) (EC 4.2.1.36), чтобы получить цис -гомоаконит . [ 34 ] Затем HAC катализирует вторую реакцию, в которой цис -гомоаконит подвергается регидратации с образованием гомоизоцитрата . [ 12 ] Полученный продукт подвергается окислительному декарбоксилированию гомоизоцитратдегидрогеназой (HIDH) (EC 1.1.1.87) с получением α -кетоаджата. [ 12 ] Затем ААА образуется через пиридоксаль 5'-фосфат (PLP) -зависимую аминотрансферазу (PLP-AT) (EC 2.6.1.39), используя глутамат в качестве донора амино. [ 33 ] С этого момента путь AAA варьируется в зависимости от [чего -то не хватает здесь? -> По крайней мере, заголовок секции! ] на королевстве. У грибов AAA снижается до α-аминоадрядового-семиалдегида через AAAредуктазу (EC 1.2.1.95) в уникальном процессе, включающем как аденилирование , так и снижение, которая активируется фосфопантеэнееинил-трансферазой (EC 2.7.8.7). [ 12 ] Как только полуалдегид образуется, сахаропинредуктаза (EC 1.5.1.10 ) катализирует реакцию конденсации с глутаматом и NAD (P) H в качестве донора протона, а имин уменьшается, чтобы получить предпоследний продукт, сахаропин. [ 32 ] Последний этап пути в грибах включает в себя сахаропиндегидрогеназу (SDH) (EC 1.5.1.8), которое катализировало окислительное дезаминирование сахаропина, что приводит к L -лизину. [ 12 ] В варианте пути AAA, обнаруженном в некоторых прокариотах, AAA сначала превращается в N -ацетил-α-аминоадипат, который фосфорилируется , а затем редуктивно дефосфорилируется в ε-альдегид. [ 32 ] [ 33 ] Альдегид затем трансамируется к н -ацетиллизину, который деацетилизируется, чтобы получить l -лизин. [ 32 ] [ 33 ] Тем не менее, ферменты, участвующие в этом варианте, нуждаются в дальнейшей проверке.
Катаболизм
[ редактировать ]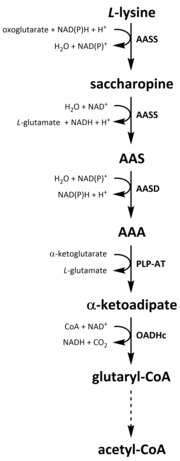
Как и во всех аминокислотах, катаболизм лизина инициируется в результате поглощения диетического лизина или от разрыва внутриклеточного белка. Катаболизм также используется в качестве средства для контроля внутриклеточной концентрации свободного лизина и поддержания устойчивого состояния для предотвращения токсических эффектов чрезмерного свободного лизина. [ 35 ] Есть несколько путей, связанных с катаболизмом лизина, но наиболее часто используемым является путь сахаропина, который в первую очередь происходит в печени (и эквивалентных органах) у животных, особенно в митохондриях . [ 36 ] [ 35 ] [ 37 ] [ 38 ] Это обратная сторона ранее описанного пути AAA. [ 36 ] [ 39 ] У животных и растений первые два этапа пути сахаропина катализируются бифункциональным ферментом, α-аминоадипическим полуалдегидом-синтазой (AASS) , которая обладает как лизин-кетоглутарат редуктазы (LKR) (EC 1.5.1.8), как это В других организмах, таких как бактерии и грибы, оба из этих ферментов кодируются отдельными генами . [ 40 ] [ 41 ] Первый шаг включает в себя катализированное LKR -восстановление L -лизина в присутствии α -кетоглутарата для получения сахаропина, причем NAD (P) H действует в качестве донора протона. [ 42 ] Сахаропин затем подвергается реакции обезвоживания, катализируемой SDH в присутствии NAD + , чтобы произвести AAS и глутамат. [ 43 ] Аас дегидрогеназа (AASD) (EC 1.2.1.31) затем далее дегидратирует молекулу в AAA. [ 42 ] Впоследствии, PLP-AT катализирует обратную реакцию на реакцию биосинтеза AAA, что приводит к тому, что AAA преобразуется в α-кетоадипат. Продукт, α -кетоадипат, декарбоксилируется в присутствии NAD + и коэнзим А, получая глутарил-КоА, однако фермент, участвующий в этом, еще не полностью выяснен. [ 44 ] [ 45 ] Некоторые данные свидетельствуют о том, что 2-оксоадипат-дегидрогеназный комплекс (OADHC), который структурно гомологичен субъединице E1 ороглутаратдегидрогеназного комплекса (OGDHC) (EC 1.2.4.2), отвечает за реакцию декарбоксилирования. [ 44 ] [ 46 ] Наконец, глутарил-КоА окислительно декарбоксилируется с кротонил-КоА с помощью глутарил-коадегидрогеназы (EC 1.3.8.6), которая далее обрабатывается с помощью нескольких ферментативных шагов для получения ацетил-КоА; Основной метаболит углерода , участвующий в цикле трикарбоновой кислоты (TCA) . [ 42 ] [ 47 ] [ 48 ] [ 49 ]
Питательная ценность
[ редактировать ]Лизин является незаменимой аминокислотой у людей. [ 50 ] Потребность в ежедневном питании человека варьируется от ~ 60 мг/кг в младенчестве до ~ 30 мг/кг у взрослых. [ 36 ] Это требование обычно выполняется в западном обществе с потреблением лизина из мяса и источников овощей, что значительно превышает рекомендуемое требование. [ 36 ] В вегетарианских рационах потребление лизина меньше из -за ограниченного количества лизина в зерновых культурах по сравнению с источниками мяса. [ 36 ]
Учитывая ограничивающую концентрацию лизина в зерновых культурах, давно предполагалось, что содержание лизина может быть увеличено с помощью генетической модификации . практики [ 51 ] [ 52 ] Часто эти практики включали преднамеренную дисрегуляцию пути DAP посредством введения, нечувствительных к обратной связи лизина, ортологов фермента DHDP. [ 51 ] [ 52 ] Эти методы достигли ограниченного успеха, вероятно, благодаря токсическим побочным эффектам повышенного свободного лизина и косвенного воздействия на цикл TCA. [ 53 ] Растения накапливают лизин и другие аминокислоты в виде белков хранения семян , обнаруженных в семенах растения, и это представляет собой съедобный компонент зерновых культур. [ 54 ] Это подчеркивает необходимость не только увеличить свободный лизин, но также прямой лизин в сторону синтеза стабильных белков хранения семян и впоследствии увеличивает питательную ценность потребляемого компонента сельскохозяйственных культур. [ 55 ] [ 56 ] В то время как практика генетической модификации достигла ограниченного успеха, более традиционные методы селективного размножения позволили выделить « качественную белковую кукурузу », что значительно повышало уровни лизина и триптофана , а также незаменимая аминокислота. Это увеличение содержания лизина объясняется непрозрачной мутацией, которая снижает транскрипцию белков , связанных с лизином, связанными с хранением семян, и, как следствие, увеличило обилие других белков, которые богаты лизином. [ 56 ] [ 57 ] Обычно, чтобы преодолеть ограничивающую численность лизина в кормлении скота , добавляется лизин в промышленности. [ 58 ] [ 59 ] Промышленный процесс включает в себя ферментативное культивирование Corynebacterium glutamicum и последующую очистку лизина. [ 58 ]
Диетические источники
[ редактировать ]Хорошими источниками лизина являются продукты с высоким содержанием белка, такие как яйца, мясо (в частности, красное мясо, ягненка, свинина и птица), соя , бобы и горох, сыр (особенно пармезан) и определенные рыбы (такие как треска и сардины ). [ 60 ] Лизин - это ограничивающая аминокислота (незаменимая аминокислота, обнаруженная в наименьшем количестве в конкретном пищевой продовольственной основе) в большинстве зерновых зерновых в изобилии , но в большинстве импульсов (бобовые). [ 61 ] Бобы содержат лизин, которого не хватает кукурузы , а в бобах и кукурузе человека часто появляются кукурузы, как у трех сестер : бобы, кукуруза и тыква. [ 62 ]
Считается, что пища имеет достаточный лизин, если он имеет не менее 51 мг лизина на грамм белка (так что белок составляет 5,1% лизин). [ 63 ] L -lysine HCl используется в качестве пищевой добавки , обеспечивающей 80,03% л -лизин. [ 64 ] Таким образом, 1 г л -лизина содержится в 1,25 г L -лизин HCl.
Биологические роли
[ редактировать ]Наиболее распространенной ролью для лизина является протеиногенез. Лизин часто играет важную роль в структуре белка . Поскольку его боковая цепь содержит положительно заряженную группу на одном конце и длинный гидрофобный углеродный хвост вблизи основы, лизин считается несколько амфипатическим . По этой причине лизин можно найти, а также чаще в каналах растворителей и на внешней стороне белков, где он может взаимодействовать с водной средой. [ 65 ] Лизин также может способствовать стабильности белка, так как его ε-амино-группа часто участвует в водородных связях , солевых мостах и ковалентных взаимодействиях с образованием основания SCHIFF . [ 65 ] [ 66 ] [ 67 ] [ 68 ]
Вторая основная роль лизина заключается в эпигенетической регуляции посредством гистонов модификации . [ 69 ] [ 70 ] Существует несколько типов ковалентных модификаций гистонов, которые обычно включают остатки лизина, обнаруженные в выступающем хвосте гистонов. Модификации часто включают в себя добавление или удаление ацетил (-Ch 3 CO) , образующего ацетиллизин или возвращение к лизину, до трех метил (-Ch 3 ) , убиквитина или белковой группы SUMO. [ 69 ] [ 71 ] [ 72 ] [ 73 ] [ 74 ] Различные модификации оказывают последующее влияние на регуляцию генов , в которых гены могут быть активированы или подавлены.
Лизин также участвовал в том, чтобы играть ключевую роль в других биологических процессах, включая; Структурные белки соединительных тканей , кальция гомеостаза и метаболизма жирных кислот . [ 75 ] [ 76 ] [ 77 ] Было показано, что лизин участвует в сшивании между тремя спиральными полипептидами в коллагене , что приводит к его стабильности и прочности растяжения. [ 75 ] [ 78 ] Этот механизм похож на роль лизина в бактериальных клеточных стенках , в которой лизин (и мезо -диаминопимелат) имеет решающее значение для образования сшивок и, следовательно, стабильности клеточной стенки. [ 79 ] Эта концепция ранее была исследована как средство обойти нежелательное высвобождение потенциально патогенных генетически модифицированных бактерий. Было предложено, чтобы ауксотрофический штамм эширихии coli ( x 1776) может быть использован для всех практик генетической модификации, поскольку штамм не может выжить без добавок DAP, и, таким образом, не может жить вне лабораторной среды. [ 80 ] Было также предложено лизин участвовать в поглощении кишечника и задержке кишечника кальция и, таким образом, может играть роль в гомеостазе кальция . [ 76 ] Наконец, было показано, что лизин является предшественником карнитина , который переносит жирные кислоты в митохондрии , где их можно окислять для высвобождения энергии. [ 77 ] [ 81 ] Карнитин синтезируется из триметиллизина , который является продуктом деградации определенных белков, так как такой лизин должен сначала быть включен в белки и метилирован до преобразования в карнитин. [ 77 ] Однако у млекопитающих основным источником карнитина является диетические источники, а не через конверсию лизина. [ 77 ]
В таких опсинах , как родопсин и визуальные опсины (кодируемые генами OPN1SW , OPN1MW и OPN1LW ), ретинализованный основание образует основание Schiff с консервативным остатками лизина, а взаимодействие света с группой ретинилидена вызывает трансдукцию сигнала по цветовому зрению (смотрите визуальный цикл. для деталей).
Спорные роли
[ редактировать ]Прошло долгое обсуждение, что лизин, когда вводится внутривенно или устно, может значительно увеличить высвобождение гормонов роста . [ 82 ] Это привело к тому, что спортсмены использовали лизин в качестве средства продвижения мышц во время тренировки, однако никаких существенных доказательств в поддержку этого применения лизина не было обнаружено на сегодняшний день. [ 82 ] [ 83 ]
Поскольку белки вируса простого герпеса (HSV) богаче в аргинине и беднее лизина, чем клетки, которые они заражают, добавки лизина были опробованы в качестве лечения. Поскольку две аминокислоты разбираются в кишечнике, восстанавливаются в почке и перемещаются в клетки с помощью тех же аминокислотных транспортеров , обилие лизина, теоретически, ограничит количество аргинина, доступного для репликации вируса. [ 84 ] Клинические исследования не дают хороших доказательств эффективности как профилактической или лечения вспышек ВПГ. [ 85 ] [ 86 ] В ответ на заявления о продукте лизин может улучшить иммунные реакции на ВПГ, обзор Европейского управления по безопасности пищевых продуктов не обнаружил никаких доказательств причинных отношений. Тот же обзор, опубликованный в 2011 году, не обнаружил никаких доказательств, подтверждающих утверждения о том, что лизин может снизить уровень холестерина, увеличить аппетит, способствовать синтезу белка в любой роли, кроме как обычное питательное вещество, или увеличить поглощение или удержание кальция. [ 87 ]
Роли в болезнях
[ редактировать ]Заболевания, связанные с лизином, являются результатом нижней обработки лизина, то есть включение в белки или модификацию в альтернативные биомолекулы. Роль лизина в коллагене была изложена выше, однако отсутствие лизина и гидроксилизина , участвующего в сшивании коллагеновых пептидов, было связано с состоянием заболевания соединительной ткани. [ 88 ] Поскольку карнитин является ключевым метаболитом, полученным из лизина, участвующим в метаболизме жирных кислот, некачественная диета, в которой отсутствует достаточное количество карнитина и лизина, может привести к снижению уровня карнитина, что может оказывать значительное каскадное воздействие на здоровье человека. [ 81 ] [ 89 ] Также было показано, что лизин играет роль в анемии , поскольку, как предполагается, лизин оказывает влияние на поглощение железа и, впоследствии, концентрации ферритина в плазме крови . [ 90 ] Тем не менее, точный механизм действия еще предстоит выяснить. [ 90 ] Чаще всего дефицит лизина наблюдается в незападных обществах и проявляется как недоедание белковой энергии , которое оказывает глубокое и системное воздействие на здоровье человека. [ 91 ] [ 92 ] Существует также наследственное генетическое заболевание, которое включает в себя мутации в ферментах, ответственных за катаболизм лизина, а именно бифункциональный AASS -фермент сахаропинного пути. [ 93 ] Из -за отсутствия катаболизма лизина аминокислота накапливается в плазме, а у пациентов развивается гиперлисинемия , которая может проявляться как бессимптомная к тяжелой неврологической инвалидности , включая эпилепсию , атаксию , спастичность и психомоторные нарушения . [ 93 ] [ 94 ] Клиническое значение гиперлизинемии является предметом дебатов в этой области, причем некоторые исследования не обнаруживают корреляции между физическими или умственными нарушениями и гиперлизинемией. [ 95 ] В дополнение к этому, мутации в генах, связанных с метаболизмом лизина, были вовлечены в несколько заболеваемых состояний, включая пиридоксинзависимую эпилепсию ( ген ALDH7A1 ), α-кетоадипический и α-аминоадипический ацидурия ( ген DHTKD1 (ген DHTKD1 ) и глютарическая ацидовая типа 1 ) и глютарическая ацидовая типа 1 ( GCDH ген ). [ 44 ] [ 96 ] [ 97 ] [ 98 ] [ 99 ]
Гиперлизинурия отмечена большим количеством лизина в моче. [ 100 ] Это часто связано с метаболическим заболеванием , при котором белок, участвующий в разрушении лизина, является не функциональным из -за генетической мутации. [ 101 ] Это также может произойти из -за неудачи почечной трубчатой транспорта. [ 101 ]
Использование лизина в корм
[ редактировать ]
Производство лизина для корма для животных является крупной глобальной промышленностью, достигающей в 2009 году почти 700 000 тонн на рыночную стоимость более 1,22 млрд. Евро. [ 102 ] Лизин является важной добавкой к корм для животных, потому что он является ограничивающей аминокислотой при оптимизации роста определенных животных, таких как свиньи и цыплят для производства мяса. Добавление лизина позволяет использовать более низкий затрат растительный белок (например, кукуруза, а не сою ), сохраняя при этом высокие темпы роста и ограничивая загрязнение от выведения азота. [ 103 ] В свою очередь, однако, загрязнение фосфатов является основной затрат на окружающую среду, когда кукуруза используется в качестве корма для птицы и свиней. [ 104 ]
Лизин продуцируется в промышленности путем микробной ферментации, из основания в основном из сахара. Генетические инженерные исследования активно преследуют бактериальные штаммы, чтобы повысить эффективность производства и позволить лизину производиться из других субстратов. [ 102 ]
В популярной культуре
[ редактировать ]В фильме «Парк Юрского периода» 1993 года , основанный на романе « Парк Юрского периода» 1990 года Майкла Крайтона , в нем участвуют динозавры , которые были генетически изменены, так что они не могли производить лизин, пример инженерной ауксотрофии . [ 105 ] Это было известно как «непредвиденные обстоятельства лизина» и должно было помешать клонированным динозаврам выжить за пределами парка, заставляя их зависеть от добавок лизина, предоставленных ветеринарным персоналом парка. На самом деле ни одно животное не может производить лизин; Это незаменимая аминокислота . [ 106 ]
В 1996 году Лизин стал в центре внимания пожирания цен , крупнейшего в истории Соединенных Штатов. Компания Archer Daniels Midland заплатила штраф в размере 100 миллионов долларов США, а трое из ее руководителей были осуждены и отбывали тюремное заключение. Также признали себя виновными в случае с фиксированием цены, были две японские фирмы ( Ajinomoto , Kyowa Hakko) и южнокорейская фирма (Sewon). [ 107 ] Секретные видеозаписи заговорщиков, исправляющих цену Лизина, можно найти в Интернете или запрашивать видео от Министерства юстиции США , антимонопольного отдела. Этот случай дал основу для книги информатор: правдивая история , [ 108 ] И фильм информатор! Полем
Ссылки
[ редактировать ]![]() Эта статья была адаптирована из следующего источника по лицензии CC по 4,0 ( 2018 ) ( отчеты рецензентов ):
Коди Дж Холл; Tatiana P. Soares Da Costa (1 июня 2018 года). «Лизин: биосинтез, катаболизм и роли» (PDF) . Викиджурнал науки . 1 (1): 4. doi : 10.15347/wjs/2018.004 . ISSN 2470-6345 . Викидата Q55120301 .
Эта статья была адаптирована из следующего источника по лицензии CC по 4,0 ( 2018 ) ( отчеты рецензентов ):
Коди Дж Холл; Tatiana P. Soares Da Costa (1 июня 2018 года). «Лизин: биосинтез, катаболизм и роли» (PDF) . Викиджурнал науки . 1 (1): 4. doi : 10.15347/wjs/2018.004 . ISSN 2470-6345 . Викидата Q55120301 .
- ^ Jump up to: а беременный Уильямс, Пенсильвания; Хьюз, CE; Харрис, KD M (2015). «L-Llysine: эксплуатируя порошковую рентгеновскую дифракцию для завершения набора кристаллических структур 20, непосредственно кодируемых протеиногенных аминокислот». Ангев. Химический Инт. Редакция 54 (13): 3973–3977. doi : 10.1002/anie.201411520 . PMID 25651303 .
- ^ «Совместная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура и символика для аминокислот и пептидов. Рекомендации 1983» . Биохимический журнал . 219 (2): 345–373. 15 апреля 1984 года. DOI : 10.1042/BJ2190345 . PMC 1153490 . PMID 6743224 .
- ^ Лизин. Биологический проект, факультет биохимии и молекулярной биофизики, Университет Аризоны.
- ^ Дрехсель Е (1889). «Zur Kenntniss der Spaltungsprodukte des caseïns» [[вклад] в [наше] знание продуктов расщепления казеина]. Журнал Für Praktische Chemie . 2 -я серия (на немецком языке). 39 : 425–429. doi : 10.1002/prac.18890390135 . На р. 428, Дрехсель представил эмпирическую формулу хлороплатинатной соли лизина - C 8 H 16 N 2 O 2 Cl 2 · Ptcl 4 + H 2 O - но позже он признал, что эта формула была неверной, потому что кристаллы соли содержали этанол вместо воды Полем Видеть: Дрехсель Е (1891). «Разборка белковых веществ» [разборка белка]. Архив анатомии и физиологии (на немецком языке): 248–278; Дрехсель Е (1877). "Знание расщепления дела" [вклад] в [наше] знание продуктов расщепления казеина] (на немецком языке). С.
От р. 256:] «… Основание, содержащаяся в нем, имеет формулу C 6 H 14 N 2 O 2. Первоначальная ошибка была вызвана тем фактом, что хлороплатинат не содержит, как предполагалось, кристаллическая вода, но кристаллический спирт. .. » (... База [которая] содержится в нем, имеет [эмпирическую] формулу C 6 H 14 N 2 O 2 . Хлороплатинатом, содержащим не воду в кристалле (как предполагалось), но этанол ...)
- ^ Викери, Хьюберт Брэдфорд.; Шмидт, Карл Л.А. (1 октября 1931 г.). «История открытия аминокислот» . Химические обзоры . 9 (2): 169–318. doi : 10.1021/cr60033a001 . ISSN 0009-2665 .
- ^ Дрехсель Е (1891). «Разборка белковых веществ» [разборка белка]. Архив анатомии и физиологии (на немецком языке): 248–278. ; Фишер Э (1891). «О новом расколе продуктов клея» [о новых продуктах расщепления желатина]. Архив анатомии и физиологии (на немецком языке): 465–469.
От р. 469:] «… База C 6 H 14 N 2 O 2 , которая может быть обозначена с именем Lysin, ...» (… База C 6 H 14 N 2 O 2 , которое может быть обозначено с помощью имени » Лизин ", ...) [Примечание: Эрнст Фишер был аспирантом Дрехселя.]
- ^ Фишер Э., Отказ от Ф (1902). «Синтез α, ε-диаминокапроновой кислоты (неактивный лизин)» [синтез α, ε-диаминогексановой кислоты ([оптически] неактивный лизин)]. Сообщения о немецком химическом обществе (на немецком языке). 35 (3): 3772–3778. Doi : 10.1002/cber.190203503211 .
- ^ Saffran, M. (апрель 1998 г.). «Аминокислотные названия и игры в гостиной: от тривиальных названий до однобуртового кода, аминокислотные названия имеют напряженные воспоминания студентов. Возможно ли более рациональная номенклатура?» Полем Биохимическое образование . 26 (2): 116–118. doi : 10.1016/s0307-4412 (97) 00167-2 .
- ^ Jump up to: а беременный Hudson AO, Bless C, Macedo P, Chatterjee SP, Singh BK, Gilvarg C, Leustek T (январь 2005 г.). «Биосинтез лизина в растениях: свидетельство варианта известных бактериальных путей». Biochimica et Biophysica Acta (BBA) - Общие субъекты . 1721 (1–3): 27–36. doi : 10.1016/j.bbagen.2004.09.008 . PMID 15652176 .
- ^ Velasco AM, Leguina Ji, Lazcano A (октябрь 2002 г.). «Молекулярная эволюция путей биосинтеза лизина». Журнал молекулярной эволюции . 55 (4): 445–459. Bibcode : 2002jmole..55..445V . doi : 10.1007/s00239-002-2340-2 . PMID 12355264 . S2CID 19460256 .
- ^ Миядзаки Т., Миядзаки Дж., Ямане Х, Нишияма М. (июль 2004 г.). «Альфа-аминоадипат аминотрансфераза из чрезвычайно термофильной бактерии, термофилуса» . Микробиология . 150 (Pt 7): 2327–2334. doi : 10.1099/mic.0.27037-0 . PMID 15256574 . S2CID 25416966 .
- ^ Jump up to: а беременный в дюймовый и фон Xu H, Andi B, Qian J, West AH, Cook PF (2006). «Альфа-аминоадипатный путь для биосинтеза лизина в грибах». Клеточная биохимия и биофизика . 46 (1): 43–64. doi : 10.1385/cbb: 46: 1: 43 . PMID 16943623 . S2CID 22370361 .
- ^ Atkinson SC, Dogovski C, Downton MT, Czabotar PE, Dobson RC, Gerrard JA, Wagner J, Perugini MA (март 2013 г.). «Структурное, кинетическое и вычислительное исследование DHDP Vitis Vinifera выявляет новое понимание механизма опосредованного лизином аллостерического ингибирования». Растительная молекулярная биология . 81 (4–5): 431–446. doi : 10.1007/s11103-013-0014-7 . HDL : 11343/282680 . PMID 23354837 . S2CID 17129774 .
- ^ Гриффин М.Д., Биллаканти Дж.М., Васон А., Келлер С., Мертенс Х.Д., Аткинсон С.К., Добсон Р.К., Перугини М.А., Джеррард Дж. А., Пирс Ф.Г. (2012). «Характеристика первых ферментов, приверженных биосинтезу лизина у Arabidopsis thaliana» . Plos один . 7 (7): E40318. BIBCODE : 2012PLOSO ... 740318G . doi : 10.1371/journal.pone.0040318 . PMC 3390394 . PMID 22792278 .
- ^ Soares Da Costa TP, Muscroft-Taylor AC, Dobson RC, Devenish SR, Jameson GB, Gerrard JA (июль 2010 г.). «Насколько важен« существенный »лизин с активным сайтом в дигидродипиколиной синтазе?». Биохими . 92 (7): 837–845. doi : 10.1016/j.biochi.2010.03.004 . PMID 20353808 .
- ^ Soares Da Costa TP, Christensen JB, Desbois S, Gordon SE, Gupta R, Hogan CJ, Nelson TG, Downton MT, Gardhi CK, Abbott BM, Wagner J, Panjikar S, Perugini MA (2015). «Анализ четвертичной структуры важного олигомерного фермента». Аналитическое ультрацентрифугирование . Методы в фермере. Тол. 562. С. 205–223. doi : 10.1016/bs.mie.2015.06.020 . ISBN 9780128029084 Полем PMID 26412653 .
- ^ Muscroft-Taylor AC, Soares Da Costa TP, Джеррард JA (март 2010 г.). «Новое понимание механизма дигидродипиколинатной синтазы с использованием калориметрии изотермического титрования». Биохими . 92 (3): 254–262. doi : 10.1016/j.biochi.2009.12.004 . PMID 20025926 .
- ^ Christensen JB, Soares Da Costa TP, Faou P, Perce FG, Panjikar S, Pergini MA (ноябрь 2016 г.). «Структура и функция цианобактериальных DHDP и DHDPR » Научные отчеты 6 (1): 37111. Bibcode : 2016natsr ... 6371111c Doi : 10.1038/ srep3 PMC 5109050 27845445PMID
- ^ McCoy AJ, Adams NE, Hudson AO, Gilvarg C, Leustek T, Maurelli AT (ноябрь 2006 г.). « L , L -диаминопимелат -аминотрансфераза, фермент транс -кожура, разделяемый хламидиозом и растениями для синтеза диаминопимелата/лизина» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (47): 17909–17914. Bibcode : 2006pnas..10317909M . doi : 10.1073/pnas.0608643103 . PMC 1693846 . PMID 17093042 .
- ^ Hudson AO, Gilvarg C, Leustek T (май 2008 г.). «Биохимическая и филогенетическая характеристика нового пути биосинтеза диаминопимелата у прокариот идентифицирует распределенную форму LL -диаминопимелат -аминотрансферазы» . Журнал бактериологии . 190 (9): 3256–3263. doi : 10.1128/jb.01381-07 . PMC 2347407 . PMID 18310350 .
- ^ Peverelli MG, Perugini MA (август 2015 г.). «Оптимизированный связанный анализ для количественной оценки диаминопимелатной активности декарбоксилазы». Биохими . 115 : 78–85. doi : 10.1016/j.biochi.2015.05.004 . PMID 25986217 .
- ^ Jump up to: а беременный Soares Da Costa TP, Desbois S, Dogois C, Gorman MA, Ketaren NE, Paxman JJ, Siddiqui T, Zammit BM, Abbott BM, Robins-Browne RM, Parker MW, Jameson GB, Hall Ne, Panjikar S, Pergini Ma (август 2016). «Структурные детерминанты, определяющие аллостерический ингибирование незаменимой антибиотической мишени » Структура 24 (8): 1282–1 Doi : 10.1016/ j.str.2016.05.0 27427481PMID
- ^ Jump up to: а беременный Jander G, Joshi V (1 января 2009 г.). «Апартатный аминокислотный биосинтез у Arabidopsis thaliana» . Книга Arabidopsis . 7 : E0121. doi : 10.1199/tab.0121 . PMC 3243338 . PMID 22303247 .
- ^ Andi B, West AH, Cook PF (сентябрь 2004 г.). «Кинетический механизм меченной гистидином гомоцитрат-синтазы из Saccharomyces cerevisiae». Биохимия . 43 (37): 11790–11795. doi : 10.1021/bi048766p . PMID 15362863 .
- ^ Bhattacharjee JK (1985). «Альфа-аминоадипатный путь для биосинтеза лизина у нижних эукариот». Критические обзоры в микробиологии . 12 (2): 131–151. doi : 10.3109/10408418509104427 . PMID 3928261 .
- ^ Bhattacharjee JK, Strassman M (май 1967). «Накопление трикарбоновых кислот, связанных с биосинтезом лизина у дрожжевого мутанта» . Журнал биологической химии . 242 (10): 2542–2546. doi : 10.1016/s0021-9258 (18) 95997-1 . PMID 6026248 .
- ^ Gaillardin CM, Ribet AM, Heslot H (ноябрь 1982). «Формы дикого типа и мутанта гомоизоцитрической дегидрогеназы в дрожжевой Saccharomycopsis lipolytica» . Европейский журнал биохимии . 128 (2–3): 489–494. doi : 10.1111/j.1432-1033.1982.tb06991.x . PMID 6759120 .
- ^ Jaklitsch Wm, Kubicek CP (июль 1990 г.). «Гомоцитрат -синтаза из Penicillium chrysogenum. Локализация, очистка цитозольного изофермента и чувствительность к лизину» . Биохимический журнал . 269 (1): 247–253. doi : 10.1042/bj2690247 . PMC 1131560 . PMID 2115771 .
- ^ Ye ZH, Bhattacharjee JK (декабрь 1988 г.). «Путь биосинтеза лизина и биохимические блоки лизинских ауксотрофов шизосахаромикса Pombe» . Журнал бактериологии . 170 (12): 5968–5970. doi : 10.1128/jb.170.12.5968-5970.1988 . PMC 211717 . PMID 3142867 .
- ^ Kobashi N, Nishiyama M, Tanokura M (март 1999 г.). «Синтез аспартаткиназы-независимого лизина в чрезвычайно термофильной бактерии, термофилус: лизин синтезируется посредством альфа-аминоадипиновой кислоты, а не посредством диаминопимелевой кислоты» . Журнал бактериологии . 181 (6): 1713–1718. doi : 10.1128/jb.181.6.1713-1718.1999 . PMC 93567 . PMID 10074061 .
- ^ Косге Т., Хошино Т. (1999). «Альфа-аминоадипатный путь для биосинтеза лизина широко распространен между штаммами термина». Журнал биологии и биоинженерии . 88 (6): 672–675. doi : 10.1016/s1389-1723 (00) 87099-1 . PMID 16232683 .
- ^ Jump up to: а беременный в дюймовый Nishida H, Nishiyama M, Kobashi N, Kosuge T, Hoshino T, Yamane H (декабрь 1999 г.). «Прокариотический кластер генов, участвующий в синтезе лизина через аминоадипатный путь: ключ к эволюции биосинтеза аминокислот» . Исследование генома . 9 (12): 1175–1183. doi : 10.1101/gr.9.12.1175 . PMID 10613839 .
- ^ Jump up to: а беременный в дюймовый Nishida H, Nishiyama M (сентябрь 2000 г.). «Что характерно для синтеза грибкового лизина через альфа-аминоадипатный путь?». Журнал молекулярной эволюции . 51 (3): 299–302. Bibcode : 2000jmole..51..299n . doi : 10.1007/s002390010091 . PMID 11029074 . S2CID 1265909 .
- ^ Забриски Т.М., Джексон М.Д. (февраль 2000 г.). «Биосинтез лизина и метаболизм в грибах». Отчеты о натуральных продуктах . 17 (1): 85–97. doi : 10.1039/a801345d . PMID 10714900 .
- ^ Jump up to: а беременный Zhu X, Galili G (май 2004 г.). «Метаболизм лизина одновременно регулируется синтезом и катаболизмом как в репродуктивных, так и в вегетативных тканях» . Физиология растений . 135 (1): 129–136. doi : 10.1104/pp.103.037168 . PMC 429340 . PMID 15122025 .
- ^ Jump up to: а беременный в дюймовый и Tomé D, Bos C (июнь 2007 г.). «Требование лизина через жизненный цикл человека» . Журнал питания . 137 (6 Suppl 2): 1642s - 1645s. doi : 10.1093/jn/137.6.1642s . PMID 17513440 .
- ^ Blemings KP, Crenshaw TD, Swick RW, Bengevenga NJ (август 1994 г.). «Лизин-альфа-кетоглутаратредуктаза и сахаропиндегидрогеназа расположены только в митохондриальной матрице в печени крысы» . Журнал питания . 124 (8): 1215–1221. doi : 10.1093/jn/124.8.1215 . PMID 8064371 .
- ^ Галили Г., Тан Г., Чжу Х, Гакье Б. (июнь 2001 г.). «Катаболизм лизина: суперрегулируемый метаболический путь стресса и развития». Современное мнение о биологии растений . 4 (3): 261–266. Bibcode : 2001copb .... 4..261g . doi : 10.1016/s1369-5266 (00) 00170-9 . PMID 11312138 .
- ^ Arruda P, Kemper EL, Papes F, Leite A (август 2000 г.). «Регуляция катаболизма лизина у более высоких растений». Тенденции в науке о растениях . 5 (8): 324–330. doi : 10.1016/s1360-1385 (00) 01688-5 . PMID 10908876 .
- ^ Sacksteder KA, Biery BJ, Morrell JC, Goodman BK, Geisbrecht BV, Cox RP, Gould SJ, Geraghty Mt (июнь 2000 г.). «Идентификация гена альфа-аминоадипического полуалдегида-синтазы, который дефектный по семейной гиперлизинемии» . Американский журнал человеческой генетики . 66 (6): 1736–1743. doi : 10.1086/302919 . PMC 1378037 . PMID 10775527 .
- ^ Zhu X, Tang G, Galili G (декабрь 2002 г.). «Активность бифункционального лизин-кетоглутарат-редуктазы/сахаропиндегидрогеназного фермента лизина катаболизма регулируется функциональным взаимодействием между двумя его ферментными доменами» . Журнал биологической химии . 277 (51): 49655–49661. doi : 10.1074/jbc.m205466200 . PMID 12393892 .
- ^ Jump up to: а беременный в Kiyota E, Pena IA, Arruda P (ноябрь 2015). «Сахаропинный путь в развитии семян и реакции на стресс на кукурузу» . Растение, клетки и окружающая среда . 38 (11): 2450–2461. doi : 10.1111/pce.12563 . PMID 25929294 .
- ^ Serrano GC, Rezende E Silva Figuera T, Kiyota E, Zanata N, Arruda P (март 2012 г.). «Разрушение лизина по пути сахаропина у бактерий: LKR и SDH у бактерий и его связь с ферментами растений и животных» . Письма Febs . 586 (6): 905–911. BIBCODE : 2012FEBSL.586..905D . doi : 10.1016/j.febslet.2012.02.023 . PMID 22449979 . S2CID 32385212 .
- ^ Jump up to: а беременный в Danhauser K, Sauer SW, Haack TB, Wieland T, Staufner C, Graf E, Zschocke J, Strom TM, Traub T, Okun JG, Meitcher T, Hoffmann GF, Prokisch H, Kölker S (декабрь 2012 г.). «Мутации DHTKD1 вызывают 2-аминоадипическую и 2-осокоадипическую ацидоурию» . Американский журнал человеческой генетики . 91 (6): 1082–1087. doi : 10.1016/j.ajhg.2012.10.006 . PMC 3516599 . PMID 23141293 .
- ^ Sauer SW, OPP S, Hoffmann GF, Koeller DM, Okun JG, Kölker S (январь 2011 г.). «Терапевтическая модуляция метаболизма церебрального L -лизина в мышиной модели для глутарной ацидории типа I» . Мозг . 134 (Pt 1): 157–170. doi : 10.1093/brain/awq269 . PMID 20923787 .
- ^ Goncalves RL, Bunik VI, Brand MD (февраль 2016 г.). «Продукция супероксида/перекиси водорода митохондриальным 2-оксоадипат-дегидрогеназной комплексом» . Свободная радикальная биология и медицина . 91 : 247–255. doi : 10.1016/j.freeradbiomed.2015.12.020 . PMID 26708453 .
- ^ Goh DL, Patel A, Thomas GH, Salomons GS, Schor DS, Jakobs C, Geraghty Mt (июль 2002 г.). «Характеристика гена человека, кодирующего альфа-аминоадипат аминотрансферазу (AADAT)». Молекулярная генетика и метаболизм . 76 (3): 172–180. doi : 10.1016/s1096-7192 (02) 00037-9 . PMID 12126930 .
- ^ Härtel U, Eckel E, Koch J, Fuchs G, Linder D, Buckel W (1 февраля 1993 г.). «Очистка глутарил-коадегидрогеназы из Pseudomonas sp., Фермента, участвующего в анаэробной деградации бензоата». Архив микробиологии . 159 (2): 174–181. Bibcode : 1993Armic.159..174H . doi : 10.1007/bf00250279 . PMID 8439237 . S2CID 2262592 .
- ^ Sauer SW (октябрь 2007 г.). «Биохимия и биоэнергетика дефицита глутарил-КоА дегидрогеназы». Журнал наследственного метаболического заболевания . 30 (5): 673–680. doi : 10.1007/s10545-007-0678-8 . PMID 17879145 . S2CID 20609879 .
- ^ Нельсон Д.Л., Кокс М.М., Лехнингер А.Л. (2013). Лехнингер Принципы биохимии (6 -е изд.). Нью -Йорк: WH Freeman and Company. ISBN 978-1-4641-0962-1 Полем OCLC 824794893 .
- ^ Jump up to: а беременный Галили Г., Амир Р (февраль 2013 г.). «Укрепляющие растения с незаменимыми аминокислотами лизина и метионина для улучшения качества питания» . Plant Biotechnology Journal . 11 (2): 211–222. doi : 10.1111/pbi.12025 . PMID 23279001 .
- ^ Jump up to: а беременный Wang G, Xu M, Wang W, Galili G (июнь 2017 г.). «Укрепляющие садоводческие культуры с незаменимыми аминокислотами: обзор» . Международный журнал молекулярных наук . 18 (6): 1306. doi : 10.3390/ijms18061306 . PMC 5486127 . PMID 28629176 .
- ^ Angelovici R, Fait A, Fernie AR, Galili G (январь 2011 г.). «Семя высокая лизиновая черта отрицательно связана с циклом TCA и замедляет прорастание семян арабидопсиса» . Новый фитолог . 189 (1): 148–159. doi : 10.1111/j.1469-8137.2010.03478.x . PMID 20946418 .
- ^ Эдельман М., Кольт М. (2016). «Питательная ценность листьев против семян» . Границы в химии . 4 : 32. DOI : 10.3389/fchem.2016.00032 . PMC 4954856 . PMID 27493937 .
- ^ Цзян С.А., Ма А., Си Л, Рамачандран С (сентябрь 2016 г.). «Улучшение содержания и качества белка путем чрезмерного экспрессирующего искусственно синтетических слитых белков с высоким содержанием лизина и треонина в рисовых растениях» . Научные отчеты . 6 (1): 34427. BIBCODE : 2016NATSR ... 634427J . doi : 10.1038/srep34427 . PMC 5039639 . PMID 27677708 .
- ^ Jump up to: а беременный Shewry PR (ноябрь 2007 г.). «Улучшение содержания белка и состав зернового зернового». Журнал зерновых наук . 46 (3): 239–250. doi : 10.1016/j.jcs.2007.06.006 .
- ^ Прасанна Б., Васал С.К., Кассахун Б., Сингх Н.Н. (2001). «Качественная белка кукуруза». Текущая наука . 81 (10): 1308–1319. JSTOR 24105845 .
- ^ Jump up to: а беременный Kircher M, Pfefferle W (апрель 2001 г.). «Ферментативное производство L -лизина как добавки для корма для животных». Хемосфера . 43 (1): 27–31. Bibcode : 2001Chmsp..43 ... 27K . doi : 10.1016/s0045-6535 (00) 00320-9 . PMID 11233822 .
- ^ Junior L, Alberto L, Letti GV, Soccol CR, Junior L, Alberto L, Letti GV, Soccol CR (2016). «Развитие L -лизинового обогащенного отруби для питания животных посредством погруженной ферментации Corynebacterium glutamicum с использованием агроиндустриальных субстратов» . Бразильские архивы биологии и технологий . 59 doi : 10.1590/1678-4324-2016150519 . ISSN 1516-8913 .
- ^ Медицинский центр Университета Мэриленда. "Лизин" . Получено 30 декабря 2009 года .
- ^ Young VR, Pellett PL (1994). «Растительные белки в отношении белка человека и аминокислотного питания» . Американский журнал клинического питания . 59 (5 Suppl): 1203S - 1212S. doi : 10.1093/ajcn/59.5.1203s . PMID 8172124 . S2CID 35271281 .
- ^ Лэндон, Аманда Дж. (2008). «Как« как »трех сестер: происхождение сельского хозяйства в Мезоамерике и человеческой нише» . Небраска антрополог : 110–124 . Получено 9 августа 2022 года .
- ^ Институт медицины Национальных академий (2005). Диетические эталонные потребления для макронутриентов . п. 589. doi : 10.17226/10490 . ISBN 978-0-309-08525-0 Полем Получено 29 октября 2017 года .
- ^ «База данных о пищевых добавках: информация со смешиванием (DSBI)» .
L -lysine HCL 10000820 80,03% лизин
- ^ Jump up to: а беременный Беттс М.Дж., Рассел Р.Б. (2003). Barnes MR, Grey IC (ред.). Биоинформатика для генетиков . John Wiley & Sons, Ltd. с. 289–316. doi : 10.1002/0470867302.CH14 . ISBN 978-0-470-86730-3 .
- ^ Blickling S, Renner C, Laber B, Pohlenz HD, Holak TA, Huber R (январь 1997 г.). «Механизм реакции Escherichia coli dihydrodipicolinate синтазы, исследованная с помощью рентгеновской кристаллографии и ЯМР-спектроскопии». Биохимия . 36 (1): 24–33. doi : 10.1021/bi962272d . PMID 8993314 . S2CID 23072673 .
- ^ Кумар С., Цай С.Дж., Нуссинова Р. (март 2000 г.). «Факторы, повышающие термостабильность белка» . Протеиновая инженерия . 13 (3): 179–91. doi : 10.1093/белок/13.3.179 . PMID 10775659 .
- ^ Sokalingam S, Raghunathan G, Soundrarajan N, Lee SG (9 июля 2012 г.). «Исследование влияния поверхностного лизина на аргининовый мутагенез на стабильность и структуру белка с использованием зеленого флуоресцентного белка» . Plos один . 7 (7): E40410. BIBCODE : 2012PLOSO ... 740410S . doi : 10.1371/journal.pone.0040410 . PMC 3392243 . PMID 22792305 .
- ^ Jump up to: а беременный Dambacher S, Hahn M, Schotta G (июль 2010 г.). «Эпигенетическая регуляция развития с помощью метилирования лизина гистона» . Наследственность . 105 (1): 24–37. doi : 10.1038/hdy.2010.49 . PMID 20442736 .
- ^ Мартин С, Чжан Y (ноябрь 2005 г.). «Разнообразные функции метилирования гистонового лизина». Природные обзоры. Молекулярная клеточная биология . 6 (11): 838–849. doi : 10.1038/nrm1761 . PMID 16261189 . S2CID 31300025 .
- ^ Black JC, Van Rechem C, Whetstine Jr (ноябрь 2012 г.). «Динамика метилирования гистонов: создание, регуляция и биологическое воздействие» . Молекулярная клетка . 48 (4): 491–507. doi : 10.1016/j.molcel.2012.11.006 . PMC 3861058 . PMID 23200123 .
- ^ Choudhary C, Kumar C, Gnad F, Nielsen ML, Rehman M, Walther TC, Olsen JV, Mann M (август 2009 г.). «Лизин ацетилирование нацелен на белковые комплексы и совместно регулирует основные клеточные функции» . Наука . 325 (5942): 834–840. Bibcode : 2009Sci ... 325..834c . doi : 10.1126/science.1175371 . PMID 19608861 . S2CID 206520776 .
- ^ Шио Y, Эйзенман Р.Н. (ноябрь 2003 г.). «Гистон Сумоилирование связано с репрессией транскрипции» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (23): 13225–13230. doi : 10.1073/pnas.1735528100 . PMC 263760 . PMID 14578449 .
- ^ Wang H, Wang L, Erdjument-Bromage H, Vidal M, Tempst P, Jones RS, Zhang Y (октябрь 2004 г.). «Роль убиквитинирования гистона H2A в поликомбном молчане». Природа . 431 (7010): 873–878. Bibcode : 2004natur.431..873W . doi : 10.1038/nature02985 . HDL : 10261/73732 . PMID 15386022 . S2CID 4344378 .
- ^ Jump up to: а беременный Плечи MD, Raines RT (2009). «Структура коллагена и стабильность» . Ежегодный обзор биохимии . 78 : 929–958. doi : 10.1146/annurev.biochem.77.032207.120833 . PMC 2846778 . PMID 19344236 .
- ^ Jump up to: а беременный Civitelli R, Villareal DT, Agnusdei D, Nardi P, Avioli LV, Gennari C (1992). «Диета -лизин и метаболизм кальция у людей». Питание . 8 (6): 400–405. PMID 1486246 .
- ^ Jump up to: а беременный в дюймовый Vaz FM, Wanders RJ (февраль 2002 г.). «Биосинтез карнитина у млекопитающих» . Биохимический журнал . 361 (Pt 3): 417–429. doi : 10.1042/bj3610417 . PMC 1222323 . PMID 11802770 .
- ^ Yamauchi M, Sricholpech M (25 мая 2012 г.). «Посттрансляционные модификации лизина коллагена» . Эссе в биохимии . 52 : 113–133. doi : 10.1042/bse0520113 . PMC 3499978 . PMID 22708567 .
- ^ Vollmer W, Blanot D, De Pedro MA (март 2008 г.). «Пептидогликан структура и архитектура» . Обзоры микробиологии FEMS . 32 (2): 149–167. doi : 10.1111/j.1574-6976.2007.00094.x . PMID 18194336 .
- ^ Curtiss R (май 1978). «Биологическая сдерживание и клонирование векторного трансмиссии». Журнал инфекционных заболеваний . 137 (5): 668–675. doi : 10.1093/infdis/137.5.668 . PMID 351084 .
- ^ Jump up to: а беременный Flanagan JL, Simmons PA, Athige J, Willcox MD, Garrett Q (апрель 2010 г.). «Роль карнитина при болезни» . Питание и метаболизм . 7 : 30. DOI : 10.1186/1743-7075-7-30 . PMC 2861661 . PMID 20398344 .
- ^ Jump up to: а беременный Chromiak JA, Antonio J (2002). «Использование аминокислот в качестве атлетов, выделяющих гормон роста». Питание . 18 (7–8): 657–661. doi : 10.1016/s0899-9007 (02) 00807-9 . PMID 12093449 .
- ^ Corpas E, Blackman MR, Roberson R, Scholfield D, Harman SM (июль 1993 г.). «Пероральный аргинин-лизин не увеличивает гормон роста или инсулиноподобный фактор роста-I у стариков». Журнал геронтологии . 48 (4): M128 - M133. doi : 10.1093/geronj/48.4.m128 . PMID 8315224 .
- ^ Габи Ар (2006). «Естественные лекарства от герпесного простого». Altern Med Rev. 11 (2): 93–101. PMID 16813459 .
- ^ Томблин Ф.А., Лукас К.Х. (2001). «Лизин для управления герпесам labialis» . Am J Health Syst Syst Pharm . 58 (4): 298–300, 304. doi : 10.1093/ajhp/58.4.298 . PMID 11225166 .
- ^ Chi CC, Wang SH, Delamere FM, Wojnarowska F, Peters MC, Kanjirath PP (7 августа 2015 г.). «Вмешательства по профилактике герпеса Simplex labialis (холодные раны на губах)» . Кокрановская база данных систематических обзоров . 2016 (8): CD010095. doi : 10.1002/14651858.cd010095.pub2 . PMC 6461191 . PMID 26252373 .
- ^ «Научное мнение об обосновлении претензий на здоровье, связанных с L -лизином и иммунной защитой от вируса герпеса (ID 453), поддержание нормальных концентраций LDL -холестерина в крови (ID 454, 4669), увеличение аппетита, приводящее к увеличению энергии» Полем EFSA Journal . 9 (4): 2063. 2011. DOI : 10.2903/j.efsa.2011.2063 . ISSN 1831-4732 .
- ^ Pinnell SR, Krane SM, Kenzora JE, Glimcher MJ (май 1972). «Наследственное расстройство соединительной ткани. Гидроксилизин-дефицитная болезнь коллагена». Новая Англия Журнал медицины . 286 (19): 1013–1020. doi : 10.1056/nejm197205112861901 . PMID 5016372 .
- ^ Rudman D, Sewell CW, Ansley JD (сентябрь 1977 г.). «Дефицит карнитина у кахектических цирротических пациентов» . Журнал клинических исследований . 60 (3): 716–723. doi : 10.1172/jci108824 . PMC 372417 . PMID 893675 .
- ^ Jump up to: а беременный Руштон Д.Х. (июль 2002 г.). «Пищевые факторы и выпадение волос». Клиническая и экспериментальная дерматология . 27 (5): 396–404. doi : 10.1046/j.1365-2230.2002.01076.x . PMID 12190640 . S2CID 39327815 .
- ^ Emery PW (октябрь 2005 г.). «Метаболические изменения в недоедании» . Глаз . 19 (10): 1029–1034. doi : 10.1038/sj.eye.6701959 . PMID 16304580 .
- ^ Ghosh S, Smriga M, Vuvor F, Suri D, Mohammed H, Armah SM, Scrimshaw NS (октябрь 2010 г.). «Влияние добавок лизина на здоровье и заболеваемость у субъектов, принадлежащих к плохим домохозяйствам по периоражам в Аккре, Гана» . Американский журнал клинического питания . 92 (4): 928–939. doi : 10.3945/ajcn.2009.28834 . PMID 20720257 .
- ^ Jump up to: а беременный Houtes SM, T Brinike H, Denis S, Ritier JP, Change AC, Cleck JB, Augoustide-Savopulou P, Häber J, Coşkun T, Schocke J, Schocke J, Polur's RJ. «Генетическая базовая или гиперлизинмия» . Orpanet Journal of RRE расставается . 8 : 57. DOI : 10,1186/1750-1172-8-8-8-57 . PMC 3626681 . PMID 2357048 .
- ^ Хоффманн Г.Ф., Кёлькер С. (2016). «Расстройства головного органического кислоты и другие расстройства катаболизма лизина». Врожденные метаболические заболевания . Спрингер, Берлин, Гейдельберг. С. 333–348. doi : 10.1007/978-3-662-49771-5_22 . ISBN 978-3-662-49769-2 .
- ^ Dancis J, Hutzler J, Ampola MG, Shih Ve, Van Gelderen HH, Kirby LT, Woody NC (май 1983). «Прогноз гиперлизинемии: промежуточный отчет» . Американский журнал человеческой генетики . 35 (3): 438–442. PMC 1685659 . PMID 6407303 .
- ^ Миллс П.Б., Струйс Е., Якобс С., Плекко Б., Бакстер П., Баумгартнер М., Виллемсен М.А., Омран Х., Так У, Уленберг Б., Уэшке Б., Клейтон П.Т. (март 2006 г.). «Мутации в антиквитине у людей с пиридоксином-зависимыми припадками». Природная медицина . 12 (3): 307–309. doi : 10.1038/nm1366 . PMID 16491085 . S2CID 27940375 .
- ^ Mills PB, Footitt EJ, Mills KA, Tuschl K, Aylett S, Varadkar S, Hemingway C, Marlow N, Rennie J, Baxter P, Dulac O, Nabbout R, Craigen WJ, Schmitt B, Feillet F, Christensen E, De Lonlay П, Пайк М.Г., Хьюз М.И., Струис Е.А., Якобс С. Зубери С.М., Клейтон П.Т. (июль 2010 г.). «Генотипический и фенотипический спектр пиридоксинзависимой эпилепсии (дефицит ALDH7A1)» . Мозг . 133 (Pt 7): 2148–2159. doi : 10.1093/brain/awq143 . PMC 2892945 . PMID 20554659 .
- ^ Hagen J, слова H, Wonders RJ, Group AC, Opsoren E, High Tree AJ, Ruise GJ, Becker D, Schwab KO, Franks I, Wood HR, SM (сентябрь 2015 г.). «Антовое основание или альфа-амонадипический и альфа-кетоадикпикапикатический ациурия» . Журнал или унаследованная метаболическая дефицита . 38 (5): 873–879. doi : 10,1007/S10545-015-9841-9 . PMID 25860818 . S2CID 20379124 .
- ^ Hedlund GL, Longo N, Pasquali M (май 2006 г.). «Глютарическая ацидовая тип 1» . Американский журнал медицинской генетики Часть C: Семинары в области медицинской генетики . 142c (2): 86–94. doi : 10.1002/ajmg.c.30088 . PMC 2556991 . PMID 16602100 .
- ^ «Hyperlysinuria | определить гиперлизинурию на dictionary.com» .
- ^ Jump up to: а беременный Уолтер, Джон; Джон Фернандес; Жан-Мари Саудубрей; Жорж Ван Ден Берге (2006). Врожденные метаболические заболевания: диагностика и лечение . Берлин: Спрингер. п. 296. ISBN 978-3-540-28783-4 .
- ^ Jump up to: а беременный «Норвежский предоставлен за улучшение процесса производства лизина» . Все о корме . 26 января 2010 г. Архивировано с оригинала 11 марта 2012 года.
- ^ Торид Y (2004). «Лизин и другие аминокислоты для подачи: производство и вклад в использование белка в кормлении животных» . Источники белка для индустрии кормления животных; Консультация эксперта ФАО и семинар по источникам белков для индустрии кормления животных; Бангкок, 29 апреля - 3 мая 2002 г. Рим: Продовольственная и сельскохозяйственная организация Организации Объединенных Наций. ISBN 978-92-5-105012-5 Полем Архивировано с оригинала 1 февраля 2019 года.
- ^ Абельсон PH (март 1999 г.). «Потенциальный фосфатный кризис» . Наука . 283 (5410): 2015. Bibcode : 1999sci ... 283.2015a . doi : 10.1126/science.283.5410.2015 . PMID 10206902 . S2CID 28106949 .
- ^ Coyne JA (10 октября 1999 г.). «Правда там выходит» . New York Times . Архивировано с оригинала 10 ноября 2012 года . Получено 6 апреля 2008 года .
- ^ Wu G (май 2009 г.). «Аминокислоты: метаболизм, функции и питание». Аминокислоты . 37 (1): 1–17. doi : 10.1007/s00726-009-0269-0 . PMID 19301095 . S2CID 1870305 .
- ^ Коннор Дж. М. (2008). Глобальное исправление цен (2 -е изд.). Гейдельберг: Springer-Verlag. ISBN 978-3-540-78669-6 .
- ^ Эйхенвальд К. (2000). Информатор: правдивая история . Нью -Йорк: Бродвейские книги. ISBN 978-0-7679-0326-4 .
- Статьи Википедии, опубликованные в рецензируемой литературе
- Статьи Википедии, опубликованные в Wikijournal of Science
- Внешне рецензируемые статьи
- Статьи Википедии, опубликованные в рецензируемой литературе (J2W)
- Протеиногенные аминокислоты
- Кетогенные аминокислоты
- Альфа-аминокислоты
- Основные аминокислоты
- Основные аминокислоты
- Диамины


