Гликозидная связь
Гликозидная связь или гликозидная связь — это тип эфирной связи , которая соединяет молекулу углевода (сахара) с другой группой, которая может быть или не быть другим углеводом.
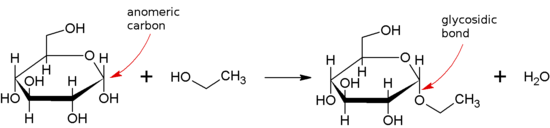
Гликозидная связь образуется между полуацетальной или гемикетальной группой сахарида (или молекулой, полученной из сахарида) и гидроксильной группой некоторого соединения, например спирта . Вещество, содержащее гликозидную связь, является гликозидом .
Термин «гликозид» теперь расширен и включает соединения, связи которых образуются между полуацетальными (или полукетальными) группами сахаров и некоторыми химическими группами, отличными от гидроксильных групп, такими как -SR (тиогликозиды), -SeR (селеногликозиды), -NR. 1 Р 2 (N-гликозиды) или даже -CR 1 Р 2 Р 3 (С-гликозиды).
В частности, в встречающихся в природе гликозидах соединение ROH, из которого удален углеводный остаток, часто называют агликоном, а сам углеводный остаток иногда называют «гликоном».
S-, N-, C- и O-гликозидные связи
[ редактировать ]
Гликозидные связи обсуждаемой выше формы известны как О-гликозидные связи по отношению к гликозидному кислороду , который связывает гликозид с агликоном или восстанавливающим концевым сахаром. По аналогии рассматривают также S-гликозидные связи (образующие тиогликозиды ), где кислород гликозидной связи заменен атомом серы . Точно так же в N-гликозидных связях кислород гликозидной связи заменен азотом . Вещества, содержащие N-гликозидные связи, также известны как гликозиламины . В C-гликозильных связях гликозидный кислород заменен углеродом ; Термин «C-гликозид» считается неправильным ИЮПАК и не рекомендуется. [1] Все эти модифицированные гликозидные связи имеют различную склонность к гидролизу, а в случае С-гликозильных структур они обычно более устойчивы к гидролизу.
Нумерация и различие α/β гликозидных связей
[ редактировать ]
Когда аномерный центр участвует в гликозидной связи (что обычно встречается в природе), тогда можно отличить α- и β-гликозидные связи по относительной стереохимии аномерного положения и стереоцентра, наиболее удаленного от C1 в сахариде. [2]
Фармакологи часто присоединяют вещества к глюкуроновой кислоте посредством гликозидных связей, чтобы повысить их растворимость в воде ; это известно как глюкуронидация . Многие другие гликозиды выполняют важные физиологические функции.
Химические подходы
[ редактировать ]Нюхтер и др. (2001) продемонстрировали новый подход к гликозидированию по Фишеру . [3] [4] [5] Используя микроволновую печь, оснащенную обратным аппаратом, в роторном реакторе с бомбами высокого давления , Nüchter et al. (2001) смогли достичь 100% выхода α- и β-D-глюкозидов. Этот метод может быть реализован в многокилограммовых масштабах.
Метод Вишала И Джоши
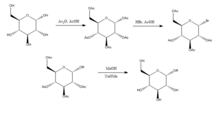
[ редактировать ]Джоши и др. (2006) [6] предложить реакцию Кенигса-Кнорра в стереоселективном синтезе алкил-D-глюкопиранозидов посредством гликозилирования, за исключением использования карбоната лития , который менее дорог и токсичен, чем традиционный метод с использованием солей серебра или ртути . D-глюкозу сначала защищают путем образования перацетата добавлением уксусного ангидрида к уксусной кислоте , а затем добавлением бромистого водорода , который бромируется в 5-положении. При добавлении спирта ROH и карбоната лития OR заменяет бром, а при снятии защиты с ацетилированных гидроксилов продукт синтезируется с относительно высокой чистотой. Это было предложено Джоши и др. (2001) что литий действует как нуклеофил, который атакует углерод в положении 5 и через переходное состояние замещает бромную группу спиртом. Преимущества этого метода, а также его стереоселективность и низкая стоимость соли лития включают в себя то, что его можно проводить при комнатной температуре, а его выход относительно хорошо сравним с традиционным методом Кенигса-Кнорра. [7]
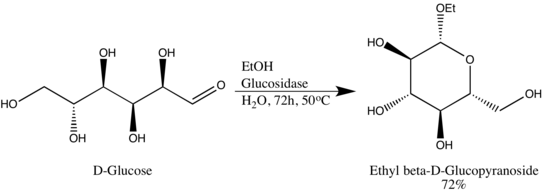
Гликозидгидролазы
[ редактировать ]Гликозидгидролазы (или гликозидазы) представляют собой ферменты , разрывающие гликозидные связи. Гликозидгидролазы обычно могут действовать либо на α-, либо на β-гликозидные связи, но не на обе. Эта специфичность позволяет исследователям получать гликозиды с высоким эпимерным избытком, одним из примеров является преобразование Вэнь-Я Лу D-глюкозы в этил-β-D-глюкопиранозид с использованием глюкозидазы природного происхождения. Стоит отметить, что Вэнь-Я Лу использовала глюкозидазу обратным образом, противоположным биологической функциональности фермента: [8]
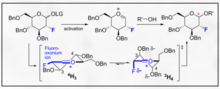
Гликозилтрансферазы
[ редактировать ]Прежде чем моносахаридные единицы будут включены в гликопротеины, полисахариды или липиды живых организмов, они обычно сначала «активируются» путем присоединения через гликозидную связь к фосфатной группе нуклеотида, такого как уридиндифосфат (UDP), гуанозиндифосфат (GDP). , тимидиндифосфат (TDP) или цитидинмонофосфат (CMP). Эти активированные биохимические промежуточные продукты известны как сахарные нуклеотиды или доноры сахара. Многие пути биосинтеза используют моно- или олигосахариды, активируемые дифосфатной связью с липидами, такими как долихол . Эти активированные доноры затем являются субстратами для ферментов, известных как гликозилтрансферазы , которые переносят сахарную единицу от активированного донора к принимающему нуклеофилу (субстрату-акцептору).

Дисахаридфосфорилазы
[ редактировать ]В последние десятилетия были разработаны различные биокаталитические подходы к синтезу гликозидов, которые с использованием «гликозилтрансфераз» и «гликозидгидролаз» являются одними из наиболее распространенных катализов. Для первого часто требуются дорогие материалы, а второй часто показывает низкую урожайность, Де Винтер и др. [10] исследовали использование целлобиозофосфорилазы (ЦФ) для синтеза альфа-гликозидов в ионных жидкостях. Было обнаружено, что наилучшими условиями для использования ЦП является присутствие IL AMMOENG 101 и этилацетата.
Направленное гликозилирование
[ редактировать ]Существует множество химических подходов для повышения селективности α- и β-гликозидных связей. Сильная субстратно-специфичная селективность и общая активность пиранозида могут создавать серьезные синтетические трудности. Общую специфичность гликозилирования можно улучшить, используя подходы, которые принимают во внимание относительные переходные состояния, которым может подвергаться аномерный углерод во время типичного гликозилирования. В частности, признание и включение моделей Фелкина-Ана-Эйзенштейна в обоснование химического проектирования обычно может обеспечить надежные результаты при условии, что трансформация может подвергаться такому типу конформационного контроля в переходном состоянии.
Фтор-направленное гликозилирование представляет собой обнадеживающий способ как для селективности B, так и для введения неприродной биомиметической функциональности C2 в углевод. Один инновационный пример, предоставленный Bucher et al. обеспечивает способ использования иона фтороксония и трихлорацетимидата для стимулирования стереоселективности B за счет эффекта гош. [11] Эта разумная стереоселективность очевидна при визуализации моделей Фелкина-Ана возможных форм стула.
Этот метод представляет собой обнадеживающий способ селективного включения B-этила, изопропила и других гликозидов с типичной химией трихлорацетимидата.
О-связанные гликопептиды; фармацевтическое использование O-гликозилированных пептидов
[ редактировать ]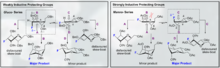
Недавно было показано, что О-связанные гликопептиды демонстрируют превосходную проницаемость и эффективность для ЦНС на многочисленных моделях животных с болезненными состояниями. Кроме того, одним из наиболее интригующих его аспектов является способность О-гликозилирования продлевать период полувыведения, снижать клиренс и улучшать ФК/ФД активного пептида, помимо увеличения проникновения в ЦНС. Врожденное использование сахаров в качестве солюбилизирующих фрагментов в метаболизме фаз II и III (глюкуроновые кислоты) обеспечило удивительное эволюционное преимущество, заключающееся в том, что ферменты млекопитающих не эволюционировали напрямую для разложения O-гликозилированных продуктов на более крупных фрагментах.
Особая природа О-связанных гликопептидов заключается в том, что существует множество примеров, проникающих в ЦНС. Считается, что фундаментальная основа этого эффекта заключается в «перескоке мембраны» или «диффузии хмеля». Считается, что процесс «прыжковой диффузии», вызванный неброуновским движением, происходит из-за разрыва плазматической мембраны. «Диффузия хмеля» сочетает в себе свободную диффузию и межкомпарментарные переходы. Недавние примеры, в частности, включают высокую проницаемость аналогов метэнкефалина среди других пептидов. Полный пентапептид-агонист mOR DAMGO также проникает в ЦНС при гликозилировании. [12] [13] [14]
N-гликозидные связи в ДНК
[ редактировать ]Молекулы ДНК содержат 5-членные углеродные кольца, называемые рибозами, которые непосредственно присоединены к двум фосфатным группам и нуклеиновому основанию, содержащему аминогруппы. Атомы азота аминогруппы нуклеотидов ковалентно связаны с аномерным углеродом структуры рибозного сахара через N-гликозидную связь. Иногда нуклеиновые основания, присоединенные к рибозе, подвергаются дезаминированию, алкилированию или окислению, что приводит к цитотоксическим повреждениям основной цепи ДНК. Эти модификации серьезно угрожают сплоченности молекулы ДНК, что приводит к развитию таких заболеваний, как рак. ДНК-гликозилазы - это ферменты, которые катализируют гидролиз N-гликозидной связи с целью освобождения поврежденного или модифицированного нуклеинового основания из ДНК путем расщепления углерод-азотной гликозидной связи на 2'-углероде, что впоследствии инициирует путь репарации вырезания оснований (BER).
Монофункциональные гликозилазы катализируют гидролиз N-гликозидной связи либо по ступенчатому механизму, подобному SN 1, либо по согласованному механизму, подобному SN 2 . Ступенчатая функция: азотистое основание действует как уходящая группа до того, как аномерный углерод подвергается атаке молекулы воды, образуя недолговечный нестабильный оксакарбения промежуточный ион . Этот промежуточный продукт быстро реагирует с близлежащей молекулой воды, заменяя N-гликозидную связь рибозы и нуклеинового основания на O-гликозидную связь с гидроксигруппой. В результате согласованного механизма вода действует как нуклеофил и атакует аномерный углерод до того, как нуцелобаза начнет действовать как уходящая группа. Полученное промежуточное соединение представляет собой аналогичный ион оксакарбения, в котором как гидроксильные группы, так и азотистое основание все еще присоединены к аномерному углероду. Оба механизма теоретически дают один и тот же продукт. Большинство рибонуклеотидов гидролизуются по согласованному S N 2 -подобному механизму, тогда как большинство дезоксирибонуклеотидов - по ступенчатому механизму.
Эти реакции практически необратимы. В связи с тем, что отщепление N-гликозидной связи от основной цепи ДНК может привести к пагубным мутагенным и цитотоксическим реакциям в организме, обладают способностью также катализировать синтез N-гликозидных связей через абазический участок ДНК и определенное азотистое основание. [15]
Ссылки
[ редактировать ]- ^ «Номенклатура углеводов (Рекомендации 1996 г.)» . Химический факультет Лондонского университета Королевы Марии .
- ^ Бертоцци С., Рабука Д. (2009). «Структурная основа разнообразия гликанов» . В Варки А., Каммингс Р.Д., Эско Дж.Д. и др. (ред.). Основы гликобиологии (2-е изд.). Лабораторный пресс Колд-Спринг-Харбор. ISBN 978-0-87969-770-9 .
- ^ Фишер, Эмиль (1893). «О глюкозидах спиртов» . Отчеты Немецкого химического общества . 26 (3): 24:00–24:12. дои : 10.1002/cber.18930260327 .
- ^ Фишер, Эмиль (1895). «О связи сахаров со спиртами и кетонами» . Отчеты Немецкого химического общества . 28 (1): 1145–1167. дои : 10.1002/cber.189502801248 . ISSN 1099-0682 .
- ^ Трезвый, Матиас; Ондрушка, Бернд; Лаутеншлегер, Вернер (2001). «Синтез алкилгликозидов с помощью микроволновой печи». Синтетические коммуникации . 31 (9): 1277–1283. дои : 10.1081/scc-100104035 . ISSN 0039-7911 . S2CID 93986043 .
- ^ Джоши В.Ю., Савант М.Р. (2006). «Удобный стереоселективный синтез β-D-глюкопиранозидов». Индийский химический журнал . 45Б : 461–465.
- ^ Кенигс В., Кнорр Э. (1901). «О некоторых производных глюкозы и галактозы» . Отчеты Немецкого химического общества . 34 (1): 957–981. дои : 10.1002/cber.190103401162 .
- ^ Jump up to: а б Лу В.И., Линь GQ, Ю Х.Л., Тонг А.М., Сюй Дж.Х. (09 декабря 2009 г.). Уиттолл Дж., Саттон П.В. (ред.). Практические методы биокатализа и биотрансформаций . Джон Уайли и сыновья. стр. 236–239. ISBN 978-0-470-74859-6 .
- ^ Бучер С., Гилмор Р. (ноябрь 2010 г.). «Фтор-направленное гликозилирование». Angewandte Chemie, международное издание . 49 (46): 8724–8. дои : 10.1002/anie.201004467 . ПМИД 20886497 .
- ^ Де Винтер К., Ван Рентергем Л., Вуйтс К., Пелантова Х., Кржен В., Соэтарт В., Десмет Т. (2015). «Хемоферментативный синтез β-D глюкозидов с использованием целлобиозофосфорилазы из Clostridium thermocellum». Расширенный синтез и катализ . 357 (8): 1961–1969. дои : 10.1002/adsc.201500077 . ISSN 1615-4150 .
- ^ Дюранти, Эстель; Бухер, Кристоф; Гилмор, Райан (16 мая 2012 г.). «Фтор-направленное β-галактозилирование: развитие химического гликозилирования путем молекулярного редактирования» . Химия – Европейский журнал . 18 (26): 8208–8215. дои : 10.1002/chem.201200468 . ПМИД 22592962 . Проверено 24 апреля 2022 г.
- ^ Эглетон Р.Д., Митчелл С.А., Хубер Дж.Д., Джандерс Дж., Стропова Д., Полт Р. и др. (октябрь 2000 г.). «Улучшенная биодоступность для мозга гликозилированных аналогов мет-энкефалина». Исследования мозга . 881 (1): 37–46. дои : 10.1016/S0006-8993(00)02794-3 . ПМИД 11033091 . S2CID 18102579 .
- ^ Полт Р., Дханасекаран М., Кейари С.М. (сентябрь 2005 г.). «Гликозилированные нейропептиды: новые перспективы нейропсихофармакологии?». Обзоры медицинских исследований . 25 (5): 557–585. дои : 10.1002/мед.20039 . ПМИД 16075406 . S2CID 38798797 .
- ^ Эглтон, Ричард Д.; Бильский, Эдвард Дж.; Толлин, Гордон; Дханасекаран, руководитель; Лоури, Джон; Алвес, Элизабет; Дэвис, Пег; Поррека, Фрэнк; Ямамура, Генри I. (10 января 2005 г.). «Биусианские гликопептиды проникают через гематоэнцефалический барьер». Тетраэдр: Асимметрия . Углеводная наука. Ч. 1. 16 (1):65–75. дои : 10.1016/j.breast.2004.11.038 .
- ^ Дрохат А.С., Маити А. (ноябрь 2014 г.). «Механизмы ферментативного расщепления N-гликозидной связи в ДНК» . Органическая и биомолекулярная химия . 12 (42): 8367–8378. дои : 10.1039/c4ob01063a . ПМЦ 4238931 . ПМИД 25181003 .
- Марко Брито-Ариас, «Синтез и характеристика гликозидов», второе издание, Editorial Springer 2016.
Внешние ссылки
[ редактировать ]- Определение гликозидов из ИЮПАК Сборника химической терминологии , « Золотой книги ».
- Варки А и др. Основы гликобиологии. Лабораторный пресс Колд-Спринг-Харбор; 1999. Доступно для поиска в Интернете.


