Биологический насос

| Часть серии обзоров по |
| Морская жизнь |
|---|
 |
( Биологический насос или океанический углеродный биологический насос или морской биологический углеродный насос океаном ) представляет собой биологически управляемый механизм поглощения углерода из атмосферы и поверхностного стока в недра океана и отложения морского дна . [ 1 ] Другими словами, это биологически опосредованный процесс, который приводит к улавливанию углерода в глубинах океана вдали от атмосферы и суши. Биологический насос — это биологический компонент «морского угольного насоса», который содержит как физический, так и биологический компонент. Это часть более широкого океанического углеродного цикла, отвечающая за круговорот органического вещества , образуемого главным образом фитопланктоном во время фотосинтеза (насос мягких тканей), а также за круговорот карбоната кальция (CaCO 3 ), образующегося в панцирях некоторыми организмами, такими как планктон и моллюски (карбонатный насос). [ 2 ]
Расчеты бюджета биологического углеродного насоса основаны на соотношении между седиментацией (вывозом углерода на дно океана) и реминерализацией (выбросом углерода в атмосферу).
Биологический насос — это не столько результат одного процесса, сколько сумма ряда процессов, каждый из которых может влиять на биологическую накачку. В целом насос перекачивает около 10,2 гигатонн углерода каждый год в недра океана и в общей сложности 1300 гигатонн углерода в среднем за 127 лет. [ 3 ] Это выводит углерод из контакта с атмосферой на несколько тысяч лет или дольше. Океан без биологического насоса приведет к тому, что уровень углекислого газа в атмосфере будет примерно на 400 частей на миллион выше, чем сегодня.
Обзор
[ редактировать ]
Элемент углерод играет центральную роль в климате и жизни на Земле. Он способен перемещаться между геосферой , криосферой , атмосферой , биосферой и гидросферой . Этот поток углерода называется углеродным циклом Земли . Он также тесно связан с круговоротом других элементов и соединений. Океан играет фундаментальную роль в углеродном цикле Земли, помогая регулировать концентрацию CO 2 в атмосфере . Биологический насос представляет собой набор процессов, которые переносят органический углерод с поверхности в глубины океана и лежат в основе круговорота углерода в океане . [ 5 ]
Биологический насос зависит от доли первично произведенного органического вещества , которое выдерживает разложение в эвфотической зоне и экспортируется из поверхностных вод в глубь океана, где оно минерализуется до неорганического углерода , в результате чего углерод транспортируется против градиента растворенный неорганический углерод (DIC) от поверхности до глубин океана. Этот перенос происходит посредством физического смешивания и переноса растворенного и дисперсного органического углерода (РОУ), вертикальной миграции организмов ( зоопланктона , рыбы ) и гравитационного осаждения дисперсного органического углерода. [ 6 ] [ 7 ] : 526 [ 8 ]
Биологический насос можно разделить на три отдельные фазы, первая из которых — производство фиксированного углерода планктонными фототрофами в эвфотической (освещенной солнцем) области поверхности океана. В этих поверхностных водах фитопланктон использует углекислый газ (СО 2 ), азот (N), фосфор (Р) и другие микроэлементы ( барий , железо , цинк и др.) в ходе фотосинтеза для образования углеводов , липидов и белков . Некоторые планктоны (например, кокколитофоры и фораминиферы ) объединяют кальций (Ca) и растворенные карбонаты ( угольную кислоту и бикарбонат ), образуя защитное покрытие из карбоната кальция (CaCO 3 ). [ 9 ]
Как только этот углерод фиксируется в мягких или твердых тканях, организмы либо остаются в эвфотической зоне и перерабатываются в рамках регенеративного цикла питательных веществ , либо, умирая, переходят ко второй фазе биологического насоса и начинают погружаться в океан. пол. Тонущие частицы часто образуют агрегаты по мере погружения, что значительно увеличивает скорость погружения. Именно эта агрегация дает частицам больше шансов избежать хищничества и разложения в толще воды и в конечном итоге достичь морского дна. [ 9 ]
Фиксированный углерод, который разлагается бактериями либо на пути вниз, либо на морском дне, затем поступает на заключительную фазу работы насоса и реминерализируется для повторного использования в первичном производстве . Частицы, которые полностью ускользают от этих процессов, задерживаются в осадке и могут оставаться там в течение миллионов лет. Именно этот секвестрированный углерод ответственен за окончательное снижение уровня CO 2 в атмосфере . [ 9 ]

| Часть серии о |
| Углеродный цикл |
|---|
 |
На схеме выше показаны компоненты биологического насоса. Биология, физика и гравитация взаимодействуют, перекачивая органический углерод в глубокое море. Процессы фиксации неорганического углерода в органическом веществе в ходе фотосинтеза, его трансформации посредством процессов пищевой сети (трофодинамики), физического смешивания, транспорта и гравитационного осаждения вместе называются биологическим насосом. [ 10 ]
Биологический насос отвечает за преобразование растворенного неорганического углерода (DIC) в органическую биомассу и перекачивание его в виде частиц или растворенного вещества в глубокие глубины океана. Неорганические питательные вещества и углекислый газ фиксируются в ходе фотосинтеза фитопланктоном, который как выделяет растворенное органическое вещество (РОВ), так и потребляется растительноядным зоопланктоном. Более крупный зоопланктон, например копеподы , выделяет фекальные гранулы , которые можно повторно проглатывать и тонуть или собирать вместе с другим органическим детритом в более крупные и быстро тонущие агрегаты. РОВ частично потребляется бактериями (черные точки) и выдыхается; оставшееся тугоплавкое РОВ переносится и смешивается с глубоководными водами. РОВ и агрегаты, экспортируемые в глубокие воды, потребляются и выдыхаются, возвращая таким образом органический углерод в огромный глубоководный резервуар океана DIC. Около 1% частиц, покидающих поверхность океана, достигают морского дна и потребляются, выдыхаются или захораниваются в отложениях. Там углерод сохраняется миллионы лет. Конечным эффектом этих процессов является удаление углерода в органической форме с поверхности и возвращение его в DIC на больших глубинах, поддерживая градиент DIC от поверхности к глубине океана. Термохалинная циркуляция возвращает глубоководный океанический DIC в атмосферу в тысячелетних масштабах. [ 10 ]
Первичное производство
[ редактировать ]
Первым шагом в биологическом насосе является синтез органических и неорганических соединений углерода фитопланктоном в самых верхних, освещенных солнцем слоях океана. [ 13 ] Органические соединения в виде сахаров, углеводов, липидов и белков синтезируются в процессе фотосинтеза :
CO 2 + H 2 O + свет → CH 2 O + O 2
Помимо углерода, органическое вещество фитопланктона состоит из азота, фосфора и различных микроэлементов . Соотношение углерода, азота и фосфора варьируется от места к месту. [ 14 ] но имеет среднее соотношение около 106C:16N:1P, известное как соотношение Редфилда . Следы металлов, такие как магний, кадмий, железо, кальций, барий и медь, на несколько порядков менее распространены в органическом материале фитопланктона, но необходимы для определенных метаболических процессов и, следовательно, могут ограничивать питательные вещества при фотосинтезе из-за их более низкого содержания в толще воды. [ 9 ]
На первичную продукцию океана приходится около половины фиксации углерода, осуществляемой на Земле. примерно 50–60 Пг Морским фитопланктоном ежегодно фиксируется углерода, несмотря на то, что они составляют менее 1% от общей фотосинтетической биомассы на Земле. Большая часть этой фиксации углерода (~ 80%) осуществляется в открытом океане, а остальная часть приходится на очень продуктивные апвеллинговые районы океана. Несмотря на то, что эти продуктивные регионы производят в 2–3 раза больше фиксированного углерода на площадь, открытый океан занимает более 90% площади океана и, следовательно, вносит больший вклад. [ 9 ]
Формы углерода
[ редактировать ]
Растворенный и твердый углерод
[ редактировать ]Фитопланктон поддерживает всю жизнь в океане, превращая неорганические соединения в органические компоненты. Эта автотрофно произведенная биомасса представляет собой основу морской пищевой сети. [ 15 ] На диаграмме ниже стрелки указывают на различные процессы производства (стрелка указывает на пул РОВ) и удаления РОВ (наконечник стрелки направлен в сторону), а пунктирные стрелки представляют доминирующие биологические процессы, участвующие в переносе РОВ. Благодаря этим процессам доля лабильного РОВ быстро уменьшается с глубиной, тогда как тугоплавкость пула РОВ значительно возрастает при его выносе в глубины океана. РОВ, растворенное органическое вещество. [ 15 ] [ 16 ]


Запасы углерода в океане
[ редактировать ]Морской биологический насос зависит от ряда ключевых пулов, компонентов и процессов, которые влияют на его функционирование. В океане есть четыре основных резервуара углерода. [ 5 ]
- Растворенный неорганический углерод (DIC) представляет собой самый большой пул. Он составляет около 38 000 Пг C. [ 18 ] и включает растворенный диоксид углерода (CO 2 ), бикарбонат ( HCO −
3 ), карбонат ( CO 2−
3 ) и угольная кислота ( Н 2 СО ) 3 . Равновесие между угольной кислотой и карбонатом определяет pH морской воды. Углекислый газ легко растворяется в воде, и его растворимость обратно пропорциональна температуре. Растворенный CO 2 поглощается в процессе фотосинтеза и может снизить парциальное давление CO 2 в морской воде, способствуя понижению давления из атмосферы. Обратный процесс дыхания, высвобождающий CO 2 обратно в воду, может увеличить парциальное давление CO 2 в морской воде, способствуя выбросу обратно в атмосферу. Образование карбоната кальция такими организмами, как кокколитофоры, приводит к выделению CO 2 в воду. [ 19 ] [ 20 ] [ 21 ] [ 5 ]
- Растворенный органический углерод (DOC) является следующим по величине пулом с содержанием около 662 Пг С. [ 22 ] DOC можно классифицировать в зависимости от его реакционной способности как тугоплавкий, полулабильный или лабильный. Лабильный пул составляет около 0,2 Пг С, биодоступен и имеет высокую скорость продукции (~ 15–25 Пг С в год). −1 ). [ 23 ] Тугоплавкий компонент представляет собой самый большой пул (~642 Pg C ± 32; [ 22 ] но имеет очень низкую текучесть кадров (0,043 Pg C y −1 ). [ 23 ] Считается, что срок службы огнеупорного DOC превышает 1000 лет. [ 24 ] [ 25 ] [ 5 ]
- Содержание органического углерода в твердых частицах (POC) составляет около 2,3 Pg C, [ 26 ] [ 27 ] и относительно невелик по сравнению с ДВС и ДОК. Несмотря на небольшой размер, этот пул очень динамичен и имеет самую высокую скорость оборота среди всех пулов органического углерода на планете. [ 28 ] За счет первичного производства он производит около 50 Pg Cy. −1 глобально. [ 29 ] [ 30 ] [ 31 ] Его можно разделить на живой (например, фитопланктон , зоопланктон , бактерии ) и неживой (например, детрит ) материал. Из них углерод фитопланктона особенно важен из-за его роли в первичной морской продукции , а также потому, что он служит пищевым ресурсом для всех более крупных организмов в пелагической экосистеме . [ 5 ]
- Неорганический углерод в виде частиц (PIC) — самый маленький из пулов, его содержание составляет около 0,03 Pg C. [ 32 ] Он присутствует в форме карбоната кальция (CaCO 3 ) в форме частиц и влияет на карбонатную систему и pH морской воды. По оценкам, производство PIC находится в районе 0,8–1,4 Pg Cy. −1 , при этом не менее 65% его растворяется в верхних слоях воды , а остальная часть способствует образованию глубоких отложений. [ 33 ] По оценкам, кокколитофороры и фораминиферы являются доминирующими источниками PIC в открытом океане . [ 34 ] [ 33 ] Пул PIC имеет особое значение из-за его роли в карбонатной системе океана и облегчения экспорта углерода в глубокие слои океана через карбонатный насос , посредством которого PIC вывозится из фотической зоны и откладывается в донных отложениях . [ 35 ] [ 5 ]
Карбонат кальция
[ редактировать ]
Частицы неорганического углерода (PIC) обычно принимают форму карбоната кальция (CaCO 3 ) и играют ключевую роль в углеродном цикле океана. [ 36 ] Этот биологически фиксированный углерод используется в качестве защитного покрытия для многих планктонных видов (кокколитофоры, фораминиферы), а также для более крупных морских организмов (раковины моллюсков). Карбонат кальция также быстро выделяется из организма во время осморегуляции рыб и может образовываться в процессе путассу . [ 37 ] Хотя эта форма углерода не извлекается напрямую из атмосферного баланса, она образуется из растворенных форм карбоната, которые находятся в равновесии с CO 2 и затем отвечают за удаление этого углерода путем секвестрации. [ 38 ]
CO 2 + H 2 O → H 2 CO 3 → H + + HCO3 −
Что 2+ + 2HCO3 − → СаСО 3 + СО 2 + Н 2 О
Хотя этот процесс действительно позволяет фиксировать большое количество углерода, две единицы щелочности . на каждую единицу секвестрированного углерода приходится [ 2 ] [ 39 ] Таким образом, образование и опускание CaCO 3 от поверхности к глубокому приводит к градиенту щелочности , что способствует повышению pH поверхностных вод, сдвигая вид растворенного углерода, что приводит к повышению парциального давления растворенного CO 2 в поверхностных водах, что фактически повышает уровень атмосферы. Кроме того, захоронение CaCO 3 в отложениях способствует снижению общей щелочности океана , что имеет тенденцию к повышению pH и, следовательно, уровня CO 2 в атмосфере , если это не уравновешивается новым привнесением щелочности в результате выветривания. [ 1 ] Та часть углерода, которая навсегда захоронена на морском дне, становится частью геологической летописи. Карбонат кальция часто образует замечательные отложения, которые затем могут быть подняты на сушу в результате тектонических движений, как в случае с Белыми скалами Дувра в Южной Англии. Эти скалы почти полностью состоят из пластин погребенных кокколитофоров . [ 40 ]
Океанический углеродный цикл
[ редактировать ]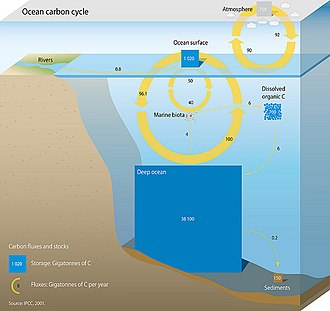
Три основных процесса (или насоса), составляющих морской углеродный цикл, переносят атмосферный углекислый газ (CO 2 ) в недра океана и распределяют его по океанам. Этими тремя насосами являются: (1) насос растворимости, (2) карбонатный насос и (3) биологический насос. Общий активный запас углерода на поверхности Земли в течение периода менее 10 000 лет составляет примерно 40 000 гигатонн С (Гт С, гигатонна равна одному миллиарду тонн, или вес примерно 6 миллионов синих китов ), и около 95% (~ 38 000 Гт C) хранится в океане, главным образом, в виде растворенного неорганического углерода . [ 41 ] [ 42 ] Видообразование растворенного неорганического углерода в морском углеродном цикле является основным регулятором кислотно-щелочной химии в океанах.
Насос растворимости
[ редактировать ]
Биологический насос сопровождается физико-химическим аналогом, известным как насос растворимости . Этот насос транспортирует значительные количества углерода в форме растворенного неорганического углерода (DIC) с поверхности океана внутрь его. Он включает в себя только физические и химические процессы и не включает биологические процессы. [ 43 ]
Насос растворимости приводится в действие совпадением двух процессов в океане:
- Растворимость ( углекислого газа является строго обратной функцией температуры морской воды т.е. растворимость выше в более прохладной воде).
- Термохалинная циркуляция обусловлена образованием глубоких вод в высоких широтах, где морская вода обычно холоднее и плотнее.
Поскольку глубинная вода (то есть морская вода во внутренней части океана) образуется в тех же поверхностных условиях, которые способствуют растворимости углекислого газа, она содержит более высокую концентрацию растворенного неорганического углерода, чем можно было бы ожидать, исходя из средних приземных концентраций. Следовательно, эти два процесса действуют вместе, перекачивая углерод из атмосферы в недра океана. Одним из последствий этого является то, что когда глубинные воды поднимаются вверх в более теплых экваториальных широтах, они сильно выделяют углекислый газ в атмосферу из-за пониженной растворимости газа. [ 44 ]
Карбонатный насос
[ редактировать ]Карбонатный насос иногда называют компонентом «твердых тканей» биологического насоса. [ 45 ] Некоторые поверхностные морские организмы, такие как кокколитофоры , производят твердые структуры из карбоната кальция, формы твердых частиц неорганического углерода, путем фиксации бикарбоната. [ 46 ] Эта фиксация DIC является важной частью океанического углеродного цикла.
Что 2+ + 2HCO3 − → СаСО 3 + СО 2 + Н 2 О
В то время как биологический углеродный насос фиксирует неорганический углерод (CO 2 ) в твердые частицы органического углерода в форме сахара (C 6 H 12 O 6 ), карбонатный насос фиксирует неорганический бикарбонат и вызывает чистый выброс CO 2 . [ 46 ] Таким образом, карбонатный насос можно назвать противокарбонатным насосом. Он работает против биологического насоса, противодействуя потоку CO 2 в биологический насос. [ 47 ]
Насос для континентального шельфа
[ редактировать ]Предполагается, что насос континентального шельфа работает на мелководье континентальных шельфов в качестве механизма, транспортирующего углерод (растворенный или твердый) из континентальных вод во внутреннюю часть прилегающего глубокого океана. [ 48 ] Согласно первоначальной формулировке, насос, как полагают, возникает там, где насос растворимости взаимодействует с более холодной и, следовательно, более плотной водой со дна шельфа, которая стекает по континентальному склону в соседний глубокий океан. [ 48 ] Мелководность континентального шельфа ограничивает конвекцию охлаждающей воды, поэтому охлаждение вод континентального шельфа может быть сильнее, чем соседних вод открытого океана. Эти более прохладные воды способствуют работе насоса растворимости и приводят к увеличению запасов растворенного неорганического углерода . Это дополнительное накопление углерода дополнительно усиливается за счет увеличения биологического производства, характерного для шельфов. [ 49 ] Плотные, богатые углеродом шельфовые воды затем опускаются на дно шельфа и попадают в подповерхностный слой открытого океана посредством изопикнального перемешивания. [ 48 ] Поскольку уровень моря повышается в ответ на глобальное потепление, площадь поверхности шельфовых морей будет увеличиваться, и, как следствие, мощность насоса шельфового моря должна увеличиться. [ 50 ]
Процессы в биологическом насосе
[ редактировать ]
На диаграмме справа фитопланктон преобразует CO 2 , растворенный из атмосферы, в поверхностные слои океанов (90 Гт/год). −1 ), в твердый органический углерод (POC) во время первичного производства (~ 50 Гт C в год −1 ). Затем фитопланктон потребляется копеподами , крилем и другими мелкими травоядными зоопланктоном, которые, в свою очередь, становятся добычей более высоких трофических уровней . Любой неизрасходованный фитопланктон образует скопления и вместе с фекальными гранулами зоопланктона быстро тонет и выносится из смешанного слоя (< 12 Гт С/год). −1 14). Криль, копеподы, зоопланктон и микробы перехватывают фитопланктон на поверхности океана и погружают детритные частицы на глубину, потребляя и выдыхая этот POC до CO 2 ( растворенный неорганический углерод , DIC), так что лишь небольшая часть углерода, образующегося на поверхности, опускается в океан. глубокий океан (т.е. глубины > 1000 м). В качестве корма для криля и более мелкого зоопланктона они также физически дробят частицы на мелкие, более медленные или нетонущие кусочки (из-за неаккуратного кормления, копрорексии в случае фрагментации фекалий), [ 52 ] замедление экспорта POC. (DOC) высвобождается При этом растворенный органический углерод либо непосредственно из клеток, либо косвенно посредством бактериальной солюбилизации (желтый кружок вокруг DOC). Затем бактерии могут реминерализовать DOC в DIC (CO 2 , микробное садоводство). [ 51 ]
Биологический углеродный насос является одним из главных факторов, определяющих вертикальное распределение углерода в океанах и, следовательно, парциальное давление CO 2 воздух-море на поверхности, регулирующее обмен CO 2 . [ 53 ] Он включает в себя клетки фитопланктона, их потребителей и бактерии, которые ассимилируют их отходы, и играет центральную роль в глобальном углеродном цикле, доставляя углерод из атмосферы в морские глубины, где он концентрируется и изолируется на протяжении столетий. [ 54 ] Фотосинтез фитопланктона снижает парциальное давление CO 2 в верхних слоях океана, тем самым облегчая поглощение CO 2 из атмосферы за счет создания более крутого градиента CO 2 . [ 55 ] Это также приводит к образованию взвешенного органического углерода (ВОУ) в эвфотическом слое эпипелагиали ( глубина 0–200 м). ВОУ перерабатывается микробами, зоопланктоном и их потребителями в фекальные гранулы, органические агрегаты («морской снег») и другие формы, которые затем вывозятся в мезопелагическую (глубина 200–1000 м) и батипелагическую зоны путем погружения и вертикальной миграции. зоопланктон и рыбы. [ 56 ] Хотя первичная продукция включает как растворенный , так и твердый органический углерод (DOC и POC соответственно), только POC приводит к эффективному экспорту углерода в глубь океана, тогда как фракция DOC в поверхностных водах в основном перерабатывается бактериями. [ 57 ] Однако более биологически устойчивая фракция РОУ, образующаяся в эвфотической зоне (на которую приходится 15–20% чистой продуктивности сообщества), не сразу минерализуется микробами и накапливается на поверхности океана в виде биологически полулабильного РОУ . [ 58 ] Этот полулабильный DOC подвергается чистому экспорту в глубины океана, образуя, таким образом, динамическую часть биологического углеродного насоса. [ 59 ] Эффективность производства и экспорта DOC варьируется в зависимости от океанографических регионов и более заметна в олиготрофных субтропических океанах. [ 60 ] Общая эффективность биологического углеродного насоса в основном контролируется экспортом РОС. [ 57 ] [ 61 ]
Морской снег
[ редактировать ]
Большая часть углерода, включенного в органические и неорганические биологические вещества, образуется на поверхности моря, где затем может начать опускаться на дно океана. Глубокий океан получает большую часть питательных веществ из верхних слоев воды, когда они опускаются в виде морского снега. Он состоит из мертвых или умирающих животных и микробов, фекалий, песка и других неорганических материалов. [ 63 ] Одна клетка фитопланктона имеет скорость погружения около одного метра в день. Учитывая, что средняя глубина океана составляет около четырех километров, этим клеткам может потребоваться более десяти лет, чтобы достичь дна океана. Однако в результате таких процессов, как коагуляция и изгнание фекальных гранул хищников, эти клетки образуют агрегаты. Эти агрегаты, известные как морской снег , имеют скорость погружения на несколько порядков большую, чем отдельные клетки, и завершают свое путешествие на глубину за считанные дни. [ 9 ]
На диаграмме справа фитопланктон фиксирует CO 2 в эвфотической зоне, используя солнечную энергию, и производит твердый органический углерод (POC). ВОУ, образующиеся в эвфотической зоне, перерабатываются микробами, зоопланктоном и их потребителями в органические агрегаты (морской снег), которые в дальнейшем экспортируются в мезопелагическую (глубина 200–1000 м) и батипелагическую зоны путем погружения и вертикальной миграции зоопланктона и рыб. Экспортный поток определяется как седиментация из поверхностного слоя (на глубине примерно 100 м), а поток секвестрации — это седиментация из мезопелагической зоны (на глубине примерно 1000 м). Часть ПОУ выдыхается обратно в CO 2 в толще океанических вод на глубине, в основном гетеротрофными микробами и зоопланктоном, тем самым поддерживая вертикальный градиент концентрации растворенного неорганического углерода (DIC). Этот глубоководный океанический ДИК возвращается в атмосферу в тысячелетнем масштабе посредством термохалинной циркуляции . От 1% до 40% первичной продукции вывозится из эвфотической зоны, которая экспоненциально затухает к основанию мезопелагической зоны, и только около 1% поверхностной продукции достигает морского дна. [ 61 ] [ 64 ] [ 56 ]
Из 50–60 Пг углерода, фиксируемого ежегодно, примерно 10% покидает поверхностный перемешанный слой океанов, а менее 0,5% в конечном итоге достигает морского дна. [ 9 ] Большая часть сохраняется в регенерированной продукции в эвфотической зоне, а значительная часть реминерализируется в средневодных процессах во время погружения частиц. Часть углерода, покидающая поверхностный смешанный слой океана, иногда считается «изолированной» и по существу удаляется из контакта с атмосферой на многие столетия. [ 64 ] Однако исследования также показывают, что в таких регионах, как Южный океан , большая часть этого углерода может быстро (в течение десятилетий) вернуться в контакт с атмосферой. [ 65 ]
Расчеты бюджета биологического углеродного насоса основаны на соотношении седиментации (экспорта углерода) и реминерализации (выброса в атмосферу). [ 62 ] Подсчитано, что тонущие частицы экспортируют до 25% углерода, захваченного фитопланктоном на поверхности океана, в более глубокие слои воды. [ 66 ] Около 20% этого экспорта (5% поверхностной стоимости) погребено в океанских отложениях. [ 67 ] в основном за счет минерального балласта. [ 68 ] В процессе погружения эти органические частицы являются очагами микробной активности и важными очагами минерализации органических веществ и перераспределения питательных веществ в толще воды. [ 69 ] [ 70 ] [ 62 ]
Биоминерализация
[ редактировать ]Балластные минералы
[ редактировать ]| Часть серии, посвященной |
| Биоминерализация |
|---|
 |
потоки балластных минералов (карбоната кальция, опала и литогенного материала) и органического углерода тесно коррелируют . Наблюдения показали, что в батипелагических зонах океана [ 68 ] Большая часть взвешенного органического вещества встречается в океане в виде агрегатов морского снега (>0,5 мм), состоящих из фитопланктона, детрита, неорганических минеральных зерен и фекальных гранул. [ 71 ] Формирование и опускание этих агрегатов приводит в действие биологический углеродный насос посредством экспорта и осаждения органического вещества из поверхностного смешанного слоя в глубокий океан и отложения. Доля органического вещества, покидающая верхний перемешанный слой океана, определяется, среди прочего, скоростью погружения и скоростью микробной реминерализации этих агрегатов. Наблюдения последних лет показали, что потоки балластных минералов (карбоната кальция, опала и литогенного материала) и потоков органического углерода в батипелагических зонах океана тесно коррелируют. Это привело к выдвижению гипотезы о том, что экспорт органического углерода определяется наличием балластных минералов в составе осадочных агрегатов. [ 72 ] [ 73 ] [ 74 ] [ 68 ]
С минеральным балластированием связано около 60% потока твердых частиц органического углерода (РОУ) в высоких широтах Северной Атлантики и около 40% потока в Южном океане. [ 75 ] В глубоком океане также существует сильная корреляция между наличием балластных минералов и потоком ВОУ. Это говорит о том, что балластные минералы усиливают поток ВОУ за счет увеличения скорости погружения балластных заполнителей. Балластные минералы могут дополнительно обеспечить некоторую защиту агрегированных органических веществ от разложения. [ 76 ]
Было высказано предположение, что органический углерод лучше сохраняется в тонущих частицах из-за повышенной плотности агрегатов и скорости погружения в присутствии балластных минералов и/или за счет защиты органического вещества за счет количественной связи с балластными минералами. [ 72 ] [ 73 ] [ 74 ] В 2002 году Клаас и Арчер заметили, что около 83% мировых потоков твердых частиц органического углерода (POC) были связаны с карбонатом , и предположили, что карбонат является более эффективным балластным минералом по сравнению с опалом и терригенным материалом. Они предположили, что более высокая плотность карбоната кальция по сравнению с плотностью опала и более высокое содержание карбоната кальция по сравнению с терригенным материалом может быть причиной эффективной балластировки карбонатом кальция. Однако прямое влияние балластных минералов на скорость погружения и скорость разрушения тонущих агрегатов до сих пор неясно. [ 74 ] [ 68 ]
Исследование 2008 года показало, что гранулы фекалий копепод, полученные на диете из диатомовых водорослей или кокколитофорид, демонстрируют более высокие скорости погружения по сравнению с гранулами, полученными на диете с нанофлагеллятами. [ 77 ] Однако скорость дыхания углерода в гранулах была одинаковой и не зависела от содержания минералов. , до 10 раз Эти результаты позволяют предположить, что различия в минеральном составе не приводят к дифференциальной защите ПОУ от микробной деградации, но повышенная скорость погружения может привести к более высокому сохранению углерода в гранулах, содержащих биогенные минералы по сравнению с гранулами без биогенных минералов. [ 77 ] [ 68 ]
Минералы, по-видимому, усиливают флокуляцию агрегатов фитопланктона. [ 78 ] [ 79 ] и может даже действовать как катализатор при образовании агрегатов. [ 80 ] Однако также было показано, что включение минералов может привести к фрагментации агрегатов на более мелкие и плотные агрегаты. [ 81 ] Это потенциально может снизить скорость погружения агрегированного органического материала из-за уменьшения размеров агрегатов и, таким образом, снизить общий экспорт органического вещества. И наоборот, если включение минералов увеличивает плотность заполнителя, скорость его погружения в зависимости от размера также может увеличиться, что потенциально может увеличить экспорт углерода. Таким образом, по-прежнему существует необходимость в более качественных количественных исследованиях того, как взаимодействие между минералами и органическими агрегатами влияет на деградацию и скорость погружения агрегатов и, следовательно, на секвестрацию углерода в океане. [ 81 ] [ 68 ]
Реминерализация
[ редактировать ]Реминерализация относится к распаду или трансформации органического вещества (молекул, полученных из биологического источника) в его простейшие неорганические формы. Эти преобразования образуют важнейшее звено внутри экосистем , поскольку они отвечают за высвобождение энергии, запасенной в органических молекулах , и переработку вещества внутри системы для повторного использования в качестве питательных веществ другими организмами . [ 7 ] Какая часть избегает реминерализации, зависит от местоположения. Например, в Северном море объемы выбросов углерода составляют ~1% от первичной продукции. [ 82 ] в то время как в открытом океане это значение в среднем составляет <0,5%. [ 83 ] Поэтому большая часть питательных веществ остается в толще воды и перерабатывается биотой . Гетеротрофные организмы будут использовать материалы, производимые автотрофными (и хемотрофными ) организмами, и посредством дыхания реминерализовать соединения из органической формы обратно в неорганическую, снова делая их доступными для первичных продуцентов.
Для большинства районов океана самые высокие скорости реминерализации углерода наблюдаются на глубинах от 100 до 1200 м (330–3940 футов) в толще воды, снижаясь примерно до 1200 м (3900 футов), где скорость реминерализации остается довольно постоянной и составляет 0,1. мкмоль кг −1 тот −1 . [ 84 ] Это обеспечивает наибольшее количество питательных веществ, доступных для первичных производителей в фотической зоне, хотя в результате этого верхние поверхностные воды остаются без неорганических питательных веществ. [ 85 ] Большая часть реминерализации осуществляется с помощью растворенного органического углерода (DOC). Исследования показали, что именно более крупные тонущие частицы переносят вещество на морское дно. [ 86 ] в то время как взвешенные частицы и растворенная органика в основном потребляются при реминерализации. [ 87 ] Частично это происходит из-за того, что организмы обычно должны потреблять питательные вещества, меньшие, чем они есть, часто на порядки. [ 88 ] Поскольку микробное сообщество составляет 90% морской биомассы, [ 89 ] это частицы мельче микробов (порядка 10 −6 ), который будет использован для реминерализации. [ 90 ]
Ключевая роль фитопланктона
[ редактировать ]| Часть серии о |
| Биогеохимические циклы |
|---|
 |
Морской фитопланктон осуществляет половину всего фотосинтеза на Земле [ 91 ] и напрямую влияют на глобальные биогеохимические циклы и климат, однако неизвестно, как они отреагируют на будущие глобальные изменения. Углекислый газ является одним из основных факторов глобальных изменений и считается одной из главных проблем 21 века. [ 92 ] Углекислый газ (CO 2 ), образующийся в результате антропогенной деятельности, такой как вырубка лесов и сжигание ископаемого топлива для производства энергии, быстро растворяется на поверхности океана и снижает pH морской воды, в то время как CO 2 , остающийся в атмосфере, повышает глобальные температуры и приводит к усилению термической стратификации океана . Хотя до промышленной революции концентрация CO 2 в атмосфере оценивалась примерно в 270 ppm , в настоящее время она выросла примерно до 400 ppm. [ 93 ] и, как ожидается, достигнет 800–1000 частей на миллион к концу этого столетия в соответствии со сценарием выбросов CO 2 «в обычном режиме» . [ 94 ] [ 61 ]
Морские экосистемы являются основным поглотителем атмосферного CO 2 и поглощают такое же количество CO 2 , как и наземные экосистемы, на долю которых в настоящее время приходится удаление почти одной трети антропогенных выбросов CO 2 из атмосферы. [ 93 ] [ 94 ] Чистый перенос CO 2 из атмосферы в океаны, а затем в отложения , в основном является прямым следствием комбинированного эффекта растворимости и биологического насоса. [ 95 ] В то время как насос растворимости служит для концентрации растворенного неорганического углерода (CO 2 плюс ионы бикарбоната и карбоната) в глубоких океанах, биологический углеродный насос (ключевой природный процесс и основной компонент глобального углеродного цикла, который регулирует уровни CO 2 в атмосфере ) переносит как органический, так и неорганический углерод фиксируется первичными продуцентами (фитопланктоном) в эвфотической зоне в глубь океана и впоследствии в подстилающие осадки. [ 95 ] [ 54 ] Таким образом, биологический насос выводит углерод из контакта с атмосферой на несколько тысяч лет или дольше и поддерживает атмосферный CO 2 на значительно более низком уровне, чем было бы, если бы его не существовало. [ 96 ] Океан без биологического насоса, перекачивающего около 11 Гт Ула в год. −1 в глубь океана, приведет к повышению уровня CO 2 в атмосфере примерно на 400 частей на миллион выше, чем в настоящее время. [ 97 ] [ 98 ] [ 61 ]
Пассоу и Карлсон определили осадконакопление из поверхностного слоя (на глубине примерно 100 м) как «вывозной поток», а из мезопелагической зоны (на глубине примерно 1000 м) как «поток секвестрации». [ 64 ] Как только углерод переносится ниже мезопелагической зоны, он остается в глубоком море в течение 100 лет или дольше, отсюда и термин «поток секвестрации». Согласно результатам моделирования Бюсслера и Бойда, от 1% до 40% первичной продукции вывозится за пределы эвфотической зоны. [ 99 ] который экспоненциально затухает к основанию мезопелагической зоны, и только около 1% поверхностной продукции достигает морского дна. [ 100 ] Эффективность экспорта твердых частиц органического углерода (POC) демонстрирует региональные различия. Например, в Северной Атлантике более 40% чистой первичной продукции экспортируется из эвфотической зоны по сравнению с лишь 10% в южной части Тихого океана. [ 99 ] и это частично обусловлено составом сообщества фитопланктона, включая размер и состав клеток (см. ниже). Экспортируемый органический углерод реминерализуется, то есть выдыхается обратно в CO 2 в толще океанических вод на глубине, главным образом, гетеротрофными микробами и зоопланктоном. Таким образом, биологический углеродный насос поддерживает вертикальный градиент концентрации растворенного неорганического углерода (DIC), причем значения становятся выше при увеличении глубины океана. [ 101 ] Этот глубоководный океанический ДИК возвращается в атмосферу в тысячелетнем масштабе посредством термохалинной циркуляции . [ 10 ] [ 61 ]
В 2001 году Хью и др. КПД биологического насоса выражается как количество углерода, экспортируемого из поверхностного слоя (экспортное производство), деленное на общее количество, произведенное фотосинтезом (общее производство). [ 10 ] Моделирование исследований Бюсслера и Бойда показало, что общая эффективность биологического насоса определяется комбинацией факторов: сезонностью; [ 99 ] видовой состав фитопланктона; фрагментация частиц зоопланктоном; и солюбилизация частиц микробами. Кроме того, эффективность биологического насоса также зависит от агрегации и дезагрегации богатых органикой агрегатов и взаимодействия между агрегатами ПОУ и взвешенными «балластными» минералами. [ 102 ] Балластные минералы (силикатные и карбонатные биоминералы и пыль) являются основными составляющими частиц, которые покидают поверхность океана в результате погружения. Обычно они плотнее морской воды и большинства органических веществ, поэтому обеспечивают большую часть разницы плотности, необходимой для погружения частиц. [ 72 ] Агрегация частиц увеличивает вертикальный поток за счет превращения мелких взвешенных частиц в более крупные и быстро тонущие. Он играет важную роль в осаждении фитодетрита из цветения фитопланктона поверхностного слоя. [ 56 ] Как показано Тернером в 2015 году, вертикальный поток тонущих частиц в основном обусловлен сочетанием фекальных гранул, морского снега и прямого осаждения цветущего фитопланктона, который обычно состоит из диатомей, кокколитофорид, динофлагеллят и другого планктона. [ 56 ] Морской снег состоит из макроскопических органических агрегатов размером >500 мкм и образуется из скоплений агрегированного фитопланктона (фитодетрита), выброшенных аппендикулярных домиков, фекалий и других различных детритных частиц. [ 56 ] Аппендикулярии выделяют слизистые питающие структуры или «дома» для сбора частиц пищи, их выбрасывания и обновления до 40 раз в день. [ 103 ] Выброшенные аппендикулярные домики очень многочисленны (тысячи на м3 в поверхностных водах) и представляют собой горячие точки микробов с высокими концентрациями бактерий, инфузорий, жгутиконосцев и фитопланктона. Таким образом, эти выброшенные дома являются одними из наиболее важных источников агрегатов, непосредственно производимых зоопланктоном, с точки зрения потенциала круговорота углерода. [ 104 ] [ 61 ]

Состав сообщества фитопланктона эвфотической зоны во многом определяет количество и качество органического вещества, опускающегося на глубину. [ 100 ] К основным функциональным группам морского фитопланктона, способствующим экспортной продукции, относятся азотфиксаторы ( диазотрофные цианобактерии ), силицификаторы (диатомовые водоросли) и кальцификаторы (кокколитофоры). Каждая из этих групп фитопланктона различается размером и составом клеточных стенок и покровов, что влияет на скорость их погружения. [ 105 ] Например, считается, что автотрофный пикопланктон (диаметром 0,2–2 мкм), включающий такие таксоны, как цианобактерии (например, Prochromococcus виды и виды Synechococcus ) и празинофиты (различные роды эукариот <2 мкм), вносят гораздо меньший вклад в экспорт углерода из поверхностных слоев из-за их небольшого размера, медленной скорости погружения (<0,5 м/день) и быстрого оборота в микробном цикле. [ 105 ] [ 106 ] Напротив, более крупные клетки фитопланктона, такие как диатомовые водоросли (2–500 мкм в диаметре), очень эффективно транспортируют углерод на глубину, образуя быстро тонущие агрегаты. [ 64 ] Они уникальны среди фитопланктона, поскольку для роста и образования панцирей им необходим Si в форме кремниевой кислоты (Si(OH)4), которые состоят из биогенного кремнезема (bSiO2) и действуют как балласт. [ 105 ] [ 107 ] По сообщениям Микласа и Денни, [ 108 ] Скорость погружения диатомей может составлять от 0,4 до 35 м/сут. [ 105 ] [ 107 ] [ 108 ] Аналогично, кокколитофоры покрыты пластинками карбоната кальция, называемыми «кокколитами», которые играют центральную роль в агрегации и балластировании, обеспечивая скорость погружения почти 5 м/день. [ 64 ] [ 105 ] Хотя предполагалось, что пикофитопланктон , характеризующий обширные олиготрофные территории океана, [ 100 ] не вносят существенного вклада в поток твердых частиц органического углерода (ВОУ), в 2007 году Ричардсон и Джексон предположили, что весь фитопланктон, включая клетки пикопланктона, в равной степени вносит вклад в экспорт ВОУ. [ 106 ] Они предложили альтернативные пути круговорота углерода в пикопланктоне, которые основаны на агрегации как механизме как для прямого погружения (экспорт пикопланктона в виде ПОУ), так и для опосредованного мезозоопланктоном или крупными фильтраторами продукции, произведенной на основе пикопланктона. [ 61 ]
Выпас зоопланктона
[ редактировать ]Небрежное кормление
[ редактировать ]DOC = растворенный органический углерод
POC = твердый органический углерод .
Адаптировано из Møller et al. (2005), [ 109 ] Саба и др. (2009) [ 110 ] и Стейнберг и др. (2017). [ 111 ]

Собрано из морских снегоуловителей (а–в) и отстойников (г–е).
Морфологические классы: а, г – округлые, б, д – цилиндрические, в, е – яйцевидные.
Масштабная линейка = 0,5 мм
Зоопланктон не только связывает первичных продуцентов с более высокими трофическими уровнями в морских пищевых цепях, но и играет важную роль в качестве «переработчика» углерода и других питательных веществ, которые существенно влияют на морские биогеохимические циклы, включая биологический насос. Это особенно касается копепод и криля и особенно важно в олиготрофных водах открытого океана. В результате небрежного питания, выделения, выведения и выщелачивания фекальных гранул зоопланктон высвобождает растворенное органическое вещество (РОВ), которое контролирует круговорот РОВ и поддерживает микробный цикл. Эффективность поглощения, дыхание и размер добычи еще больше усложняют то, как зоопланктон способен преобразовывать и доставлять углерод в глубины океана. [ 111 ]
Экскреция и небрежное питание (физическое расщепление источника пищи) составляют 80% и 20% высвобождения РОВ ракообразными, опосредованного зоопланктоном, соответственно. [ 113 ] В том же исследовании было обнаружено, что выщелачивание фекальных гранул вносит незначительный вклад. У простейших, питающихся травоядными, РОВ выделяется в основном посредством экскреции и пищеварения, а студенистый зоопланктон также может выделять РОВ посредством выработки слизи. Выщелачивание фекальных гранул может продолжаться от нескольких часов до нескольких дней после первоначального выделения, и его последствия могут варьироваться в зависимости от концентрации и качества пищи. [ 114 ] [ 115 ] Различные факторы могут влиять на то, сколько РОВ высвобождается отдельными особями или популяциями зоопланктона.
Фекальные гранулы
[ редактировать ]Фекальные гранулы зоопланктона могут быть важным средством переноса твердых частиц органического углерода (POC) в глубины океана, часто внося большой вклад в секвестрацию углерода. Распределение по размерам сообщества копепод указывает на то, что в эпипелагиали образуется большое количество мелких фекальных шариков . Однако мелкие фекальные гранулы редко встречаются в более глубоких слоях, что позволяет предположить, что они не передаются на глубину эффективно. Это означает, что небольшие фекальные гранулы вносят лишь незначительный вклад в потоки фекальных гранул в мезо- и батипелагиали, особенно с точки зрения углерода. Исследование сосредоточено на море Скотия , которое содержит некоторые из наиболее продуктивных регионов Южного океана, преобладающие фекальные гранулы в верхней мезопелагиали были цилиндрическими и эллиптическими, тогда как яйцевидные фекальные гранулы преобладали в батипелагиали . Изменение морфологии фекальных гранул, а также распределения по размерам указывает на переупаковку поверхностных фекальных гранул в мезопелагиали и продукцию in situ в нижней мезо- и батипелагии, которая может быть дополнена поступлением фекальных гранул через зоопланктон. вертикальные миграции . Это предполагает, что поток углерода в более глубокие слои Южного океана сильно модулируется мезо- и батипелагическим зоопланктоном, а это означает, что структура сообщества в этих зонах оказывает большое влияние на эффективность переноса фекальных гранул в глубины океана. [ 112 ]
Эффективность поглощения (AE) — это доля пищи, поглощаемая планктоном, которая определяет, насколько доступны потребляемые органические материалы для удовлетворения необходимых физиологических потребностей. [ 111 ] В зависимости от скорости кормления и состава добычи, вариации AE могут привести к изменениям в производстве фекальных гранул и, таким образом, регулировать количество органического материала, перерабатываемого обратно в морскую среду. Низкая скорость подачи обычно приводит к высокой AE и получению мелких и плотных гранул, тогда как высокая скорость подачи обычно приводит к низкой AE и более крупным гранулам с большим содержанием органических веществ. Еще одним фактором, способствующим высвобождению РОВ, является частота дыхания. Физические факторы, такие как доступность кислорода, pH и условия освещенности, могут влиять на общее потребление кислорода и на то, сколько углерода теряется из зоопланктона в виде вдыхаемого CO 2 . Относительные размеры зоопланктона и добычи также влияют на то, сколько углерода выделяется при неаккуратном кормлении. Меньшая добыча проглатывается целиком, тогда как более крупная добыча может питаться более «небрежно», то есть больше биовещества высвобождается в результате неэффективного потребления. [ 116 ] [ 117 ] Есть также доказательства того, что состав рациона может влиять на высвобождение питательных веществ: в рационе плотоядных животных выделяется больше растворенного органического углерода (DOC) и аммония, чем в рационе всеядных животных. [ 114 ]
Микробная петля
[ редактировать ]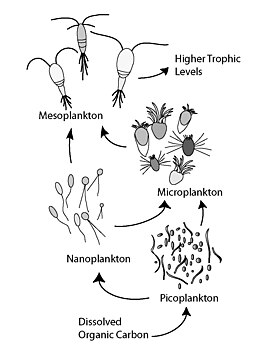
Бактериальный лизис
[ редактировать ]Микробная петля описывает трофический путь в морской микробной пищевой сети , где растворенный органический углерод (DOC) возвращается на более высокие трофические уровни посредством его включения в бактериальную биомассу, а затем соединяется с классической пищевой цепью, образованной фитопланктоном - зоопланктоном - нектоном . Термин «микробная петля» был придуман Фаруком Азамом , Томом Фенчелом и др. [ 118 ] в 1983 году, чтобы включить роль бактерий в круговороте углерода и питательных веществ в морской среде. В общем, растворенный органический углерод попадает в окружающую среду океана в результате бактериального лизиса , утечки или выделения фиксированного углерода из фитопланктона (например, слизистого экзополимера диатомовых водорослей ), внезапного старения клеток, небрежного питания зоопланктона, выделения продуктов жизнедеятельности водными организмами. животных, а также расщепление или растворение органических частиц наземных растений и почв. [ 119 ] Бактерии в микробной петле разлагают эти частицы детрита, чтобы использовать это богатое энергией вещество для роста. Поскольку более 95% органического вещества в морских экосистемах состоит из полимерных высокомолекулярных ( ВМВ) соединений (например, белков, полисахаридов, липидов), лишь небольшая часть общего количества растворенного органического вещества (РОВ) легко утилизируется большинством морских организмов. организмы, находящиеся на более высоких трофических уровнях. Это означает, что растворенный органический углерод недоступен непосредственно для большинства морских организмов; Морские бактерии вносят этот органический углерод в пищевую сеть, в результате чего дополнительная энергия становится доступной для более высоких трофических уровней. [ 120 ]
Вирусный шунт
[ редактировать ]До 25% первичной продукции фитопланктона в мировом океане может быть переработано в микробном цикле посредством вирусного шунтирования . [ 121 ] Вирусный шунт — это механизм, с помощью которого морские вирусы предотвращают микробных твердых частиц органического вещества миграцию (ПОМ) на трофические уровни , перерабатывая их в растворенное органическое вещество (РОВ), которое может быть легко поглощено микроорганизмами. МОВ, перерабатываемый вирусным шунтирующим путем, сопоставим с количеством, вырабатываемым другими основными источниками морского РОВ. [ 122 ] Вирусы могут легко инфицировать микроорганизмы в микробной петле из-за их относительной численности по сравнению с микробами. [ 123 ] [ 124 ] Смертность прокариот и эукариот способствует рециркуляции углеродных питательных веществ посредством лизиса клеток . Имеются также свидетельства регенерации азота (особенно аммония). Такая рециркуляция питательных веществ помогает стимулировать рост микробов. [ 125 ]
Макроорганизмы
[ редактировать ]Желе падает
[ редактировать ]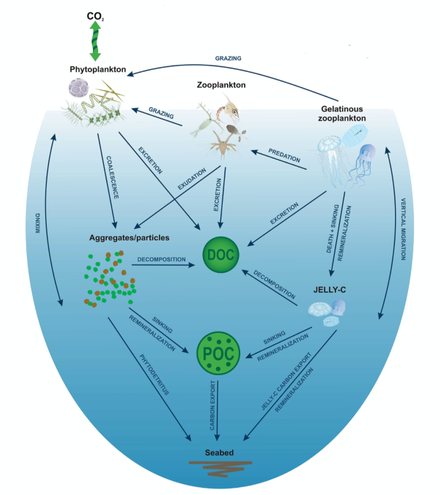
Желепадение — это морской углеродный цикл , при котором студенистый зоопланктон , в первую очередь книдарии , опускается на морское дно и усиливает потоки углерода и азота за счет быстро тонущих твердых частиц органического вещества . [ 127 ] Эти события обеспечивают питание донной мегафауны и бактерий . [ 128 ] [ 129 ] Желе-падение считается основным «желатиновым путем» секвестрации биогенного углерода лабильного через биологический насос. [ 130 ] Эти явления обычны на охраняемых территориях с высоким уровнем первичной продукции и качеством воды, подходящим для поддержания видов книдарий. Эти районы включают устья рек , и несколько исследований было проведено во фьордах Норвегии . [ 129 ]

Китовый насос
[ редактировать ]
Киты и другие морские млекопитающие также повышают первичную продуктивность в своих районах нагула, концентрируя азот у поверхности за счет выделения хлопьевидных фекальных шлейфов. [ 132 ] [ 133 ] Например, киты и тюлени могут нести ответственность за пополнение эвфотической зоны залива Мэн большего количества азота , чем все реки вместе взятые. Этот восходящий китовый насос играл гораздо большую роль до того, как промышленное рыболовство опустошило запасы морских млекопитающих, когда переработка азота, вероятно, более чем в три раза превышала поступление атмосферного азота. [ 132 ]
Биологический насос обеспечивает удаление углерода и азота из эвфотической зоны посредством нисходящего потока агрегатов, фекалий и вертикальной миграции беспозвоночных и рыб. [ 134 ] Копеподы и другой зоопланктон производят тонущие фекальные гранулы и способствуют нисходящему транспорту растворенных и твердых частиц органического вещества, дыша и выделяя на глубине во время миграционных циклов, играя таким образом важную роль в экспорте питательных веществ (N, P и Fe) из поверхностных вод. . [ 135 ] [ 136 ] [ 132 ]
Зоопланктон питается в эвфотической зоне и экспортирует питательные вещества посредством тонущих фекальных гранул и вертикальной миграции. Рыбы обычно выделяют питательные вещества на той же глубине, на которой они кормятся. Ожидается, что экскременты морских млекопитающих, привязанных к поверхности для дыхания, в толще воды будут меньше, чем там, где они питаются. [ 132 ]
Морские млекопитающие предоставляют важные экосистемные услуги. В глобальном масштабе они могут влиять на климат посредством оплодотворения и экспорта углерода из поверхностных вод в глубокое море через тонущие туши китов. [ 137 ] В прибрежных районах киты сохраняют питательные вещества локально, повышая продуктивность экосистем и, возможно, увеличивая пропускную способность других морских потребителей, включая промысловые виды рыб. [ 132 ] Подсчитано, что с точки зрения связывания углерода один кит эквивалентен тысячам деревьев. [ 138 ]
Вертикальные миграции
[ редактировать ]Диль-вертикально мигрирующие криль, сальпы, более мелкий зоопланктон и рыба могут активно переносить углерод на глубину, потребляя ВОУ в поверхностном слое ночью и метаболизируя его в дневное время, в мезопелагических глубинах проживания. В зависимости от истории жизни вида активный перенос может происходить и на сезонной основе. [ 51 ]
Без вертикальной миграции биологический насос не был бы столь эффективным. Ночью организмы мигрируют вверх, чтобы питаться, поэтому, когда они днем мигрируют обратно на глубину, они испражняются большими тонущими фекальными шариками. Хотя некоторые более крупные фекальные гранулы могут тонуть довольно быстро, скорость, с которой организмы возвращаются на глубину, все же выше. Ночью организмы находятся в верхних 100 метрах толщи воды, а днем они опускаются на глубину от 800 до 1000 метров. Если бы организмы испражнялись на поверхности, фекальным гранулам потребовались бы дни, чтобы достичь глубины, которой они достигают за считанные часы. Таким образом, выбрасывая фекальные гранулы на глубину, им приходится преодолевать почти на 1000 метров меньше пути, чтобы добраться до глубокого океана. Это то, что известно как активный транспорт . Организмы играют более активную роль в перемещении органического вещества на глубину. Поскольку большая часть глубоководных организмов, особенно морских микробов, зависит от падающих вниз питательных веществ, чем быстрее они достигнут дна океана, тем лучше. [ 63 ]
зоопланктон и сальпы Большую роль в активном транспорте фекальных гранул играют . По оценкам, 15–50% биомассы зоопланктона мигрирует, что составляет перенос 5–45% органического азота в виде частиц на глубину. [ 63 ] Сальпы — это крупный студенистый планктон, который может вертикально мигрировать на 800 метров и поедать большое количество пищи на поверхности. У них очень длительное время удержания в кишечнике, поэтому фекальные гранулы обычно выделяются на максимальную глубину. Сальпы также известны тем, что содержат одни из самых крупных фекальных гранул. Из-за этого они имеют очень большую скорость погружения, детрита на них, как известно, агрегируются мелкие частицы . Из-за этого они тонут гораздо быстрее. Таким образом, хотя в настоящее время проводится еще много исследований о том, почему организмы вертикально мигрируют, ясно, что вертикальная миграция играет большую роль в активном переносе растворенного органического вещества на глубину. [ 139 ]
Липидный насос
[ редактировать ]Липидный насос связывает углерод с поверхности океана в более глубокие воды посредством липидов, связанных с зимующим вертикально мигрирующим зоопланктоном . Липиды представляют собой класс соединений с высоким содержанием углеводородов и дефицитом азота и фосфора , необходимых для клеточных структур. Связанный с липидами углерод попадает в глубины океана в виде углекислого газа, образующегося в результате дыхания запасов липидов, и в виде органического вещества в результате смертности зоопланктона. По сравнению с более общим биологическим насосом, липидный насос также приводит к липидному шунту, при котором другие питательные вещества, такие как азот и фосфор, которые потребляются в избытке, должны выводиться обратно в поверхностную среду и, таким образом, не удаляются из поверхностного смешанного слоя. океан. [ 140 ] Это означает, что углерод, транспортируемый липидным насосом, не ограничивает доступность необходимых питательных веществ на поверхности океана. Таким образом, секвестрация углерода через липидный насос отделена от удаления питательных веществ, что позволяет продолжать поглощение углерода первичным производством углерода в океане. В биологическом насосе удаление питательных веществ всегда сочетается с секвестрацией углерода; Первичное производство ограничено, поскольку углерод и питательные вещества переносятся на глубину вместе в форме органического вещества. [ 140 ] Вклад липидного насоса в связывание углерода в более глубоких водах океана может быть существенным: количество углерода, переносимого копеподами рода Calanus в Северном Ледовитом океане на глубину ниже 1000 метров (3300 футов), почти равно количеству углерода, транспортируемому ниже той же глубины. ежегодно по частицам органического углерода (POC) в этом регионе. [ 141 ] Значительная часть этого перенесенного углерода не вернулась на поверхность из-за дыхания и смертности. Исследования продолжаются, чтобы более точно оценить количество оставшихся на глубине. [ 140 ] [ 141 ] [ 142 ] Скорость экспорта липидного насоса может варьироваться от 1–9,3 г См. −2 и −1 в умеренных и приполярных регионах, содержащих сезонно мигрирующий зоопланктон. [ 142 ] Роль зоопланктона, и особенно веслоногих раков, в пищевой сети имеет решающее значение для выживания организмов более высокого трофического уровня , основным источником питания которых являются копеподы. Потепление океанов и увеличение таяния ледяных шапок из-за изменения климата могут поражать организмы, связанные с липидным насосом, что влияет на выживание многих коммерчески важных рыб и находящихся под угрозой исчезновения морских млекопитающих . [ 143 ] [ 144 ] [ 145 ] Дальнейшие исследования липидного насоса, как нового и ранее не поддающегося количественному определению компонента секвестрации углерода в океане, могут улучшить точность и общее понимание потоков углерода в глобальных океанических системах . [ 140 ] [ 141 ] [ 142 ]
Биолюминесцентный шунт
[ редактировать ]
Светящиеся бактерии в симбиозах световых органов последовательно приобретаются хозяином (кальмарами, рыбами) из морской воды в молодом возрасте, а затем регулярно выбрасываются в океан. [ 146 ]
На схеме справа, в зависимости от положения органа света, светящиеся бактерии выделяются из кишечника в фекальные шарики или непосредственно в морскую воду (шаг 1). Подвижные светящиеся бактерии заселяют органические вещества, опускающиеся в толще воды . Биолюминесцентные бактерии, колонизирующие фекальные гранулы и частицы, влияют на скорость потребления зоопланктона. Такие визуальные маркеры усиливают обнаружение («гипотеза приманки»), привлечение и, наконец, хищничество со стороны верхних трофических уровней (этап 2). В мезопелагических зоопланктон и их хищники питаются тонущими светящимися частицами и фекальными гранулами, которые образуют либо агрегаты (переупаковку) с более высокими скоростями погружения, либо фрагментируют органическое вещество (из-за неаккуратного питания) с более медленными скоростями погружения (этап 3). [ 146 ]
Фильтраторы-питатели также агрегируют тонущую органику без особого визуального обнаружения и отбора светящихся веществ. Дневные (и сезонные) вертикальные мигранты, питающиеся светящейся пищей, метаболизируют и выделяют светящиеся фекальные шарики с поверхности в мезопелагическую зону (этап 4). Это подразумевает распространение биолюминесцентных бактерий в больших пространственных масштабах для зоопланктона или даже некоторых рыб, активно плавающих на большие расстояния. Светящиеся бактерии, прикрепленные к частицам, опускаются на морское дно, а осадок может быть повторно взвешен в океанографических физических условиях (этап 5) и поглощен эпибентическими организмами. Приборы: (а) планктонная сеть, (б) рыбная сеть, (в) пробоотборник воды Нискина , (г) батифотометр, (д) отстойники , (е) автономные подводные аппараты , (ж) модуль фотоумножителя , (з) астрофизический оптический модули АНТАРЕС и (i–j) дистанционно управляемые аппараты . [ 146 ]
Количественная оценка
[ редактировать ]
Геологическая составляющая углеродного цикла действует медленно по сравнению с другими частями глобального углеродного цикла. Это один из наиболее важных факторов, определяющих количество углерода в атмосфере и, следовательно, глобальную температуру. [ 148 ]
Поскольку биологический насос играет важную роль в углеродном цикле Земли, значительные усилия затрачиваются на количественную оценку его силы. Однако, поскольку они происходят в результате плохо ограниченных экологических взаимодействий, обычно на глубине, процессы, образующие биологический насос, трудно измерить. Распространенным методом является оценка первичной продукции, подпитываемой нитратами и аммонием , поскольку эти питательные вещества имеют разные источники, связанные с реминерализацией тонущего материала. Из них можно вывести так называемый f-коэффициент , показатель локальной силы биологического насоса. Применение результатов локальных исследований в глобальном масштабе осложняется ролью циркуляции океана в различных океанических регионах. [ 149 ]
Последствия изменения климата
[ редактировать ]
Изменения в землепользовании, сжигание ископаемого топлива и производство цемента привели к увеличению концентрации CO 2 в атмосфере. В настоящее время около трети (около 2 Pg C y −1 = 2 × 10 15 грамм углерода в год) [ 150 ] [ 151 ] [ ненадежный источник? ] антропогенных выбросов CO 2 может поступать в океан, но это весьма сомнительно. [ 152 ] Некоторые исследования показывают, что существует связь между повышенным уровнем выбросов CO 2 и первичной морской продукцией. [ 153 ]


Изменение климата может повлиять на биологический насос в будущем из-за потепления и расслоения поверхности океана. Считается, что это может уменьшить поступление питательных веществ в эвфотическую зону, что приведет к снижению первичной продукции там. Кроме того, изменения в экологическом успехе кальцинирующих организмов, вызванные закислением океана, могут повлиять на биологический насос, изменяя силу насоса твердых тканей. [ 156 ] Это может затем оказать эффект на насос мягких тканей, поскольку карбонат кальция действует на балласт, погружающий органический материал. [ 157 ]
Вторая диаграмма справа показывает некоторые возможные последствия сокращения морского льда и таяния вечной мерзлоты на потоки углерода в Арктике. На суше растения поглощают углерод, а микроорганизмы в почве производят метан и выдыхают CO 2 . Озера являются чистыми источниками метана, а органический и неорганический углерод (растворенный и твердый) попадает в океан через пресноводные системы. В океане метан может выделяться в результате таяния подводной вечной мерзлоты, а CO 2 поглощается из-за недостаточного насыщения CO 2 в воде по сравнению с атмосферой. Кроме того, с морским льдом тесно связаны многочисленные потоки. На данный момент лучшие оценки атмосферных потоков даны в Tg C год. −1 , где это возможно. Обратите внимание, что оценка выбросов для озер относится к территории к северу от ~50° с.ш., а не для более узкого определения арктической тундры для других наземных потоков. Диапазоны неопределенности, если они доступны, показаны в скобках. Стрелки не обозначают размер каждого потока. [ 155 ] [ 154 ]
Считается, что биологический насос играл значительную роль в колебаниях CO 2 в атмосфере в прошлые ледниково-межледниковые периоды. Однако пока неясно, как биологический насос отреагирует на будущие изменения климата. [ 56 ] Чтобы такие прогнозы были обоснованными, важно сначала расшифровать реакцию фитопланктона, одного из ключевых компонентов биологического насоса, на будущие изменения содержания CO 2 в атмосфере . Из-за своего филогенетического разнообразия разные таксоны фитопланктона, вероятно, будут по-разному реагировать на изменение климата. [ 105 ] Например, ожидается уменьшение численности диатомей из-за усиления стратификации в будущем океане. [ 158 ] Диатомеи очень эффективно транспортируют углерод на глубину, образуя большие, быстро тонущие агрегаты, а уменьшение их количества может, в свою очередь, привести к снижению экспорта углерода. [ 64 ]
Кроме того, снижение pH океана из-за закисления океана может помешать способности кокколитофоров образовывать известковые пластины, что потенциально влияет на биологический насос; [ 105 ] однако оказывается, что некоторые виды более чувствительны, чем другие. [ 159 ] Таким образом, будущие изменения в относительной численности тех или иных таксонов фитопланктона могут оказать заметное влияние на общую продуктивность океана, что впоследствии повлияет на биогеохимию океана и накопление углерода.
Исследование 2015 года показало, что концентрации кокколитофоров в Северной Атлантике увеличились на порядок с 1960-х годов, и было смоделировано, что увеличение поглощенного CO 2 , а также температуры является наиболее вероятной причиной этого увеличения. [ 160 ]
В исследовании 2017 года ученые использовали моделирование распределения видов (SDM), чтобы предсказать будущее глобальное распространение двух видов фитопланктона, важных для биологического насоса: диатомовой водоросли Chaetoceros diadema и кокколитофоры Emiliania huxleyi . [ 161 ] Они использовали экологические данные, описанные в МГЭИК сценарии 8.5 «Репрезентативные пути концентрации» , который прогнозирует радиационное воздействие в 2100 году по сравнению с доиндустриальными значениями. Результаты их моделирования предсказали, что общая площадь океана, покрытая C. diadema и E. huxleyi , сократится на 8% и 16% соответственно в рамках рассматриваемого климатического сценария. Они предсказали, что изменения в ареале и распределении этих двух видов фитопланктона в будущих условиях океана, если они будут реализованы, могут привести к уменьшению вклада в секвестрацию углерода посредством биологического насоса. [ 61 ] В 2019 году исследование показало, что при нынешних темпах закисления морской воды мы можем увидеть, что антарктические фитопланктоны станут меньше и менее эффективно сохранят углерод до конца столетия. [ 162 ]
Мониторинг
[ редактировать ]
Мониторинг биологического насоса имеет решающее значение для понимания того, как меняется углеродный цикл Земли. Для мониторинга биологического насоса используются различные методы, которые можно использовать с различных платформ, таких как корабли, автономные транспортные средства и спутники. В настоящее время спутниковое дистанционное зондирование является единственным доступным инструментом для наблюдения за всей поверхностью океана в высоких временных и пространственных масштабах. [ 5 ]
Необходимое исследование
[ редактировать ]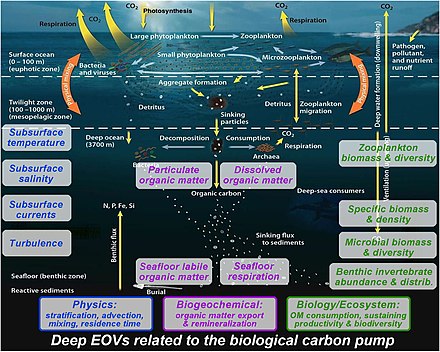
правильно понять биологический насос [ 165 ]
по-прежнему необходимы междисциплинарные наблюдения в толще глубокой воды : Чтобы правильно понять работу биологического насоса, [ 165 ]
- Физика: стратификация влияет на опускание частиц; Понимание происхождения частиц и времени пребывания DIC в результате реминерализации частиц в глубоком океане требует измерения адвекции и перемешивания. [ 165 ]
- Биогеохимия: экспорт / смешивание твердых частиц и растворенного органического вещества из поверхностного слоя определяет лабильное органическое вещество, поступающее на морское дно, которое либо вдыхается биотой морского дна, либо сохраняется в течение более длительного времени в отложениях. [ 165 ]
- Биология и экосистемы: зоопланктон и микроорганизмы расщепляют и реминерализуют тонущие частицы в толще воды. Экспортируемое органическое вещество питает всю водную толщу и донную биоту (зоопланктон, донные беспозвоночные, микробы), поддерживая их биомассу, плотность и биоразнообразие. [ 165 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Сигман Д.М. и Г.Х. Хауг. 2006. Биологический насос в прошлом. В: Трактат по геохимии; том. 6 (ред.). Пергамон Пресс , стр. 491-528.
- ^ Jump up to: а б Хейн, член парламента; Сигман, DM; Хауг, GH (2014). «Биологический насос в прошлом». Трактат по геохимии (PDF) . Том. 8 (2-е изд.). стр. 485–517. дои : 10.1016/B978-0-08-095975-7.00618-5 . ISBN 9780080983004 . Проверено 1 июня 2015 г.
- ^ Новицкий, Майкл; ДеВрис, Тим; Сигел, Дэвид А. (март 2022 г.). «Количественная оценка путей экспорта и секвестрации углерода биологическим углеродным насосом океана» . Глобальные биогеохимические циклы . 36 (3). Бибкод : 2022GBioC..3607083N . дои : 10.1029/2021GB007083 . S2CID 246458736 .
- ^ Jump up to: а б Босколо-Галаццо, Ф.; Крайтон, Калифорния; Баркер, С.; Пирсон, ПН (2018). «Температурная зависимость скорости метаболизма в верхних слоях океана: положительная обратная связь с глобальным изменением климата?» . Глобальные и планетарные изменения . 170 : 201–212. Бибкод : 2018GPC...170..201B . дои : 10.1016/j.gloplacha.2018.08.017 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а б с д и ж г час Брюин, Роберт Дж.В.; Сатьендранатх, Шубха ; Платт, Тревор; Бауман, Хизер; и др. (2021). «Обнаружение биологического углеродного насоса океана из космоса: обзор возможностей, концепций, пробелов в исследованиях и будущих разработок». Обзоры наук о Земле . 217 . Elsevier BV: 103604. Бибкод : 2021ESRv..21703604B . doi : 10.1016/j.earscirev.2021.103604 . hdl : 10871/125469 . ISSN 0012-8252 . S2CID 233682755 .
 Измененный материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Волк, Тайлер; Хофферт, Мартин И. (2013). «Океанские углеродные насосы: анализ относительной силы и эффективности изменений CO2 в атмосфере, вызванных океаном». Углеродный цикл и атмосферный CO2: естественные вариации от архея до настоящего времени . Серия геофизических монографий. стр. 99–110. дои : 10.1029/GM032p0099 . ISBN 9781118664322 .
- ^ Jump up to: а б Сармьенто, Хорхе Л. (17 июля 2013 г.). Биогеохимическая динамика океана . Издательство Принстонского университета. п. 526. ИСБН 9781400849079 .
- ^ Мидделбург, Джек Дж. (2019). «Возвращение от органического углерода к неорганическому». Морская углеродная биогеохимия . SpringerBriefs по наукам о системе Земли. стр. 37–56. дои : 10.1007/978-3-030-10822-9_3 . ISBN 978-3-030-10821-2 . S2CID 104330175 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а б с д и ж г де ла Роча, CL; Пассоу, У. (2014). «Биологический насос». Трактат по геохимии . стр. 93–122. дои : 10.1016/B978-0-08-095975-7.00604-5 . ISBN 9780080983004 .
- ^ Jump up to: а б с д Даклоу, Хью; Стейнберг, Дебора; Бюсселер, Кен (2001). «Экспорт углерода из верхних слоев океана и биологический насос» . Океанография . 14 (4): 50–58. дои : 10.5670/oceanog.2001.06 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Монрой, П., Эрнандес-Гарсия, Э., Росси, В. и Лопес, К. (2017) «Моделирование динамического опускания биогенных частиц в океаническом потоке». Нелинейные процессы в геофизике , 24 (2): 293–305. дои : 10.5194/npg-24-293-2017 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
- ^ Саймон М., Гроссарт Х., Швейцер Б. и Плауг Х. (2002) «Микробная экология органических агрегатов в водных экосистемах». Водная микробная экология , 28 : 175–211. два : 10.3354/ame028175 .
- ^ Сигман, DM; Хейн, член парламента (2012). «Биологическая продуктивность океана» (PDF) . Знания о природном образовании . 3 (6): 1–16 . Проверено 1 июня 2015 г.
Ценность NEP [чистой экосистемной продукции] зависит от границ, определенных для экосистемы. Если рассматривать освещенную солнцем поверхность океана до уровня освещенности 1% («эуфотическая зона») в течение всего года, то NEP эквивалентен осаждению твердых частиц органического углерода в темные глубины океана плюс растворенный органический углерод , циркулирует за пределами эвфотической зоны. В этом случае НЭП также часто называют «экспортным производством» (или «новым производством» (Dugdale & Goering 1967), как обсуждается ниже).
- ^ Мартини, Адам С.; Фам, Чау Т.А.; Примо, Франсуа В.; Вругт, Джаспер А.; Мур, Дж. Кейт; Левин, Саймон А.; Ломас, Майкл В. (апрель 2013 г.). «Сильные широтные закономерности в соотношении элементов морского планктона и органического вещества» . Природа Геонауки . 6 (4): 279–283. Бибкод : 2013NatGe...6..279M . дои : 10.1038/NGEO1757 . S2CID 5677709 .
- ^ Jump up to: а б с Генрихс, Мара Э.; Мори, Коринна; Длугош, Леон (2020). «Сложные взаимодействия между водными организмами и их химической средой, выясненные с разных точек зрения». YOUMARES 9 – Океаны: наши исследования, наше будущее . стр. 279–297. дои : 10.1007/978-3-030-20389-4_15 . ISBN 978-3-030-20388-7 . S2CID 210308256 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Карлсон Калифорния (2002) [books.google.com/books?id=D6TMKZOgldAC&q=%22Production+and+removal+processes%22&pg=PA91 «Процессы производства и удаления»]. В: Ханселл Д.А., Карлсон К.А. (ред.) Биогеохимия морских растворенных органических веществ . Academic Press, Сан-Диего, страницы 91–151. ISBN 9780123238412 .
- ^ Капелле, Дэвид В.; Кузык, Зоу Зоу А.; Папакириаку, Тим; Геген, Селин; Миллер, Лиза А.; Макдональд, Роби В. (2020). «Влияние наземного органического вещества на закисление океана и поток CO2 в арктическом шельфовом море» . Прогресс в океанографии . 185 : 102319. Бибкод : 2020Proce.18502319C . дои : 10.1016/j.pocean.2020.102319 . HDL : 1993/34767 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Хеджес, Джон И. (1992). «Глобальные биогеохимические циклы: прогресс и проблемы». Морская химия . 39 (1–3). Эльзевир Б.В.: 67–93. Бибкод : 1992Март..39...67H . дои : 10.1016/0304-4203(92)90096-с . ISSN 0304-4203 .
- ^ Зибе, Ричард Э.; Вольф-Гладроу, Дитер А. (2001). CO2 в морской воде: равновесие, кинетика, изотопы . Амстердам. п. 65. ИСБН 978-0-08-052922-6 . OCLC 246683387 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Рост, Бьёрн; Рибезель, Ульф (2004). «Кокколитофоры и биологический насос: реакция на изменения окружающей среды». Кокколитофоры . Берлин, Гейдельберг: Springer Berlin Heidelberg. стр. 99–125. дои : 10.1007/978-3-662-06278-4_5 . ISBN 978-3-642-06016-8 .
- ^ Зибе, Ричард Э. (30 мая 2012 г.). «История химии карбонатов морской воды, атмосферного CO2 и подкисления океана». Ежегодный обзор наук о Земле и планетах . 40 (1). Годовые обзоры: 141–165. Бибкод : 2012AREPS..40..141Z . doi : 10.1146/annurev-earth-042711-105521 . ISSN 0084-6597 .
- ^ Jump up to: а б Ханселл, Деннис А.; Карлсон, Крейг А. (12 августа 2013 г.). «Локальные тугоплавкие поглотители растворенного органического углерода в глубинах океана». Глобальные биогеохимические циклы . 27 (3). Американский геофизический союз (AGU): 705–710. дои : 10.1002/gbc.20067 . ISSN 0886-6236 . S2CID 17175370 .
- ^ Jump up to: а б Ханселл, Деннис А. (3 января 2013 г.). «Упорные растворенные органические фракции углерода». Ежегодный обзор морской науки . 5 (1). Годовые обзоры: 421–445. doi : 10.1146/annurev-marine-120710-100757 . ISSN 1941-1405 . ПМИД 22881353 .
- ^ Уильямс, Питер М.; Дрюффель, Эллен Р.М. (1987). «Радиоуглерод в растворенном органическом веществе в центральной части северной части Тихого океана» . Природа . 330 (6145). ООО «Спрингер Сайенс энд Бизнес Медиа»: 246–248. Бибкод : 1987Natur.330..246W . дои : 10.1038/330246a0 . ISSN 0028-0836 . S2CID 4329024 .
- ^ Дрюффель, ERM; Гриффин, С.; Коппола, AI; Уокер, Б.Д. (28 мая 2016 г.). «Радиоуглерод в растворенном органическом углероде Атлантического океана» . Письма о геофизических исследованиях . 43 (10). Американский геофизический союз (AGU): 5279–5286. Бибкод : 2016GeoRL..43.5279D . дои : 10.1002/2016gl068746 . ISSN 0094-8276 . S2CID 56069589 .
- ^ Страмска, Малгожата; Цешиньская, Агата (18 июля 2015 г.). «Оценки цвета океана в резервуарах органического углерода в виде твердых частиц в мировом океане – пересмотр». Международный журнал дистанционного зондирования . 36 (14). Информа Великобритания Лимитед: 3675–3700. Бибкод : 2015IJRS...36.3675S . дои : 10.1080/01431161.2015.1049380 . ISSN 0143-1161 . S2CID 128524215 .
- ^ Викланд, Делавэр, Пламмер, С. и Накадзима, М. (октябрь 2013 г.). «Стратегия CEOS по наблюдениям за выбросами углерода из космоса». В: Международная конференция «На пути к глобальной системе наблюдения за выбросами углерода: прогресс и проблемы» , 1 :. 2.
- ^ Сармьенто, Хорхе Л. (1 января 2006 г.). Биогеохимическая динамика океана . Издательство Принстонского университета. дои : 10.1515/9781400849079 . ISBN 978-1-4008-4907-9 .
- ^ Лонгхерст, Алан; Сатьендранатх, Шубха; Платт, Тревор; Каверхилл, Карла (1995). «Оценка глобальной первичной продукции в океане по данным спутникового радиометра». Журнал исследований планктона . 17 (6). Издательство Оксфордского университета (OUP): 1245–1271. дои : 10.1093/планкт/17.6.1245 . ISSN 0142-7873 .
- ^ Сатьендранат, С.; Платт, Т.; Брюин, Роберт Дж.В.; Джексон, Томас (2019). «Основное распределение продукции». Энциклопедия наук об океане . Эльзевир. стр. 635–640. дои : 10.1016/b978-0-12-409548-9.04304-9 . ISBN 9780128130827 .
- ^ Кулк, Джемма; Платт, Тревор; Дингл, Джеймс; Джексон, Томас; и др. (3 марта 2020 г.). «Первичная продукция, индекс изменения климата в океане: спутниковые оценки за два десятилетия» . Дистанционное зондирование . 12 (5). MDPI AG: 826. Бибкод : 2020RemS...12..826K . дои : 10.3390/rs12050826 . hdl : 11336/128979 . ISSN 2072-4292 .
- ^ Хопкинс, Джейсон; Хенсон, Стефани А.; Поултон, Алекс Дж.; Балч, Уильям М. (2019). «Региональные характеристики временной изменчивости глобального реестра твердых частиц неорганического углерода» . Глобальные биогеохимические циклы . 33 (11). Американский геофизический союз (AGU): 1328–1338. Бибкод : 2019GBioC..33.1328H . дои : 10.1029/2019gb006300 . ISSN 0886-6236 . S2CID 210342576 .
- ^ Jump up to: а б Фили, Ричард А.; Сабина, Кристофер Л.; Ли, Китак; Берельсон, Уилл; Клейпас, Джоани; Фабри, Виктория Дж.; Миллеро, Фрэнк Дж. (16 июля 2004 г.). «Воздействие антропогенного CO 2 на систему CaCO 3 в океанах». Наука . 305 (5682). Американская ассоциация содействия развитию науки (AAAS): 362–366. Бибкод : 2004Sci...305..362F . дои : 10.1126/science.1097329 . ISSN 0036-8075 . ПМИД 15256664 . S2CID 31054160 .
- ^ Шибель, Ральф (24 октября 2002 г.). «Осадконакопление планктических фораминифер и бюджет морского кальцита». Глобальные биогеохимические циклы . 16 (4). Американский геофизический союз (AGU): 3–1–3–21. Бибкод : 2002GBioC..16.1065S . дои : 10.1029/2001gb001459 . ISSN 0886-6236 . S2CID 128737252 .
- ^ Рибезель, Ульф; Зондерван, Ингрид; Рост, Бьёрн; Тортелл, Филипп Д.; Зибе, Ричард Э.; Морель, Франсуа ММ (2000). «Снижение кальцификации морского планктона в ответ на увеличение содержания CO2 в атмосфере» (PDF) . Природа . 407 (6802). ООО «Спрингер Сайенс энд Бизнес Медиа»: 364–367. Бибкод : 2000Natur.407..364R . дои : 10.1038/35030078 . ISSN 0028-0836 . ПМИД 11014189 . S2CID 4426501 .
- ^ Митчелл, К.; Ху, К.; Боулер, Б.; Драпо, Д.; Балч, WM (2017). «Оценка концентрации неорганического углерода в твердых частицах в мировом океане на основе измерений цвета океана с использованием метода разницы в отражательной способности» . Журнал геофизических исследований: Океаны . 122 (11): 8707–8720. Бибкод : 2017JGRC..122.8707M . дои : 10.1002/2017JC013146 .
- ^ Уилсон, RW; Миллеро, Ф.Дж.; Тейлор, младший; Уолш, Пи Джей; Кристенсен, В.; Дженнингс, С.; Гроселл, М. (16 января 2009 г.). «Вклад рыбы в морской цикл неорганического углерода». Наука . 323 (5912): 359–362. Бибкод : 2009Sci...323..359W . дои : 10.1126/science.1157972 . ПМИД 19150840 . S2CID 36321414 .
- ^ Пилсон MEQ. 2012. Введение в химию моря. Издательство Кембриджского университета, стр.
- ^ Хейн, член парламента; Сигман, DM; Хауг, GH (2010). «Влияние углекислого газа на стратификацию Антарктики, образование промежуточных вод в Северной Атлантике и субантарктическое истощение питательных веществ во время последнего ледникового периода: диагностика и синтез в геохимической коробчатой модели». Глобальные биогеохимические циклы . 24 (4): 1–19. Бибкод : 2010GBioC..24.4023H . дои : 10.1029/2010GB003790 .
- ^ Уэбб, Пол (2019) Введение в океанографию , Глава 12: Океанские отложения , страницы 273–297, Сообщество Ребуса. Обновлено 2020 г.
- ^ Х., Шлезингер, Уильям (2013). Биогеохимия: анализ глобальных изменений . Бернхардт, Эмили С. (3-е изд.). Уолтем, Массачусетс: Академическая пресса. ISBN 9780123858740 . OCLC 827935936 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Фальковский, П.; Скоулз, Р.Дж.; Бойл, Э.; Канаделл, Дж.; Кэнфилд, Д.; Эльзер, Дж.; Грубер, Н.; Хиббард, К.; Хёгберг, П. (13 октября 2000 г.). «Глобальный углеродный цикл: проверка наших знаний о Земле как системе». Наука . 290 (5490): 291–296. Бибкод : 2000Sci...290..291F . дои : 10.1126/science.290.5490.291 . ISSN 0036-8075 . ПМИД 11030643 .
- ^ Рэйвен, Дж.А.; П.Г. Фальковский (1999). «Океанические поглотители атмосферного CO 2 » . Растение, клетка и окружающая среда . 22 (6): 741–755. дои : 10.1046/j.1365-3040.1999.00419.x .
- ^ Рэйвен, Дж.А.; Фальковски, П.Г. (1999). «Океанические поглотители атмосферного CO2» . Растение, клетка и окружающая среда . 22 (6): 741–755. дои : 10.1046/j.1365-3040.1999.00419.x .
- ^ Хейн, член парламента; Сигман, DM; Хауг, GH (2014). «Биологический насос в прошлом». Трактат по геохимии . 8 : 485–517. дои : 10.1016/B978-0-08-095975-7.00618-5 . ISBN 9780080983004 .
- ^ Jump up to: а б Рост, Бьёрн; Райбессель, Ульф (2004). Кокколитофоры и биологический насос: реакция на изменения окружающей среды . Берлин, Гейдельберг: Springer. ISBN 978-3-642-06016-8 .
- ^ Zeebe, RE, 2016. «Счетчик карбоната кальция: основы, эволюция во времени и будущие отзывы» . Американский геофизический союз , стр. B23A-08.
- ^ Jump up to: а б с Цуногай, С.; Ватанабэ, С.; Сато, Т. (1999). «Существует ли «насос континентального шельфа» для поглощения атмосферного CO 2 ». Теллус Б. 51 (3): 701–712. Бибкод : 1999TellB..51..701T . doi : 10.1034/j.1600-0889.1999.t01-2-00010.x .
- ^ Волласт, Р. (1998). Оценка и сравнение глобального углеродного цикла в прибрежной зоне и в открытом океане, с. 213-252. В К. Х. Бринк и А. Р. Робинсон (ред.), Глобальный прибрежный океан . Джон Уайли и сыновья.
- ^ Риппет, ТП; Скурс, Джей Ди; Уэхара, К.; Маккеун, С. (2008). «Влияние повышения уровня моря во время последнего дегляциального перехода на силу насоса CO2 на континентальном шельфе» . Геофиз. Рез. Летт . 35 (24): L24604. Бибкод : 2008GeoRL..3524604R . дои : 10.1029/2008GL035880 . S2CID 1049049 .
- ^ Jump up to: а б с Каван Э.Л., Белчер А., Аткинсон А., Хилл С.Л., Кавагути С., МакКормак С., Мейер Б., Николь С., Ратнараджа Л., Шмидт К. и Стейнберг, ДК (2019) «Значение антарктического криля в биогеохимических циклах». Природные коммуникации , 10 (1): 1–13. два : 10.1038/s41467-019-12668-7 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Лэмпитт, RS; Ноджи, Т.; фон Бодунген, Б. (1990). «Что происходит с фекальными гранулами зоопланктона? Последствия для потока материала». Морская биология . 104 (1): 15–23. Бибкод : 1990МарБи.104...15Л . дои : 10.1007/BF01313152 . S2CID 86523326 .
- ^ Бишоп, Джеймс (2009). «Автономные наблюдения за океаническим биологическим углеродным насосом» . Океанография . 22 (2): 182–193. дои : 10.5670/oceanog.2009.48 .
- ^ Jump up to: а б Чисхолм, Салли В. (1995). «Железная гипотеза: фундаментальные исследования соответствуют экологической политике». Обзоры геофизики . 33 (С2): 1277–1286. Бибкод : 1995RvGeo..33S1277C . дои : 10.1029/95RG00743 .
- ^ Фальковский, П.; Скоулз, Р.Дж.; Бойл, Э.; Канаделл, Дж.; Кэнфилд, Д.; Эльзер, Дж.; Грубер, Н.; Хиббард, К.; Хёгберг, П.; Линдер, С.; Маккензи, штат Форт; Мур б, 3-й; Педерсен, Т.; Розенталь, Ю.; Зейтцингер, С.; Сметачек, В.; Стеффен, В. (2000). «Глобальный углеродный цикл: проверка наших знаний о Земле как системе». Наука . 290 (5490): 291–296. Бибкод : 2000Sci...290..291F . дои : 10.1126/science.290.5490.291 . ПМИД 11030643 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Jump up to: а б с д и ж Тернер, Джефферсон Т. (2015). «Фекальные гранулы зоопланктона, морской снег, фитодетрит и биологический насос океана». Прогресс в океанографии . 130 : 205–248. Бибкод : 2015Proce.130..205T . дои : 10.1016/j.pocean.2014.08.005 .
- ^ Jump up to: а б Ким, Джа-Мён; Ли, Китак; Шин, Кёнсун; Ян, Ын Джин; Энгель, Аня; Карл, Дэвид М.; Ким, Хён Чоль (2011). «Изменение потока биогенного углерода от твердых частиц к растворенным формам в условиях высокого содержания углекислого газа и теплых условий океана» . Письма о геофизических исследованиях . 38 (8): н/д. Бибкод : 2011GeoRL..38.8612K . дои : 10.1029/2011GL047346 .
- ^ Ханселл, Деннис; Карлсон, Крейг; Репета, Дэниел; Шлитцер, Райнер (2009). «Растворенное органическое вещество в океане: противоречия стимулируют новые идеи» . Океанография . 22 (4): 202–211. дои : 10.5670/oceanog.2009.109 . hdl : 1912/3183 .
- ^ Карлсон, Крейг А.; Даклоу, Хью В.; Майклс, Энтони Ф. (1994). «Годовой поток растворенного органического углерода из эвфотической зоны северо-западной части Саргассова моря». Природа . 371 (6496): 405–408. Бибкод : 1994Natur.371..405C . дои : 10.1038/371405a0 . S2CID 4279712 .
- ^ Рошан, Саид; Деврис, Тимоти (2017). «Эффективное производство и экспорт растворенного органического углерода в олиготрофном океане» . Природные коммуникации . 8 (1): 2036. Бибкод : 2017NatCo...8.2036R . дои : 10.1038/s41467-017-02227-3 . ПМЦ 5725454 . ПМИД 29230041 .
- ^ Jump up to: а б с д и ж г час я Басу, Самарпита; Макки, Кэтрин (2018). «Фитопланктон как ключевые медиаторы биологического углеродного насоса: их реакция на изменение климата» . Устойчивость . 10 (3): 869. дои : 10.3390/su10030869 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а б с Ионеску, Дэнни; Бизич-Ионеску, Мина; Халили, Аржанг; Малекмохаммади, Реза; Морад, Мохаммад Реза; Де Бир, Дирк; Гроссарт, Ханс-Петер (2015). «Новый инструмент для долгосрочных исследований взаимодействия ПОМ-бактерий: преодоление векового эффекта бутылки» . Научные отчеты . 5 : 14706. Бибкод : 2015NatSR...514706I . дои : 10.1038/srep14706 . ПМЦ 4592964 . ПМИД 26435525 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а б с Стейнберг, Дебора; Сара Голдтуэйт; Деннис Ханселл (2002). «Вертикальная миграция зоопланктона и активный транспорт растворенного органического и неорганического азота в Саргассовом море». Глубоководные исследования . Часть I. 49 (8): 1445–1461. Бибкод : 2002DSRI...49.1445S . CiteSeerX 10.1.1.391.7622 . дои : 10.1016/S0967-0637(02)00037-7 . ISSN 0967-0637 .
- ^ Jump up to: а б с д и ж Пассоу, У.; Карлсон, Калифорния (2012). «Биологический насос в мире с высоким содержанием CO2» . Серия «Прогресс в области морской экологии» . 470 : 249–271. Бибкод : 2012MEPS..470..249P . дои : 10.3354/meps09985 .
- ^ Робинсон, Дж.; Попова Э.Е.; Юл, А.; Срокош, Массачусетс; Лэмпитт, RS; Бланделл, младший (2014). «Насколько глубока достаточно глубока? Удобрение океана железом и связывание углерода в Южном океане» (PDF) . Геофиз. Рез. Летт . 41 (7): 2489–2495. Бибкод : 2014GeoRL..41.2489R . дои : 10.1002/2013GL058799 .
- ^ Фальковски, П.Г.; Барбер, RT; Сметачек против В. (1998). «Биогеохимический контроль и обратная связь на первичное производство океана». Наука . 281 (5374): 200–206. дои : 10.1126/science.281.5374.200 . ПМИД 9660741 .
- ^ Юл, Эндрю; Мартин, Адриан П.; Фернандес, Камила; Кларк, Даррен Р. (2007). «Значение нитрификации для новой продукции океана». Природа . 447 (7147): 999–1002. Бибкод : 2007Natur.447..999Y . дои : 10.1038/nature05885 . ПМИД 17581584 . S2CID 4416535 .
- ^ Jump up to: а б с д и ж Иверсен, МХ; Плауг, Х. «Балластные минералы и опускающийся поток углерода в океане: скорость дыхания углерода и скорость погружения макроскопических органических агрегатов (морской снег)» . дои : 10.5194/bgd-7-3335-2010 .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
- ^ Саймон, М.; Гроссарт, HP; Швейцер, Б.; Плауг, Х. (2002). «Микробная экология органических агрегатов водных экосистем» . Водная микробная экология . 28 : 175–211. дои : 10.3354/ame028175 .
- ^ Азам, Ф.; Фенчел, Т.; Филд, Дж. Г.; Грей, Дж. С.; Мейер-Рейл, Луизиана; Вингстад, Ф. (1983). «Экологическая роль микробов водной толщи моря» . Серия «Прогресс в области морской экологии» . 10 : 257–263. Бибкод : 1983MEPS...10..257A . дои : 10.3354/meps010257 .
- ^ Олдридж, Элис Л.; Сильвер, Мэри В. (1988). «Характеристика, динамика и значение морского снега». Прогресс в океанографии . 20 (1): 41–82. Бибкод : 1988Proce..20...41A . дои : 10.1016/0079-6611(88)90053-5 .
- ^ Jump up to: а б с Армстронг, Роберт А.; Ли, Синди; Хеджес, Джон И.; Хондзё, Сусуму; Уэйкхэм, Стюарт Г. (2001). «Новая механистическая модель потоков органического углерода в океане, основанная на количественной связи ВОУ с балластными минералами». Глубоководные исследования, часть II: Актуальные исследования в океанографии . 49 (1–3): 219–236. Бибкод : 2001DSRII..49..219A . дои : 10.1016/S0967-0645(01)00101-1 .
- ^ Jump up to: а б Франсуа, Роджер; Хондзё, Сусуму; Кришфилд, Ричард; Манганини, Стив (2002). «Факторы, контролирующие поток органического углерода в батипелагическую зону океана» . Глобальные биогеохимические циклы . 16 (4): 34-1–34-20. Бибкод : 2002GBioC..16.1087F . дои : 10.1029/2001GB001722 . S2CID 128876389 .
- ^ Jump up to: а б с Клаас, Кристина; Арчер, Дэвид Э. (2002). «Связь тонущего органического вещества с различными типами минерального балласта в глубоком море: последствия для количества осадков» . Глобальные биогеохимические циклы . 16 (4): 63-1–63-14. Бибкод : 2002GBioC..16.1116K . дои : 10.1029/2001GB001765 .
- ^ Ле Муань, Фредерик AC; Паборцева, Екатерина; Марсинко, Шарлотта LJ; Мартин, Патрик; Сандерс, Ричард Дж. (2014). «Где минеральный балласт важен для поверхностного экспорта твердых частиц органического углерода в океан?» . Письма о геофизических исследованиях . 41 (23): 8460–8468. Бибкод : 2014GeoRL..41.8460L . дои : 10.1002/2014GL061678 . ПМК 4459180 . ПМИД 26074644 .
- ^ Иверсен, Мортен Х.; Роберт, Майя Л. (2015). «Балластирующее воздействие смектита на образование агрегатов и их экспорт из природного планктонного сообщества». Морская химия . 175 : 18–27. Бибкод : 2015МартЧ.175...18I . дои : 10.1016/j.marchem.2015.04.009 .
- ^ Jump up to: а б Плауг, Хелле; Иверсен, Мортен Хвитфельдт; Коски, Марья; Бютенхейс, Эрик Теодор (2008). «Производство, скорость дыхания кислорода и скорость погружения фекальных гранул копепод: прямые измерения балластировки опалом и кальцитом» . Лимнология и океанография . 53 (2): 469–476. Бибкод : 2008LimOc..53..469P . дои : 10.4319/lo.2008.53.2.0469 .
- ^ Энгель, Аня; Абрамсон, Линн; Шлосек, Дженнифер; Лю, Жанфэй; Стюарт, Джиллиан; Хиршберг, Дэвид; Ли, Синди (2009). «Исследование влияния балластировки CaCO3 на Emiliania huxleyi, II: Разложение твердых частиц органического вещества». Глубоководные исследования, часть II: Актуальные исследования в океанографии . 56 (18): 1408–1419. Бибкод : 2009DSRII..56.1408E . дои : 10.1016/j.dsr2.2008.11.028 .
- ^ Энгель, Аня; Шлосек, Дженнифер; Абрамсон, Линн; Лю, Жанфэй; Ли, Синди (2009). «Исследование влияния балластировки CaCO3 на Emiliania huxleyi: I. Образование, скорость осаждения и физические свойства агрегатов». Глубоководные исследования, часть II: Актуальные исследования в океанографии . 56 (18): 1396–1407. Бибкод : 2009DSRII..56.1396E . дои : 10.1016/j.dsr2.2008.11.027 .
- ^ Ли, Синди; Петерсон, Майкл Л.; Уэйкхэм, Стюарт Г.; Армстронг, Роберт А.; Кокран, Дж. Кирк; Микель, Хуан Карлос; Фаулер, Скотт В.; Хиршберг, Дэвид; Бек, Аарон; Сюэ, Цзяньхун (2009). «Потоки твердых частиц органического вещества и балласта, измеренные с использованием временных рядов и ловушек для отложений со скоростью осаждения в северо-западной части Средиземного моря». Глубоководные исследования, часть II: Актуальные исследования в океанографии . 56 (18): 1420–1436. Бибкод : 2009DSRII..56.1420L . дои : 10.1016/j.dsr2.2008.11.029 .
- ^ Jump up to: а б Пассов, Ута; де ла Роша, Кристина Л. (2006). «Накопление минерального балласта на органических заполнителях» . Глобальные биогеохимические циклы . 20 (1): н/д. Бибкод : 2006GBioC..20.1013P . дои : 10.1029/2005GB002579 .
- ^ Томас, Хельмут; Божец, Янн; Элькалай, Халид; Баар, Хейн Дж.В. де (14 мая 2004 г.). «Улучшенное хранение CO2 в открытом океане в результате выкачки шельфа моря» (PDF) . Наука . 304 (5673): 1005–1008. Бибкод : 2004Sci...304.1005T . дои : 10.1126/science.1095491 . hdl : 11370/e821600e-4560-49e8-aeec-18eeb17549e3 . ISSN 0036-8075 . ПМИД 15143279 . S2CID 129790522 .
- ^ Де Ла Роша, CL (2006). «Биологический насос». В Голландии Генрих Д.; Турекян, Карл К. (ред.). Трактат по геохимии . Том. 6. Пергамон Пресс. п. 625. Бибкод : 2003TrGeo...6...83D . дои : 10.1016/B0-08-043751-6/06107-7 . ISBN 978-0-08-043751-4 .
- ^ Фили, Ричард А.; Сабина, Кристофер Л.; Шлитцер, Райнер; Буллистер, Джон Л.; Мекинг, Сабина; Грили, Дана (1 февраля 2004 г.). «Утилизация кислорода и реминерализация органического углерода в верхней толще вод Тихого океана». Журнал океанографии . 60 (1): 45–52. Бибкод : 2004JOce...60...45F . doi : 10.1023/B:JOCE.0000038317.01279.aa . ISSN 0916-8370 . S2CID 67846685 .
- ^ Администрация Министерства торговли США, Национальная служба океанических и атмосферных исследований. «Как далеко проходит свет в океане?» . Oceanservice.noaa.gov . Проверено 29 февраля 2016 г.
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Карл, Дэвид М.; Кнауэр, Джордж А.; Мартин, Джон Х. (1 марта 1988 г.). «Нисходящий поток твердых частиц органического вещества в океане: парадокс разложения частиц». Природа . 332 (6163): 438–441. Бибкод : 1988Natur.332..438K . дои : 10.1038/332438a0 . ISSN 0028-0836 . S2CID 4356597 .
- ^ Лефевр, Д.; Денис, М.; Ламберт, CE; Микель, Ж.-К. (1 февраля 1996 г.). «Является ли DOC основным источником реминерализации органических веществ в толще океанских вод?». Журнал морских систем . Прибрежный океан в перспективе глобальных изменений. 7 (2–4): 281–291. Бибкод : 1996JMS.....7..281L . дои : 10.1016/0924-7963(95)00003-8 .
- ^ Шульце, Эрнст-Детлеф; Муни, Гарольд А. (6 декабря 2012 г.). Биоразнообразие и функции экосистемы . Springer Science & Business Media. ISBN 978-3-642-58001-7 .
- ^ «Международная перепись морских микробов (ICoMM)» . www.coml.org . Перепись морской жизни. Архивировано из оригинала 17 марта 2016 года . Проверено 29 февраля 2016 г.
- ^ «Размеры микробов – безграничный открытый учебник» . Безграничный . Проверено 29 февраля 2016 г.
- ^ Баумерт, Хельмут З.; Петцольдт, Томас (2008). «Роль температуры, клеточной квоты и концентрации питательных веществ для фотосинтеза, роста и адаптации к свету и темноте в фитопланктоне». Лимнологика . 38 (3–4): 313–326. Бибкод : 2008Limng..38..313B . дои : 10.1016/j.limno.2008.06.002 .
- ^ Лам, Ман Ки; Ли, Кит Теонг; Мохамед, Абдул Рахман (2012). «Текущее состояние и проблемы улавливания углерода с помощью микроводорослей». Международный журнал по контролю парниковых газов . 10 : 456–469. Бибкод : 2012IJGGC..10..456L . дои : 10.1016/j.ijggc.2012.07.010 .
- ^ Jump up to: а б Хадер, Донат-П.; Виллафанье, Вирджиния Э.; Хелблинг, Э. Уолтер (2014). «Продуктивность водных первичных продуцентов в условиях глобального изменения климата» . Фотохим. Фотобиол. Наука . 13 (10): 1370–1392. дои : 10.1039/C3PP50418B . hdl : 11336/24725 . ПМИД 25191675 . S2CID 25740029 .
- ^ Jump up to: а б Ли, Вэй; Гао, Куньшань; Бердалл, Джон (2012). «Интерактивное воздействие подкисления океана и ограничения содержания азота на диатомовую водоросль Phaeodactylum tricornutum» . ПЛОС ОДИН . 7 (12): e51590. Бибкод : 2012PLoSO...751590L . дои : 10.1371/journal.pone.0051590 . ПМЦ 3517544 . ПМИД 23236517 .
- ^ Jump up to: а б Хюльсе, Доминик; Арндт, Сандра; Уилсон, Джейми Д.; Манховен, Гай; Риджвелл, Энди (2017). «Понимание причин и последствий изменчивости морского углеродного цикла в прошлом с помощью моделей» (PDF) . Обзоры наук о Земле . 171 : 349–382. Бибкод : 2017ESRv..171..349H . doi : 10.1016/j.earscirev.2017.06.004 . hdl : 1983/7035f071-71c5-48a5-91f6-a8286e386d21 .
- ^ Хатчинс, Дэвид А.; Фу, Фейсюэ (2017). «Микроорганизмы и глобальные изменения океана». Природная микробиология . 2 (6): 17058. doi : 10.1038/nmicrobiol.2017.58 . ПМИД 28540925 . S2CID 23357501 .
- ^ Сандерс, Ричард; Хенсон, Стефани А.; Коски, Марья; де ла Роша, Кристина Л.; Художник Стюарт К.; Поултон, Алекс Дж.; Райли, Дженнифер; Салихоглу, Барис; Виссер, Андре; Юл, Эндрю; Беллерби, Ричард; Мартин, Адриан П. (2014). «Биологический углеродный насос в Северной Атлантике». Прогресс в океанографии . 129 : 200–218. Бибкод : 2014Proce.129..200S . дои : 10.1016/j.pocean.2014.05.005 .
- ^ Бойд, Филип В. (2015). «К количественной оценке реакции биологического насоса океанов на изменение климата» . Границы морской науки . 2 . дои : 10.3389/fmars.2015.00077 . S2CID 16787695 .
- ^ Jump up to: а б с Бюсселер, Кен О.; Бойд, Филип В. (2009). «Пролить свет на процессы, которые контролируют экспорт частиц и затухание потока в сумеречной зоне открытого океана» . Лимнология и океанография . 54 (4): 1210–1232. Бибкод : 2009LimOc..54.1210B . дои : 10.4319/lo.2009.54.4.1210 .
- ^ Jump up to: а б с Херндль, Герхард Дж.; Рейнталер, Томас (2013). «Микробный контроль темного конца биологического насоса» . Природа Геонауки . 6 (9): 718–724. Бибкод : 2013NatGe...6..718H . дои : 10.1038/ngeo1921 . ПМЦ 3972885 . ПМИД 24707320 .
- ^ Хофманн, М.; Шелльнхубер, Х.-Й. (2009). «Закисление океана влияет на морской углеродный насос и вызывает появление расширенных морских кислородных дыр» . Труды Национальной академии наук . 106 (9): 3017–3022. Бибкод : 2009PNAS..106.3017H . дои : 10.1073/pnas.0813384106 . ПМЦ 2642667 . ПМИД 19218455 .
- ^ де ла Роча, Кристина Л.; Пассов, Ута (2007). «Факторы, влияющие на погружение ПОУ и эффективность биологического углеродного насоса» (PDF) . Глубоководные исследования, часть II: Актуальные исследования в океанографии . 54 (5–7): 639–658. Бибкод : 2007DSRII..54..639D . дои : 10.1016/j.dsr2.2007.01.004 .
- ^ Сато, Р.; Танака, Ю.; Ишимару, Т. (2003). «Видовая домашняя продуктивность аппендикуляристов» . Серия «Прогресс в области морской экологии» . 259 : 163–172. Бибкод : 2003MEPS..259..163S . дои : 10.3354/meps259163 .
- ^ Куроги, Хироаки; Сайто, Хироаки (2015 Нисибе , Юитиро, Итикава, Тадафуми ; ) . : 967–976 . Цифровой код : 2015LimOc..60..967N . doi : 10.1002/ lno.10061
- ^ Jump up to: а б с д и ж г Коллинз, Шинейд; Рост, Бьёрн; Райнерсон, Татьяна А. (2014). «Эволюционный потенциал морского фитопланктона в условиях закисления океана» . Эволюционные приложения . 7 (1): 140–155. Бибкод : 2014EvApp...7..140C . дои : 10.1111/eva.12120 . ПМЦ 3894903 . ПМИД 24454553 .
- ^ Jump up to: а б Ричардсон, ТЛ; Джексон, Джорджия (2007). «Маленький фитопланктон и экспорт углерода с поверхности океана». Наука . 315 (5813): 838–840. Бибкод : 2007Sci...315..838R . дои : 10.1126/science.1133471 . ПМИД 17289995 . S2CID 45563491 .
- ^ Jump up to: а б Рагено, Оливье; Шультес, Сабина; Бидл, Кей; Клакен, Паскаль; Морисо, Бриваэла (2006). «Взаимодействие Si и C в мировом океане: важность экологических процессов и значение роли диатомей в биологическом насосе» . Глобальные биогеохимические циклы . 20 (4): н/д. Бибкод : 2006GBioC..20.4S02R . дои : 10.1029/2006GB002688 .
- ^ Jump up to: а б Миклас, Кевин А.; Денни, Марк В. (2010). «Скорость погружения диатомей: улучшенные прогнозы и понимание модифицированного закона Стокса» . Лимнология и океанография . 55 (6): 2513–2525. Бибкод : 2010LimOc..55.2513M . дои : 10.4319/lo.2010.55.6.2513 .
- ^ Мёллер, Э.Ф.; Тор, П.; Нильсен, Т.Г. (2003). «Производство DOC Calanus finmarchicus , C. Glacialis и C. Hyperboreus в результате небрежного кормления и утечки фекальных гранул» . Серия «Прогресс в области морской экологии» . 262 : 185–191. Бибкод : 2003MEPS..262..185M . дои : 10.3354/meps262185 .
- ^ Саба, ГК; Стейнберг, ДК; Бронк, Д.А. (2009). «Влияние диеты на высвобождение растворенных органических и неорганических питательных веществ копеподом Acartiatonsa » . Серия «Прогресс в области морской экологии» . 386 : 147–161. Бибкод : 2009MEPS..386..147S . дои : 10.3354/meps08070 .
- ^ Jump up to: а б с Стейнберг, Дебора К.; Лэндри, Майкл Р. (2017). «Зоопланктон и углеродный цикл океана». Ежегодный обзор морской науки . 9 : 413–444. Бибкод : 2017ARMS....9..413S . doi : 10.1146/annurev-marine-010814-015924 . ПМИД 27814033 .
- ^ Jump up to: а б с Белчер, Анна; Манно, Клара; Уорд, Питер; Хенсон, Стефани А.; Сандерс, Ричард; Тарлинг, Герайнт А. (2017). «Перенос фекальных гранул копепод через мезо- и батипелагические слои Южного океана весной» . Биогеонауки . 14 (6): 1511–1525. Бибкод : 2017BGeo...14.1511B . дои : 10.5194/bg-14-1511-2017 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 3.0 .
- ^ Саба, Грейс К.; Стейнберг, Дебора К.; Бронк, Дебора А. (2011). «Относительная важность небрежного кормления, выделения и выщелачивания фекальных шариков в выделении растворенного углерода и азота веслоногими ракообразными Acartiatonsa». Журнал экспериментальной морской биологии и экологии . 404 (1–2): 47–56. Бибкод : 2011JEMBE.404...47S . дои : 10.1016/j.jembe.2011.04.013 .
- ^ Jump up to: а б Тор, П.; Плотина, ХГ; Роджерс, ДР (2003). «Судьба органического углерода, выделяющегося из разлагающихся фекальных гранул копепод, в связи с производством бактерий и эктоферментативной активностью» . Водная микробная экология . 33 : 279–288. дои : 10.3354/ame033279 .
- ^ Ханселл, Деннис А.; Карлсон, Крейг А. (2 октября 2014 г.). Биогеохимия морских растворенных органических веществ . Академическая пресса. ISBN 9780124071537 .
- ^ Моллер, Э.Ф. (2004). «Небрежное питание морских копепод: производство растворенного органического углерода в зависимости от размера добычи» . Журнал исследований планктона . 27 : 27–35. дои : 10.1093/plankt/fbh147 .
- ^ Мюллер, Ева Фриис (2007). «Производство растворенного органического углерода в результате неаккуратного питания копеподами Acartia tonsa, Centropages typicus и Temora longicornis» . Лимнология и океанография . 52 (1): 79–84. Бибкод : 2007LimOc..52...79M . дои : 10.4319/lo.2007.52.1.0079 .
- ^ Азам, Фарук ; Фенчел, Том ; Филд, Дж. Г.; Грей, Дж. С.; Мейер-Рейл, Луизиана; Вингстад, Ф. (1983). «Экологическая роль микробов водной толщи моря» . Серия «Прогресс в области морской экологии» . 10 : 257–263. Бибкод : 1983MEPS...10..257A . дои : 10.3354/meps010257 .
- ^ Ван ден Меерше, Карел; Мидделбург, Джек Дж.; Соэтарт, Карлайн; ван Рейсвейк, Питер; Бошкер, Хенрикус Т.С.; Хейп, Карло Х.Р. (2004). «Сопряжение углерода и азота и взаимодействие водорослей и бактерий во время экспериментального цветения: моделирование эксперимента с индикатором a13C» . Лимнология и океанография . 49 (3): 862–878. Стартовый код : 2004LimOc..49..862V . дои : 10.4319/lo.2004.49.3.0862 . hdl : 1854/LU-434810 . ISSN 0024-3590 . S2CID 53518458 .
- ^ Менгес, А.; Финдерс, К.; Дойч, К.; Блазиус, Б.; Диттмар, Т. (2019). «Долгосрочная стабильность морского растворенного органического углерода обусловлена нейтральной сетью соединений и микробов» . Научные отчеты . 9 (1): 17780. Бибкод : 2019НатСР...917780М . дои : 10.1038/s41598-019-54290-z . ПМК 6883037 . ПМИД 31780725 .
- ^ Вильгельм, Стивен В.; Саттл, Кертис А. (1999). «Вирусы и циклы питательных веществ в море: вирусы играют решающую роль в структуре и функциях водных пищевых сетей» . Бионаука . 49 (10): 781–788. дои : 10.2307/1313569 . JSTOR 1313569 .
- ^ Робинсон, Кэрол и Нагаппа Рамайя. «Скорость микробного гетеротрофного метаболизма ограничивает микробный углеродный насос». Американская ассоциация содействия развитию науки, 2011 г.
- ^ Фурман, Джед А. (1999). «Морские вирусы и их биогеохимические и экологические эффекты». Природа . 399 (6736): 541–548. Бибкод : 1999Natur.399..541F . дои : 10.1038/21119 . ISSN 0028-0836 . ПМИД 10376593 . S2CID 1260399 .
- ^ Вигингтон, Чарльз Х.; Зондереггер, Дерек; Брюссаард, Корина П.Д.; Бьюкен, Элисон; Финке, Ян Ф.; Фурман, Джед А.; Леннон, Джей Т.; Мидделбо, Матиас; Саттл, Кертис А.; Сток, Чарльз; Уилсон, Уильям Х. (март 2016 г.). «Повторное исследование взаимосвязи между морским вирусом и численностью микробных клеток» . Природная микробиология . 1 (3): 15024. doi : 10.1038/nmicrobiol.2015.24 . ISSN 2058-5276 . ПМИД 27572161 . S2CID 52829633 .
- ^ Цай, Ань-И, Гво-Цзин Гун и Ю-Вэнь Хуан. «Важность вирусного шунта в круговороте азота у Synechococcus Spp. Рост в субтропических прибрежных водах западной части Тихого океана». Науки о Земле, атмосфере и океане 25.6 (2014).
- ^ Лебрато, Марио; Пахлоу, Маркус; Фрост, Джессика Р.; Кютер, Мари; Хесус Мендес, Педро; Молинеро, Хуан-Карлос; Ошлис, Андреас (2019). «Затопление студенистой биомассы зоопланктона повышает эффективность глубокого переноса углерода во всем мире» . Глобальные биогеохимические циклы . 33 (12): 1764–1783. Бибкод : 2019GBioC..33.1764L . дои : 10.1029/2019GB006265 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Лебрато, Марио; Питт, Кайли А.; Свитман, Эндрю К.; Джонс, Дэниел О.Б.; Картес, Джоан Э.; Ошлис, Андреас; Кондон, Роберт Х.; Молинеро, Хуан Карлос и Адлер, Летиция (2012). «Исторические и недавние наблюдения о желе-падении: обзор, который определит будущие направления исследований» . Гидробиология . 690 (1): 227–245. дои : 10.1007/s10750-012-1046-8 . S2CID 15428213 .
- ^ Лебрато, М. и Джонс, дата рождения (2009). «Массовое осаждение туш Pyrosoma atlanticum у Берега Слоновой Кости (Западная Африка)» (PDF) . Лимнология и океанография . 54 (4): 1197–1209. Бибкод : 2009LimOc..54.1197L . дои : 10.4319/lo.2009.54.4.1197 .
- ^ Jump up to: а б Свитман, Эндрю К. и Чепмен, Аннелиз (2011). «Первые наблюдения желе-падений на морском дне глубоководного фьорда». Глубоководные исследования. Часть I: Статьи океанографических исследований . 58 (12): 1206–1211. Бибкод : 2011DSRI...58.1206S . дои : 10.1016/j.dsr.2011.08.006 .
- ^ Берд, Адриан. «На пути к преобразующему пониманию биологического насоса океана: приоритеты будущих исследований - отчет о биологии семинара по биологическим насосам NSF» (PDF) . OCB: Углерод океана и биогеохимия . Проверено 30 октября 2016 г.
- ^ Хейс, Грэм С .; Дойл, Томас К.; Хоутон, Джонатан Д.Р. (2018). «Смена парадигмы трофического значения медуз?» . Тенденции в экологии и эволюции . 33 (11): 874–884. Бибкод : 2018TEcoE..33..874H . дои : 10.1016/j.tree.2018.09.001 . ПМИД 30245075 . S2CID 52336522 .
- ^ Jump up to: а б с д и Роман, Джо; Маккарти, Джеймс Дж. (2010). «Китовый насос: морские млекопитающие повышают первичную продуктивность в прибрежном бассейне» . ПЛОС ОДИН . 5 (10): е13255. Бибкод : 2010PLoSO...513255R . дои : 10.1371/journal.pone.0013255 . ПМЦ 2952594 . ПМИД 20949007 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Браун, Джошуа Э. (12 октября 2010 г.). «Китовый экскремент улучшает здоровье океана» . Наука Дейли . Проверено 18 августа 2014 г.
- ^ Лонгхерст, Алан Р.; Глен Харрисон, В. (1989). «Биологический насос: Профили производства и потребления планктона в верхних слоях океана». Прогресс в океанографии . 22 (1): 47–123. Бибкод : 1989Proce..22...47L . дои : 10.1016/0079-6611(89)90010-4 .
- ^ Хатчинс, Дэвид А.; Ван, Вэнь-Сюн; Фишер, Николас С. (1995). «Выпас веслоногих ракообразных и биогеохимическая судьба диатомового железа» . Лимнология и океанография . 40 (5): 989–994. Бибкод : 1995LimOc..40..989H . дои : 10.4319/lo.1995.40.5.0989 .
- ^ Стейнберг, Дебора К.; Голдтуэйт, Сара А.; Ханселл, Деннис А. (2002). «Вертикальная миграция зоопланктона и активный транспорт растворенного органического и неорганического азота в Саргассовом море». Глубоководные исследования. Часть I: Статьи океанографических исследований . 49 (8): 1445–1461. Бибкод : 2002DSRI...49.1445S . дои : 10.1016/S0967-0637(02)00037-7 .
- ^ Першинг, Эндрю Дж.; Кристенсен, линия Б.; Запись, Николас Р.; Шервуд, Грэм Д.; Стетсон, Питер Б. (2010). «Влияние китобойного промысла на углеродный цикл океана: почему чем больше, тем лучше» . ПЛОС ОДИН . 5 (8): e12444. Бибкод : 2010PLoSO...512444P . дои : 10.1371/journal.pone.0012444 . ПМЦ 2928761 . ПМИД 20865156 .
- ^ «Природное решение проблемы изменения климата – Ф&Р МВФ» . Международный валютный фонд . Проверено 2 ноября 2019 г.
- ^ Вибе, PH; Л.П. Мадин; Л. Р. Хори; Г. Р. Харбисон; Л. М. Филбин (1979). «Вертикальная миграция Diel Salpa aspera и ее потенциал для крупномасштабного переноса твердых частиц органических веществ на глубоководные глубины». Морская биология . 53 (3): 249–255. Бибкод : 1979MarBi..53..249W . дои : 10.1007/BF00952433 . S2CID 85127670 .
- ^ Jump up to: а б с д Йонасдоттир, Сигрун Хульд; Виссер, Андре В.; Ричардсон, Кэтрин; Хит, Майкл Р. (29 сентября 2015 г.). «Сезонный липидный насос веслоногих ракообразных способствует секвестрации углерода в глубинах Северной Атлантики» . Труды Национальной академии наук . 112 (39): 12122–12126. дои : 10.1073/pnas.1512110112 . ISSN 0027-8424 . ПМЦ 4593097 . ПМИД 26338976 .
- ^ Jump up to: а б с Виссер, Андре (2 марта 2017 г.). «Calanus Hyperboreus и липидный насос» . Лимнология и океанография . 62 (3): 1155–1165. Бибкод : 2017LimOc..62.1155V . дои : 10.1002/lno.10492 . S2CID 51989153 .
- ^ Jump up to: а б с Стейнберг, Дебора К.; Лэндри, Майкл Р. (3 января 2017 г.). «Зоопланктон и углеродный цикл океана» . Ежегодный обзор морской науки . 9 (1): 413–444. Бибкод : 2017ARMS....9..413S . doi : 10.1146/annurev-marine-010814-015924 . ISSN 1941-1405 . ПМИД 27814033 .
- ^ Родитель, Женевьева Дж.; Плурд, Стефан; Турджен, Джули (1 ноября 2011 г.). «Перекрывающиеся диапазоны размеров видов Calanus у канадского арктического и атлантического побережья: влияние на численность видов» . Журнал исследований планктона . 33 (11): 1654–1665. дои : 10.1093/plankt/fbr072 . ISSN 0142-7873 .
- ^ Кристиансен, Инга; Гаард, Эйлиф; Хатун, Хьялмар; Йонасдоттир, Сигрун; Феррейра, А. София А. (1 мая 2016 г.). «Постоянное перемещение видов Calanus в юго-западной части Норвежского моря с 2003 года связано с климатом океана» . Журнал морских наук ICES . 73 (5): 1319–1329. doi : 10.1093/icesjms/fsv222 . ISSN 1054-3139 .
- ^ Дженсен, майор Холст; Нильсен, Торкель Гиссель; Даллёф, Анжела (28 апреля 2008 г.). «Влияние пирена на выпас и размножение Calanus finmarchicus и Calanus glacialis из залива Диско, Западная Гренландия» . Водная токсикология . 87 (2): 99–107. Бибкод : 2008AqTox..87...99J . дои : 10.1016/j.aquatox.2008.01.005 . ISSN 0166-445X . ПМИД 18291539 .
- ^ Jump up to: а б с д Танет, Лиза; Мартини, Северин; Казалот, Лори; Тамбурини, Кристиан (2020). «Обзоры и синтезы: Бактериальная биолюминесценция – экология и влияние на биологический углеродный насос» . Биогеонауки . 17 (14): 3757–3778. Бибкод : 2020BGeo...17.3757T . дои : 10.5194/bg-17-3757-2020 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Кайлер З., Яновяк М., Суонстон К. (2017). «Глобальный углеродный цикл». Учет углерода лесов и пастбищ в землепользовании . Том. 95. Министерство сельского хозяйства США, Лесная служба. стр. 3–9. doi : 10.2737/WO-GTR-95 .
{{cite book}}:|journal=игнорируется ( справка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ НАСА (16 июня 2011 г.). «Медленный углеродный цикл» . Архивировано из оригинала 16 июня 2012 года . Проверено 24 июня 2012 г.
- ^ Маринов И.; Гнанадэсикан, А.; Тоггвайлер-младший; Сармьенто, JL (2006). «Биогеохимический разрыв Южного океана». Природа . 441 (7096): 964–967. Бибкод : 2006Natur.441..964M . дои : 10.1038/nature04883 . ПМИД 16791191 . S2CID 4428683 .
- ^ Такахаси, Таро; Сазерленд, Стюарт К.; Суини, Колм; Пуассон, Ален; Мецль, Николас; Тилбрук, Бронте; Бейтс, Николас; Ваннинхоф, Рик; Фили, Ричард А.; Сабина, Кристофер; Олафссон, Джон; Нодзири, Юкихиро (2002). «Глобальный поток CO2 из моря в воздух, основанный на климатологических показателях pCO2 на поверхности океана, а также сезонных биологических и температурных эффектах». Глубоководные исследования, часть II: Актуальные исследования в океанографии . 49 (9–10): 1601–1622. Бибкод : 2002DSRII..49.1601T . дои : 10.1016/S0967-0645(02)00003-6 .
- ^ Орр, Дж. К., Э. Майер-Реймер, У. Миколаевич, П. Монфрей, Дж. Л. Сармьенто, Дж. Р. Тоггвейлер, Н. К. Тейлор, Дж. Палмер, Н. Грубер, К. Л. Сабина, К. Ле Кере, Р. М. Ки и Дж. Бутен (2001). Оценки антропогенного поглощения углерода на основе четырех трехмерных моделей глобального океана. Глобальная биогеохимия. Циклы 15 , 43–60.
- ^ «Исследование показывает неопределенность в отношении того, сколько углерода поглощает океан с течением времени» . Новости Массачусетского технологического института | Массачусетский технологический институт . 5 апреля 2021 г. Проверено 7 мая 2021 г.
- ^ Рибеселл, У., Шульц, К.Г., Беллерби, Р.Дж., Ботрос, М., Фриче, П., Мейерхёфер, М., Нил, К., Нондал, Г., Ошлис, А., Волерс, Дж. и Цёлльнер , Э. (2007). Повышенное биологическое потребление углерода в океане с высоким содержанием CO2 . Природа 450 , 545–548.
- ^ Jump up to: а б Пармантье, Франс-Ян В.; Кристенсен, Торбен Р.; Рисгаард, Сорен; Бендтсен, Йорген; Глуд, Ронни Н.; Еще, Брент; Ван Хейстеден, Якобус; Сакс, Торстен; Вонк, Джориен Э.; Сейр, Микаэль К. (2017). «Синтез арктического наземного и морского углеродного цикла под давлением истощающейся криосферы» . Амбио . 46 (Приложение 1): 53–69. Бибкод : 2017Амбио..46S..53P . дои : 10.1007/s13280-016-0872-8 . ПМЦ 5258664 . ПМИД 28116680 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Jump up to: а б Пармантье, Франс-Ян В.; Кристенсен, Торбен Р.; Соренсен, Лиз Лотте; Рюсгаард, Сёрен; Макгуайр, А. Дэвид; Миллер, Пол А.; Уокер, Дональд А. (2013). «Влияние меньшей площади морского льда на обмен парниковых газов в Арктике». Природа Изменение климата . 3 (3): 195–202. Бибкод : 2013NatCC...3..195P . дои : 10.1038/nclimate1784 .
- ^ Орр, Джеймс С.; Фабри, Виктория Дж.; Омон, Оливье; Бопп, Лоран; Дони, Скотт С.; Фили, Ричард А.; Гнанадэсикан, Ананд; Грубер, Николас; Исида, Акио; и др. (2005). «Антропогенное закисление океана в XXI веке и его влияние на кальцифицирующие организмы» (PDF) . Природа . 437 (7059): 681–686. Бибкод : 2005Natur.437..681O . дои : 10.1038/nature04095 . ПМИД 16193043 . S2CID 4306199 .
- ^ Армстронг, Роберт А.; Ли, Синди; Хеджес, Джон И.; Хондзё, Сусуму и Уэйкхэм, Стюарт Г. (2001). «Новая механистическая модель потоков органического углерода в океане, основанная на количественной связи ВОУ с балластными минералами». Глубоководные исследования, часть II: Актуальные исследования в океанографии . 49 (1–3): 219–236. Бибкод : 2001DSRII..49..219A . дои : 10.1016/s0967-0645(01)00101-1 .
- ^ Бопп, Л.; Омон, О.; Кадуле, П.; Альвен, С.; Гелен, М. (2005). «Реакция распространения диатомей на глобальное потепление и потенциальные последствия: исследование глобальной модели» . Письма о геофизических исследованиях . 32 (19): н/д. Бибкод : 2005GeoRL..3219606B . дои : 10.1029/2005GL023653 .
- ^ Иглесиас-Родригес, доктор медицинских наук; Холлоран, PR; Рикаби, REM; Холл, ИК; Кольменеро-Идальго, Э.; Гиттинс, младший; Грин, ДРХ; Тиррелл, Т.; Гиббс, С.Дж.; фон Дассов, П.; Рем, Э.; Армбруст, EV; Боссенкол, КП (2008). «Кальцификация фитопланктона в мире с высоким содержанием CO2». Наука . 320 (5874): 336–340. Бибкод : 2008Sci...320..336I . дои : 10.1126/science.1154122 . ПМИД 18420926 . S2CID 206511068 .
- ^ Риверо-Калле, Сара; Гнанадэсикан, Ананд; Кастильо, Карлос Э. Дель; Балч, Уильям М. и Гикема, Сет Д. (2015). «Многодесятилетнее увеличение численности кокколитофоров Северной Атлантики и потенциальная роль повышения уровня CO 2 » . Наука . 350 (6267): 1533–1537. Бибкод : 2015Sci...350.1533R . дои : 10.1126/science.aaa8026 . ПМИД 26612836 .
- ^ Йенсен, Лассе Эрстед; Маусинг, Эрик Асков; Ричардсон, Кэтрин (2017). «Использование моделирования распределения видов для прогнозирования будущего распределения фитопланктона: тематическое исследование с использованием видов, важных для биологического насоса». Морская экология . 38 (3): e12427. Бибкод : 2017MarEc..38E2427J . дои : 10.1111/maec.12427 .
- ^ Петру, Катерина; Нильсен, Дэниел (27 августа 2019 г.). «Кислотные океаны сокращают планктон, ускоряя изменение климата» . физ.орг . Проверено 7 сентября 2019 г.
- ^ Сигел, Дэвид А.; Бюсселер, Кен О.; Беренфельд, Майкл Дж.; Бенитес-Нельсон, Клаудия Р.; Босс, Эммануэль; Бжезинский, Марк А.; Бурд, Адриан; Карлсон, Крейг А.; Д'Асаро, Эрик А.; Дони, Скотт С.; Перри, Мэри Дж.; Стэнли, Рэйчел HR; Стейнберг, Дебора К. (8 марта 2016 г.). «Прогнозирование экспорта и судьбы чистой первичной продукции мирового океана: научный план экспорта» . Границы морской науки . 3 . Фронтирс Медиа С.А. дои : 10.3389/fmars.2016.00022 . ISSN 2296-7745 .
- ^ Комитет по спутникам наблюдения Земли (2014) «Стратегия CEOS по наблюдениям за углеродом из космоса». Ответ на углеродную стратегию Группы по наблюдениям за Землей (GEO). Отпечатано в Японии компаниями JAXA и I&A Corporation.
- ^ Jump up to: а б с д и Левин Л.А., Бетт Б.Дж., Гейтс А.Р., Хаймбах П., Хоу Б.М., Янссен Ф., МакКарди А., Рул Х.А., Снелгроув П., Стокс К.И., Бэйли Д. и 27 другие (2019) «Глобальные потребности в наблюдениях в глубоком океане». Границы морской науки , 6 : 241. два : 10.3389/fmars.2019.00241 .
 Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Измененный текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .






