Трихотецен
Эта статья нуждается в дополнительных цитатах для проверки . ( октябрь 2008 г. ) |
Трихотецены представляют собой большое семейство химически родственных микотоксинов . Их продуцируют различные виды Fusarium , Myrothecium , Trichoderma / Podostroma , Trichothecium , Cephalosporium , Verticimonosporium и Stachybotrys . По химическому составу трихотецены представляют собой класс сесквитерпенов .
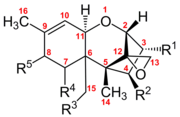
Определяющими структурными особенностями, обуславливающими биологическую активность трихотеценов, являются 12,13-эпоксидное кольцо, наличие гидроксильных или ацетильных групп в соответствующих положениях ядра трихотецена, а также строение и положение боковой цепи. Они производятся на многих различных зернах, таких как пшеница, овес или кукуруза, различными видами Fusarium, включая F. graminearum , F. sporotrichioides , F. poae и F. equiseti .
Некоторые плесени, вырабатывающие трихотеценовые микотоксины, например Stachybotryschartarum , могут расти во влажных помещениях. Было обнаружено, что макроциклические трихотецены, продуцируемые S.chartarum, могут передаваться по воздуху и, таким образом, усугублять проблемы со здоровьем жителей зданий. [1] [2] Ядовитый гриб, произрастающий в Японии и Китае , Podostroma cornu-damae , содержит шесть трихотеценов, включая сатратоксин H , роридин E и веррукарин .
Классификация
[ редактировать ]Общая классификация
[ редактировать ]
Трихотецены представляют собой группу из более чем 150 химически родственных микотоксинов . [3] Каждый трихотецен имеет структуру ядра, состоящую из одного шестичленного кольца, содержащего один атом кислорода, окруженного двумя углеродными кольцами. [4] Эта основная кольцевая структура содержит эпоксид или трициклический эфир в положениях углерода 12, 13, а также двойную связь в положениях углерода 9, 10. [5] Эти две функциональные группы в первую очередь ответственны за способность трихотецена ингибировать синтез белка и вызывать общие цитотоксические эффекты. [6] Примечательно, что эта основная структура является амфипатической и содержит как полярные, так и неполярные части. [7] Все трихотецены связаны этой общей структурой, но каждый трихотецен также имеет уникальный образец замещения кислородсодержащих функциональных групп в возможных местах на атомах углерода 3, 4, 7, 8 и 15. [5] Эти функциональные группы определяют свойства отдельного трикотецена, а также служат основой наиболее часто используемой системы классификации этого семейства токсинов. Эта система классификации разбивает семейство трихотеценов на четыре группы: тип A, B, C и D.
Трикотецены типа А имеют замещения гидроксильных , сложноэфирных групп или отсутствие функциональных групп вокруг структуры основного кольца. [4] Типичными примерами являются неозоланиол с гидроксильным замещением у углерода 8 и токсин Т-2 с сложноэфирным замещением у углерода 8.
Трикотецены типа B классифицируются по наличию карбонильных функциональных групп, замещенных вокруг основной кольцевой структуры. [4] Общие примеры включают ниваленол и трихотецин, оба из которых имеют кетоновую функциональную группу при атоме углерода 8.
Трихотецены типа C имеют дополнительную эпоксидную группу углерода 7 и углерода 8. [4] Типичным примером является кротоцин. который также имеет сложноэфирную функциональную группу у углерода 4.
Трихотецены типа D имеют дополнительное кольцо между углеродом 4 и углеродом 15. [4] Эти кольца могут иметь разнообразные дополнительные функциональные группы. Типичными примерами являются роридин А и сатратоксин H.
Хотя отдельные функциональные группы этих классификационных типов придают каждому трихотецену уникальные химические свойства, их классификационный тип не указывает явно на их относительную токсичность. [4] Хотя трихотецены типа D считаются наиболее токсичными, типы A и B имеют относительно смешанную токсичность. [4]
Альтернативные классификации
[ редактировать ]Описанная выше система классификации наиболее часто используется для группировки молекул семейства трихотеценов. Однако для этих сложных молекул также существует множество альтернативных систем классификации. Трихотецены также можно охарактеризовать как простые или макроциклические. [6] Простые трихотецены включают типы А, В и С, тогда как макроциклические трикотецены включают тип D и характеризуются наличием мостика углерод 4 – углерод 15. Кроме того, Дж. Ф. Гроув предложил классификацию трикотеценов на три группы, которая также была основана на моделях функциональных замещений кольцевого скелета. [8] Трикотецены группы 1 имеют функциональные группы, замещенные только в третьем, полностью насыщенном углеродном кольце. [8] Трикотецены группы 2 содержат дополнительные функциональные группы в основном кольце, содержащем двойную связь углерода 9, 10. [8] Наконец, трихотецены группы 3 содержат кетоновую функциональную группу у углерода 8; это те же критерии для трихотеценов типа B. [8]
Достижения в области эволюционной генетики также привели к предложению систем классификации трихотеценов, основанных на пути их биосинтеза. Гены, ответственные за биосинтез микотоксина, обычно расположены группами; у Fusariumi они известны как TRI-гены. [9] Каждый из генов TRI отвечает за выработку фермента , который выполняет определенный этап биосинтеза трихотеценов. Мутации в этих генах могут привести к образованию вариантов трихотеценов, и поэтому эти молекулы можно сгруппировать на основе общих этапов биосинтеза. Например, общий этап биосинтеза трихотеценов контролируется геном TRI4 . [10] Этот ферментный продукт контролирует присоединение трех или четырех атомов кислорода к триходиену с образованием изотриходиола или изотрихотриола соответственно. [10] Затем из любого из этих промежуточных продуктов можно синтезировать различные трихотецены, и поэтому их можно классифицировать либо как t-тип, если синтезируют из изотрихотриола, либо как d-тип, если синтезируют из изотрихотриола. [4]
Механизм действия
[ редактировать ]
Токсичность трикотеценов в первую очередь является результатом их широко упоминаемого действия как ингибиторов синтеза белка; это ингибирование происходит в рибосомах на всех трех стадиях синтеза белка: инициации, элонгации и терминации. [11] Во время инициации трихотецены могут либо ингибировать ассоциацию двух субъединиц рибосомы, либо ингибировать функцию зрелой рибосомы, предотвращая ассоциацию первой тРНК со стартовым кодоном. [11] Ингибирование элонгации, скорее всего, происходит из-за трихотеценов, препятствующих функции пептидилтрансферазы , фермента, который катализирует образование новых пептидных связей на 60-й субъединице рибосомы. [12] Ингибирование во время терминации также может быть результатом ингибирования пептидилтрансферазы или способности трихотеценов предотвращать гидролиз, необходимый на этом последнем этапе. [11]
Интересно отметить, что характер замещения кольцевого ядра трихотеценов влияет на действие токсина либо как ингибитор инициации, либо как ингибитор элонгации/терминации. [11] Трихотецены также обладают способностью влиять на общую функцию клеточных ферментов из-за склонности тиоловых групп активного центра атаковать 12,13-углеродное эпоксидное кольцо. [13] Эти ингибирующие эффекты наиболее ярко проявляются в активно пролиферирующих клетках, таких как желудочно-кишечный тракт или костный мозг .
Синтез белка происходит как в цитоплазме клетки, так и в люминальном пространстве митохондрий , цитоплазматических органелл, ответственных за выработку энергии клетки. Это осуществляется посредством ферментативного пути, который генерирует сильно окисленные молекулы, называемые активными формами кислорода , например, перекисью водорода . [14] Активные формы кислорода могут вступать в реакцию и вызывать повреждение многих важных частей клетки, включая мембраны, белки и ДНК . [15] Ингибирование трихотеценом синтеза белка в митохондриях позволяет накапливаться в клетке активным формам кислорода, что неизбежно приводит к окислительному стрессу и индукции запрограммированного пути гибели клеток - апоптоза . [15]
Индукция апоптоза в клетках с высоким уровнем активных форм кислорода обусловлена разнообразием клеточных сигнальных путей. Первый — это путь р53 , который, как показано, активируется токсином Т-2. p53 — белок, отвечающий за контроль клеточного цикла, однако повышение активности этого белка приводит также к усилению активации белков BAX в клетке. [16] Эти белки BAX в первую очередь ответственны за увеличение проницаемости митохондриальной мембраны и приводят к высвобождению цитохрома с и активных форм кислорода. [16] Высвобождение цитохрома с из митохондрий вызывает апоптоз, инициируя сборку каспаз или белков, ответственных за разрушение клетки изнутри.
Кроме того, было показано, что трихотецены, такие как Т-2, усиливают сигнальный путь N-концевой киназы c-Jun в клетках. [17] Здесь N-концевая киназа c-Jun способна усиливать фосфорилирование своей мишени, c-Jun, до ее активной формы. Активированный c-jun действует как фактор транскрипции в ядре клетки для белков, важных для облегчения последующего апоптотического пути. [17]
Симптомология
[ редактировать ]Трихотеценовые микотоксины токсичны для человека, других млекопитающих, птиц, рыб, различных беспозвоночных, растений и эукариотических клеток. [18] Специфическая токсичность варьируется в зависимости от конкретного токсина и вида животных, однако путь введения играет значительно большую роль в определении летальности. Последствия отравления будут зависеть от концентрации воздействия, продолжительности времени и способа воздействия на человека. Высококонцентрированный раствор или большое количество газообразной формы токсина с большей вероятностью вызовут серьезные последствия, включая смерть. При употреблении токсин ингибирует синтез рибосомального белка, ДНК и РНК. [19] [18] [20] митохондриальные функции [21] [22] [23] деление клеток [24] [25] одновременно активируя клеточную реакцию на стресс, называемую риботоксической реакцией на стресс . [26]
Трихотеценовые микотоксины могут всасываться местно , перорально и ингаляционно и являются высокотоксичными на субклеточном, клеточном и органическом уровне. [18]
Трихотецены отличаются от большинства других потенциальных токсинов оружия, поскольку они могут действовать через кожу, что объясняется их амфипатическими и липофильными характеристиками. Небольшая амфипатическая природа трихотеценов позволяет им легко проникать через клеточные мембраны. [7] и взаимодействуют с различными органеллами, такими как митохондрии, [27] [28] эндоплазматическая сеть (ЭР). [29] и хлоропласт [30] Липофильная природа трихотеценов позволяет им легко впитываться через кожу. [31] слизистая легких и кишечника. Прямое кожное применение или пероральный прием трихотецена вызывает быстрое раздражение кожи или слизистой оболочки кишечника. [19] [18] Утверждается, что как раздражитель кожи и вызывающий образование волдырей он в 400 раз более опьяняющий, чем сернистый иприт .

Реакция организма на микотоксин — алиментарно-токсическую алейкию — возникает через несколько дней после употребления и проходит в четыре стадии:
- Первая стадия включает воспаление слизистой оболочки желудка и кишечника .
- Вторая стадия характеризуется лейкопенией , гранулопенией и прогрессирующим лимфоцитозом .
- Третья стадия характеризуется появлением красной сыпи на коже тела, а также кровоизлияниями кожи и слизистых оболочек. В тяжелых случаях может возникнуть афония и смерть от удушения.
- К четвертой стадии истощаются клетки лимфоидных органов и эритропоэза в костном мозге и селезенке, снижается иммунный ответ.
Инфекция может быть вызвана даже незначительной травмой, например порезом, царапиной или ссадиной. [32]
Проявляются следующие симптомы:
- Сильный зуд и покраснение кожи, язвы, шелушение кожи.
- Искажение любого из органов чувств, потеря способности координировать движения мышц.
- Тошнота, рвота и диарея
- Боль в носу и горле, выделения из носа, зуд и чихание.
- Кашель, затрудненное дыхание, хрипы, боль в груди и рвота кровью.
- Временные нарушения свертываемости крови
- Повышенная температура тела [33] [34]
Нормативные вопросы
[ редактировать ]Когда дело доходит до продуктов питания для животных и человека, трихотецены типа А (например, токсин Т-2 , токсин НТ-2 , диацетоксисцирпенол ) представляют особый интерес, поскольку они более токсичны, чем другие трихотецены пищевого происхождения, т.е. группа типа В (например, дезоксиниваленол , ниваленол , 3- и 15- ацетилдезоксиниваленол ). Однако дезоксиниваленол вызывает беспокойство, поскольку он является наиболее распространенным трихотеценом в Европе. [35] Основными эффектами трихотеценов, связанными с их концентрацией в товаре, являются снижение потребления корма, рвота и подавление иммунитета.Относительно немногие страны, в первую очередь в Европейском Союзе , рекомендуют максимальные пределы содержания этих микотоксинов в пищевых продуктах и кормах для животных. Однако трихотецены часто проверяют на наличие в других местах, чтобы предотвратить их попадание в пищевую цепь и предотвратить потери в животноводстве.
История
[ редактировать ]Считается, что трихотецены были обнаружены в 1932 году в Оренбурге, Россия, во время Второй мировой войны Советским Союзом . Около 100 000 человек (смертность 60%) начали страдать и умирать от алиментарно-токсической алейкии — смертельного заболевания с симптомами, напоминающими радиацию. Считается, что советские мирные жители заболели в результате употребления в пищу зараженного хлеба и вдыхания плесени через загрязненное сено, пыль и системы вентиляции. Считается, что виновником являются токсины Fusarium sporotrichioides и Fusarium poae , которые являются высокими продуцентами токсина Т-2 . [36] Виды Fusarium, вероятно, являются наиболее часто упоминаемыми и одними из самых распространенных грибов, продуцирующих трихотецен. [37]
Трихотецены являются идеальным боевым биологическим агентом, смертельным и недорогим в производстве в больших количествах, стабильным в виде аэрозоля для распыления и не требующим эффективной вакцинации/лечения. [12] Имеющиеся данные свидетельствуют о том, что микотоксины уже использовались в качестве биологического оружия.
- 1964 г. Есть неподтвержденные сообщения о том, что египетские или российские войска использовали Т-2 с ипритом.
- 1974–1981 гг. Инциденты « желтого дождя » в Юго-Восточной Азии (Лаос, Камбоджа) и Афганистане. [38] [39] [40] [41]
- Утверждалось, что в 1975 и 1981 годах во время войны во Вьетнаме Советский Союз поставлял микотоксины армиям Вьетнама и Лаоса для использования против сил сопротивления в Лаосе и Камбодже. [42] [43]
- 1979–1989 годы во время советско-афганской войны . [44]
- 1985–1989 гг. Ирано-иракская война, сообщения о поставках микотоксинов в Ирак (в виде порошка и дыма). [45]
С тех пор о трихотеценах сообщалось во всем мире. [46] Они оказали значительное экономическое воздействие на мир из-за гибели людей и животных, увеличения затрат на здравоохранение и ветеринарную помощь, сокращения производства животноводческой продукции, утилизации загрязненных пищевых продуктов и кормов, а также инвестиций в исследования и применения для снижения серьезности микотоксина. проблема. Эти микотоксины ежегодно приносят убытки в миллионы долларов из-за факторов, которые часто находятся вне контроля человека (окружающая среда, экология или метод хранения). [47]
Загрязнение пищевых продуктов
[ редактировать ]Опасные концентрации трихотеценов обнаружены в кукурузе, пшенице, ячмене, овсе, рисе, ржи, овощах и других культурах. Заболевания, возникающие в результате инфекции, включают гниль семян, фитофтороз рассады, корневую гниль , гниль стебля и гниль початков. [48] Трихотецены также являются частыми загрязнителями кормов для птиц , и их неблагоприятное воздействие на здоровье и продуктивность птицы широко изучено. [49]
Некоторые исследования показали, что оптимальные условия для роста грибов не обязательно являются оптимальными для производства токсинов. [50] Наибольшее образование токсинов наблюдается при высокой влажности и температуре 6–24 °C. Размножение и производство грибков усиливаются в тропических условиях с высокими температурами и уровнями влажности; муссоны , ливневые паводки и несезонные дожди во время сбора урожая. [51] Трихотецены были обнаружены в пробах воздуха, что позволяет предположить, что они могут распыляться на спорах или мелких частицах. [52] [53]
Сообщалось о естественном возникновении ТСТ в Азии , Африке , Южной Америке , Европе и Северной Америке. [54]
- Акакабибьо, болезнь аналогичной этиологии, также была связана с зараженным трихотеценом зерном в Японии. [55]
- В Китае зерновые или продукты из них, загрязненные трихотеценами, включая ДОН, токсин Т-2 и НИВЛ, также были связаны со вспышками желудочно-кишечных расстройств. [56]
- В Югославии исследования микотоксигенных грибов в сыром молоке показали, что 91% протестированных образцов были заражены. [57]
- В США исследование, проведенное в семи штатах Среднего Запада в 1988–1989 годах, выявило микотоксины в 19,5–24,7% образцов кукурузы. [58] С начала 1900-х годов случаи [ написание? ] Описаны случаи рвоты у животных и человека после употребления в пищу зерновых, зараженных видами Fusarium. [59] [60]
- В исследовании, проведенном в регионе Бихар с 1985 по 1987 год, 51% протестированных образцов были заражены плесенью. [61]
- В другом исследовании, проведенном в регионе Бихар, [62] высокие уровни были зарегистрированы в арахисовой муке, используемой для молочного скота.
- В Лудхиане и Пенджабе исследователи обнаружили загрязнение 75% образцов с молочных ферм. [63]
- В Индии потери арахиса микотоксинами составили около 10 миллионов долларов. [64]
Безопасность
[ редактировать ]Прямых противоядий от воздействия трихотецена не существует. Таким образом, управление рисками на загрязненных территориях в первую очередь определяется лечением симптомов воздействия, а также предотвращением возможного воздействия в будущем.
Уход
[ редактировать ]Типичные пути воздействия трихотеценовых токсинов включают местное всасывание, проглатывание и вдыхание. Тяжесть симптомов зависит от дозы и типа воздействия, но лечение в первую очередь направлено на поддержку систем организма, поврежденных микотоксином. Первым шагом в большинстве случаев заражения является снятие потенциально загрязненной одежды и тщательное промывание мест воздействия водой. [65] Это предотвращает повторное воздействие на жертву. Жертвам с тяжелыми нарушениями желудочно-кишечного тракта можно давать жидкости и электролиты, чтобы смягчить последствия снижения всасывания в желудочно-кишечном тракте. Свежий воздух и искусственная вентиляция легких также могут быть назначены при развитии легкой респираторной недостаточности. [65] Все более серьезные симптомы могут потребовать применения передовой медицинской помощи. Возникновение лейкопении или снижения количества лейкоцитов можно лечить переливанием плазмы или тромбоцитов . [65] Гипотонию можно лечить введением норадреналина или дофамина . [65] Развитие тяжелого сердечно-легочного дистресса может потребовать интубации и дополнительного медикаментозного лечения для стабилизации деятельности сердца и легких.
Кроме того, существует множество химических веществ, которые могут косвенно снизить повреждающее воздействие трихотеценов на клетки и ткани. Растворы активированного угля часто назначают при приеме внутрь в качестве адсорбента . [66] Здесь древесный уголь действует как пористое вещество для связывания токсина, предотвращая его всасывание через желудочно-кишечный тракт и увеличивая его выведение из организма через кишечник. Подобные детоксифицирующие адсорбенты также можно добавлять в корм для животных при загрязнении, чтобы снизить биодоступность токсина при употреблении в пищу. Антиоксиданты также полезны для смягчения повреждающего действия трихотеценов в ответ на увеличение количества активных форм кислорода, которые они производят в клетках. В целом считается, что хорошая диета, богатая пробиотиками, витаминами и питательными веществами, белками и липидами, эффективна для уменьшения симптомов отравления трихотеценом. [16] Например, было обнаружено, что витамин Е противодействует образованию перекисей липидов, вызванному токсином Т-2 у кур. [67] Аналогично, совместное добавление модифицированных глюкоманнанов и селена в рационы кур, также потребляющих токсин Т-2, уменьшало вредные эффекты связанного с токсином истощения антиоксидантов в печени. Несмотря на то, что эти антиоксиданты не являются прямым противоядием, они могут иметь решающее значение для снижения тяжести воздействия трихотецена.
Профилактика
[ редактировать ]
Трихотецены – это микотоксины, вырабатываемые плесенью, которая часто загрязняет склады зерновых продуктов. Это делает загрязнение трихотеценом серьезной проблемой общественного здравоохранения, и во многих регионах действуют строгие ограничения на разрешенное содержание трихотецена. Например, в Европейском Союзе разрешено содержание токсина Т-2 только в концентрации 0,025 ppm в хлебобулочных изделиях, предназначенных для потребления человеком. [68] Плесени, способные продуцировать трихотецены, хорошо растут в темных местах с умеренным климатом и высоким содержанием влаги. Поэтому один из лучших способов предотвратить загрязнение пищевых продуктов трихотеценом — хранить ресурсы в надлежащих условиях, чтобы предотвратить рост плесени. [16] Например, обычно рекомендуется хранить зерно только в помещениях с влажностью менее 15%. [69] Однако, если территория уже загрязнена трихотеценовыми токсинами, существует множество возможных стратегий дезактивации для предотвращения дальнейшего воздействия. обработка 1% гипохлоритом натрия (NaOCl) в 0,1 М гидроксиде натрия (NaOH) в течение 4–5 часов ингибирует биологическую активность токсина Т-2. Было показано, что [16] Также было показано, что инкубация с водным раствором озона при концентрации примерно 25 частей на миллион приводит к разложению различных трихотеценов по механизму, включающему окисление двойной связи углерода 9, 10. [70] ультрафиолетовое воздействие эффективно при правильных условиях. Также было доказано, что [16]
Помимо стратегий физической и химической дезактивации, развитие исследований в области молекулярной генетики также привело к появлению потенциала биологического метода дезактивации. Многие микробы, включая бактерии, дрожжи и грибы, выработали ферментативные генные продукты, которые способствуют специфическому и эффективному расщеплению трихотеценовых микотоксинов. [69] Многие из этих ферментов специфически разрушают эпоксидное кольцо углерода 12,13, что важно для токсичности трихотеценов. Например, штамм Eubacteria BBSH 797 вырабатывает ферменты деэпоксидазы, которые восстанавливают эпоксидное кольцо углерода 12,13 до группы двойной связи. [69] Их, наряду с другими микробами, проявляющими детоксикационные свойства трихотецена, можно использовать в магазинах кормов для предотвращения токсического воздействия загрязненных кормов при потреблении. [16] Кроме того, молекулярное клонирование генов, ответственных за выработку этих детоксифицирующих ферментов, может быть полезно для получения штаммов сельскохозяйственной продукции, устойчивых к отравлению трихотеценом. [16]
Эпокситрихотецены
[ редактировать ]Эпокситрихотецены являются разновидностью вышеперечисленных и когда-то исследовались для использования в военных целях в Восточной Германии и, возможно, во всем советском блоке. [71] При появлении симптомов отравления эпокситихотеценом никакого лечения невозможно, хотя последствия могут исчезнуть, не оставляя необратимых повреждений.
От планов использования в качестве крупномасштабного биологического оружия отказались, поскольку соответствующие эпокситрихотецены очень быстро разлагаются под воздействием ультрафиолета и тепла, а также под воздействием хлора, что делает их бесполезными для открытых атак и отравления источников воды. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Обнаружение переносимых по воздуху макроциклических трихотеценовых микотоксинов Stachybotryschartarum во внутренних помещениях.
- ^ Эцель Р.А. (2002). «Микотоксины». ДЖАМА . 287 (4): 425–7. дои : 10.1001/jama.287.4.425 . ПМИД 11798344 .
- ^ «Американское фитопатологическое общество» . Американское фитопатологическое общество . Архивировано из оригинала 07 мая 2018 г. Проверено 7 мая 2018 г.
- ^ Перейти обратно: а б с д и ж г час Маккормик С.П., Стэнли А.М., Стовер Н.А., Александр Нью-Джерси (июль 2011 г.). «Трихотецены: от простых к сложным микотоксинам» . Токсины . 3 (7): 802–14. дои : 10.3390/toxins3070802 . ПМК 3202860 . ПМИД 22069741 .
- ^ Перейти обратно: а б Защита от трихотеценовых микотоксинов . Национальные академии. 1 января 1983 г. ISBN 9780309034302 .
- ^ Перейти обратно: а б Беннетт Дж.В., Клих М. (июль 2003 г.). «Микотоксины» . Обзоры клинической микробиологии . 16 (3): 497–516. doi : 10.1128/CMR.16.3.497-516.2003 . ПМК 164220 . ПМИД 12857779 .
- ^ Перейти обратно: а б Миддлбрук Дж.Л., Лезерман Д.Л. (сентябрь 1989 г.). «Специфическая ассоциация токсина Т-2 с клетками млекопитающих». Биохимическая фармакология . 38 (18): 3093–102. дои : 10.1016/0006-2952(89)90020-8 . ПМИД 2783163 .
- ^ Перейти обратно: а б с д Гроув Дж. Ф. (1988). «Немакроциклические трихотецены». Отчеты о натуральных продуктах . 5 (2): 187–209. дои : 10.1039/NP9880500187 . ISSN 0265-0568 . ПМИД 3062504 .
- ^ Кимура, Макото; Токай, Такеши; о'Доннелл, Керри; Уорд, Тодд Дж.; Фудзимура, Макото; Хамамото, Хироши; Сибата, Такэхико; Ямагучи, Исаму (27 марта 2003 г.). «Кластер генов биосинтеза трихотецена Fusarium graminearum F15 содержит ограниченное количество генов основного пути и экспрессируемых несущественных генов» . Письма ФЭБС . 539 (1–3): 105–110. дои : 10.1016/S0014-5793(03)00208-4 . ПМИД 12650935 . S2CID 19787988 .
- ^ Перейти обратно: а б Маккормик С.П., Александр Нью-Джерси, Проктор Р.Х. (июль 2006 г.). «Fusarium Tri4 кодирует многофункциональную оксигеназу, необходимую для биосинтеза трихотецена». Канадский журнал микробиологии . 52 (7): 636–42. дои : 10.1139/w06-011 . ПМИД 16917519 .
- ^ Перейти обратно: а б с д Кисслинг К.Х. (1986). «Биохимический механизм действия микотоксинов» (PDF) . Чистая и прикладная химия . 58 (2): 327–338. дои : 10.1351/pac198658020327 . S2CID 94777285 .
- ^ Перейти обратно: а б Хенгхольд ВБ (июль 2004 г.). «Другие биологические токсины биологического оружия: рицин, стафилококковый энтеротоксин B и трихотеценовые микотоксины». Дерматологические клиники . 22 (3): 257–62, v. doi : 10.1016/j.det.2004.03.004 . ПМИД 15207307 .
- ^ Уэно Ю, Мацумото Х (октябрь 1975 г.). «Инактивация некоторых тиоловых ферментов трихотеценовыми микотоксинами видов Fusarium» . Химический и фармацевтический вестник . 23 (10): 2439–42. дои : 10.1248/cpb.23.2439 . ПМИД 1212759 .
- ^ Зоров Д.Б., Юхашова М., Соллотт С.Дж. (июль 2014 г.). «Митохондриальные активные формы кислорода (АФК) и АФК-индуцированное высвобождение АФК» . Физиологические обзоры . 94 (3): 909–50. doi : 10.1152/physrev.00026.2013 . ПМК 4101632 . ПМИД 24987008 .
- ^ Перейти обратно: а б Фан Х, Ву Ю, Го Дж, Жун Дж, Ма Л, Чжао З, Цзо Д, Пэн С (август 2012 г.). «Токсин Т-2 индуцирует апоптоз в дифференцированных мышиных эмбриональных стволовых клетках посредством митохондриального пути, опосредованного активными формами кислорода». Апоптоз . 17 (8): 895–907. дои : 10.1007/s10495-012-0724-3 . ПМИД 22614820 . S2CID 17446994 .
- ^ Перейти обратно: а б с д и ж г час Адхикари М., Неги Б., Кошик Н., Адхикари А., Аль-Хедхайри А.А., Кошик Н.К., Чой Э.Х. (май 2017 г.). «Микотоксин Т-2: токсикологические эффекты и стратегии обеззараживания» . Онкотаргет . 8 (20): 33933–33952. дои : 10.18632/oncotarget.15422 . ПМЦ 5464924 . ПМИД 28430618 .
- ^ Перейти обратно: а б Ли М, Пестка Джей Джей (сентябрь 2008 г.). «Сравнительная индукция расщепления 28S рибосомальной РНК рицином и трихотеценами, дезоксиниваленолом и токсином Т-2 в макрофагах» . Токсикологические науки . 105 (1): 67–78. дои : 10.1093/toxsci/kfn111 . ПМЦ 2734305 . ПМИД 18535001 .
- ^ Перейти обратно: а б с д Ваннемахер Р., Винер С.Л., Сиделл Ф.Р., Такафудзи Э.Т., Франц Д.Р. (1997). «Медицинские аспекты химической и биологической войны». Трихотеценовые микотоксины . Том. 6 (1-е изд.). Правительственная печать США. стр. 100-1 655–76. ISBN 978-9997320919 .
- ^ Перейти обратно: а б Маклафлин С., Вон М., Кэмпбелл И., Вэй С.М., Стаффорд М., Хансен Б. (1977). «Ингибирование синтеза белка трихотеценами». Микотоксины в здоровье человека и животных . Парк Форест Саут, Иллинойс: Издательство Pathotox. стр. 263–75.
- ^ Дежарден А.Е., Хон Т.М., Маккормик С.П. (сентябрь 1993 г.). «Биосинтез трихотецена у видов Fusarium: химия, генетика и значение» . Микробиологические обзоры . 57 (3): 595–604. дои : 10.1128/MMBR.57.3.595-604.1993 . ПМЦ 372927 . ПМИД 8246841 .
- ^ Фрид Х.М., Уорнер-младший (январь 1981 г.). «Клонирование дрожжевого гена устойчивости к триходермину и рибосомального белка L3» . Труды Национальной академии наук Соединенных Штатов Америки . 78 (1): 238–42. Бибкод : 1981PNAS...78..238F . дои : 10.1073/pnas.78.1.238 . ПМК 319027 . ПМИД 7017711 .
- ^ Буазиз С., Мартель С., Шараф эль-Дейн О., Абид-Эссефи С., Бреннер С., Лемэр С., Бача Х. (август 2009 г.). «Токсичность, вызванная фузариальным токсином, в культивируемых клетках и изолированных митохондриях включает PTPC-зависимую активацию митохондриального пути апоптоза» . Токсикологические науки . 110 (2): 363–75. дои : 10.1093/toxsci/kfp117 . ПМИД 19541794 .
- ^ Бин-Умер М.А., Маклафлин Дж.Э., Басу Д., Маккормик С., Тумер Н.Е. (декабрь 2011 г.). «Трихотеценовые микотоксины ингибируют митохондриальную трансляцию – значение механизма токсичности» . Токсины . 3 (12): 1484–501. дои : 10.3390/toxins3121484 . ПМК 3268453 . ПМИД 22295173 .
- ^ Аскона-Оливера Дж.И., Оуян Ю., Мурта Дж., Чу Ф.С., Пестка Дж.Дж. (июль 1995 г.). «Индукция мРНК цитокинов у мышей после перорального воздействия трихотеценового вомитоксина (дезоксиниваленол): связь с распределением токсина и ингибированием синтеза белка». Токсикология и прикладная фармакология . 133 (1): 109–20. дои : 10.1006/taap.1995.1132 . ПМИД 7597700 .
- ^ Томпсон В.Л., Ваннемахер Р.В. (1986). «Структурно-функциональные взаимосвязи 12,13-эпокситрихотеценовых микотоксинов в клеточной культуре: сравнение со смертностью всего животного». Токсикон . 24 (10): 985–94. дои : 10.1016/0041-0101(86)90004-8 . ПМИД 3824405 .
- ^ Шифрин В.И., Андерсон П. (май 1999 г.). «Трихотеценовые микотоксины вызывают риботоксический стрессовый ответ, который активирует N-концевую киназу c-Jun и митоген-активируемую протеинкиназу p38 и индуцирует апоптоз» . Журнал биологической химии . 274 (20): 13985–92. дои : 10.1074/jbc.274.20.13985 . ПМИД 10318810 .
- ^ Кандифф Э., Кэннон М., Дэвис Дж. (январь 1974 г.). «Механизм ингибирования синтеза эукариотических белков трихотеценовыми грибковыми токсинами» . Труды Национальной академии наук Соединенных Штатов Америки . 71 (1): 30–4. Бибкод : 1974ПНАС...71...30С . дои : 10.1073/pnas.71.1.30 . ПМЦ 387925 . ПМИД 4521056 .
- ^ Кандифф Э., Дэвис Дж. Э. (март 1977 г.). «Ингибирование инициации, удлинения и прекращения синтеза эукариотических белков трихотеценовыми грибковыми токсинами» . Антимикробные средства и химиотерапия . 11 (3): 491–9. дои : 10.1128/AAC.11.3.491 . ПМК 352012 . ПМИД 856003 .
- ^ Уэно Ю (1985). «Токсикология микотоксинов». Критические обзоры по токсикологии . 14 (2): 99–132. дои : 10.3109/10408448509089851 . ПМИД 3158480 .
- ^ Пейс Дж.Г., Уоттс М.Р., Кентербери У.Дж. (1988). «Микотоксин Т-2 ингибирует синтез митохондриального белка». Токсикон . 26 (1): 77–85. дои : 10.1016/0041-0101(88)90139-0 . ПМИД 3347933 .
- ^ Куломб Р.А. (март 1993 г.). «Биологическое действие микотоксинов» . Журнал молочной науки . 76 (3): 880–91. doi : 10.3168/jds.S0022-0302(93)77414-7 . ПМИД 8463495 .
- ^ Шварцер К. (2009). «Вредное воздействие микотоксинов на физиологию животных». 17-й ежегодный семинар ASAIM SEA по кормовым технологиям и питанию . Хюэ, Вьетнам.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ «Трихотеценовый микотоксин | IDPH» . www.dph.illinois.gov . Проверено 7 мая 2018 г.
- ^ Уэно Ю (апрель 1984 г.). «Токсикологические особенности токсина Т-2 и родственных ему трихотеценов». Фундаментальная и прикладная токсикология . 4 (2, часть 2): S124–32. дои : 10.1016/0272-0590(84)90144-1 . ПМИД 6609858 .
- ^ Миллер Дж.Д. (2003). «Аспекты экологии фузариозных токсинов зерновых культур». Ин де Врис Дж.В., Траксесс М.В., Джексон Л.С. (ред.). Микотоксины и безопасность пищевых продуктов . Нью-Йорк: Издательство Kluwer Academic/Plenum. стр. 19–27.
- ^ Иоффе А.З. (1950). Токсичность грибов на перезимовавших в поле злаках: к этиологии пищевой токсической алейкии (к.б.н.). Ленинград: Инт. Бот. акад. наук. п. 205.
- ^ Роча О, Ансари К, Духан FM (апрель 2005 г.). «Влияние трихотеценовых микотоксинов на эукариотические клетки: обзор». Пищевые добавки и загрязнители . 22 (4): 369–78. дои : 10.1080/02652030500058403 . ПМИД 16019807 . S2CID 1534222 .
- ^ Хейндрикс А., Сукваничсилп Н., Ван ден Хид М. (1984). «Обнаружение трихотеценовых микотоксинов (желтый дождь) в крови, моче и фекалиях иранских солдат, ставших жертвами газовой атаки». Архивы Belges = Belgisch Archief . Приложение: 143–6. ПМИД 6535464 .
- ^ Мироча С.Дж., Павлоски Р.А., Чаттерджи К., Уотсон С., Хейс В. (ноябрь 1983 г.). «Анализ токсинов Fusarium в различных образцах, причастных к биологической войне в Юго-Восточной Азии». Журнал Ассоциации официальных химиков-аналитиков . 66 (6): 1485–99. ПМИД 6643363 .
- ^ Спайкер М.С., Спайкер Д.А. (октябрь 1983 г.). «Желтый дождь: химическая война в Юго-Восточной Азии и Афганистане». Ветеринарная и человеческая токсикология . 25 (5): 335–40. ПМИД 6636506 .
- ^ Ваннемахер-младший, Винер С.Л. «Глава 34: Трихотеценовые микотоксины». В Sidell FR, Takafuji ET, Франц DR (ред.). Медицинские аспекты химической и биологической войны . Серия Учебник военной медицины. Управление главного хирурга Министерства армии США.
- ^ Хейг А.М. (22 марта 1982 г.). Специальный отчет 98: Химическая война в Юго-Восточной Азии и Афганистане: отчет Конгрессу государственного секретаря Хейга (Отчет). Вашингтон, округ Колумбия: Типография правительства США.
- ^ Такер Дж. Б. (2001). « Спор о желтом дожде : уроки соблюдения контроля над вооружениями». Нераспространение преп . 8 : 25–39. дои : 10.1080/10736700108436836 . S2CID 22473397 .
- ^ «Мировые дела, том 145, № 3, Афганистан» . JSTOR 20671950 .
- ^ «ЦНС — получение микробного исходного материала для стандартного или нового агента» . webarchive.loc.gov . Архивировано из оригинала 27 ноября 2001 г. Проверено 06 мая 2018 г.
- ^ Донал В., Жезкова А., Джун Д., Куча К. (январь 2008 г.). «Метаболические пути токсина Т-2». Современный метаболизм лекарств . 9 (1): 77–82. дои : 10.2174/138920008783331176 . ПМИД 18220574 .
- ^ Зейн, Мохамед Э. (1 апреля 2011 г.). «Воздействие микотоксинов на человека и животных» . Журнал Саудовского химического общества . 15 (2): 129–144. дои : 10.1016/j.jscs.2010.06.006 . ISSN 1319-6103 .
- ^ Шолленбергер М., Мюллер Х.М., Эрнст К., Зондерманн С., Либшер М., Шлекер С., Вишер Г., Дрохнер В., Хартунг К., Пьефо Х.П. (октябрь 2012 г.). «Наличие и распространение 13 трихотеценовых токсинов в естественно загрязненных растениях кукурузы в Германии» . Токсины . 4 (10): 778–87. дои : 10.3390/toxins4100778 . ПМЦ 3496988 . ПМИД 23162697 .
- ^ Лисон С., Диас Г.Дж., Саммерс Дж.Д. (1995). «Трикотецены». Метаболические нарушения у птицы . Гуэлф, Онтарио, Канада. стр. 190–226.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Хессельтин К.В., Шотвелл О.Л., Смит М., Эллис Дж.Дж., Вандеграфт Э., Шеннон Г. (1970). «Продукция различных афлатоксинов штаммами серии Aspergillis flavus ». Учеб. Первая американо-японская конф. Токсичная микроорг . Вашингтон.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Дудея П., Гупта Р.К., Минхас А.С. (ред.). Безопасность пищевых продуктов в XXI веке: взгляд на общественное здравоохранение .
- ^ Брасел Т.Л., Дуглас Д.Р., Уилсон С.С., Штраус, округ Колумбия (январь 2005 г.). «Обнаружение переносимых по воздуху макроциклических трихотеценовых микотоксинов Stachybotryschartarum на частицах размером меньше конидий» . Прикладная и экологическая микробиология . 71 (1): 114–22. Бибкод : 2005ApEnM..71..114B . дои : 10.1128/АЕМ.71.1.114-122.2005 . ПМК 544211 . ПМИД 15640178 .
- ^ Чо С.Х., Сео С.К., Шмечель Д., Гриншпун С.А., Репонен Т. (сентябрь 2005 г.). «Аэродинамические характеристики и отложение фрагментов грибов в дыхательных путях». Атмосферная среда . 39 (30): 5454–5465. Бибкод : 2005AtmEn..39.5454C . дои : 10.1016/j.atmosenv.2005.05.042 .
- ^ Бизли VR, изд. (1989). Трикотеценовый микотоксикоз: патофизиологические эффекты . Том. 1. Бока-Ратон: CRC Press. стр. 1–26.
- ^ Уэно Ю, Исии К, Сакаи К, Канаэда С, Цунода Х (1972). «Токсикологические подходы к метаболитам Fusaria. IV. Микробиологическое исследование при «отравлении шелухой лошадей» с выделением токсичных трихотеценов, неозоланиола и Т-2 токсина Fusarium solani М-1-1». Японский J. Exp. Мед . 42 (3): 187–203. ПМИД 4538152 .
- ^ Лу XY (1988). «Заражение зерновых культур фузариозными токсинами в Китае». Учеб. Японский доц. Микотоксикология . Доп. 1: 97–98.
- ^ Скринжар М, Данев М, Димич Г (1995). «Исследование на наличие токсигенных грибов и афлатоксинов в сыром молоке». Акта Алимент . 24 : 395–402.
- ^ Рассел Л., Кокс Д.Ф., Ларсен Г., Бодвелл К., Нельсон CE (январь 1991 г.). «Заболеваемость плесенью и микотоксинами на коммерческих комбикормовых заводах в семи штатах Среднего Запада, 1988–1989 годы» . Журнал зоотехники . 69 (1): 5–12. дои : 10.2527/1991.6915 . ПМИД 1825995 .
- ^ Naumov NA (1916). "Intoxicating bread". Min. Yeml. (Russia), Trudy Ruiri Miwel. I. Fitopatol. Uchen, Kom. : 216.
- ^ Дунин М. (1930). «Фузариоз зерновых культур в Европейской России в 1923 году». Фитопатол . 16 : 305–308.
- ^ Ранджан К.С., Синха А.К. (1991). «Наличие микотоксигенных грибов и микотоксинов в кормах для животных из Бихара, Индия». Журнал науки о продовольствии и сельском хозяйстве . 56 (1): 39–47. дои : 10.1002/jsfa.2740560105 .
- ^ Филлипс С.И., Уэринг П.В., Датта А., Паниграхи С., Медлок В. (1 января 1996 г.). «Микофлора и распространенность афлатоксина, зеараленона и стеригматоцистина в образцах молочных кормов и фуража из Восточной Индии и Бангладеш». Микопатология . 133 (1): 15–21. дои : 10.1007/BF00437094 . ISSN 0301-486X . S2CID 32084324 .
- ^ Дханд Н.К., Джоши Д.Б., Джанд С.К. (1998). «Афлатоксины в молочных кормах/ингредиентах». Индийский Дж. Аним. Нутр . 15 : 285–286.
- ^ Васанти С., Бхат Р.В. (ноябрь 1998 г.). «Микотоксины в пищевых продуктах - возникновение, медико-экономическое значение и меры контроля за пищевыми продуктами». Индийский журнал медицинских исследований . 108 : 212–24. ПМИД 9863277 .
- ^ Перейти обратно: а б с д «ТОКСИН Т-2 - База данных HSDB Национальной медицинской библиотеки» . toxnet.nlm.nih.gov . Проверено 7 мая 2018 г.
- ^ Эдрингтон Т.С., Кубена Л.Ф., Харви Р.Б., Роттингхаус GE (сентябрь 1997 г.). «Влияние суперактивированного угля на токсическое действие афлатоксина или токсина Т-2 у выращиваемых бройлеров» . Птицеводство . 76 (9): 1205–11. дои : 10.1093/ps/76.9.1205 . ПМИД 9276881 . S2CID 3648573 .
- ^ Хелер Д., Марквардт Р.Р. (декабрь 1996 г.). «Влияние витаминов Е и С на токсическое действие охратоксина А и токсина Т-2 у цыплят» . Птицеводство . 75 (12): 1508–15. дои : 10.3382/ps.0751508 . ПМИД 9000276 .
- ^ Стоев С.Д. (март 2015). «Пищевые микотоксикозы, оценка риска и недооценка опасности замаскированных микотоксинов и совместных эффектов или взаимодействия микотоксинов». Экологическая токсикология и фармакология . 39 (2): 794–809. дои : 10.1016/j.etap.2015.01.022 . ПМИД 25734690 .
- ^ Перейти обратно: а б с Девриз М., Де Бакер П., Крубельс С. (2013). «Различные методы противодействия выработке микотоксинов и их влиянию на здоровье животных» . Флаамс Дирген Тейдс . 82 (4): 181–190. дои : 10.21825/vdt.v82i4.16695 .
- ^ Янг Джей Си, Чжу Х, Чжоу Т (март 2006 г.). «Разложение трихотеценовых микотоксинов водным озоном». Пищевая и химическая токсикология . 44 (3): 417–24. дои : 10.1016/j.fct.2005.08.015 . ПМИД 16185803 .
- ^ Химия боевых отравляющих веществ, Издание правительства ГДР, 1988 г.